2. 国能锦界能源有限责任公司, 陕西 榆林 719319;
3. 浙江大学 能源工程学院, 浙江 杭州 310027
2. Guoneng Jinjie Energy Co. Ltd., Yulin 719300, China;
3. College of Energy Engineering, Zhejiang University, Hangzhou 310027, China
由于高反应速率、高吸收容量等特性,有机胺捕集二氧化碳(CO2)在工业烟气脱碳中发展最为成熟[1-3]。然而,以商用乙醇胺(MEA,质量分数为30%)为例的单相胺溶液的再生能耗高达3.8 GJ⋅t−1(以CO2计),制约其大规模应用[4]。因此,开发高效节能、绿色环保的新型吸收剂是目前实现工业脱碳亟须解决的问题。相较于单相吸收剂,相变吸收剂的节能与设备成本优势突出。自2005年相变CO2吸收剂专利被首次公布以来,国内外学者开展了越来越多相变吸收剂的研究工作[5-6]。相变吸收剂在捕集CO2前是均相溶液,通过调节温度或负荷,使与CO2反应后的饱和吸收液转变成两相。因只需解吸富含CO2的一相(富相),可大幅度减少解吸产物体积并提高CO2分压,从而实现降低该吸收剂所需的再生能量与设备体积的目标[7]。根据分相类型,相变吸收剂可分为液-液相变吸收剂和固-液相变吸收剂。固-液相变吸收剂在吸收CO2后形成固-液两相,CO2吸收产物主要富集于固相。固相生成时不断沉聚在吸收器底部,有利于固-液两相的高效分离,且后续仅对固相进行输送、解吸,可降低液相黏度对输送、解吸环节的影响。Zheng等[8]发现三乙烯四胺(TETA)/乙醇体系在CO2吸收饱和后生成的固相呈白色晶体粉末状而非黏稠胶状,有利于固相从吸收设备转移至再生设备实现高效分离与输送,且烷基碳酸盐产物在90 ℃下可完全分解;同时含多胺基的主吸收剂TETA使体系达到很高的吸收负荷(1.48 mol⋅mol−1,单位摩尔吸收剂吸收CO2的量)。Wang等[9]利用L-丙氨酸(L-Ala)和氢氧化钠(NaOH)制备了氨基酸盐类吸收剂用于CO2捕集,该吸收剂具有低挥发性、抗降解、低毒性和再生稳定性良好(循环吸收负荷为0.62 mol⋅mol−1)的优势,其吸收CO2饱和后发生固-液分相,固相中CO2含量为总吸收负荷的90%,且因分相而具有明显的节能潜力。Chen等[10]创新性开发了一种具有固-液相变可控特征的新型非水吸收剂,其由乙二胺(EDA)、2-氨基-2-甲基-1-丙醇(AMP)和N-甲基甲酰胺(NMF)组成。当CO2负荷低于1.04 mol⋅mol−1时,溶液始终保持单相。此后,随着溶液逐渐达到饱和临界点发生固-液相分离行为。当CO2饱和负荷达到1.07 mol⋅mol−1时,约91.45% 的CO2富集在固相中。Chen等[10]通过核磁表征和分子模拟研究了固-液可控的相变机理,证实是产物间的相互作用力增加了中间体的溶解度,从而控制了反应过程中发生的固-液相变。Zheng等[11]构建的新型“可逆极性”功能化离子液体(异佛尔酮二胺-咪唑,[IPDAH][Im]),在仅有水存在时即可发生CO2负荷诱导的固液相变行为。饱和吸收后的CO2产物富集在下相,沉淀为白色结晶粉末。基于实验表征和理论计算的结果,产物之间的强氢键力、汉森(Hansen)溶解度参数以及高晶格能导致了产物在水中自团聚形成,进一步生成固体粉末。[IPDAH][Im]-H2O的再生热负荷仅为1.23 GJ⋅t−1,比传统MEA低约67%,表明其具有巨大的节能潜力。
综上,固-液相变吸收剂节能性能良好,具有较高的研究价值。氨基酸固-液相变吸收剂因其对环境友好、高抗氧化性、高抗热降解性、高表面张力、低挥发性、低腐蚀性、易分相等优势成为较为热门的CO2固-液相变吸收剂。然而,基于纯氨基酸构建的固-液相变吸收剂,其体系黏度、CO2吸收-解吸能力普遍低于胺类吸收剂,无法达到工业性能要求。将氨基酸经中和处理后得到的氨基酸盐被证实具有高CO2反应性和良好的沉淀潜能[12]。在本研究中,充分结合有机胺和氨基酸盐在捕集CO2性能方面的优势,综合选取CO2负荷与沉淀能力等性能较优的丙氨酸钾(K-Ala)作为主吸收剂,并引入耐热降解性好、耐腐蚀性强的仲胺——哌嗪(PZ)作为活化剂,与常见的低毒性有机分相剂正丙醇(NPA)组合,来提高反应速率、生成更易解吸的CO2产物;而后,考察所构建吸收体系的吸收-解吸性能,探究其反应机理与相变机理。本研究为开发新型固-液相变吸收剂提供数据支持和理论依据。
2 实验方法 2.1 实验装置本研究构建的吸收体系于鼓泡吸收装置内进行CO2吸收反应,并测定其吸收负荷、吸收速率等吸收性能,实验装置如图 1所示。
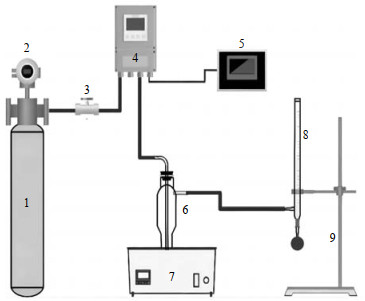
|
图 1 CO2吸收装置 Fig.1 The experimental setup for CO2 absorption 1. CO2+N2 mixed gas cylinder 2. pressure gauge 3. valve 4. mass flowmeter 5. flow indicator 6. bubbling absorption tube 7. thermostatic water bath 8. soap film flowmeter 9. iron support stand |
在解吸阶段,吸收饱和后取富相进行转移并再生CO2。本研究将富含CO2吸收产物的固相及防止固相蒸干的少量液相混合物置于三颈圆底烧瓶中,在常压加热条件下进行解吸再生,以此考察吸收体系的解吸性能。
2.2 表征测试方法通过核磁共振波谱仪(500 MHz AVANCE Ⅲ Bruker,Switzerland)获得样品的碳谱图谱并分析吸收体系于吸收-解吸过程中的组分组成、分布及变化情况。实验中使用氘代水(D2O)作为测试试剂。按照V样品: VD2O=3:4的配比配制溶液。
2.3 参数定义及计算方法(1) CO2吸收速率
CO2吸收速率由计算鼓泡吸收管进、出口处的混合气流量差值获得,具体计算如式(1):
| $R_{\mathrm{CO}_2}=\frac{Q_{\text {in},\text {gas}}-Q_{\text {out},\text{gas}}}{22.4 \times1000}\left(\frac{P_{\text {act}} T_0}{P_0 T_{\text{act}}}\right)$ | (1) |
式中:
(2) CO2吸收容量
CO2吸收容量指吸收剂饱和后的CO2总吸收量,通过CO2吸收速率对时间积分获得,具体计算如式(2):
| $L_{\text {total}, \mathrm{CO}_2}=\int_0^t R_{\mathrm{CO}_2} \mathrm{~d} t$ | (2) |
式中:
(3) CO2吸收负荷
CO2吸收负荷指单位物质的量吸收剂的CO2吸收容量,是表示吸收体系吸收性能强弱的指标。具体计算如式(3):
| $\alpha_{\mathrm{CO}_2}=\frac{L_{\text {total,} \mathrm{CO}_2}}{L_{\text {absorbent }}}$ | (3) |
式中:
(4) CO2再生效率
CO2再生效率指吸收剂解吸后CO2吸收容量与新鲜吸收剂CO2吸收容量的比值,具体计算如式(4):
| $\eta_{\mathrm{CO}_2}=\frac{L_{\mathrm{r}, \mathrm{CO}_2}}{L_{0, \mathrm{CO}_2}} \times 100 \%$ | (4) |
式中:
本研究基于密度泛函理论(DFT)计算了吸收体系各组分的分子偶极矩以及吸收体系中各CO2吸收产物离子对的溶剂化自由能,分析了相变机理,而后基于DFT计算了吸收体系中各CO2吸收产物离子对的分子间氢键数据,初步探究了固相形成原因。
(1) 偶极矩
偶极矩是分子正、负电荷中心间的距离和电荷中心所带电量的乘积,可表示物质极性的强弱,用以判断吸收体系各组分在反应前后的极性差异。根据相似相溶原理,极性相近的组分具有更好的互溶性;相反极性差异越大,溶质与溶剂分相的潜能更大[13]。在Guassian 16W软件中,基于b3lyp/def2-SVPD机组(加弥散函数),对不同反应物及产物分子进行构型优化和频率分析并设置密度溶剂模型(SMD),在最终结果文件中读取偶极矩数据。其中def2系列基组实现了元素周期表前六周期的完全覆盖,在传统pople系列基组上优化了s、p角动量基函数,适合描述分子的极化特性和电子分布[14-15]。
(2) 溶剂化自由能
溶剂化自由能是溶质与溶剂发生溶剂化作用所释放的能量,也是表现溶解性质的物性参数。在相同的内置溶剂中,溶质分子的溶剂化自由能负值越高,说明其被溶剂化的能力越高,从而在溶剂效应下改变化学反应平衡,并影响产物物种分布[16]。在Guassian 16W软件中,设置SMD溶剂模型,基于b3lyp/6-311G基组对吸收产物离子对做结构优化并得到自由能热校正量(EA1),而后基于M052X/6-311G基组计算SMD溶剂模型下的单点能,记为EA2。EA1+EA2即为溶剂存在下的自由能(Esol)。然后,取消溶剂模型(及真空气相),基于b3lyp/6-311G基组做结构优化并得到自由能热校正量(EA3),再基于M052X/6-311G基组计算真空下的单点能,记为EA4。EA3+EA4即为真空气相下的自由能(Egas)。Esol与Egas的差值即为该内置溶剂下的溶剂化自由能,如式(5)。其中,溶剂化自由能的计算除了需要考虑溶剂对溶质电子分布的极化作用,也依赖溶质对溶剂分子熵效应的影响,以及溶质-溶剂分子间的交换互斥和色散吸引作用。Ho等[17]对不同计算级别分别进行参数化,证实了M052X/6-311G机组在计算溶剂效应方面的通用性。
| $ \Delta E={E_{{\text{sol}}}}-{E_{{\text{gas}}}} $ | (5) |
式中:ΔE为溶剂化自由能,kJ⋅mol−1。
3 结果与讨论 3.1 吸收剂捕集CO2性能本研究首先选择了溶解度适中、分子质量较小的K-Ala作为主吸收剂,并选择水作为溶剂,NPA作为分相剂,构建了丙氨酸固-液相变吸收剂,之后向体系中引入PZ活化剂以进一步提高吸收速率,并定向调控固相的生成时间。K-Ala+PZ吸收体系在不同的溶质质量比中的吸收-解吸性能差异如图 2所示。其中,NPA和水的体积比固定为5:5。
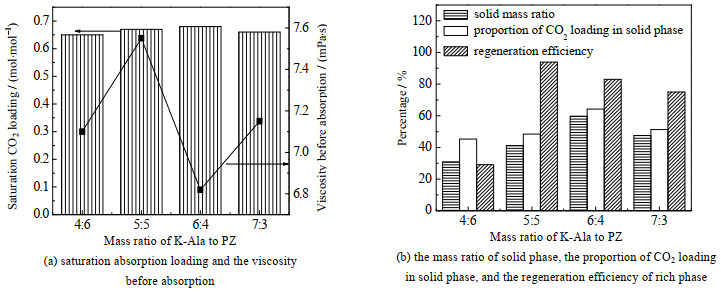
|
图 2 不同溶质质量比下K-Ala+PZ体系的吸收-解吸性能差异 Fig.2 Absorption-desorption properties of the K-Ala+PZ system under different solute mass ratios |
如图 2(a)所示,随PZ质量分数提高,体系吸收负荷先上升后下降,当吸收剂质量比mK-Ala: mPZ=6:4时,吸收体系CO2饱和吸收负荷达到最大值(0.68 mol⋅mol−1)并且接近理论吸收负荷(0.70 mol⋅mol−1)。而传统的商用MEA溶液(质量分数为30%)吸收负荷仅为0.40~0.50 mol⋅mol−1[18]。此外,不同溶质质量配比下体系的初始黏度差异不大(6.82~7.55 mPa⋅s),且质量比mK-Ala: mPZ=6:4的吸收体系初始黏度最低。进一步针对体系中固相质量占比、固相中CO2负荷百分比及富相再生效率展开测试,结果如图 2(b)所示。在图 2(b)中,吸收剂质量比mK-Ala: mPZ=5:5时固相再生效率最高(93.89%),但该比例下CO2在固相中的负荷占比不到50%,说明分相性能不理想;当吸收剂质量比mK-Ala: mPZ=6:4时,吸收饱和后固相中CO2负荷占比达64.20%,此时再生效率也较优,为83.04%,而商用MEA溶液的再生效率不到50% [19]。此外,Zhang等[20]总结了几十种有机胺类相变吸收剂的捕集性能,发现这些吸收剂的再生效率大多仅为40%~50%;类似地,Zhou等[21]开发的二乙烯三胺(DETA)/五甲基二乙烯三胺(PMDETA)/H2O相变吸收体系再生后仅能释放出富液中CO2总物质的量的40.7%。由此表明,本研究构建的K-Ala+PZ体系在捕集CO2过程中具有良好的可循环性。分析不同吸收剂质量配比下CO2捕集性能差异的原因,在吸收剂质量比mK-Ala: mPZ=6:4~7:3的区间内,此时K-Ala作为主要组分参与CO2吸收并持续产生固体产物——丙氨酸钾氨基甲酸酯(K-Ala-COO−),且吸收剂中PZ质量分数的适当提高会增加吸收产物哌嗪氨基甲酸酯(PZ-COO-)的伴随析出。当吸收剂质量比mK-Ala: mPZ=5:5时,PZ-COO−开始有向液相中转移的趋势;而当吸收剂质量比继续降低至mK-Ala: mPZ=4:6时,PZ-COO−主要位于液相中。综合图 2,确认mK-Ala: mPZ=6:4为最佳溶质比例。
在明确了溶质比例后,进一步对溶剂NPA和水的比例进行优化,不同溶剂比例下体系的吸收-解吸性能差异如图 3所示。此时,固定mK-Ala: mPZ=6:4。
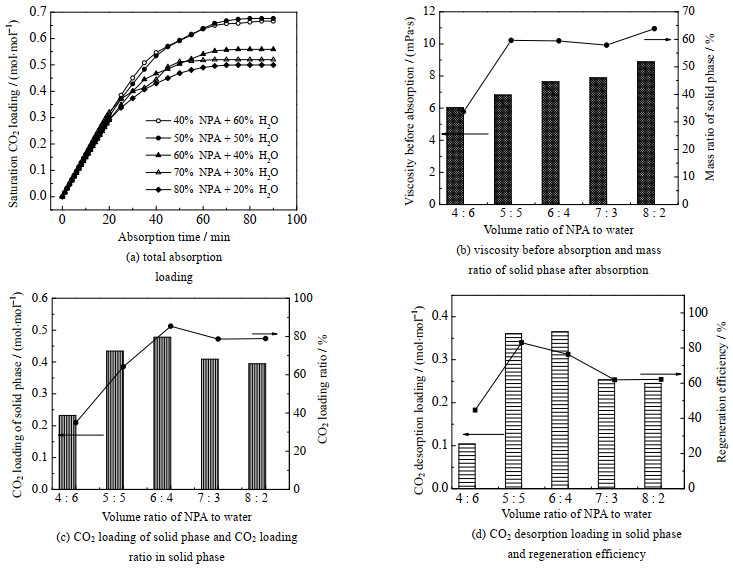
|
图 3 不同溶剂体积比下K-Ala+PZ体系的吸收-解吸性能差异 Fig.3 Absorption-desorption properties of the K-Ala+PZ system under different solvent volume ratios |
由图 3(a)可知,VNPA: VH2O=4:6~5:5时,总吸收负荷均很高,可接近理论吸收负荷,但随着NPA体积分数增加,体系吸收饱和时的吸收负荷开始下降。在吸收体系黏度及生成的固相质量占比方面,由图 3(b)可知,当溶剂中NPA的体积比从4:6提高至5:5时,固相生成量明显增加,而后继续提高NPA的溶剂配比时固相生成量略微上升,同时随着NPA溶剂体积比的提高,体系初始黏度保持明显上升趋势。上述结果说明分相剂的体积比是影响体系初始黏度的关键因素,而体系黏度的增加会限制CO2与吸收剂之间的气-液传质,降低反应速率进而影响吸收性能。因此,在相变吸收剂的构建中,需要严格把控分相剂与水的比例。进一步考虑到固相中的CO2负荷,由图 3(c)可知,在K-Ala+PZ吸收体系中,NPA溶剂体积比的提高使得固相吸收负荷及负荷占比均呈先上升后下降的趋势,推测原因为在溶剂配比VNPA: VH2O=4:6~5:5的体系中NPA体积分数适中,促进了固相的生成与吸收产物向固相的转移。在解吸环节,如图 3(d),随着NPA溶剂体积比的提高,固相解吸负荷及再生效率均呈先上升后下降的趋势。在VNPA: VH2O=4:6~5:5的适中比例下,固相饱和产物除了有K-Ala-COO−和PZ-COO−外,也很可能加速了水在碱性环境中的解离,因而生成了极易解吸的碳酸氢盐(HCO3−)。随着HCO3−在该溶剂比下的伴随析出,大大提高了CO2再生效率。综合考虑NPA对体系吸收-解吸性能的影响,确定最佳溶剂体积比VNPA: VH2O=5:5,最佳溶质质量比mK-Ala: mPZ=6:4。
3.2 吸收-解吸机理在确定了新型CO2固-液相变吸收体系组成及相应配比后,本研究结合核磁共振碳谱(13C NMR)表征测定吸收体系在不同反应阶段的组分种类及分布变化情况。由图 4可知,在吸收前的体系中,于化学位移9.79(C1)、24.86(C3)、63.45(C7)处可观察到NPA的烷基信号峰,于20.55(C2)、51.49(C6)、184.03(C11)处可观察到K-Ala的烷基信号峰,于大约45.00(C4、C5)处可观察到PZ的烷基信号峰。此外,在体系吸收CO2后,在固相中可于162.40、163.15(C8、C8’)处观察到PZ-COO−的烷基信号峰,于163.75(C9)处观察到K-Ala-COO−的烷基信号峰,于161.44(C10)处观察到HCO3−的烷基信号峰。在解吸后,固相中HCO3−的烷基信号峰消失,两种氨基甲酸酯的信号峰仍存在。
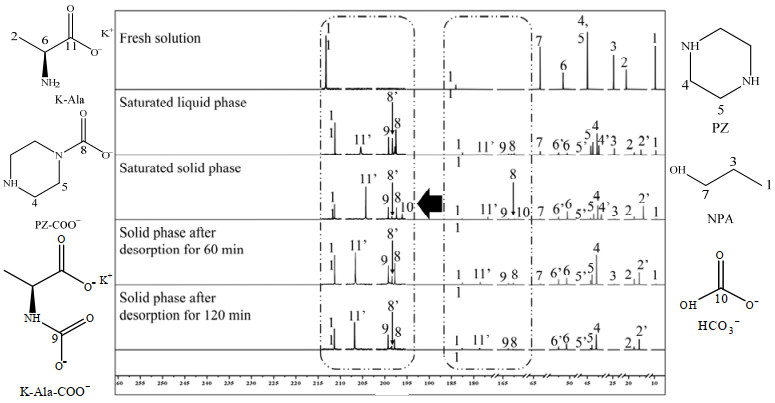
|
图 4 K-Ala+PZ+NPA+H2O体系捕集CO2的13C NMR图 Fig.4 13C NMR spectra of CO2 capture in the K-Ala+PZ+NPA+H2O system |
如图 4所示,在吸收阶段,饱和的液相和固相中都存在部分K-Ala、PZ-COO−及K-Ala-COO−等CO2产物,但固相中还存在明显的HCO3−信号峰,印证了前述的观点,即特定的溶剂比下,溶质组分可以促使水的部分解离并与CO2结合生成HCO3−,其中HCO3−、PZ-COO−及K-Ala-COO−等产物伴随析出,提升固相中CO2负荷。在固-液相变吸收剂中,为了使溶质更多地存在于富相,需要严格控制并优化溶剂的比例。另外,在解吸阶段,发现解吸时间由120 min减少至60 min后,解吸后固相中未出现HCO3−的信号峰,说明HCO3−具备较高的解吸反应平衡常数的同时,还具备较快的解吸反应速率,因此可适当减少解吸所需时间,有利于进一步降低解吸能耗。相反,氨基甲酸酯在120 min后仍不能完全解吸,但PZ-COO−的剩余质量浓度低于K-Ala-COO−,说明PZ的衍生产物结构更加不稳定,这与其环状结构的斥力和位阻作用有关。通常分子的立体位阻性越强,CO2产物的结合能越低,越有利于解吸[22]。在本研究中,K-Ala的存在使得PZ及其产物更易在固相中析出,以共同促进CO2的吸收和再生过程。
3.3 分相机理吸收剂中各组分的相变行为与其分子的极性有关,在吸收前体系中吸收剂与溶剂极性相近,形成均相,而吸收CO2后体系生成极性与溶剂存在明显差异的吸收产物,出现分相性状。分子的极性可用偶极矩来反映其强弱,偶极矩数值越大,分子极性越强[23]。本研究通过量子化学计算获得了在溶剂体积比VNPA: VH2O=5:5的溶剂环境下,K-Ala+PZ贫水吸收体系在吸收CO2前后,各组分的极性变化情况。为了辅助说明分相机理,研究还选择与H2O和NPA溶解度均更高的脯氨酸钾(K-Pro)体系进行对比。结果如图 5所示。
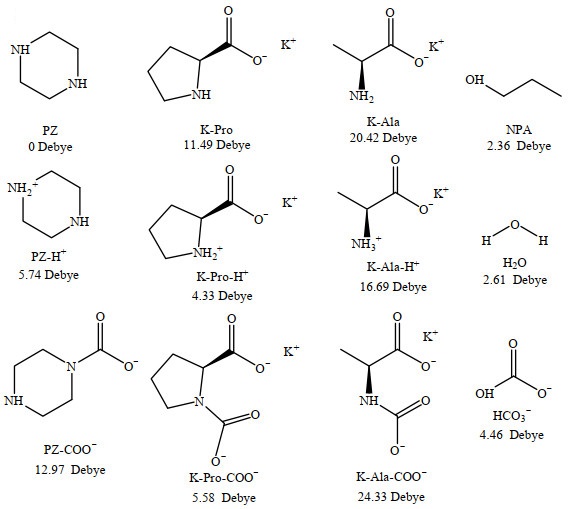
|
图 5 不同物质于溶剂体积比为VNPA: VH2O=5:5的溶剂环境下的偶极矩 Fig.5 Dipole moment of different molecule in solvent environment with volume ratio of VNPA: VH2O=5:5 |
在捕集CO2前,K-Ala+PZ贫水吸收体系中主要包含的组分是溶质PZ、K-Ala、分相剂NPA和溶剂H2O。其中PZ因具有完全对称的结构,净偶极矩为零。相较于K-Ala的偶极矩数值(20.42 Debye),PZ的偶极矩数值与溶剂NPA和H2O的偶极矩数值(2.36 Debye和2.61 Debye)更为接近,故反应前PZ在整个体系中溶解性更好。在吸收CO2过程中,基于两性离子机理,PZ与CO2反应后生成的产物PZ-H+(5.74 Debye)与PZ-COO−(12.97 Debye)的偶极矩均较未反应的PZ均有所提高,即PZ的吸收产物比PZ更易在溶剂中发生相变。对于K-Ala而言,产物K-Ala-H+的偶极矩数值(16.69 Debye)较K-Ala降低,但K-Ala-COO−的偶极矩数值(24.33 Debye)较K-Ala提高,这使得在固液分相后K-Ala于两相中均有分布。整体而言,K-Ala吸收产物的偶极矩与NPA和H2O的差值最大,导致实验时出现K-Ala的吸收产物最先析出并快速转移至固相的现象。
为了说明K-Ala在相分离方面的优势,将K-Ala的偶极矩变化情况与天然氨基酸中溶解性能最好的K-Pro进行比较,发现反应前K-Pro的偶极矩(11.49 Debye)明显低于K-Ala,并且在反应后,与K-Ala-COO−偶极矩大于K-Ala使得吸收产物易发生分相的情况不同,产物K-Pro-COO−的偶极矩(5.58 Debye)甚至小于反应前的K-Pro,故K-Pro贫水吸收体系吸收饱和后分相现象不明显,且导致K-Pro贫水吸收体系生成的固相主要组分为偶极矩更大的K-Pro,而非产物K-Pro-COO−。
除偶极矩外,吸收体系中不同组分的分相行为还受溶剂化效应的影响。基于两性离子机理,吸收CO2后,产物分子在溶剂中受静电相互作用,易以离子对形式存在[11]。研究构建了基于不同产物的离子对模型,并计算了在溶剂体积比为VNPA: VH2O=5:5的环境下,K-Pro-COO−与K-Pro-H+离子对以及K-Ala+PZ贫水吸收体系与CO2反应后生成的产物离子对的溶剂化自由能,结果如图 6所示。
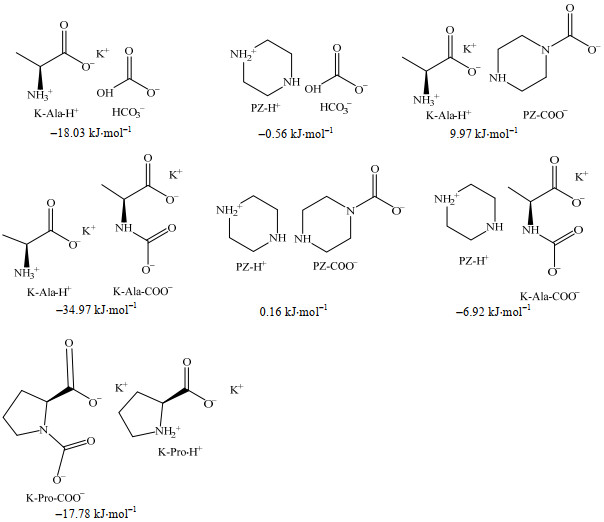
|
图 6 不同CO2吸收产物离子对在溶剂体积比为VNPA: VH2O=5:5的溶剂环境下的溶剂化自由能 Fig.6 Solvation free energy of ion pairs of different CO2 absorption products with volume ratio of VNPA: VH2O=5:5 |
以分相现象不明显的K-Pro-COO−与K-Pro-H+离子对的溶剂化自由能(−17.78 kJ⋅mol−1)为基准,发现在K-Ala+PZ吸收体系的产物离子对中,PZ-H+与HCO3−离子对(−0.56 kJ⋅mol−1)、PZ-H+与K-Ala-COO−离子对(−6.92 kJ⋅mol−1)的溶剂化自由能较基准更接近正值,而PZ-H+与PZ-COO−离子对(0.16 kJ⋅mol−1)、K-Ala-H+与PZ-COO−离子对(9.97 kJ⋅mol−1)的溶剂化自由能已是正值,即大部分K-Ala与PZ的CO2吸收产物溶剂化自由能较低,说明吸收产物分子间内聚力大于溶剂分子对产物分子的作用力,因此处于溶剂中的状态不稳定,易发生分相。此外,K-Ala相关产物离子对的溶剂化自由能较PZ产物离子对而言负值更高,说明在当前溶剂条件下K-Ala吸收体系引入PZ更有利于固相吸收产物生成。
4 结论研究构建的新型固-液相变吸收体系为吸收剂质量比mK-Ala: mPZ=6:4、溶剂体积比为VNPA: VH2O=5:5的K-Ala+PZ+NPA+H2O吸收体系,其物质的量吸收量为0.68 mol⋅mol−1、吸收饱和后固相中CO2负荷占比达64.20%、再生效率为83.04%。此外,固相呈粉末状易于分离运输。13C NMR和量子化学计算结果表明,在选定的K-Ala+PZ+NPA+H2O吸收体系中,吸收产物为存在于固液两相的K-Ala-COO−、PZ-COO−与存在于固相的HCO3−。PZ及K-Ala在与CO2反应后生成极性较溶剂差异大、溶剂化自由能低的产物(氨基甲酸酯及质子化胺)。产物在溶剂中溶解度逐渐降低并使得吸收体系出现分相性状,最终产物间实现强自聚并形成粉末状的固-液分相。
| [1] |
牟俊锟, 毕金鹏, 李福昭, 等. 燃煤电厂二氧化碳燃烧后捕集技术研究进展[J]. 齐鲁工业大学学报, 2023, 37(3): 8-17. MU J K, BI J P, LI F Z, et al. Research progress of post-combustion carbon dioxide capture technologies in coal fired power plants[J]. Journal of Qilu University of Technology, 2023, 37(3): 8-17. |
| [2] |
鲁博文, 张立麒, 徐勇庆, 等. 碳捕集、利用与封存(CCUS)技术助力碳中和实现[J]. 工业安全与环保, 2021, 47(增刊1): 30-34. LU B W, ZHANG L Q, XU Y Q, et al. Carbon capture, utilization and storage (CCUS) technology helps to the realization of carbon neutralization[J]. Industrial Safety and Environmental Protection, 2021, 47(Suppl.1): 30-34. |
| [3] |
刘凡. 氨基功能化离子液体/有机溶剂复合体系捕集CO2的传质-反应机理及动力学[D]. 杭州: 浙江大学, 2022. LIU F. Mass transfer-reaction mechanisms and kinetics of CO2 capture by amino functionalized ionic liquid organic solvents [D]. Hangzhou: Zhejiang University, 2022. |
| [4] |
沈丽, 刘凡, 沈遥, 等. 新型AEP-相变吸收剂捕集CO2研究[J]. 高校化学工程学报, 2021, 35(6): 1067-1072. SHEN L, LIU F, SHEN Y, et al. Study on novel AEP-based biphasic solvents for CO2 capture[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(6): 1067-1072. DOI:10.3969/j.issn.1003-9015.2021.06.015 |
| [5] |
张宝幸, 李海涛, 陈曦, 等. 相变吸收剂捕集CO2技术的研究进展[J]. 能源化工, 2020, 41(5): 8-11. ZHANG B X, LI H T, CHEN X, et al. Research progress on CO2 capture technology with phase change absorbent[J]. Energy Chemical Industry, 2020, 41(5): 8-11. DOI:10.3969/j.issn.1006-7906.2020.05.002 |
| [6] |
CHEN Z, YUAN B L, ZHAN G X, et al. Energy-efficient biphasic solvents for industrial carbon capture: Role of physical solvents on CO2 absorption and phase splitting[J]. Environmental Science & Technology, 2022, 56(18): 13305-13313. |
| [7] |
PAPADOPOULOS A I, TZIRAKIS F, TSIVINTZELIS I, et al. Phase-change solvents and processes for postcombustion CO2 capture: A detailed review[J]. Industrial & Engineering Chemistry Research, 2019, 58(13): 5088-5111. |
| [8] |
ZHENG S D, TAO M N, LIU Q, et al. Capturing CO2 into the precipitate of a phase-changing solvent after absorption[J]. Environmental Science & Technology, 2014, 48(15): 8905-8910. |
| [9] |
WANG X F, AKHMEDOV N G, HOPKINSON D, et al. Phase change amino acid salt separates into CO2-rich and CO2-lean phases upon interacting with CO2[J]. Applied Energy, 2016, 161: 41-47. DOI:10.1016/j.apenergy.2015.09.094 |
| [10] |
CHEN X Y, LIJIN Y Z, CHEN Y L, et al. Regulation mechanism of CO2 capture into the novel non-aqueous biphasic solvent: Solid-liquid phase change controllable[J]. Separation and Purification Technology, 2024, 340: 126751. DOI:10.1016/j.seppur.2024.126751 |
| [11] |
ZHENG Y M, ZHANG S Y, LIU Y C, et al. A novel binary solid-liquid biphasic functionalized ionic liquids for efficient CO2 capture: Reversible polarity and low energy penalty[J]. Separation and Purification Technology, 2023, 313: 123486. DOI:10.1016/j.seppur.2023.123486 |
| [12] |
RAMEZANI R, MAZINANI S, DI FELICE R. State-of-the-art of CO2 capture with amino acid salt solutions[J]. Reviews in Chemical Engineering, 2022, 38(3): 273-299. DOI:10.1515/revce-2020-0012 |
| [13] |
JIN L J, HOU X Y, ZHAN L X, et al. Capturing CO2 using novel nonaqueous biphasic solvent TMEDA/MEA/DMSO: Absorption and phase splitting mechanism[J]. Chemical Engineering Journal, 2024, 484: 149293. DOI:10.1016/j.cej.2024.149293 |
| [14] |
POLLAK P, WEIGEND F. Segmented contracted error-consistent basis sets of double-and triple-ζ valence quality for one-and two-component relativistic all-electron calculations[J]. Journal of Chemical Theory and Computation, 2017, 13(8): 3696-3705. DOI:10.1021/acs.jctc.7b00593 |
| [15] |
RAPPOPORT D. Property-optimized Gaussian basis sets for lanthanides[J]. The Journal of Chemical Physics, 2021, 155(12): 124102. DOI:10.1063/5.0065611 |
| [16] |
WANG C, KONG W X, DONG Z F, et al. Alcohol regulated phase change absorbent for efficient carbon dioxide capture: Mechanism and energy consumption[J]. Journal of Environmental Sciences, 2025, 150: 440-450. DOI:10.1016/j.jes.2023.09.022 |
| [17] |
HO J, KLAMT A, COOTE M L. Comment on the correct use of continuum solvent models[J]. The Journal of Physical Chemistry A, 2010, 114(51): 13442-13444. DOI:10.1021/jp107136j |
| [18] |
PUTTA K R, PINTO D D D, SVENDSEN H F, et al. CO2 absorption into loaded aqueous MEA solutions: Kinetics assessment using penetration theory[J]. International Journal of Greenhouse Gas Control, 2016, 53: 338-353. DOI:10.1016/j.ijggc.2016.08.009 |
| [19] |
AVOR E P, SUPAP T, NARKU-TETTEH J, et al. Achieving net-zero CO2 emissions from indirect co-combustion of biomass and natural gas with carbon capture using a novel amine blend[J]. International Journal of Greenhouse Gas Control, 2023, 130: 104005. DOI:10.1016/j.ijggc.2023.104005 |
| [20] |
ZHANG S H, SHEN Y, WANG L D, et al. Phase change solvents for post-combustion CO2 capture: Principle, advances, and challenges[J]. Applied Energy, 2019, 239: 876-897. DOI:10.1016/j.apenergy.2019.01.242 |
| [21] |
ZHOU X B, JING G H, LYU B H, et al. Low-viscosity and efficient regeneration of carbon dioxide capture using a biphasic solvent regulated by 2-amino-2-methyl-1-propanol[J]. Applied Energy, 2019, 235: 379-390. DOI:10.1016/j.apenergy.2018.10.118 |
| [22] |
LIU S, LING H, GAO H X, et al. Kinetics and new Brønsted correlations study of CO2 absorption into primary and secondary alkanolamine with and without steric-hindrance[J]. Separation and Purification Technology, 2020, 233: 115998. DOI:10.1016/j.seppur.2019.115998 |
| [23] |
LIU F, FANG M X, YI N T, et al. Research on alkanolamine-based physical-chemical solutions as biphasic solvents for CO2 capture[J]. Energy & Fuels, 2019, 33(11): 11389-11398. |




