目前生物冶金技术在工业应用上取得了一定进展,但由于存在菌体增长速度缓慢,氧化周期较长等问题严重限制了其在工业生产中的大规模应用[1]。浸矿菌氧化还原性硫和二价铁获得能量维持生长,将得到的电子通过电子传递链传递给氧气,因此充足的氧供应(即富氧条件)对微生物快速高效地进行氧化反应至关重要,由于使用的矿石、菌种、反应器结构和反应条件不同,不同研究关于氧的供应存在较大差异。de Cock等[2]用古菌浸矿时发现,DO高于1.5 ppm时就不会发生氧限制,也有报道[3]称限制性DO浓度为0.1 ppm。然而,Gericke等[4]用极端嗜热菌浸出黄铜矿精矿时总结出当DO高于50%饱和溶氧时才不会发生氧限制。有研究表明,矿石的生物氧化速率和菌体的比生长速率随着溶氧(DO)浓度提高而增大[5],然而溶氧也不是可以无限增大,当溶解氧处于较高水平时,进一步提高DO时,却会导致生物氧化效率增长减慢。因此,对于特定的氧化系统仍需要实验确定最佳的溶氧水平,本实验所用富含黄铁矿的金精矿在氧化过程中需要消耗较多的氧气,常规空气进气不能满足其氧化过程中对氧的需求,理论上,富氧条件下氧分压增大,氧传质速率增加,对生物氧化效率的提高有明显的促进作用,而现有报道对于其在富氧条件下的氧化情况研究较少,为此本论文对富氧条件下的矿石氧化、菌体生长和活性等方面进行了深入细致的研究。此外,Fe2+是铁氧化浸矿菌较易利用的能源物质,溶液中Fe2+可为细菌提供能源物质,加快浸矿菌的生长繁殖速度,进而对矿石的生物氧化产生影响[6],另外初始添加Fe2+的量也影响到浸矿反应后期铁沉淀的生成量,沉淀量增多会覆盖在矿石颗粒表面减慢反应速率,所以研究初始Fe2+浓度对生物预处理难处理金精矿的影响具有非常重要的意义,特别是在富氧条件下,冶金菌株对能源物质Fe2+的需求情况也会影响到后续改进策略的建立,关于这方面的研究尚未见公开报道。
为此本研究重点考察富氧条件下DO对生物氧化过程效率、活性氧含量的影响,并研究了富氧条件下Fe2+初始浓度对生物氧化过程效率的影响。希望深入探究气体及能源物质供应对生物氧化过程的影响机制,为生物冶金的进一步发展提供技术支持和科学指导。
2 实验材料和方法 2.1 菌种和培养基本实验所用菌种由新疆某金矿提供,采用高通量测序的方法对菌种16S rDNA V4区进行测序分析,混合菌群中细菌所在的属主要为Leptospirillum(78%)和Sulfobacillus(13%)。使用时将冰箱中冻存的原始菌种加入到10 %(wt)浓度的矿浆中,使初始pH为1.40,温度41℃,200 r·min-1摇床培养至对数生长期,然后作为种子进行接种。
实验所用培养基为9K培养基[7],组成为(g·L-1):(NH4)2SO4 3.0,KCl 0.1,K2HPO4 0.5,MgSO4·7H2O 0.5,Ca (NO3)20.01,FeSO4·7H2O 44.2,浓硫酸调节pH至1.40。
2.2 实验矿样实验所用矿样由新疆某金矿提供,其中Au含量为(45±1)g·t-1,Ag含量为(60±2) g·t-1,其他元素含量分别为Fe (28±1)%,S (28±2)%,As含量在3%~4%,基本不含C、Cu、Pb、Zn。矿石的XRD分析结果显示,矿物主要成分为黄铁矿和石英石。矿样经磨细后筛分,用于实验的矿石粒径在63~90 μm。
2.3 实验方法 2.3.1 DO对难处理金精矿生物氧化的影响在1.5 L实验室通气搅拌釜式反应器中加入900 mL无铁9K培养基和100 g难处理金精矿,100 mL种子液,设置搅拌转速为300 r·min-1,初始pH为1.40,温度41℃。本实验为考察提高DO对生物氧化过程的影响,控制DO分别为2.51 ppm,3.75 ppm,5.01 ppm,7.51 ppm(对应40%,60%,80%,120%饱和溶氧)。四组实验中空气流量始终相同,通过控制通入纯O2量以实现不同溶氧浓度。每天定时取样,离心后测定上清的pH、Eh、Fe2+浓度、Fe3+浓度、菌体量,并测定菌体OUR(摄氧率)的变化。取对数生长期菌体测定菌体内活性氧含量。
2.3.2 Fe2+浓度对难处理金精矿生物氧化的影响为考察富氧条件下初始Fe2+浓度对难处理金精矿生物氧化效率的影响关系,本研究在三个反应器的培养基中分别加入1)0 g·t-1的Fe2+;2)1 g·t-1的Fe2+;3)6 g·t-1的Fe2+,控制初始Fe2+浓度分别为:0.14,1.11,5.99 g·t-1 Fe2+,为保证富氧条件,实验过程中通过富氧空气将DO控制在4.0 ppm,其余条件分别为:矿浆浓度10%(wt),搅拌转速300 r·min-1,初始pH 1.40,温度41℃,接种量10%(v/v)。每天定时取样,离心后测定溶液的pH、Eh、Fe2+浓度、Fe3+浓度和菌体量。并跟踪测定过程中OUR的变化。
2.4 测定和分析方法使用pH/Eh计测量矿浆的pH和Eh (Mettler model Fe2+0),DO采用溶氧电极(OXYFERM 225, Hamilton)测量。矿石溶解情况通过矿浆溶液中铁离子浓度测定,Fe3+浓度采用乙二胺四乙酸二钠(EDTA-2Na)溶液络合滴定法[8]进行测定,Fe2+浓度通过重铬酸钾滴定的方式[9]进行测定,总铁浓度为Fe3+浓度和Fe2+浓度之和。OUR可以采用动态法[10]测定。由于本实验所用浸矿菌绝大多数吸附在矿石上,显微镜观察液相中游离细菌数极少,且细菌与矿石吸附紧密不易获得,故菌体量的测定采用Bradford法[11],即考马斯亮蓝(CBB)测定矿石上吸附菌菌体蛋白量的方法来估测细菌数量,取0.2 g烘干的矿样,加入3 mL浓度为0.2 mol·L-1的NaOH溶液,沸水浴15 min后,定容至5 mL,取1 mL稀释一定倍数的消化液,加入4 mL考马斯亮蓝染色液,5 min后测定595 nm波长处的吸光值,与标准曲线进行对比即知蛋白量。活性氧检测取对数生长中后期菌体,采用DCFH法[12]进行。
矿石的氧化率(λ)和氧化速率(υ)通过以下方法计算[13]:
| $\lambda = \frac{{{{\left[{{\rm{Fe}}} \right]}_{{t_i}}} - {{\left[{{\rm{Fe}}} \right]}_{{t_0}}}}}{{{{\left[{{\rm{Fe}}} \right]}\rm{_p}}}} \times 100\% $ |
| $\upsilon = \frac{{{{\left[{{\rm{Fe}}} \right]}_{{t_j}}} - {{\left[{{\rm{Fe}}} \right]}_{{t_i}}}}}{{{t_j} - {t_i}}}$ |
[Fe]t0,[Fe]ti和[Fe]tj分别为初始时刻和任意两个时刻时矿浆中的总铁浓度,[Fe]p为氧化前矿石内含有的铁若全部浸出矿浆中的总铁浓度。所有实验操作均重复三次以减少误差。
3 实验结果与讨论 3.1 DO对矿石生物氧化的影响DO对矿石生物氧化过程的影响如图 1所示。如图 1 A和1 D,Fe3+浓度和矿石氧化率随着生物氧化过程进行而增大,且随DO浓度升高,二者均先增加后降低。3.75 ppm DO时,Fe3+浓度最高,Fe2+浓度最低,表明此时矿石氧化效果最好。值得注意的是,DO高于5.01 ppm时,矿石氧化受到抑制,此时的矿石氧化速率和氧化率均低于3.75 ppm DO。可见,DO为3.75 ppm已经足够维持高的矿石氧化速率,继续升高DO对氧化不利且会造成资源浪费。De kock[2]等提出,4.1 ppm及以上溶氧浓度为抑制性溶氧浓度,这与本研究的结果非常接近。
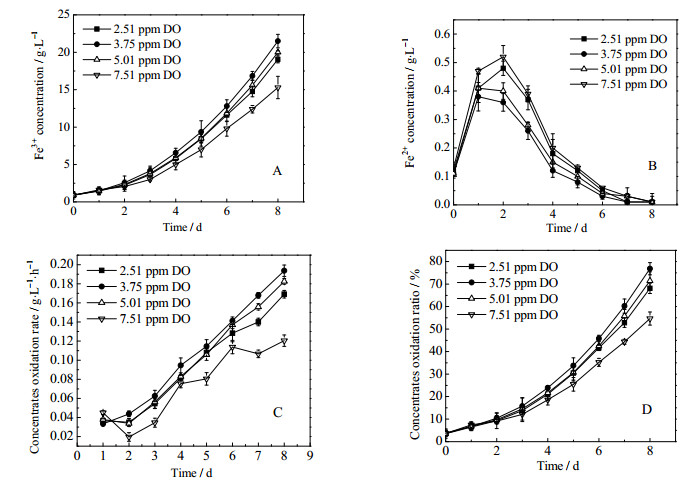
|
图 1 DO对矿石生物氧化过程的影响 Fig.1 Effects of DO on biooxidation of refractory gold concentrates A: Fe3+ concentration B: Fe2+ concentration C: concentrates oxidation rate D: concentrates oxidation ratio |
从图 1 C可以看出,随溶氧浓度增大,氧化速率先增加后下降,3.75 ppm DO时生物氧化速率达到最大。氧作为电子传递链的最终电子受体,当DO低于3.75 ppm时会因氧供应不足限制生物氧化的进行,然而,继续增加DO也会导致氧化效率降低,这可能是高溶氧对微生物的毒害作用[14]。
浸矿菌生活在低pH、高可溶性金属浓度和高氧消耗的环境中,极易产生活性氧[15],同时,溶氧浓度增加会导致产生更多的活性氧[16],这些活性氧可能是高溶氧条件下生物氧化效率下降的重要原因[17]。Imlay[18]发现,细胞外的H2O2可以持续通过细胞膜扩散进入细胞质,在那里与不稳定的铁离子形成•OH。有证据表明,一定条件下黄铁矿表面可以持续产生活性氧,尤其在pH低于3的时候,即活性氧的产生并不局限于与溶液接触的初始阶段[19, 20],因此活性氧对微生物氧化具有很大的影响。胞内活性氧含量是否会随着环境DO水平的变化而变化呢?是否与矿石氧化效率之间存在某种对应关系呢?为此,本研究对不同DO条件下菌体内ROS含量进行了考察。
本实验采用DCFH法对各溶氧水平下菌体内活性氧含量进行了检测,测定结果如图 2。可以看到,随溶氧水平提高菌体内活性氧含量呈上升趋势。Cárdenas等人[14]发现浸矿微生物缺乏消除活性氧的酶,仅靠大分子修复系统对受损的DNA、蛋白质等进行修复,因此更易受到活性氧的毒害,高溶氧水平下活性氧的大量产生会对菌体活性产生更多的不利影响[17],降低矿石氧化速率[16],这或许能够解释为什么为浸矿微生物提供更多的溶氧反而使生物氧化效率下降。
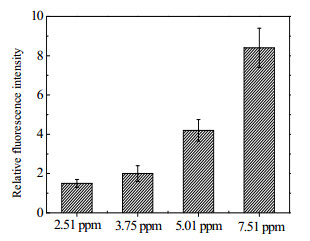
|
图 2 不同溶氧水平下菌体内ROS含量 Fig.2 The content of ROS in cells under different DO concentrations |
图 3A 显示了不同DO水平下浸出液的pH值,在整个生物氧化过程中,pH值先略有上升后随时间下降。因为生物氧化初期,菌体浓度低活性差,矿石氧化主要是通过化学氧化[21]:
| $ 4{\rm{F}}{{\rm{e}}^{2 + }} + {{\rm{O}}_2} + 4{{\rm{H}}^ + } = 4{\rm{F}}{{\rm{e}}^{3 + }} + 2{{\rm{H}}_2}{\rm{O}} $ |

|
图 3 溶氧对pH和Eh的影响 Fig.3 Effects of DO on pH and Eh A: effect of DO on pH B: effect of DO on Eh |
该反应是耗酸过程,因此浸矿初期pH值上升。随浸矿过程进行,浸矿菌不断氧化黄铁矿生成H2SO4,浸出液pH也不断下降。相同浸矿时间3.75 ppm DO时pH值最低,表明此溶氧水平时矿石氧化生成H2SO4的速率最大。
观察图 3B ,生物氧化开始后,四个DO水平下浸出液的Eh值均先下降后上升。因为接种后菌体氧化活性低,导致浸出液中Fe3+化学氧化产生的Fe2+不能快速被细菌氧化,由Nernst方程:
| $ E = {E^0} + 2.3RT/nF \cdot \log \left( {{\rm{F}}{{\rm{e}}^{3 + }}/{\rm{F}}{{\rm{e}}^{2 + }}} \right) $ |
可知,Eh与溶液中[Fe3+]/[Fe2+]呈正相关,因此随菌体数量增加和氧化活性增强,对Fe2+氧化加快,Fe2+迅速被氧化成Fe3+,导致Eh值出现上升。由于3.75 ppm DO时Fe2+氧化的速度更快,导致同时间3.75 ppm DO时的Eh值高于其他溶氧水平。
OUR是发酵过程中一个非常重要的参数,它反映了整个菌群的代谢活性。如图 4,氧化过程中OUR大小依次是:OUR(3.75 ppm)>OUR(5.01 ppm)>OUR(2.51 ppm)>OUR(7.51 ppm),反映出了菌群代谢活性在3.75 ppm DO时最高,溶氧低于3.75 ppm时,供氧不足导致OUR较低,溶氧高于3.75 ppm DO时,如前所述,由于高溶氧水平下会产生更多的活性氧,其对菌体产生的毒害可能是OUR下降的重要原因。
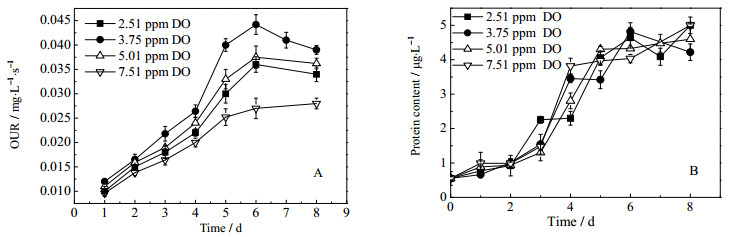
|
图 4 溶氧对菌体生长和活性的影响 Fig.4 Activity and growth of bacteria during biooxidation processes under different DO concentrations A: evolution of OUR during the biooxidation process under different DO concentrations B: growth of bacteria during the biooxidation process under different DO concentrations |
图 4B 为不同溶氧条件下,生物氧化过程中菌体的生长情况,由蛋白含量表示。由实验结果可以发现,菌体量随氧化过程进行而增多,随生长进入稳定期而维持平稳水平,各溶氧水平下菌体量差别不大。根据前面的分析,溶氧水平高于和低于3.75 ppm时,矿石氧化率和氧化速率均下降,但从菌体量的变化来看菌体量并未发生明显下降,因此溶氧主要是通过影响菌体活性而非菌体量的方式影响了生物氧化效率。
3.2 初始Fe2+浓度对矿石生物氧化的影响图 5显示了初始Fe2+浓度对矿石生物氧化的影响。图 5A 可见,第1天时5.99 g·t-1初始Fe2+浓度的实验组矿浆中Fe3+浓度突然升高并在之后维持较高水平,是因为开始时加入了较多的Fe2+,而Fe2+是细菌较易利用的能源物质,第1天时就被大量氧化成为Fe3+,故维持了较高的Fe3+浓度。
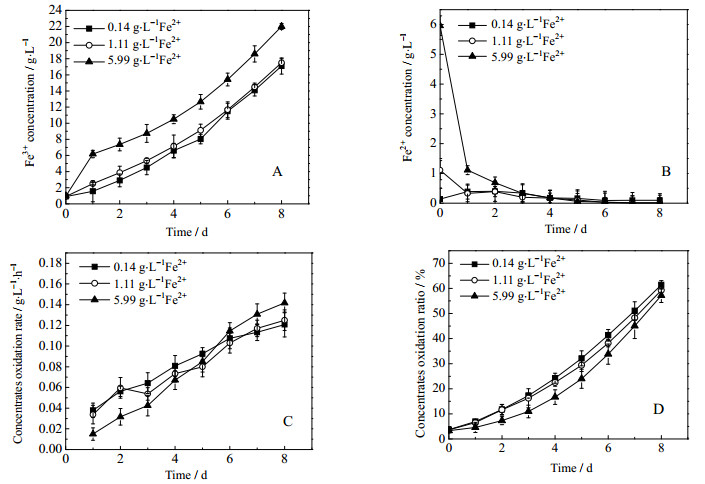
|
图 5 初始Fe2+浓度对矿石生物氧化的影响 Fig.5 Effects of initial Fe2+ concentration on biooxidation of refractory gold concentrates A: concentration of Fe3+ B: concentration of Fe2+ C: concentrates oxidation rate D: concentrates oxidation ratio |
图 5 B是Fe2+浓度的变化图,除了对照组Fe2+浓度在第1天稍有升高之后不断下降外,另两组浸出液中Fe2+浓度第1天开始就大幅下降,可见相比于矿石中的二价铁,矿浆中的Fe2+更易被浸矿菌所利用。
从图 5 C和图 5 D可以看到富氧条件下添加Fe2+在浸矿前期降低了矿石的氧化速率和氧化率,但随着浸矿过程进行,氧化速率会逐渐增大,氧化率也会逐渐接近对照组。
虽然很多研究均表明,初始Fe2+浓度存在一个最佳值,随Fe2+浓度的升高细菌对矿石的氧化速率先增大后降低,但本研究结果显示,升高初始Fe2+浓度对浸矿并没有促进作用。Jones等[22]在研究黄铁矿细颗粒对活性氧(ROS)产生及浸矿的影响时发现ROS的产生随着黄铁矿表面积负荷和溶液中Fe2+浓度的升高而增多,而ROS会显著降低细菌生长和Fe2+氧化速率,本实验在富氧条件下进行,较常规溶氧水平产生了更多的ROS,此时再提高Fe2+浓度,矿浆中ROS含量进一步提升,对细菌产生了强烈的抑制作用,故初始Fe2+浓度提高未对矿石氧化产生积极作用,而是降低了氧化速率和氧化率。为考察不同Fe2+浓度下活性氧含量,本研究对菌体内ROS含量进行了检测,结果如图 6,从图中可以看出,随Fe2+浓度升高,菌体内ROS含量显著升高,与Jones等人的研究结果一致[22]。
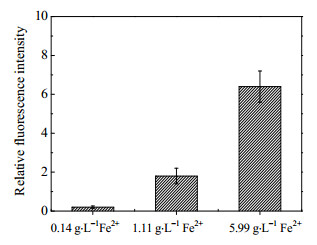
|
图 6 不同初始Fe2+浓度下菌体内ROS含量 Fig.6 The content of ROS in cells under different initial Fe2+ concentrations |
观察图 7 A,随着初始Fe2+浓度增大,相同浸矿时间pH值出现上升,矿石氧化生成H2SO4的速率降低。4天后,5.99 g·t-1初始Fe2+浓度的实验组pH开始低于1.11 g·t-1初始Fe2+浓度的实验组,表明其菌体氧化矿石生成H2SO4的能力不断增强。
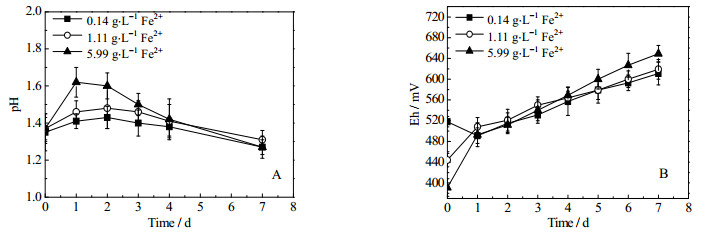
|
图 7 初始Fe2+浓度对pH值及Eh的影响 Fig.7 Effects of initial Fe2+ concentration on pH and Eh |
图 7 B显示了初始Fe2+浓度对难处理金精矿氧化过程中Eh的影响,生物氧化过程中三组实验的Eh值总体均呈上升趋势,生物氧化开始后,除了对照组浸出液的Eh值先下降后上升,其他两组实验的Eh均不断上升,由Nernst方程可知,Eh与溶液中CFe3+/CFe2+呈正相关,由于Fe2+极易被浸矿菌氧化产生Fe3+,在补加了Fe2+的实验组中CFe3+/CFe2+的值迅速增大,故Eh值迅速上升,并且随着氧化活性的不断增强Fe2+越来越少,Fe3+不断增加,Eh值不断增大。
OUR反映了整个菌群的代谢活性,观察图 8 A,三组实验中OUR在整个氧化过程中均呈不断上升趋势,表明菌群代谢活性不断增强。初始Fe2+浓度为1.11 g·t-1时OUR在第1天低于对照组,第2天开始高于对照组,表明菌体活性在初始阶段受到了抑制,而初始Fe2+浓度为5.99 g·t-1时在前2天OUR均低于不添加Fe2+的组,说明其受抑制的程度高于1.11 g·t-1的初始Fe2+浓度,可见高Fe2+浓度会抑制菌体活性,且抑制作用随Fe2+浓度增高而加强。随着反应进行,添加Fe2+的实验组菌体活性逐渐增强,且在第5天对照组OUR开始出现下降时实验组OUR仍在增大,这可能是由于随Fe2+消耗,ROS产生量减少,抑制作用减弱,菌群的OUR开始不断升高。
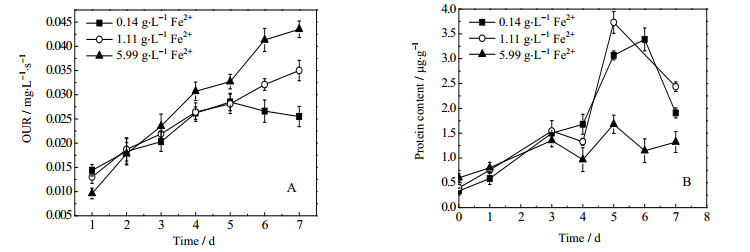
|
图 8 初始Fe2+浓度对菌体生长和活性的影响 Fig.8 Effects of initial Fe2+ concentration on the activity and growth of bacteria A: evolution of OUR during the biooxidation process under different initial Fe2+ concentrations B: growth of bacteria during the biooxidation process under different initial Fe2+ concentrationsc |
从图 8 B初始Fe2+浓度对菌体生长的影响可以看出,初始Fe2+浓度对菌体生长影响显著,1.11 g·t-1初始Fe2+浓度与对照组相比菌体生长状况相似,而当初始Fe2+浓度达到5.99 g·t-1时,菌体量较另外两组显著减少,这也与溶液中Fe2+浓度升高ROS增多,抑制细菌生长有关,另外亚铁离子浓度增加导致的渗透压改变也可能是抑制菌体生长的原因。
4 结论(1) 试验范围内,矿浆体系中3.75 ppm的溶氧水平足以满足矿石生物氧化过程所需,单纯再提高溶氧不能提高矿石氧化率,过高溶氧会产生大量的ROS反而对细菌有害,对氧化效果不利。采用Hansford逻辑方程对不同溶氧水平下的矿石氧化过程进行拟合发现最大速率常数Km在DO 3.75 ppm时最大,随DO继续上升而减小;此时,矿石最大氧化率Xm达到最大值76.82%。实验发现矿浆中的活性氧含量随溶解氧水平的增加而增多。
(2) 不同溶解氧水平下菌体摄氧率OUR大小依次是:OUR(3.75 ppm)>OUR(5.01 ppm)>OUR(2.51 ppm)>OUR(7.51 ppm),表明DO在3.75 ppm时菌群代谢活性最高。
(3) 试验范围内,富氧条件下(4.0 ppm)初始Fe2+浓度的提高会降低矿石的氧化率、抑制菌体的生长。而菌群氧化活性在氧化初期受到抑制,后期得到加强。富氧条件下(3.75 ppm)随Fe2+浓度升高,菌体内ROS含量显著升高,抑制矿石氧化。
符号说明:| [1] | YUAN Yuan(袁源), WANG Mo-hui(汪模辉), WANG Jian-wei(王建伟) . Research Progress on Biohydrometallurgy and Comprehensive Leaching of Sulfide Minerals(硫化矿微生物冶金及其强化技术的研究进展)[J]. Hydrometallurgy of China(湿法冶金) , 2007, 26 (4) : 175-183 |
| [2] | de Cock S H, Naldrett K, du Plessis C A. Optimal oxygen and carbon dioxide concentrations for thermophilic bioleaching archaea[C]. Athens:Proceedings XV International Biohydrometallurgy Symposium, 2003 September 14-19:34. |
| [3] | Richtie I, Barter J. Process and engineering aspects of biological oxidation plants[C]. Proceedings IBS'97 Biomine'97 Conference, Sydney:Australian Mineral Foundation, 1997 August 4-6:M.14.4.1 |
| [4] | Gericke M, Pinches A, van Rooyen J V . Bioleaching of a chalcopyrite concentrate using an extremely thermophilic culture[J]. Int J Miner Process , 2001, 62 (1) : 243-255 |
| [5] | Gleisner M, Herbert JRB, Frogner Kockum PC . Pyrite oxidation by Acidithiobacillus ferrooxidans at various concentrations of dissolved oxygen[J]. Chem Geol , 2006, 225 (1-2) : 16-29 DOI:10.1016/j.chemgeo.2005.07.020 |
| [6] | LIU Yu-long(刘玉龙), LI Guang-yue(李广悦), WANG Yong-dong(王永东) . The study on purification of thiobacillus ferrooxidans and Fe2+ oxidation in medium(氧化亚铁硫杆菌筛选及基质Fe2+氧化研究)[J]. Mining R & D(矿业研究与开发) , 2008, 28 (1) : 38-40 |
| [7] | Silverman M, Lundgren D . Studies on the chemoautotrophic iron bacterium Ferrobacillus ferrooxidans:I. An improved medium and a harvesting procedure for securing high cell yields[J]. J Bacteriol , 1959, 77 (5) : 642 |
| [8] | Davis D G, Jacobsen W R . Determination of iron and iron-aluminum mixtures by titration with EDTA[J]. Anal Chem , 1960, 32 (2) : 215-217 DOI:10.1021/ac60158a024 |
| [9] | Vogel A L . A textbook of quantitative inorganic analysis[M]. London: Longman, 1961 . |
| [10] | Bandyopadhyay B, Humphrey A, Taguchi H . Dynamic measurement of the volumetric oxygen transfer coefficient in fermentation systems[J]. Biotechnol Bioeng , 1967, 9 (4) : 533-544 DOI:10.1002/(ISSN)1097-0290 |
| [11] | Bradford M M . A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem , 1976, 72 (1-2) : 248-254 DOI:10.1016/0003-2697(76)90527-3 |
| [12] | Farrell H P, Hayes J, Laffeh J . Studies on the relationship between pulsed UV light irradiation and the simultaneous occurrence of molecular and cellular damage in clinically-relevant Candida albicans[J]. J Microbiol Methods , 2011, 84 (2) : 317-326 DOI:10.1016/j.mimet.2010.12.021 |
| [13] | Gleisner M, Herbert J R B, Frogner Kockum P C . Pyrite oxidation by Acidithiobacillus ferrooxidans at various concentrations of dissolved oxygen[J]. Chem Geol , 2006, 225 (1-2) : 16-29 DOI:10.1016/j.chemgeo.2005.07.020 |
| [14] | Schoonen M A A, Harrington A D, Laffers R . Role of hydrogen peroxide and hydroxyl radical in pyrite oxidation by molecular oxygen[J]. Geochim Cosmochim Acta , 2010, 74 (17) : 4971-4987 DOI:10.1016/j.gca.2010.05.028 |
| [15] | Cárdenas J P, Moya F . Comparative genomics of the oxidative stress response in bioleaching microorganisms[J]. Hydrometallurgy , 2012, 127-128 : 162-167 DOI:10.1016/j.hydromet.2012.07.014 |
| [16] | Duan X J, Niu H X, Tan W S . Mechanism analysis of effect of oxygen on molecular weight of hyaluronic acid produced by Streptococcus zooepidemicus[J]. J Microbiol Biotechnol , 2009, 19 (3) : 299-306 |
| [17] | Jones G C, Corin K C, van Hille R P . The generation of toxic reactive oxygen species(ROS) from mechanically activated sulphide concentrates and its effect on thermophilic bioleaching[J]. Miner Eng , 2011, 24 (11) : 1198-1208 DOI:10.1016/j.mineng.2011.05.016 |
| [18] | Imlay J A . Cellular defenses against superoxide and hydrogen peroxide[J]. Annu Rev Biochem , 2008, 77 : 755-776 DOI:10.1146/annurev.biochem.77.061606.161055 |
| [19] | Borda M J, Elsetinow A R, Schoonen M A . Pyrite-induced hydrogen peroxide formation as a driving force in the evolution of photosynthetic organisms on an early earth[J]. Astrobiology , 2001, 1 (3) : 283-288 DOI:10.1089/15311070152757474 |
| [20] | Schoonen M A A, Harrington A D, Laffers R . Role of hydrogen peroxide and hydroxyl radical in pyrite oxidation by molecular oxygen[J]. Geochim Cosmochim Acta , 2010, 74 (17) : 4971-4987 DOI:10.1016/j.gca.2010.05.028 |
| [21] | OU Le-ming(欧乐明), HE Rong-quan(何荣权), FENG Qi-ming(冯其明) . Pyrite leaching in germ-free system and thermodynamic analysis(无菌体系下黄铁矿浸出及热力学分析)[J]. Nonferrous Metals(有色金属) , 2007, 59 (4) : 87-90 |
| [22] | Jones G C, van Hille R P, Harrison S T L . Reactive oxygen species generated in the presence of fine pyrite particles and its implication in thermophilic mineral bioleaching[J]. Appl Microbiol Biotechnol , 2013, 97 : 2735-2742 DOI:10.1007/s00253-012-4116-y |




