2. 北京化工大学 化工资源有效利用国家重点实验室, 北京 100029
2. State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Engineering, Beijing 100029, China
全世界范围的燃油消耗量逐年增加,造成了严重的环境污染,燃油的低硫超低硫生产成为世界各国炼油技术的发展趋势[1]。氧化脱硫技术[2]的反应条件温和,能够高效脱除噻吩类硫化物,受到了广泛的关注,钛硅分子筛作为一种高效、绿色环保的脱硫催化剂越来越被重视[3~5]。
HMS分子筛具有短程有序的蠕虫状或海绵状的介孔孔道结构,孔道连通性好,反应物及产物分子的扩散速度快,吸附容量高、热稳定性好,很适合用作催化剂载体。向纯硅基的分子筛骨架中引入具有氧化还原能力的过渡金属原子 (如Ti、Ni、Mo、Pt等) [6],得到的介孔分子筛对有机大分子底物具有很好的选择催化氧化性能[7],其中Ti-HMS分子筛作为一种氧化脱硫的催化剂已见诸报道[8~11],而对于其作为载体进行改性的研究还未见报道。金属氧化物常被用作脱硫吸附剂,因为能形成L酸中心而对油品中的L碱含硫化合物具有一定的吸附能力[12, 13]。本工作以Ti-HMS分子筛为载体,对其进行了负载金属改性,制备了Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS催化剂,采用XRD、SEM、TEM、FTIR、BET等手段对催化剂进行表征,对比考察了它们的催化氧化脱硫性能。
2 实验部分 2.1 主要原料十二胺 (DDA),化学纯,国药集团化学试剂有限公司;正硅酸乙酯 (TEOS),分析纯,天津市登科化学试剂有限公司;钛酸四丁酯 (TBOT),分析纯,天津市瑞金特化学品有限公司;无水乙醇 (EtOH),分析纯,莱阳经济开发区精细化工厂;异丙醇 (IPA),分析纯,天津市永大化学试剂有限公司;Fe (NO3)3·9H2O,分析纯,天津市巴斯夫化工有限公司;Cu (NO3)2·3H2O,分析纯,国药集团化学试剂有限公司;Zn (NO3)2·6H2O,分析纯,天津市瑞金特化学品有限公司。
2.2 分子筛的合成及改性采用溶胶凝胶法合成Ti-HMS分子筛[14]。室温下,将一定量的十二胺溶于乙醇水溶液中,搅拌得A液;将一定量的正硅酸乙酯、钛酸四丁酯和异丙醇混合得B液,剧烈搅拌下,将B液缓慢滴加到A液中,继续搅拌一段时间后,静置24 h,经洗涤、抽滤及100℃下干燥过夜后得Ti-HMS前驱体,最后于马弗炉中550℃下焙烧6 h脱除模板剂。
采用超声浸渍的方法,分别以Fe (NO3)3·9H2O为Fe源,Cu (NO3)2·3H2O为Cu源,Zn (NO3)2·6H2O为Zn源,按照n(Si)/n(M)=40(M=Fe、Cu、Zn) 的比例负载到Ti-HMS分子筛载体上,浸渍一段时间后,100℃下干燥过夜除去残留水分,550℃下焙烧4 h,即得Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS催化剂。
2.3 催化剂的表征采用荷兰帕纳科公司的X’Pert PRO MPD型X射粉末线衍射仪进行XRD分析,Cu-Kα (λ=0.1548 nm) 为射线源,电压40 kV,电流40 mA,小角扫射角度2θ=1°~10°,步长为0.02°,扫描速度0.02°×min-1;采用日本电子公司的JSM-6700F型冷场发射扫描电子显微镜对样品形貌进行观察;采用日本电子公司的JEM-2000EX透射型电子显微镜进行TEM测定;采用德国布鲁克公司的BRUKERTENSOR-27型红外光谱仪对样品进行FT-IR测试;采用美国Micromeritics公司的ASAP 2020全自动快速比表面积及介孔/微孔分析仪进行比表面积和孔结构的测试。
2.4 脱硫性能评价实验中所用的模型油为硫含量1000 μg×g-1的噻吩/正辛烷模拟汽油。将10 mL模型油、10 mL乙腈 (萃取剂) 和一定量的催化剂置于三口烧瓶中,待水浴温度升至所需温度后,加入一定量30%(wt) 的双氧水,磁力搅拌下反应一段时间后将反应液离心,取油相用气相色谱检测仪 (山东鲁南瑞虹仪器有限公司,SP-6890型) 检测其硫含量,通过式 (1) 计算脱硫率。
| $\eta = \frac{{{C_0} - {C_1}}}{{{C_0}}} \times 100\% $ | (1) |
式中:η为脱硫率,%;C0为模型油中的初始硫含量,经测定,本实验所用模型油实际硫含量为0.7384 g×L-1;C1为模型油经脱硫反应后的硫含量,g×L-1。
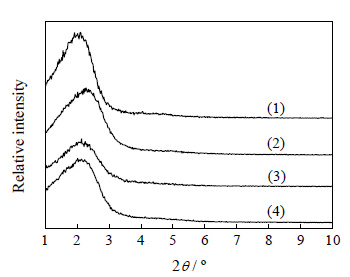
3 结果与讨论 3.1 催化剂的表征 3.1.1 XRD表征分析图 1为Ti-HMS (1)、Fe/Ti-HMS (2)、Cu/Ti-HMS (3) 和Zn/Ti-HMS (4) 样品的小角XRD图。图中Ti-HMS分子筛在2θ=2.3°附近出现了唯一的衍射峰,对应于六方介孔材料 (100) 晶面的特征衍射峰,说明原位合成的Ti-HMS分子筛具有短程有序的介孔结构[15],Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS催化剂也具有相同的特征峰,说明催化剂保留了介孔结构。比较四条曲线可以看出,负载金属后催化剂的衍射峰强度明显降低,峰型宽化,说明Ti-HMS载体孔道的有序性有所降低,可能是浸渍堵塞了部分孔道或者二次焙烧破坏了孔道结构所致;另外,负载金属后催化剂的出峰位置略微向高角度发生了不同程度的位移,认为是金属组分分散在分子筛的内外表面造成孔道结构不规则的变化[16],改变了孔道尺寸大小的均匀程度,这也可认为是金属组分进入分子筛载体的辅助证据。
|
图 1 Ti-HMS (1)、Fe/Ti-HMS (2)、Cu/Ti-HMS (3) 和Zn/Ti-HMS (4) 的小角XRD图 Fig.1 Small-angle XRD patterns of Ti-HMS (1), Fe/Ti-HMS (2), Cu/Ti-HMS (3) and Zn/Ti-HMS (4) |
图 2为Ti-HMS (a)、Fe/Ti-HMS (b)、Cu/Ti-HMS (c) 和Zn/Ti-HMS (d) 样品的SEM图。从图中可以看出各组样品呈现出良好的结晶状态,球状颗粒彼此粘连在一起,少数没有完全晶化的颗粒团聚形成絮状结构,颗粒表面光滑规整,粒径在0.2~1 μm,颗粒间存在着丰富的孔隙结构,有利于反应物分子进入和扩散[17],提高反应体系的效率。图 2(b)、2(c)、2(d)中,在颗粒的表面都分布着片状结晶物质,晶体的直径在0.05~0.25 μm,认为是硝酸盐焙烧分解后生成的金属氧化物,说明在介孔材料上已经负载上了金属组分。

|
图 2 Ti-HMS (a)、Fe/Ti-HMS (b)、Cu/Ti-HMS (c) 和Zn/Ti-HMS (d) 的SEM图 Fig.2 SEM images of Ti-HMS (a), Fe/Ti-HMS (b), Cu/Ti-HMS (c) and Zn/Ti-HMS (d) |
图 3为Ti-HMS (a)、Fe/Ti-HMS (b)、Cu/Ti-HMS (c) 和Zn/Ti-HMS (d) 样品的TEM图。从图中可以看出各组样品具有典型的蠕虫状孔道结构,说明负载金属组分后催化剂保持了较好的介孔结构。在图 3(b)、3(c)、3(d)中分散着许多粒径处于纳米尺度的黑点,说明金属硝酸盐经高温焙烧之后分解生成的金属氧化物颗粒均匀分布在分子筛的表面;图中也出现了一些形状不规则的暗斑,直径在15~30 nm,认为可能是因煅烧不均匀而导致聚集形成的金属氧化物大颗粒,造成了各样品的金属组分分散均匀程度不同。

|
图 3 Ti-HMS (a)、Fe/Ti-HMS (b)、Cu/Ti-HMS (c) 和Zn/Ti-HMS (d) 的TEM图 Fig.3 TEM images of Ti-HMS (a), Fe/Ti-HMS (b), Cu/Ti-HMS (c) and Zn/Ti-HMS (d) |
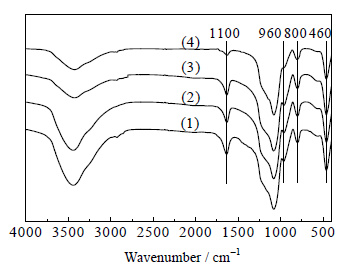
图 4为Ti-HMS (1)、Fe/Ti-HMS (2)、Cu/Ti-HMS (3) 和Zn/Ti-HMS (4) 的FT-IR谱图。从图中可以看出,对于钛硅分子筛Ti-HMS,在460、800、1100 cm-1附近出现的吸收峰分别对应于分子筛骨架中Si-O-Si的弯曲振动吸收峰、对称伸缩振动吸收峰和反对称伸缩振动吸收峰。960 cm-1附近出现的吸收峰一般被认为是Ti原子进入骨架中取代部分Si原子后与硅氧四面体协同伸缩振动吸收峰,表明钛已进入介孔分子筛骨架[18],并且该峰的强度与分子筛中骨架钛的含量有关,含量越高,强度越大,但是也有学者在合成的纯硅分子筛材料中发现了该峰,使得关于该峰的归属仍有很大争议[19]。图中Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS均与Ti-HMS的吸收特征峰相似,表明分子筛结构得以保留,金属组分并没有进入分子筛骨架中,主要分散在分子筛的内外表面,这与前面XRD表征结果相互印证。
|
图 4 Ti-HMS (1)、Fe/Ti-HMS (2)、Cu/Ti-HMS (3) 和Zn/Ti-HMS (4) 的FT-IR谱图 Fig.4 FT-IR spectra of Ti-HMS (1), Fe/Ti-HMS (2), Cu/Ti-HMS (3) and Zn/Ti-HMS (4) |
各样品的比表面积及孔结构参数见表 1。由表 1可知,Ti-HMS分子筛具有较大的比表面积,为反应物分子提供了广阔的场所,平均孔径为2.61 nm,在介孔孔径范围之内。与Ti-HMS分子筛相比,负载金属组分后的催化剂,其比表面积、孔体积和平均孔径都有所减少,这是由于金属组分分布在分子筛载体的表面,并且占据了部分孔道的缘故。其中负载Cu的Ti-HMS分子筛各项参数最低,可能是由于高温煅烧不均匀,CuO组分聚集程度较重,占据了较多的空间,这与TEM表征结果一致。
| 表 1 各样品的比表面积及孔结构参数 Table 1 Specific surface area and pore structure parameters of the samples |
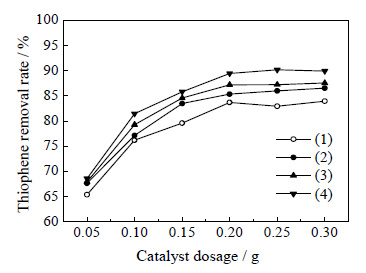
图 5为Ti-HMS (1)、Fe/Ti-HMS (2)、Cu/Ti-HMS (3) 和Zn/Ti-HMS (4) 对噻吩脱除率的影响。从图中可以得知,Cu/Ti-HMS、Fe/Ti-HMS和Zn/Ti-HMS催化剂样品对噻吩氧化脱除反应的催化活性要好于Ti-HMS,分析造成这种结果的原因可能有以下两种:1.噻吩是一种L碱,易被吸附在L酸中心上,因此能形成L酸中心的金属氧化物对其具有较强吸附能力[12],催化剂中金属组分的存在使得噻吩能够被充分吸附到分子筛的表面进而完成在Ti4+活性中心上的催化氧化反应。2.分子筛表面负载的部分金属氧化物与骨架中的Ti4+活性中心协同作用,催化过氧化氢发生歧化分解反应,类似于Fenton试剂的产生机理[20, 21],即催化过氧化氢分解产生了更多的氧化电位非常高的自由基 (OH·和HO2·)[22, 23]。活性氧物种增多,增强了对噻吩的氧化作用,因而脱硫率提高。
|
图 5 不同催化剂对噻吩脱除率的影响 Fig.5 Effects of different catalysts on thiophene removal (1) Ti-HMS; (2) Fe/Ti-HMS; (3) Cu/Ti-HMS; (4) Zn/Ti-HMS (Reaction conditions: T=70℃, n(H2O2)/n(S)=4, t=60 min) |
负载金属组分的催化剂催化活性由大到小依次为Zn/Ti-HMS > Cu/Ti-HMS > Fe/Ti-HMS。这种差异可能是由于不同金属氧化物对噻吩的吸附能力不同所导致。在Pearson的软硬酸碱理论[24]中,酸、碱被分别归为“硬”、“软”两种,在所有其他因素相同时,“软酸”与“软碱”反应较快速,形成较稳定络合物;而“硬酸”与“硬碱”反应较快速,形成较稳定络合物。Zn2+和Cu2+为交界酸,Fe3+和为硬酸,而噻吩为软碱,容易与Zn2+和Cu2+形成较稳定的配合物,与Fe3+的结合能力较弱。同时从TEM和比表面积及孔结构表征结果可知,CuO组分烧结聚集程度较重,会限制噻吩分子和H2O2在催化剂孔道内的扩散,阻碍氧化反应的进行,而ZnO组分在分子筛表面的分散均匀程度较好,故本实验中Cu/Ti-HMS的催化活性低于Zn/Ti-HMS。由此推测,金属氧化物能更好地吸附噻吩到分子筛表面完成Ti4+活性中心上的催化氧化反应是导致脱硫率提高的主要原因,噻吩分子因为金属氧化物的吸附作用而分散在分子筛载体的表面或进入孔道内部,这就增加了反应物分子和骨架Ti4+碰撞几率,促进反应进行。
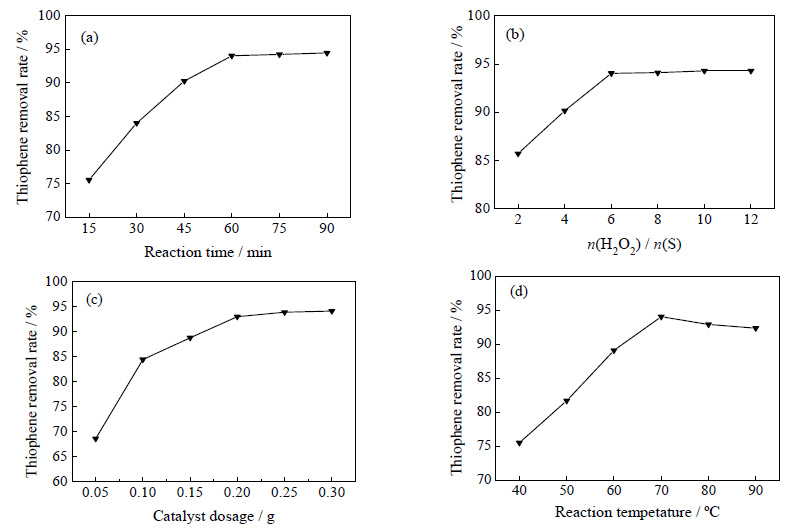
选用Zn/Ti-HMS催化剂用于噻吩氧化脱除反应,考察反应时间、n(H2O2)/n(S)、催化剂用量和反应温度对脱硫率的影响,结果如图 6所示。从图 6(a)可以看出,反应时间从15 min延长至60 min时,噻吩的脱除率明显提高,反应时间为60 min时,反应接近平衡,噻吩脱除率可达到94.03%,继续增加反应时间,噻吩的脱除率变化不明显。n(H2O2)/n(S) 对噻吩脱除率的影响见图 6(b),随着n(H2O2)/n(S) 的数值增加,噻吩的脱除率也随之提高,最高的噻吩脱除率可达94.3%,与n(H2O2)/n(S)=6时的噻吩脱除率相差不大,因此确定反应的最佳n(H2O2)/n(S) 为6。根据化学计量反应,1 mol噻吩完全转化的需要2 mol H2O2,n(H2O2)/n(S) 的理论值仅为2,在实际反应中可能存在涉及H2O2热分解副反应,消耗了多余的氧化剂[25]。图 6(c)表明,增加催化剂的用量,有助于噻吩的脱除,这是由于反应体系中的催化活性位增加,更多的氧化反应进行,将噻吩氧化成为亚砜或砜类物质,当催化剂用量为0.2 g×(10 mL)-1模型油时,噻吩的脱除率已经很高,再增加催化剂用量,脱除率变化不大,说明此时的用量已经能够提供此反应体系所需的活性中心。图 6(d)为反应温度对噻吩脱除率的影响,在一定范围内升高温度,噻吩脱除率逐渐增大,当温度从40℃升高至70℃,噻吩的脱除率由75.52%提高到94.03%。这是由于升温导致反应速率常数增大,加快反应的进行,并且高温有助于分子的扩散,增加了活性氧物种与噻吩的碰撞几率。但是过高的温度会造成H2O2挥发或者无效分解[26],使噻吩的脱除率下降。综上所述,噻吩氧化脱除反应的最佳反应条件为:反应温度为70℃、n(H2O2)/n(S) 为6、Zn / Ti-HMS催化剂用量0.2 g×(10 mL)-1、反应时间60 min,该条件下的噻吩脱除率达到了94.03%。
|
图 6 (a) 反应时间、(b) n(H2O2)/n(S)、(c) 催化剂用量和 (d) 反应温度对噻吩脱除率的影响 Fig.6 Effects of (a) reaction time, (b) n(H2O2)/n(S), (c) catalyst dosage and (d) reaction temperature on thiophene removal (Reaction conditions: T=70 ℃, catalyst dosage=0.2 g⋅(10 mL)-1, n(H2O2)/n(S)=6, t=60 min) |
对使用过的催化剂采取极性溶剂洗涤方式进行再生,使用乙腈洗涤三次,300℃下焙烧4 h后再使用。图 7为催化剂Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS首次使用时的脱硫率 (a) 和重复使用五次后的脱硫率 (b) 对比结果。从图中可以看出重复使用五次后的Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS催化剂样品的催化活性都有所下降,脱硫率分别减少到了73.92%、72.68%和75.26%,其中Zn/Ti-HMS的催化活性下降最多,脱硫率前后相差14.91%,Cu/Ti-HMS次之,Fe/Ti-HMS的脱硫率前后相差最小。分析原因,可能是因为每次反应过程中都会有少量被金属组分吸附的噻吩未被氧化脱除,再生后依然残留在分子筛表面,减少了金属活性组分,并占据一定的空间,造成较大的空间位阻,不利于反应物和产物的扩散。Zn2+对噻吩的吸附能力较强,能够形成较稳定的络合物,重复使用后Zn/Ti-HMS表面残留的噻吩较多,因而催化氧化脱硫效果下降最为明显。
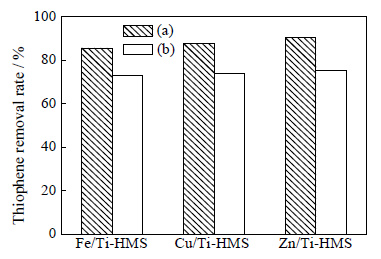
|
图 7 催化剂再生对噻吩脱除率的影响 Fig.7 Effects of catalyst regeneration on thiophene removal (a) fresh catalyst (b) regenerated catalyst (Reaction conditions: T=70℃, n(H2O2)/n(S)=4, t=60 min, catalyst dosage=0.2 g⋅(10 mL)-1) |
(1) 以十二胺为模板剂,正硅酸乙酯为硅源,钛酸丁酯为钛源,直接合成了Ti-HMS分子筛,通过超声浸渍的方法制备了Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS催化剂。各样品具有典型的介孔结构,Ti元素成功进入分子筛骨架,金属组分以金属氧化物的形式均匀分散在分子筛表面,负载金属组分后催化剂的比表面积和平均孔径都有所变化,变化范围分别为:37.4~75.1 m2×g-1、0.14~0.36 nm。
(2) 各催化剂样品催化H2O2氧化脱除噻吩具有很好的效果,负载金属催化剂的催化活性要好于Ti-HMS分子筛催化剂,三组负载金属催化剂的催化活性由大到小依次为Zn/Ti-HMS > Cu/Ti-HMS > Fe/Ti-HMS。认为是金属氧化物能更好地吸附噻吩到分子筛表面完成Ti4+活性中心上的催化氧化反应是导致脱硫率提高的主要原因,不同金属组分对噻吩的吸附能力不同导致了负载金属催化剂催化氧化脱硫效果的差异。
(3) 将Zn/Ti-HMS催化剂用于氧化脱除噻吩反应,获得最佳反应条件为:反应温度为70℃、n(H2O2)/n(S)=6、Zn/Ti-HMS催化剂用量达到0.2 g×(10 mL)-1、反应时间60 min,噻吩的氧化脱除率可达94.03%。
(4) 催化剂经乙腈洗涤后可再生利用,但催化氧化脱硫性能有所下降,重复使用五次后Fe/Ti-HMS、Cu/Ti-HMS和Zn/Ti-HMS的脱硫率分别为73.92%、72.68%和75.26%,可能是由于金属活性组分减少和部分孔道堵塞两方面因素造成。
| [1] | Yan X M, Mei P, Lei J, et al. Synthesis and characterization of mesoporous phosphotungstic acid/TiO2 nanocomposite as a novel oxidative desulfurization catalyst[J]. Journal of Molecular Catalysis A:Chemical , 2009, 304(1): 52-57. |
| [2] | Kim T W, Kim M J, Kleitz F, et al. Tailor-made mesoporous Ti-SBA-15 catalysts for oxidative desulfurization of refractory aromatic sulfur compounds in transport fuel[J]. ChemCatChem , 2012, 4(5): 687-697. DOI:10.1002/cctc.v4.5. |
| [3] | Shiraishi Y, Hirai T, Komasawa I. Oxidative desulfurization process for light oil using titanium silicate molecular sieve catalysts[J]. Journal of Chemical Engineering of Japan , 2002, 35(12): 1305-1311. DOI:10.1252/jcej.35.1305. |
| [4] | Shan J H, Liu X Q. Adsorption of sulfur-containing compounds on CuCl/SBA-15 molecular sieve prepared by the thermal diffusion method[J]. Journal of Functional Materials , 2010, 12(47): 2194-2197. |
| [5] | Lü H, Gao J, Jiang Z, et al. Oxidative desulfurization of dibenzothiophene with molecular oxygen using emulsion catalysis[J]. Chemical Communications , 2007(2): 150-152. DOI:10.1039/B610504A. |
| [6] | HU Deng-hong(胡灯红), ZHENG Hua-jun(郑华均). Research development of modified mesoporous molecular sieve(MCM-41介孔分子筛改性研究进展)[J]. Zhejiang Chemical Industry(浙江化工) , 2011, 42(3): 15-19. |
| [7] | FU Zai-hui(伏再辉), CHEN Jun-hua(陈君华), CHEN Yuan-dao(陈远道), et al. Synthesis, characterization and catalytic properties of transition metals substituted HMS(含过渡金属HMS的合成和催化性能)[J]. Acta Physico-Chimica Sinica(物理化学学报) , 2000, 16(5): 410-415. |
| [8] | Chen S, Lu W, Yao Y, et al. Oxidative desulfurization of dibenzothiophene with molecular oxygen catalyzed by carbon fiber-supported iron phthalocyanine[J]. Reaction Kinetics Mechanisms & Catalysis , 2013, 111(2): 1-13. |
| [9] | Yun W, Gang L, Wang X, et al. Oxidative desulphurization of 4, 6-dimethyldibenzothiophene with hydrogen peroxide over Ti-HMS[J]. Energy & Fuels , 2007, 21(3): 1415-1419. |
| [10] | Cui S, Ma F, Wang Y. Oxidative desulfurization of model diesel oil over Ti-containing molecular sieves using hydrogen peroxide[J]. Reaction Kinetics & Catalysis Letters , 2007, 92(1): 155-163. |
| [11] | Zhang H, Liu G, Song H, et al. Direct synthesis of H2O2 over Ti-containing molecular sieves supported gold catalysts:a comparative study for in-situ-H2O2-ODS of fuel[J]. Bulletin of the Korean Chemical Society , 2013, 34(10): 3065-3072. DOI:10.5012/bkcs.2013.34.10.3065. |
| [12] | MENG Xuan(孟璇), Zakaty S(翁慧新), WENG Hui-xin(), et al. Adsorptive removal of thiophene over nickel-based ZnO with different supports(不同载体的镍基氧化锌对噻吩的吸附脱除性能)[J]. Journal of Fuel Chemistry and Technology(燃料化学学报) , 2012, 40(3): 364-369. |
| [13] | Larrubia M A, Gutièrrez-Alejandre A, Ramı?rez J, et al. A FT-IR study of the adsorption of indole, carbazole, benzothiophene, dibenzothiophene and 4, 6-dibenzothiophene over solid adsorbents and catalysts[J]. Applied Catalysis A:General , 2002, 224(1): 167-178. |
| [14] | Tuel A. Modification of mesoporous silicas by incorporation of heteroelements in the framework[J]. Microporous and Mesoporous Materials , 1999, 27(2): 151-169. |
| [15] | Tanev P T, Pinnavaia T J. A neutral templating route to mesoporous molecular sieves[J]. Science , 1995, 267(5199): 865-867. DOI:10.1126/science.267.5199.865. |
| [16] | WANG Yu(王玉), YAN Hong-yan(鄢红艳), CHEN Xiao-hui(陈晓晖), et al. Study on the synthesis, structure and catalytic performance of Bi-MSU-4 silicas molecular sieves(Bi-MSU-4分子筛合成、结构及催化性能的研究)[J]. Functional Materials(功能材料) , 2008, 39(4): 636-640. |
| [17] | ZHANG Wen-min(张文敏), LIU Yi-wu(刘义武), LI Hao(李颢), et al. Preparation of Au/N-Ti-HMS and the direct epoxidation of propylene using H2 and O2(Au/N-Ti-HMS的制备及其催化丙烯直接环氧化反应的研究)[J]. Journal of Molecular Catalysis(分子催化) , 2011, 25(3): 213-219. |
| [18] | Zhang W H, Shi J L, Chen H R, et al. Solution grafting of Ti (IV) inside MCM-41 materials[J]. Journal of Inorganic Materials , 2001, 16(1): 87-92. |
| [19] | Sobczak I, Ziolek M, Renn M, et al. Cu state and behaviour in MCM-41 mesoporous molecular sieves modified with copper during the synthesis-comparison with copper exchanged materials[J]. Microporous & Mesoporous Materials , 2004, 74(1-3): 23-36. |
| [20] | Wang G J, Zhang J K, Liu Y. Catalytic oxidative desulfurization of benzothiophene with hydrogen peroxide over Fe/AC in a biphasic model diesel-acetonitrile system[J]. Korean Journal of Chemical Engineering , 2013, 30(8): 1559-1565. DOI:10.1007/s11814-013-0052-5. |
| [21] | Ramirez J H, Maldonado-Hódar F J, Pérez-Cadenas A F, et al. Azo-dye orange Ⅱ degradation by heterogeneous fenton-like reaction using carbon-Fe catalysts[J]. Applied Catalysis B:Environmental , 2007, 75(3-4): 312-323. DOI:10.1016/j.apcatb.2007.05.003. |
| [22] | YU Guo-xian(余国贤), LU Shan-xiang(陆善祥), CHEN Hui(陈辉), et al. Oxidation of thiophene with hydrogen peroxide catalyzed by activated carbon and formic acid(活性炭及甲酸催化过氧化氢氧化噻吩脱硫研究)[J]. Journal of Fuel Chemistry and Technology(燃料化学学报) , 2005, 33(1): 74-78. |
| [23] | Boehm H P. Some aspects of the surface chemistry of carbon blacks and other carbons[J]. Carbon , 1994, 32(5): 759-769. DOI:10.1016/0008-6223(94)90031-0. |
| [24] | Ormazábaltoledo R, Contreras R. Philicity and fugality scales for organic reactions[J]. Advances in Chemistry , 2014, 2014: 1-13. |
| [25] | Zhao D, Wang Y, Duan E, et al. Oxidation desulfurization of fuel using pyridinium-based ionic liquids as phase-transfer catalysts[J]. Fuel Processing Technology , 2010, 91(12): 1803-1806. DOI:10.1016/j.fuproc.2010.08.001. |
| [26] | Luo G, Kang L, Zhu M, et al. Highly active phosphotungstic acid immobilized on amino functionalized MCM-41 for the oxidesulfurization of dibenzothiophene[J]. Fuel Processing Technology , 2014, 118(1): 20-27. |




