2. 南京理工大学 环境与生物工程学院, 江苏 南京 210094
2. School of Environmental and Biological Engineering, Nanjing University of Science and Technology, Nanjing 210094, China
抗生素的过度使用引发了严重的环境残留污染[1],这可能对公众健康和生态平衡构成威胁[2]。左氧氟沙星(LVF)是第三代氟喹诺酮类药物的广谱抗生素,由于其滥用和不完全的新陈代谢,LVF在各种水生环境中反复被发现,例如地下水,地表水,饮用水和废水流出物。残留的LVF不仅会影响水生生态系统群落的多样性,还会导致耐药细菌和耐药基因的产生[3-4]。因此,从水生环境中有效去除LVF具有重要意义。
阴极氧气还原产H2O2技术作为电化学合成法的一种,因其具有不需要蒸馏、不以有毒有害的有机溶剂作原料、不需氢气的加入,避免爆炸事故等优点而成为一种绿色、有前途的传统H2O2合成法的替代性技术[5]。H2O2的电化学生成速率决定了后续实验过程中·OH生成量的大小,进而影响着整个体系中污染物的降解效率,因此阴极材料的选择就变得至关重要[6-7]。
纳米零价铁(nZVI)因其电子传递效率高、比表面积大等特点,已成一种新型的多功能修复材料,被广泛用于废水处理和地下水修复[8]。零价铁在水环境中会发生一定的化学反应,零价铁被腐蚀后产生的Fe2+会与H2O2发生类芬顿反应[9-10],构建零价铁/高级氧化体系。
因此,电生H2O2联合nZVI技术的潜力不容忽视。本研究通过比较4种阴极材料电生过氧化氢的性能,选择石墨作为阴极材料,并探究了体系中不同自由基(·OH,
除甲醇外使用的试剂均为分析级(> 98%),无水硫酸钠、碳酸钠、氢氧化钠、硫酸、无水乙醇等均购于天津市德恩化学试剂有限公司;纳米铁粉(nZVI)、左氧氟沙星、叔丁醇(TBA)、2,9-二甲基-1,10-邻菲罗啉、氯化硝基四氮唑蓝(NBT)、对苯醌(BQ)等均购于上海麦克林生化科技有限公司;甲醇(色谱级)购于上海安谱实验科技股份有限公司。
2.2 实验方法 2.2.1 不同电极材料电生过氧化氢实验以城市生活污水处理厂出水中常见阴离子的出水浓度为参考,配制电化学反应的电解液,即:Na2SO4:1.035 1 g⋅L−1、NaCl:0.659 3 g⋅L−1、Na2CO3:0.076 6 g⋅L−1,溶液总体积为1 L,初始pH值为10(反应前用1.25 mol⋅L−1的H2SO4和2.00 mol⋅L−1的NaOH溶液调节电解液至所需pH值),以铱钽电极为阳极、4种电极(石墨、钛、不锈钢和铱钽)为阴极,构成双电极体系,曝气量为160 mL⋅min−1,且在电化学实验开始前预先曝氧15 min,使电解液达到氧饱和状态,通过恒温水浴控制实验在室温25 ℃下进行,实验在开启外加直流电源时开始,并在预定的时间间隔进行取样测定,所有实验均重复进行3遍。
2.2.2 左氧氟沙星降解实验LVF降解实验分为2个阶段,首先是电化学氧化降解阶段,溶液中LVF的初始质量浓度为90 mg⋅L−1,其他步骤与电生H2O2过程相同。接着是联合nZVI体系降解阶段,具体操作如下: 经过5 h的电解,H2O2累积浓度达到平衡,LVF也得到部分降解。在此基础上终止电解和供氧,向溶液中投加预处理后的nZVI开始此实验,实验全程在450 r⋅min−1的机械搅拌下进行,分别在0.25、0.50、1、5和15 min时进行取样(该降解阶段的计时以加入nZVI后重新开始),然后将1 mL经孔径为0.45 μm的水相滤膜过滤后的水样加入含有0.2 mL甲醇的液相瓶内,置于4 ℃冰箱中冷藏待测。
2.2.3 分析方法选用2、9-二甲基-1、10-邻菲罗啉(DMP)分光光度法测定溶液中H2O2的浓度。·OH浓度的测定采用一种间接方法:叔丁醇能够与·OH反应生成甲醛,且每消耗2 mol的·OH生成1 mol甲醛。甲醛的测定采用乙酰丙酮分光光度法进行[11]。以氯化硝基四氮唑蓝(NBT)为探针间接测定
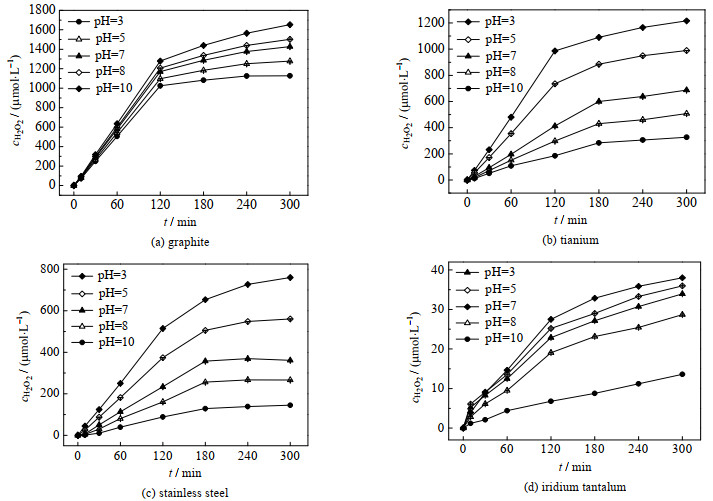
图 1是电解液pH值分别为3、5、7、8和10时,4种不同阴极材料构成的体系下H2O2累积浓度cH2O2随时间t的变化。电还原生成H2O2,同时还会进一步还原或分解生成水(见式(1)和(2)),当H2O2的生成和分解达到平衡后,其浓度的增加就会变得缓慢。然而,通过对各电极体系下H2O2累积浓度的比较,发现它们之间存在较大差异。从图 1可看出,石墨电极电生H2O2的性能最突出,钛电极次之,铱钽电极最差,几乎未生成H2O2。石墨作为电生H2O2的阴极材料,其主要优势为比表面积大、吸附性强、高电导率以及H2O2分解活性低,这些特性不仅使其能够吸附更多O2,从而提高电生H2O2的产率,而且减少了副反应的发生。
| $ \rm{H_2}{O_2} + 2{H^ + } + 2{e^ - } \to 2{H_2}O $ | (1) |
| $ \rm2{H_2}{O_2} \to 2{H_2}O + {O_2} $ | (2) |
|
图 1 pH对四种阴极材料电生H2O2的影响 Fig.1 Effects of pH on electrogenic H2O2 of four cathode materials |
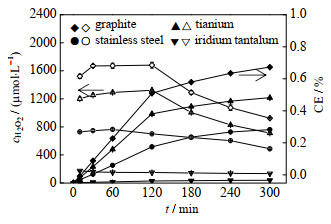
在最佳pH条件下对4种阴极材料电生H2O2的累计浓度和电流效率进行分析,结果如图 2所示:以石墨为阴极时,发现随着pH的增大,H2O2累积浓度亦随之上升,初始pH值为10时,H2O2有最大生成量1 652.5 µmol⋅L−1。由此可知,石墨在碱性条件下生成H2O2的效率更高。相比而言,以钛板和不锈钢为阴极时,随着pH的增大,H2O2累积浓度反而不断下降,初始pH值为3时,H2O2累积浓度分别达到了初始pH值为10时的3.7和5.2倍。这可能是因为碱性溶液中,氧的溶解度和扩散系数均很小,会限制氧还原反应的发生,进而影响H2O2生成[13-14]。与以上两种现象不同的是以铱钽为阴极时,酸性和中性条件下更有利于H2O2的累积。并可观察到,H2O2累积浓度随着pH的增大呈先上升后下降的趋势,在初始pH值为7时,H2O2累积浓度达到了最高值,随着初始pH值增大至10,H2O2累积浓度急剧下降,仅是pH为7时的35.7%。此外,相同条件下,电流效率(CE)与溶液中H2O2浓度呈正比。在整个电解过程中,CE石墨 > CE钛 > CE不锈钢 > CE铱钽。
|
图 2 各阴极材料在最佳pH值下电生H2O2的累积浓度和电流效率 Fig.2 Accumulated concentration and current efficiency of electrogenerated H2O2 for each cathode material at the optimal pH value |
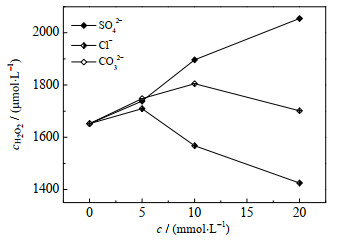
SO42−、Cl−和CO32−是水体中主要的阴离子,研究它们对电生H2O2工艺的影响是很有必要的。由图 3可知,不同浓度c的共存离子对H2O2生成有很大影响。H2O2累积浓度随着SO42−浓度的增加而不断上升,其累积浓度在投加20 mmol⋅L−1 SO42−时达到2 055.0 μmol⋅L−1,此时体系的电流效率达到44.1%。产生这一现象的原因可能是SO42−浓度的增加促使溶液的电导率增强,进而影响电荷输运,最终促进了H2O2的生成,对于CO32−来说,随着其浓度的增加,溶液的导电性增强,H2O2的生成略有增加,但各浓度所对应生成的H2O2均低于SO42−体系。相同浓度及温度下,硫酸钠溶液电导率远高于碳酸钠溶液,因而CO32−体系下H2O2生成不及SO42−体系。当CO32−浓度继续增加到20 mmol⋅L−1时,大量的CO32−水解生成弱电解质HCO3−,并生成OH−使溶液的pH增加,导致电荷转移效率降低,H2O2的生成量减少[15-16]。相比较而言,当Cl−浓度为5 mmol⋅L−1时,H2O2累积浓度达到最大值1 709.7 μmol⋅L−1,而当Cl−浓度继续增大到20 mmol⋅L−1时,H2O2累积浓度和相应的电流效率均持续下降,H2O2浓度下降至1 424.8 μmol⋅L−1,是最大值的83.3%。与SO42−在电化学反应过程中具有的强稳定性不同,在含有Cl−的水体中,阳极容易发生析氯反应[17],产生Cl2(见式(3)),Cl2会在水中部分溶解并转化成HClO/ClO−(见式(4))。而大量研究表明,无论是Cl2还是HClO/ClO−,二者均可与H2O2发生反应,相应的反应速率常数分别为1.83×102 (mol⋅L−1)−1⋅s−1和3.4×103 (mol⋅L−1)−1⋅s−1,见式(5)和(6)。因此,相较于溶液中高浓度Cl−增强电导率而对H2O2生成所起的促进作用,其与H2O2反应而起到的抑制作用占据了主导,故导致H2O2生成不增反减。
| $\rm 2C{{\text{l}}^ - } \to C{l_2} + 2{e^ - } $ | (3) |
| $\rm C{l_2} + {{\rm H}_2}{\rm O} \to {\rm H}Cl{\rm O} + C{l^ - } + {{\rm H}^ + } _{ } $ | (4) |
| $\rm {{\rm H}_2}{{\rm O}_2} + C{l_2} \to {{\rm O}_2} + 2{{\rm H}^ + } + 2C{l^ - } $ | (5) |
| $\rm {{\rm H}_2}{{\rm O}_2} + Cl{{\rm O}^ - } \to {{\rm H}_2}{\rm O} + {{\rm O}_2} + 2C{l^ - } $ | (6) |
|
图 3 不同浓度的共存离子对石墨电生H2O2性能的影响 Fig.3 Effects of coexisting ions with different concentrations on the performance of graphite electrogenic H2O2 |
通过研究水中常见阴离子对H2O2生成的影响,可以发现,硫酸钠对石墨电生H2O2起促进作用,氯化钠反之。
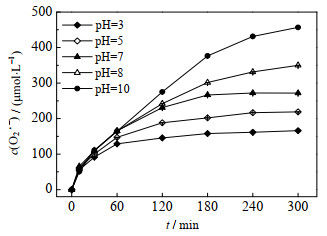
3.2 石墨体系下pH对图 4反映了pH值对石墨体系O2·-生成的影响。通过观察可以发现,当pH值范围在3~7时,体系中
|
图 4 pH值对石墨体系 |
由图 5(a)可见,pH值对石墨体系·OH的生成浓度无影响,在实验所实施的整个pH范围内,·OH浓度c(·OH)随时间的变化曲线几乎完全重合,且各pH值下生成的·OH浓度最终保持在0.375~0.425 μmol⋅L−1。鉴于该变化规律与前文中H2O2及
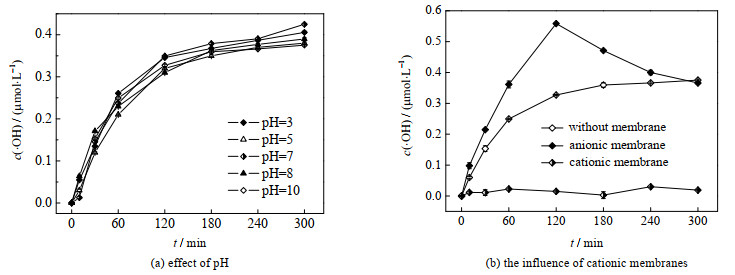
|
图 5 不同因素对•OH生成的影响 Fig.5 Effects of different factors on •OH generation |
第一组对照实验的具体实施条件为:TBA体积为20 mL,pH = 10,电流为0.05 A,以石墨为阴极,分别在不曝氧气和不曝氧气但投加2 mmol⋅L−1 30% 的双氧水条件下进行·OH的测定实验。由于未曝氧气,则在此体系下不会有
从图 5(b)可以看出,在阳极室未检测出•OH,说明阳极并不能通过直接氧化生成·OH,再结合上文的分析结果,体系中的·OH只可能来自阴极反应过程中生成的H2O2和
| $ {{\rm O}}_{2}{{}^{·}}^{-}+{{\rm H}}_{2}{{\rm O}}_{2}\to \cdot {\rm O}{\rm H}+{\rm O}{{\rm H}}^{-}+{{\rm O}}_{2} $ | (7) |
| $ \cdot {\rm O}{\rm H} + {{\rm H}_2}{{\rm O}_2} \to {{\rm H}_2}{\rm O} + {\rm H}{{\rm O}_2} \cdot $ | (8) |
第二组实验所用的电解槽由两个半反应器组合而成,中间通过阳离子交换膜将其分为双室(一室为阳极室,一室为阴极室),反应装置如图 6所示。由于中间隔有阳离子交换膜,限制了阴、阳两室溶液的相互交换,故可将该实验看作两个单独进行的反应,有利于区分·OH是来自阳极的直接氧化还是阴极的H2O2和
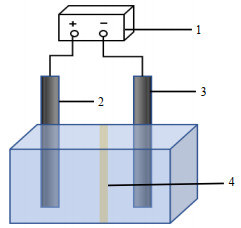
|
图 6 反应装置示意图 Fig.6 Schematic diagram of the reaction setup 1. power supply 2. anode 3. cathode 4. cation exchange membrane |
综上所述,作者提出了阴极电生H2O2的工作机制。一是“单电子途径”:氧气通过得到一个电子还原成
图 7(a)探究了各阴极材料对LVF降解的影响,图中ρ为污染物实时质量浓度(mg⋅L−1),ρ0为污染物初始质量浓度(mg⋅L−1),ρ/ρ0为污染物降解效率。发现石墨和钛电极对LVF降解的贡献大致相同,反应结束时LVF约降解了63.0%;不锈钢体系下LVF降解了55.5%;铱钽体系下LVF降解了39.6%,但排除电化学氧化阶段降解的33.8%,联合nZVI阶段仅贡献了5.8% 的降解率。由表 1可看出,不同体系下,LVF在电化学氧化阶段的降解率基本相同,说明此阶段主要通过直接电子转移(DET)降解LVF,而联合nZVI阶段和整体阶段的降解率变化与对应电生H2O2体系中H2O2的累积浓度呈正相关。显然,只有充足的H2O2才能与溶出的Fe2+反应生成足量的·OH,进而促进LVF降解。
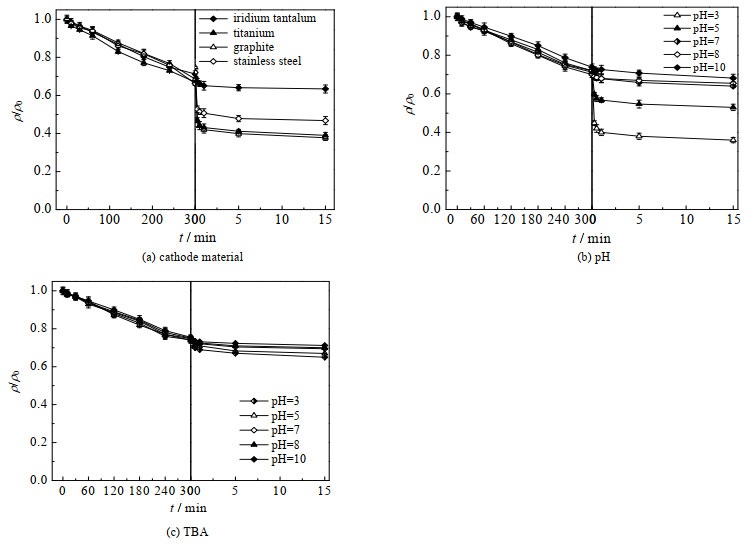
|
图 7 不同条件对LVF降解的影响 Fig.7 Effects of different conditions on LVF degradation |
|
|
表 1 各阴极体系中LVF降解和H2O2累积浓度的关系 Table 1 Relationship between LVF degradation and H2O2 accumulation concentration in various cathode systems |
pH值是影响类芬顿反应的重要因素之一。研究考察了不同初始pH值对石墨体系LVF降解的影响,结果如图 7(b)所示。观察发现,在实验所选择的pH范围内,初始pH值越低,LVF的降解效率越高。当初始pH值为3时,LVF达到最高降解率64.7%,而当pH值≥7时,LVF几乎不再降解。联合nZVI体系中,偏低的pH值更有利于LVF的氧化分解,其原因具体可从3个方面进行阐述:(1)酸性条件有利于nZVI向Fe2+转换,进而促进LVF的降解;(2)酸性条件下溶液中生成的·OH的氧化还原电位会增大,导致其氧化能力得到进一步增强;(3)反应过程中生成的氢氧化铁沉淀物以及羟基铁复合物会覆盖在nZVI表面,阻碍反应持续进行,而较低的pH值会降低沉淀物的形成,使反应能够长期持续进行。另外,当溶液初始pH较高时,H2O2变得不稳定,容易与碱反应生成O2和H2O,且nZVI在碱性条件下不易转化为Fe2+,进一步抑制了·OH的生成,故酸性条件下LVF降解效率更高。
3.4.3 类芬顿体系下LVF的降解机制为了鉴定LVF降解过程中生成的活性物种,实验以TBA作为·OH捕获剂(反应速率常数为3.8×108~7.6×108 (mol⋅L−1)−1s−1)BQ为
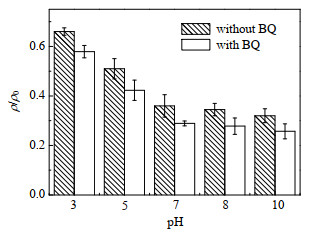
|
图 8 BQ的加入对不同pH下LVF降解的影响 Fig.8 Effects of BQ addition on LVF degradation at different pH values |
为了确认体系中·OH是否存在,利用DMPO作为自旋捕获剂进行电子自旋共振技术(ESR)实验,通过检测加合物DMPO-·OH的信号来判断自由基的生成,结果如图 9(a)所示。当不加电时(反应1 min),没有发现明显的ESR波谱,当电流为0.05 A时,可以清楚看到峰高比为1:2:2:1的4重峰谱图,这是DMPO-·OH的典型特征波谱,与文献报道的DMPO-·OH峰谱图一致,证明了体系中确实存在·OH。另外,图 9(b)为不同初始pH值时(反应1 min),体系中·OH的ESR检测结果,由图可看出pH值越低,·OH的生成量越多,这与3.3节结论一致。
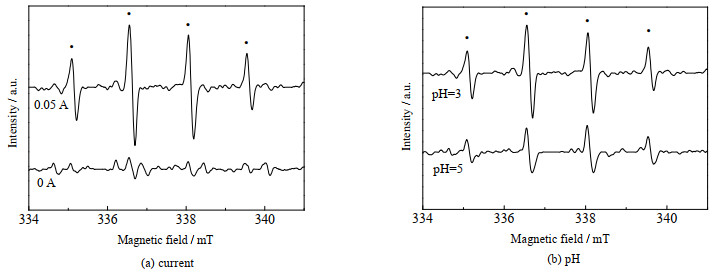
|
图 9 不同条件下·OH的ESR图谱 Fig.9 ESR spectra of ·OH under different conditions |
综合上述LVF降解和自由基捕获实验结果,加上空白对照实验,作者总结了各活性物种对整个实验过程中LVF降解的相对贡献,详细数据如表 2所示。由表可知,随着pH的增大,·OH对LVF降解的贡献不断减小,从pH为3时的43.9% 降至pH为10时的0.0%,反之,DET和吸附(包括电极板和nZVI的吸附作用)的贡献不断增加,当pH等于10时,二者对LVF降解的贡献达到了45.4% 和34.5%。相比较而言,
|
|
表 2 LVF降解过程中活性物种的相对贡献 Table 2 Relative contribution of active species in the degradation of LVF |
结合降解产物种类及反应路径分析,明确了不同反应基团对LVF的降解机理。使用高效液相色谱—质谱联用技术分析了电生过氧化氢联合零价铁体系降解LVF的中间体。观察到LVF由3种主要成分组成,即哌嗪基、喹啉和恶嗪基,其降解产生脱甲基、脱羧、去哌嗪基和脱氟。在此,根据反应中间体和文献报道,提出了3种可能的左氧氟沙星降解途径,见图 10。
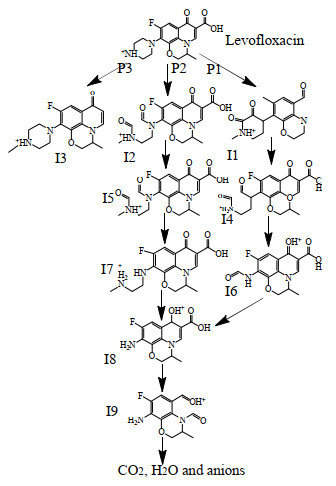
|
图 10 左氧氟沙星的可能降解途径 Fig.10 Possible degradation pathways of levofloxacin |
在途径1中,反应性自由基(主要是·OH)攻击哌嗪基的氮原子,从而打开环并剥离C2H2。它通过去甲基化形成中间体I1。随后,中间体I1的仲胺基团受到攻击,通过除去氮和碳原子而形成中间体I4。之后,反应性基团攻击中间体I4的仲胺基团形成中间体I6。随后,中间体I6经历喹诺酮部分的脱氟和羧基氧化以形成中间体I8。在途径2中,通过脱羧和脱甲基逐渐形成中间体I2和I5。由于哌嗪基环的打开、脱氟和C2H2剥离,随后形成中间体I7和I8。实际上,去哌嗪基过程分别发生在从I1到I6(途径1)和从I2到I8(途径2)的连续转化上。最后,通过途径1和2产生的中间体I8被进一步氧化为形成易受伤害的中间体I9,随后被降解为CO2、H2O和阴离子。
4 结论本实验通过对4种阴极材料电生H2O2的性能及机理进行探究,从中选择出最佳条件和效果最好的电极,联合nZVI应用于LVF的降解实验中,初步探究了电生过氧化氢联合nZVI体系下LVF的降解机制.得出以下结论:
(1) 溶液pH值的变化(3~10)对H2O2生成有显著影响。石墨电极在酸性、中性及碱性条件下均能高效生成H2O2,钛和不锈钢电极则在酸性条件下生成H2O2的效率更高,但二者电生H2O2性能均不及石墨,而铱钽电极在中性条件下生成的H2O2浓度最高,但仅有38.0 μmol⋅L−1,不适合作为电生H2O2工艺的阴极材料使用。
(2) SO42−和CO32−等共存离子的加入促进了H2O2的生成,而低浓度Cl−的加入在一定程度上也能够促进H2O2的生成,但当其浓度继续增大,溶液中形成的Cl2和ClO−/HClO会与H2O2反应,使H2O2浓度降低。
(3) 通过对电生H2O2过程中形成的自由基的测定,提出了阴极电生H2O2的两种途径,一是“单电子途径”:氧气通过得到一个电子还原成
(4) 石墨电极联合nZVI体系下,溶液初始pH值对LVF降解影响较大,石墨联合nZVI体系下,当pH为3时,LVF降解率达到64.7%。
(5) 通过自由基捕获实验和ESR实验确定了活性物种
| [1] |
邹星, 吴小莲, 莫测辉, 等. 蒙脱石对四环素类抗生素的吸附平衡及动力学[J]. 高校化学工程学报, 2011, 25(3): 524-528. ZOU X, WU X L, MO C H, et al. Adsorption equilibrium and kinetics of adsorbing tetracycline antibiotics on montmorillonite[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(3): 524-528. |
| [2] |
李莹, 陈维涵, 单胜道, 等. 水体中内分泌干扰物的高效脱除与多技术组合联用[J]. 高校化学工程学报, 2022, 36(3): 318-326. LI Y, CHEN W H, SHAN S D, et al. Research progress of hybrid systems for EDCs efficient removal in water[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(3): 318-326. |
| [3] |
HE F X, CAI W L, LIN J J, et al. Reducing the impact of antibiotics in wastewaters: Increased removal of mitoxantrone from wastewater by biosynthesized manganese nanoparticles[J]. Journal of Cleaner Production, 2021, 293: 126207. DOI:10.1016/j.jclepro.2021.126207 |
| [4] |
ZHU Y J, WANG Y Y, JIANG X X, et al. Microbial community compositional analysis for membrane bioreactor treating antibiotics containing wastewater[J]. Chemical Engineering Journal, 2017, 325: 300-309. DOI:10.1016/j.cej.2017.05.073 |
| [5] |
MOREIRA J, LIMA V B, GOULART L A, et al. Electrosynthesis of hydrogen peroxide using modified gas diffusion electrodes (MGDE) for environmental applications: Quinones and azo compounds employed as redox modifiers[J]. Applied Catalysis B: Environmental, 2019, 248: 95-107. DOI:10.1016/j.apcatb.2019.01.071 |
| [6] |
栾国颜, 高维平, 姚平经. 国内、外过氧化氢生产与应用进展[J]. 化工科技市场, 2005, 28(1): 15-19. LUAN G Y, GAO W P, YAO P J. The progress for production and application of hydrogen peroxide at home and abroad[J]. Chemical Technology Market, 2005, 28(1): 15-19. |
| [7] |
DU X, MO Z Y, LI Z Y, et al. Boron-doped diamond (BDD) electro-oxidation coupled with nanofiltration for secondary wastewater treatment: Antibiotics degradation and biofouling[J]. Environment International, 2021, 146: 106291. DOI:10.1016/j.envint.2020.106291 |
| [8] |
张霞, 白波, 丁晨旭, 等. Fe3O4@沙棘枝炭吸附去除强力霉素及其非均相Fenton氧化再生[J]. 高校化学工程学报, 2015, 29(5): 1179-1185. ZHANG X, BAI B, DING C X, et al. Doxycycline adsorption with Fe3O4@ seabuckthorn carbon and adsorbents regeneration under heterogeneous Fenton oxidation[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(5): 1179-1185. |
| [9] |
张柯, 闫云涛, 董勇. Fe3+/H2O2类芬顿降解性能及反应机理[J]. 高校化学工程学报, 2022, 36(2): 249-257. ZHANG K, YAN Y T, DONG Y. Degradation performance and reaction mechanism of Fe3+/H2O2 Fenton-like systems[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(2): 249-257. |
| [10] |
郑展望, 雷乐成, 邵振华, 等. UV/Fenton反应体系Fe2+固定化技术及催化反应工艺研究[J]. 高校化学工程学报, 2004, 18(6): 739-744. ZHENG Z W, LEI L C, SHAO Z H, et al. Immobilization of Fe2+ in UV/Fenton systems and the catalytic reaction of the system[J]. Journal of Chemical Engineering of Chinese Universities, 2004, 18(6): 739-744. |
| [11] |
DRIESSCHAERT B, BOBKO A A, KHRAMTSOV V V, et al. Nitro-triarylmethyl radical as dual oxygen and superoxide probe[J]. Cell Biochemistry and Biophysics, 2017, 75(2): 241-246. DOI:10.1007/s12013-016-0732-y |
| [12] |
YANG J, CAO Y, ZHANG N D. Spectrophotometric method for superoxide anion radical detection in a visible light (400-780 nm) system[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2020, 239: 118556. DOI:10.1016/j.saa.2020.118556 |
| [13] |
LI L, CHENG M, ALMATRAFI E, et al. Tuning the intrinsic catalytic sites of magnetite to concurrently enhance the reduction of H2O2 and O2: Mechanism analysis and application potential evaluation[J]. Journal of Hazardous Materials, 2023, 457: 131800. DOI:10.1016/j.jhazmat.2023.131800 |
| [14] |
DUAN Y H, JIANG W L, SEDLAK D L. Surface processes control the fate of reactive oxidants generated by electrochemical activation of hydrogen peroxide on stainless-steel electrodes[J]. Environmental Science & Technology, 2023, 57(47): 18680-18689. |
| [15] |
WANG J L, WANG S Z. Reactive species in advanced oxidation processes: Formation, identification and reaction mechanism[J]. Chemical Engineering Journal, 2020, 401: 126158. DOI:10.1016/j.cej.2020.126158 |
| [16] |
ZHOU Y J, CHEN C Y, GUO K H, et al. Kinetics and pathways of the degradation of PPCPs by carbonate radicals in advanced oxidation processes[J]. Water Research, 2020, 185: 116231. DOI:10.1016/j.watres.2020.116231 |
| [17] |
CONNICK R E. The interaction of hydrogen peroxide and hypochlorous acid in acidic solutions containing chloride ion[J]. Journal of the American Chemical Society, 1947, 69(6): 1509-1514. DOI:10.1021/ja01198a074 |
| [18] |
LI J X, ZHONG D, HUANG J Y, et al. Cobalt mediated perovskite as efficient Fenton-like catalysts for the tetracycline removal over a neutral condition: The importance of superoxide radical[J]. Chemosphere, 2023, 313: 137564. DOI:10.1016/j.chemosphere.2022.137564 |
| [19] |
ZHANG Y J, HUANG G X, WINTER L R, et al. Simultaneous nanocatalytic surface activation of pollutants and oxidants for highly efficient water decontamination[J]. Nature Communications, 2022, 13(1): 3005. DOI:10.1038/s41467-022-30560-9 |
| [20] |
李峰, 刘桂芳, 梁涛, 等. Fe2+/NH2OH联合活化过硫酸盐降解水中磺胺甲恶唑[J]. 高校化学工程学报, 2017, 31(5): 1210-1216. LI F, LIU G F, LIANG T, et al. Degradation of sulfamethoxazole in aqueous solution by ferrous/hydroxylamine activated peroxymonosulfate[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(5): 1210-1216. |




