2. 浙江博锐生物制药有限公司, 浙江 台州 318000
2. Zhejiang Bioray Biopharmaceutical Co. Ltd., Taizhou 318000, China
单克隆抗体(单抗)在治疗肿瘤和自身免疫性疾病方面具有良好的专一性和显著的疗效[1]。N-糖基化、氨基酸翻译后修饰和空间构象的改变会使单抗在电荷和疏水性方面表现出异质性[2-3]。其中,电荷异质性在生物创新药的开发和生物类似药的相似性评价过程中被视为关键质量属性[4-6]。毛细管区带电泳、等电聚焦、阳离子交换色谱(cationic exchange,CEX)和阴离子交换色谱等都可以实现电荷异构体的分离[7-10]。在CEX中,早于主峰洗脱的称为酸性峰(表观等电点更低),晚于主峰洗脱的称为碱性峰(表观等电点更高)[11]。酸性变异体通常源于N-糖唾液酸化、天冬酰胺(Asn)脱酰胺修饰、糖化、三硫键、半胱氨酸化和蛋白碎片等[12]。碱性变异体通常由C-末端赖氨酸(Lys)缺失不完全、N-末端谷氨酰胺环化不完全、天冬氨酸(Asp)异构、甲硫氨酸(Met)氧化修饰、C-末端酰胺化、前导序列移除不完全和聚集体等引起[12]。Du等[12]指出电荷异质性对生物学功能的影响通常取决于翻译后修饰位点:可变区的修饰可能对抗原结合活性产生影响[13];而可结晶片段(fragment crystallizable,Fc)的修饰则只可能影响Fc相关功能[14]。此外,Khawli等[15]报道称,等电点变化小于1的电荷差异通常不会影响单抗的生物学功能和药代动力学。因此,电荷异质性对功能的影响一般是源于氨基酸翻译后修饰,包括修饰位点、类型和比例[16]。通常,生物类似药与原研药间电荷异构体水平的差异很常见,要通过工艺优化来调控[11, 17-18]。依照质量源于设计的理念,为了对工艺过程进行理性的设计和调控,需要对产品本身结构和性质有深入的理解[11, 19]。因此,必须建立电荷异质性与结构(主要是翻译后修饰)的相关性。更重要的是,需要研究电荷异质性和翻译后修饰对功能的影响来确定调控的必要性和调控策略。
阿达木单抗修美乐(Humira®)是美国食品和药物管理局在2002年批准上市的第一个重组全人源单抗,用于治疗类风湿关节炎、强直性脊柱炎和银屑病等[20-22]。修美乐从2012年至今蝉联全球“药王”,2019年销售额突破200亿美元。海正生物制药有限公司开发的阿达木单抗生物类似药HS016(商品名:安健宁®)已于2019年12月获国家药监局批准上市。本研究拟通过CEX分离和制备HS016的电荷异构体组分,鉴定各组分形成的结构基础,并分析生物学功能,以期建立结构-电荷异质性-功能的相关性,为生产工艺优化过程中电荷异构体的调控提供理论指导。
2 实验部分 2.1 材料HS016注射液由海正生物制药有限公司生产并提供。羧肽酶B(carboxypeptidase B,CpB)购自上海雅心生物技术有限公司。十二烷基硫酸钠(sodium dodecyl sulfate,SDS)样品缓冲液购自美国Beckman Coulter公司。碘乙酰胺(iodacetamide,IAM)购自日本东京化成工业株式会社。二硫苏糖醇(dithiothreitol,DTT)、10倍磷酸盐吐温缓冲液(10×phosphate buffered solution with tween 20,10×PBST)和牛血清白蛋白(bovine albumin,BSA)购自加拿大生工生物公司。胰蛋白酶购自美国Promega公司。Glu-C蛋白酶和羊抗人IgG Fc抗体-HRP购自美国Sigma-Aldrich公司。质谱级乙腈和甲酸购自美国Thermo Fisher Scientific公司。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)购自美国R & D公司。四甲基联苯胺(tetramethylbenzidine,TMB)购自天根生化科技(北京)有限公司。放线菌素D由浙江海正药业股份有限公司提供。L929细胞(CCL-1)购自美国模式培养物研究所。细胞计数试剂盒CCK-8购自日本同仁化学研究所。其他均为市售分析纯生化试剂。
2.2 实验方法 2.2.1 电荷异构体组分的分离制备HS016注射液高温样品(40 ℃放置5 d)用质量分数为1.3 % 的CpB在37 ℃水浴酶切2 h去除C-末端Lys。电荷异构体分离制备在AKTA pure 25蛋白纯化系统(美国GE公司)上进行,色谱柱为半制备柱(Tricon,10 mm × 300 mm,美国GE公司),填料为TSKgel WCX-10 (粒径10 μm,日本Tosoh公司),上样载量为2.2 mg·mL-1。流动相A为浓度0.01 mol·L-1 Na2HPO4溶液(pH= 7.5),流动相B是浓度为0.01 mol·L-1 Na2HPO4 + 0.5 mol·L-1 NaCl溶液(pH= 5.5),用10倍柱体积的体积分数为6% ~ 16% 的流动相B线性梯度洗脱,体积流量为1.0 mL·min-1。重复2次分离和收集后获得的组分经G-25柱(美国GE公司)脱盐置换至制剂缓冲液(浓度为6.2 mmol·L-1枸橼酸、1.2 mmol·L-1枸橼酸钠、5.5 mmol·L-1磷酸二氢钠、8.6 mmol·L-1磷酸氢二钠、242 mmol·L-1蔗糖、体积分数为0.1% 的聚山梨酯80,pH=5.2),保存在-70 ~ -80 ℃。
2.2.2 阳离子交换色谱分析在Aglient1260高效液相色谱仪(美国Aglient公司)上分析各电荷异构体组分的CEX纯度。分析色谱柱为ProPac WCX-10(4.0 mm × 250 mm,5 μm,美国Thermo公司),柱温35 ℃。流动相A是浓度为0.01 mol·L-1的Na2HPO4溶液(pH =7.5),流动相B是浓度为0.01 mol·L-1 Na2HPO4 + 0.5 mol·L-1 NaCl溶液(pH= 5.5)。洗脱梯度为20 min内从流动相B的体积分数从6% 增加到16%,体积流量为1.0 mL·min-1,进样量为100 μg,紫外检测波长为280 nm。
2.2.3 尺寸排阻色谱分析在Aglient 1260高效液相色谱仪上进行尺寸排阻色谱(size exclusion chromatography,SEC)分析。色谱柱为TSKgel G3000 SWXL(7.8 mm × 300 mm,5 μm,日本Tosoh公司),柱温25 ℃。流动相是浓度0.02 mol·L-1 NaH2PO4 + 0.2 mol·L-1 NaCl溶液(pH= 7.4),进样量为20 μg,体积流量为0.5 mL·min-1,恒定洗脱35 min,紫外检测波长为280 nm。
2.2.4 毛细管凝胶电泳分析在Aglient 7100毛细管电泳仪(美国Aglient公司)上进行非还原毛细管凝胶电泳(capillary gel electrophoresis,CGE或CE-SDS)分析。用SDS样品缓冲液(质量分数为1% SDS溶于0.1 mol·L-1Tris-HCl缓冲液,pH= 9.0)和终浓度40 mmol·L-1IAM将供试品稀释至质量浓度为1.0 mg·mL-1,供试品在70 ℃水浴5 min进行变性和烷基化封闭反应。在温度为20 ℃,电压为-10.0 kV进样40 s,-15.0 kV运行40 min,紫外检测波长为214 nm。
2.2.5 稳定性实验将电荷异构体样品分装出4支,每支200 μL,放置在2~8 ℃冰箱中,在第4 d、第7 d、第10 d和第13 d分别取出1支,进行CEX和SEC纯度分析。
2.2.6 液相色谱-二级串联质谱分析在Waters ACQUITY UPLC - Xevo-G2S Q-TOF超高效液相色谱-二级串联质谱联用仪(LC-MS/MS,美国Waters公司)进行电荷异构体的结构表征。将供试品用10K超滤离心管(美国Millipore公司)浓缩至质量浓度为20 mg·mL-1以上,用浓度为6 mol·L-1盐酸胍-0.1 mol·L-1Tris变性缓冲液(pH= 8.3)稀释至质量浓度为8 mg·mL-1。加入终浓度为0.02 mol·L-1的DTT在37 ℃还原1.5 h,加入终浓度为0.06 mol·L-1的IAM,室温,避光反应40 min,封闭游离半胱氨酸。用3 K超滤离心管(美国Millipore公司)在转速为12 000 r·min-1,温度为4 ℃超滤离心3次,置换缓冲液(浓度为0.2 mol·L-1、pH =7.8磷酸盐缓冲液)。按照质量比m(蛋白): m(酶)=20:1加入胰蛋白酶,再加入终体积分数为5% 的Glu-C蛋白酶溶液(每mL酶溶液含1 000酶活力单位数),37 ℃水浴酶切15 h,用终体积分数为1% 的甲酸终止反应,进行LC-MS/MS分析。色谱柱为Waters BEH 300 C18 (1.7 μm,2.1mm ×150 mm,美国Waters公司),柱温40 ℃。流动相A是体积分数为0.1%的甲酸水溶液,流动相B是体积分数为0.1%为甲酸的质谱级乙腈溶液。洗脱梯度为40 min内从流动相B为体积分数5% 增加到50%,体积流量0.2 mL·min-1,进样量40 μg,紫外检测波长214 nm。质谱操作参数为:毛细管电压2.5 kV,锥孔电压60 V,离子源温度95 ℃,雾化温度400 ℃,雾化体积流量为400 L·h-1,质量分析质荷比为50~2 000,二级碰撞能量20~45 eV。利用Biopharmalynx 1.3.3软件(Waters)对液质联用获得数据进行分析。N-糖糖型比例和氨基酸翻译后修饰比例均通过目标肽段的一级质谱信号强度进行计算,并用二级质谱信息对肽段和修饰位点进行确认。计算公式为:糖型比例(%)=含某糖型的目标肽段信号强度/含各种糖型的目标肽段信号强度之和×100;翻译后修饰比例(%)=发生修饰的目标肽段信号强度/(发生修饰的目标肽段信号强度+未发生修饰的目标肽段信号强度)×100。
2.2.7 TNF-α体外结合活性分析利用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)进行TNF-α体外结合活性分析。将TNF-α用包被液(pH=9.6的碳酸盐缓冲液)稀释至质量浓度为0.25 μg·mL-1,以每孔100 μL加入酶标板中,37 ℃振荡2 h。将酶标板用洗涤液(1×PBST)清洗3次,以每孔200 μL加入封闭液(质量分数为1% BSA的1×PBST),37 ℃封闭1 h。将HS016参比品和供试品用封闭液稀释至质量浓度为9 000 ng·mL-1,然后按体积比1:2进行共10个梯度稀释。将封闭后的酶标板清洗3次,以每孔100 μL加入各浓度梯度的参比品和供试品溶液,设2个复孔,室温以转速500 r·min-1振荡1.5 h。将酶标板清洗5次,以每孔100 μL加入1:10 000封闭液稀释后的羊抗人IgG Fc抗体-HRP,室温以转速为500 r·min-1振荡1 h。将酶标板清洗5次,以每孔100 µL加入TMB显色液,室温避光反应15 min,以每孔100 µL加入1.0 mol·L-1硫酸终止反应,在450 nm波长下测定各孔吸光度值。
以参比品和供试品作用量(ng)为横坐标,各孔吸光度平均值为纵坐标,用酶标仪自带分析软件进行拟合,选择四参数方程回归模型,计算各供试品相对于参比品的TNF-α结合活性。
2.2.8 细胞(L929)死亡抑制活性分析收集对数期的L929细胞,用细胞完全培养液调整细胞密度为1.3×105个·mL-1,以每孔100 µL接种于96孔细胞培养板,放入37 ℃、体积分数为5%的二氧化碳培养箱培养18~24 h。将参比品和供试品用阴性对照液(质量浓度为60 µg·mL-1放线菌素D和2.5×10-4 µg·mL-1 TNF-α的细胞完全培养液)稀释至5 µg·mL-1,以此为首孔浓度进行共11个梯度稀释。将参比品和供试品溶液分别以每孔50 µL加入接种有L929细胞的培养板中,设3个复孔。阴性、阳性和空白对照孔分别加入50 µL的阴性对照液、阳性对照液(质量浓度为60 µg·mL-1放线菌素D的细胞完全培养液)和细胞完全培养液,设2个复孔。置于37 ℃、体积分数为5% 二氧化碳培养箱培养16 h。每孔加入10 µLCCK-8振荡1~2 min后置于37 ℃、体积分数为5% 二氧化碳培养箱中孵育1.5 h显色,以490 nm为测定波长,630 nm为参比波长测定吸光度。
以参比品和供试品作用量(ng)为横坐标,各孔吸光度平均值为纵坐标,用酶标仪自带分析软件进行拟合,选择四参数方程回归模型,计算各供试品相对于参比品的细胞死亡抑制活性。
3 结果与讨论 3.1 电荷异构体组分的分离制备和理化分析 3.1.1 CEX制备电荷异构体和纯度分析本研究利用CEX半制备柱分离了HS016的CpB酶切样品,共得到4个电荷异构体组分,按出峰顺序依次命名为酸性峰1(AP1)、酸性峰2(AP2)、主峰(MP)和碱性峰(BP),质量浓度均大于1.0 mg·mL-1。用CEX分析柱分析制备的电荷异构体组分纯度。如图 1和表 1所示,图中纵坐标UV为紫外吸光值;表中HMW为高分子量聚集体峰面积百分比(high molecular weight),LMW为低分子量碎片峰面积百分比(low molecular weight);从表 1中可以看出MP纯度达100%,其余组分纯度均大于90%。此外,图 1展示了制备得到的电荷异构体组分的CEX峰形和出峰时间均与HS016(原料)中相应的峰一致,证实了制备结果的可靠性。
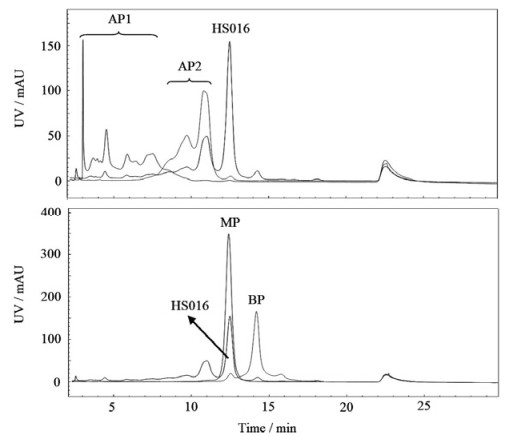
|
图 1 电荷异构体和CpB消化的HS016的CEX色谱图 Fig.1 CEX spectra of collected charge variants and raw material of CpB-digested HS016 |
|
|
表 1 电荷异构体的理化表征结果 Table 1 Physicochemical characterization of charge variants |
分子大小异质性是单抗的一种常见的异质性,表现为HMW和LMW。SEC通常被用于分析单抗的HMW,具有较高的分离度和准确性。如图 2和表 1所示,本研究的电荷异构体酸性峰和碱性峰的HMW均高于主峰。据文献[12,15]报道,HMW在碱性峰中增加主要是由于聚集体与阳离子交换树脂有更强的亲和力而在CEX中被较晚洗脱。而HMW在酸性峰中增加则可能是在缓冲液置换为制剂缓冲液的过程中发生的,因为酸性峰pI值更低,更接近于制剂缓冲液的pH= 5.2,因此在理论上更容易聚集。
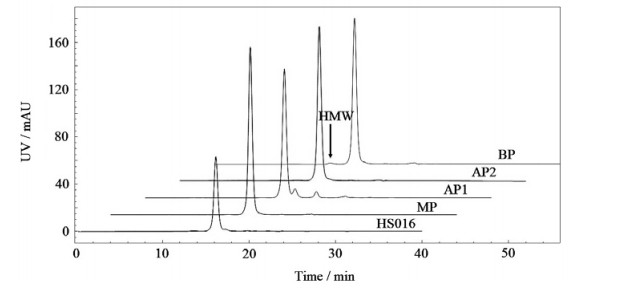
|
图 2 电荷异构体和HS016的SEC色谱图 Fig.2 SEC spectra of charge variants and HS016 |
CE-SDS是最常被用于分析单抗LMW的方法,比SEC具有更高的分离度和分辨率,能准确检出微量(峰面积占比为0.1%以下)碎片。如图 3和表 1所示,AP1的LMW高达16.6%,与文献[12]报道的结果一致。AP2和BP的LMW也高于MP,说明LMW由于其氨基酸序列的不同,不仅能形成酸性峰,也能引起碱性峰。此外,如图 2和3所示,各电荷异构体组分的CE-SDS和SEC色谱图的主峰峰形和保留时间均与HS016(原料)一致,说明CEX制备法是一种较温和的制备方法,不会破坏单抗的主要结构。
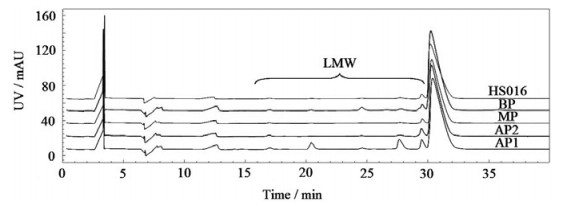
|
图 3 电荷异构体和HS016的CE-SDS色谱图 Fig.3 CE-SDS spectra of charge variants and HS016 |
为确保制备的电荷异构体在后续结构和功能研究过程中样品的一致性和结果的可靠性,对电荷异构体在2~8 ℃加速条件下的稳定性进行分析。如图 4所示,在考察的13 d内,CEX纯度和SEC纯度均未发生明显变化。结果表明,制备得到的电荷异构体组分具有较强的稳定性,能满足后续结构和功能研究对样品的要求。
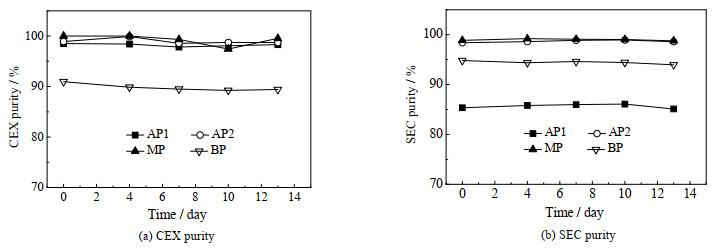
|
图 4 电荷异构体在2~8 ℃下的稳定性 Fig.4 Stability of charge variants stored at 2~8 ℃ |
氨基酸序列是蛋白质一级结构的基础,而N/C-末端氨基酸序列是较易发生突变、修饰和缺失的高风险区域。本研究在酶切肽段水平上用LC-MS/MS法对N/C-末端氨基酸序列进行确证。结果如表 2所示,4个电荷异构体组分的重链和轻链的N/C-末端肽段氨基酸序列都得到了确证,肽段分子量测定结果一致,且相对分子质量误差在0.2内。
|
|
表 2 电荷异构体N/C-末端氨基酸序列质谱测定结果 Table 2 MS results of N/C-terminal amino acid sequences of charge variants |
为进一步确证电荷异构体的氨基酸序列,用LC-MS/MS法测定了4个电荷异构体组分的肽段覆盖率。各组分的肽段覆盖情况均如图 5所示(仅展示一个),肽段覆盖率一致,均为100%。结果表明,4个电荷异构体组分的氨基酸序列一致,且与理论序列一致。

|
图 5 电荷异构体的肽段覆盖情况 Fig.5 Peptide coverage of a charge variant |
HS016是一种治疗性IgG1单抗,在CH2区域的QYNSTYR肽段上有一个N-糖基化位点Asn (301)。N-糖末端的唾液酸化会引入一个负电荷的羧基基团,因此通常被认为是酸性变异体形成的一个主要因素[11]。本研究用LC-MS/MS法测定N-糖的QYNSTYR肽段相对分子质量,从而获得N-糖糖型质谱信号强度百分比。电荷异构体的N-糖测定结果如表 3所示,主要的糖型包括G0F、G1F、Man5、G2F、G0、G1、G1FS1和G2FS1,其中AP1和AP2的唾液酸化比例显著高于MP和BP。因此,N-糖唾液酸化是HS016酸性变异体形成的因素之一。
|
|
表 3 电荷异构体的糖基化结果 Table 3 Glycosylation results of charge variants |
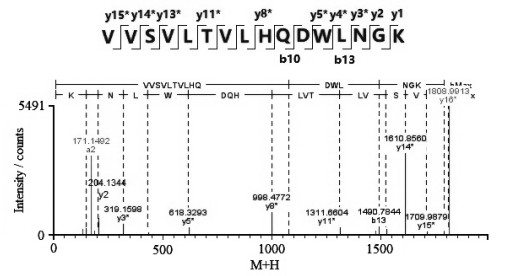
氨基酸翻译后修饰是电荷异构体形成的一个主要原因,其中最常见的是Asn脱酰胺、Met氧化和C-末端Lys缺失。Asn脱酰胺修饰由于引入了一个负电荷的羧基基团而形成酸性变异体[23]。Met氧化修饰会造成蛋白构象的改变,引起酸性变异体[24]或碱性变异体[12]。C-末端Lys是碱性氨基酸,Lys缺失不完全会产生碱性变异体[12]。本研究用LC-MS/MS法测得电荷异构体的主要翻译后修饰结果如表 4所示。重链的Asn (319)位发生了脱酰胺修饰,生成中间体琥珀酰亚胺(Asu)和产物Asp。其中,AP1的重链Asn (319)脱酰胺生成Asp所在肽段的二级质谱碎片离子图如图 6所示,y1和y2离子没有发生脱酰胺修饰,而y3及之后的离子均发生了一个脱酰胺修饰,说明脱酰胺发生在y3离子的Asn上,即Asn (319)。AP1和AP2的重链Asn (319)脱酰胺生成Asp和Asu的修饰比例均高于MP和BP,表明脱酰胺修饰是HS016酸性变异体形成的原因之一。AP1、AP2和BP的重链Met (256)氧化修饰比例均低于MP,表明HS016氧化修饰比例降低既能引起酸性变异体也有助于形成碱性变异体。AP1、AP2和MP的C-末端Lys缺失比例均大于99.5%,而BP仅为72.4%,即理论上BP两条重链都发生C-末端Lys缺失的比例仅为52.4% (72.4%×72.4%),仍有47.6 % BP存在C-末端Lys切除不完全的情况。因此,C-末端Lys切除不完全是HS016碱性变异体形成的主要原因。
|
|
表 4 电荷异构体的翻译后修饰结果 Table 4 Post-translational modifications of charge variants |
|
图 6 AP1 的重链 Asn (319)脱酰胺生成 Asp 所在肽段的二级质谱图(*表示发生了脱酰胺修饰) Fig.6 Secondary order tandem mass spectrogram of peptide with an HC-Asn (319) deamidation to Asp of AP1 (*deamidation) |
阿达木单抗的可变区发挥的TNF-α结合活性是其最主要的生物学功能。在有机体内,TNF-α能与TNF受体结合,激发一系列的细胞信号通路,诱导促炎细胞因子的产生,导致炎症的发生。阿达木单抗作为一种抗TNF-α全人源单抗,能够通过结合并中和TNF-α来阻断TNF-α与TNF受体的结合,从而抑制炎症[21]。如表 5所示,利用ELISA法分析得到的电荷异构体相对于参比品的TNF-α结合活性在95%~99%,处于产品质量标准范围内(80%~120%),不构成差异。
|
|
表 5 电荷异构体的活性表征结果 Table 5 Biological characterization of charge variants |
TNF-α和放线菌素D协同作用可以对L929小鼠成纤维细胞产生杀伤作用,阿达木单抗通过中和TNF-α的活性,阻止TNF-α与其受体的结合,对TNF-α诱导的细胞杀伤产生抑制作用。因此L929细胞死亡抑制实验可反映阿达木单抗的TNF-α中和活性。如表 5所示,电荷异构体相对于参比品的L929细胞死亡抑制活性在90%~117%,处于产品质量标准范围内(80%~125%),不构成差异。
TNF-α体外结合活性和细胞死亡抑制活性的结果表明,电荷异质性对HS016主要的体外生物学功能没有产生影响。
4 结论本研究用半制备型CEX对阿达木单抗进行分离获得4个电荷异构体组分:AP1、AP2、MP和BP。通过结构表征和纯度分析,发现酸性变异体的形成因素主要包括HMW、LMW、N-糖末端唾液酸化、Asn脱酰胺化比例升高和Met氧化比例降低;碱性变异体主要由HMW、LMW、C-末端Lys缺失不完全和Met氧化比例降低引起。进一步考察功能活性,发现电荷异质性对TNF-α体外结合活性和细胞死亡抑制活性这两项最关键的体外生物学功能没有影响。因此,在总的HMW和LMW含量被SEC和CE-SDS监控在质量标准范围内的基础上,电荷异构体不能一概被定义为杂质,而可能是有效成分,应在对其体内安全性和有效性进行评估后将其含量控制在一定标准范围内即可。
| [1] |
LÓPEZ-MORALES C A, MIRANDA-HERNÁNDEZ M P, JUÁREZ-BAYARDO L C, et al. Physicochemical and biological characterization of a biosimilar trastuzumab[J]. BioMed Research International, 2015, 2015: 1-10. |
| [2] |
BECK A, LIU H. Macro- and micro-heterogeneity of natural and recombinant IgG antibodies[J]. Antibodies, 2019, 8(1): 18-39. DOI:10.3390/antib8010018 |
| [3] |
HASELBERG R, De VIJLDER T, HEUKERS R, et al. Heterogeneity assessment of antibody-derived therapeutics at the intact and middle-up level by low-flow sheathless capillary electrophoresis-mass spectrometry[J]. Analytica Chimica Acta, 2018, 1044: 181-190. DOI:10.1016/j.aca.2018.08.024 |
| [4] |
BEYER B, WALCH N, JUNGBAUER A, et al. How similar is biosimilar? A comparison of infliximab therapeutics in regard to charge variant profile and antigen binding affinity[J]. Biotechnology Journal, 2019, 14(4): 1800340. DOI:10.1002/biot.201800340 |
| [5] |
DADA O O, JAYA N, VALLIERE-DOUGLASS J, et al. Characterization of acidic and basic variants of IgG1 therapeutic monoclonal antibodies based on non-denaturing IEF fractionation[J]. Electrophoresis, 2015, 36(21): 2695-2702. |
| [6] |
LIU H, REN W, ZONG L, et al. Characterization of recombinant monoclonal antibody charge variants using WCX chromatography, icIEF and LC-MS/MS[J]. Analytical Biochemistry, 2019, 564-565: 1-12. DOI:10.1016/j.ab.2018.10.002 |
| [7] |
JING S, GOU J, GAO D, et al. Separation of monoclonal antibody charge variants using cation exchange chromatography: Resins and separation conditions optimization[J]. Separation and Purification Technology, 2020, 235: 116136. DOI:10.1016/j.seppur.2019.116136 |
| [8] |
KHANAL O, KUMAR V, WESTERBERG K, et al. Multi-column displacement chromatography for separation of charge variants of monoclonal antibodies[J]. Journal of Chromatography A, 2019, 1586: 40-51. DOI:10.1016/j.chroma.2018.11.074 |
| [9] |
ZHANG Y, WANG W, XIAO X, et al. Separation of monoclonal antibody charge state variants by open tubular capillary electrochromatography with immobilised protein as stationary phase[J]. Journal of Chromatography A, 2016, 1466: 180-188. DOI:10.1016/j.chroma.2016.09.008 |
| [10] |
KAHLE J, ZAGST H, WIESNER R, et al. Comparative charge-based separation study with various capillary electrophoresis (CE) modes and cation exchange chromatography (CEX) for the analysis of monoclonal antibodies[J]. Journal of Pharmaceutical and Biomedical Analysis, 2019, 174: 460-470. DOI:10.1016/j.jpba.2019.05.058 |
| [11] |
MIAO S, XIE P, ZOU M, et al. Identification of multiple sources of the acidic charge variants in an IgG1 monoclonal antibody[J]. Applied Microbiology and Biotechnology, 2017, 101(14): 5627-5638. DOI:10.1007/s00253-017-8301-x |
| [12] |
DU Y, WALSH A, EHRICK R, et al. Chromatographic analysis of the acidic and basic species of recombinant monoclonal antibodies[J]. MAbs, 2012, 4(5): 578-585. DOI:10.4161/mabs.21328 |
| [13] |
YAN Y T, WEI H, FU Y, et al. Isomerization and oxidation in the complementarity-determining regions of a monoclonal antibody: A study of the modification-structure-function correlations by hydrogen-deuterium exchange mass spectrometry[J]. Analytical Chemistry, 2016, 88(4): 2041-2050. DOI:10.1021/acs.analchem.5b02800 |
| [14] |
LEE H S, IM W. Effects of N-glycan composition on structure and dynamics of IgG1 Fc and their implications for antibody engineering[J]. Scientific Reports, 2017, 7(1): 12659. DOI:10.1038/s41598-017-12830-5 |
| [15] |
KHAWLI L A, GOSWAMI S, HUTCHINSON R, et al. Charge variants in IgG1:Isolation, characterization, in vitro binding properties and pharmacokinetics in rats[J]. MAbs, 2010, 2(6): 613-624. DOI:10.4161/mabs.2.6.13333 |
| [16] |
VLASAK J, IONESCU R. Heterogeneity of monoclonal antibodies revealed by charge-sensitive methods[J]. Current Pharmaceutical Biotechnology, 2008, 9: 468-481. DOI:10.2174/138920108786786402 |
| [17] |
XU Y P, XIE L Q, ZHANG E H, et al. Physicochemical and functional assessments demonstrating analytical similarity between rituximab biosimilar HLX01 and the MabThera[J]. MAbs, 2019, 11(3): 606-620. DOI:10.1080/19420862.2019.1578147 |
| [18] |
LEE K H, LEE J, BAE J S, et al. Analytical similarity assessment of rituximab biosimilar CT-P10 to reference medicinal product[J]. MAbs, 2018, 10(3): 380-396. DOI:10.1080/19420862.2018.1433976 |
| [19] |
BRUEHLMANN D, JORDAN M, HEMBERGER J, et al. Tailoring recombinant protein quality by rational media design[J]. Biotechnology Progress, 2015, 31(3): 615-629. DOI:10.1002/btpr.2089 |
| [20] |
LIU J, ERIS T, LI C, et al. Assessing analytical similarity of proposed Amgen biosimilar ABP 501 to adalimumab[J]. BioDrugs, 2016, 30(4): 321-338. DOI:10.1007/s40259-016-0184-3 |
| [21] |
LEE N, LEE J J, YANG H, et al. Evaluation of similar quality attribute characteristics in SB5 and reference product of adalimumab[J]. MAbs, 2019, 11(1): 129-144. DOI:10.1080/19420862.2018.1530920 |
| [22] |
BANDYOPADHYAY S, MAHAJAN M, MEHTA T, et al. Physicochemical and functional characterization of a biosimilar adalimumab ZRC-3197[J]. Biosimilars, 2015, 5: 1-18. |
| [23] |
DIEPOLD K, BOMANS K, WIEDMANN M, et al. Simultaneous assessment of Asp isomerization and Asn deamidation in recombinant antibodies by LC-MS following incubation at elevated temperatures[J]. PloS One, 2012, 7(1): e30295. DOI:10.1371/journal.pone.0030295 |
| [24] |
LIU S, MADREN S, FENG P, et al. Characterization of the acidic species of a monoclonal antibody using free flow electrophoresis fractionation and mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2020, 185: 113217. DOI:10.1016/j.jpba.2020.113217 |




