银既是一种高技术用金属,也是一种军民两用贵金属,在工业和人们日常生活中有着非常广泛的用途。然而大量的银残留物会导致水体、土壤等环境污染,能在食物链的生物放大作用下富集,最后进入人体,造成潜在的危害。银或银盐被人吸入后会在皮肤、眼睛及黏膜沉着,产生病变,还可使体内的巯基酶失活,甚至具有致癌作用。因此迫切需要建立一种方便快捷、灵敏且选择专一的检测银方法。
传统的银检测方法,如容量分析法,ICP-MS[1],原子吸收法[2]等,对仪器要求高,分析成本昂贵,操作繁琐,容量法吸附现象严重,准确度差等,因此应用受到很大的限制。
荧光探针敏感性高、选择性好、操作便捷,利用荧光性能和离子浓度的关系可以进行离子的定量分析,成为重金属离子的实时或原位检测的重要手段。黄世稳等[3]采用四氢硼钠和凝血酶(TB)修饰,制备了识别凝血酶的纳米银探针,其灵敏度高、线性范围宽, 检出限为17×10-12 mol·L-1。李慧等[4]采用寡核苷酸为连接分子,成功制备了生物素修饰的纳米银探针,可对微量蛋白显示可视化检测。许智祥等[5]以巯基乙酸为稳定剂, 合成了一种新型水溶性CdTe量子点荧光探针,对Ag+具有高度选择性,检出限为3×10-8 mol·L-1。吕鉴泉等[6]报道的新型杯芳烃衍生物PVC膜电极,该探针成功地应用于Ag+的电位分析,但Hg2+、Cr3+等干扰较大。Zhou等[7]合成了一类以席夫碱为受体,萘酰亚胺为母体的探针,可在水相中检测Ag+。但在682 nm处的荧光强度发生猝灭,导致灵敏度不高。
要解决上述灵敏度不高、干扰大、操作复杂等问题,如何设计新型荧光增强型分子探针,使之与被测物作用前后荧光关闭-开启而受干扰影响小,具有极高选择性和灵敏度,以提供准确的检测信号是关键。
本文研究利用罗丹明螺内酰胺母体在金属离子诱导下发生开环的机理,在罗丹明6G酰肼上,引入芳香醛和烯丙基结构,通过扩大芳香共轭结构,提高整个分子共平面的刚性结构,调节碳氧双键的氧原子、亚氨基的氮原子对Ag+的亲和性,得到一个off-on增强型荧光探针。用红外、核磁光谱等方法对其结构进行表征,利用紫外、荧光光谱等研究光化学性质及识别性能,同时考察了金属离子浓度,pH等因素的影响,并研究其对Ag+识别行为。以期望获得可实现生物体以及环境中的Ag+的高灵敏、高选择性检测。
2 实验 2.1 实验材料与仪器日立F-7000荧光分光光度计,jena Specord 50紫外分光光度计,NICOLET iS 10红外光谱仪,罗丹明6G、水合联氨(阿拉丁试剂公司),香草醛,氯丙烯(分析纯,国药集团化学试剂公司)。
2.2 荧光探针RP的合成合成路线如Scheme 1所示。
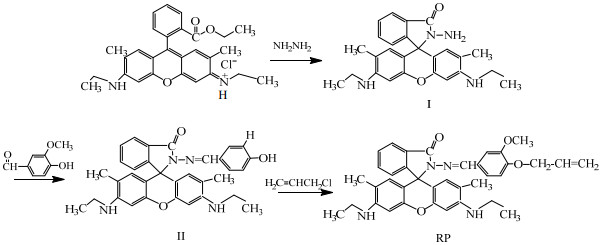
|
Scheme 1 荧光探针RP的合成路线 Scheme1 Synthetic route of the fluorescent probe RP |
将罗丹明6G (2.2 g,5 mmol)于盛有无水乙醇三颈瓶中,搅拌,逐滴加入7 mL (80%)过量水合联氨的乙醇溶液,加热回流至深粉色消失,倒入冷水中,用乙酸乙酯萃取多次,合并萃取液,无水Na2SO4干燥,浓缩后得浅红色粉末罗丹明6G酰肼[8]。产率67.7%
1H NMR (CDCl3, 400 MHz) δ/ppm: 7.84 (d, 1H, J = 8.0 Hz), 7.58 (m, 1H), 7.46 (d, 1H, J = 7.8 Hz), 7.18 (m, 1H), 6.92 (s, 1H), 6.79 (s, 1H), 6.14 (s, 1H), 5.57 (d, J = 6.2 Hz, 1H), 5.41 (s, 1H), 5.10 (s, 2H), 4.24 (d, J = 6.2 Hz, 1H), 4.07 (q, J = 7.0 Hz, 2H), 3.45 (q, J = 6.8 Hz, 2H), 2.17 (s, 3H), 2.12 (s, 3H), 1.41 (t, J = 7.0 Hz, 3H), 1.28 (t, J = 6.8 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ/ppm: 160.8, 148.8, 143.7, 139.5, 132.6, 131.3, 130.6, 129.2, 128.3, 128.0, 119.8, 113.1, 100.2, 80.0, 37.9, 17.9, 15.1。
IR (kBr, σ/cm-1):3440, 3100, 1690, 1630, 1520, 1430, 1380。
2.2.2 化合物(Ⅱ)的合成向盛有化合物Ⅰ (2.7g,6 mmol)和无水乙醇三颈瓶中,滴加香草醛(1.4 g,9 mmol)的醇溶液,滴加1d冰乙酸作催化剂,加热回流18 h。TLC跟踪反应进程,反应结束后旋转蒸发去除溶剂,以石油醚-乙酸乙酯(3/1,V/V)为洗脱剂,用柱层析法分离提纯,干燥得灰绿色粉末[9]。产率为79.2 %。
1H NMR (CDCl3, 400 MHz) δ/ppm: 9.55 (s, 1H), 8.39 (s, 1H), 7.84 (d, 1H, J = 8.0 Hz), 7.58 (m, 1H), 7.46 (d, 1H, J = 7.8 Hz), 7.34 (m, 2H), 6.88 (d, 1H, J = 8.6 Hz), 7.18 (m, 1H), 6.92 (s, 1H), 6.79 (s, 1H), 6.14 (s, 1H), 5.57 (d, J = 6.2 Hz, 1H), 5.41 (s, 1H), 4.24 (d, J = 6.2 Hz, 1H), 4.07 (q, J = 7.0 Hz, 2H), 3.83 (s, 3H), 3.45 (q, J = 6.8 Hz, 2H), 2.17 (s, 3H), 2.12 (s, 3H), 1.41 (t, J = 7.0 Hz, 3H), 1.28 (t, J = 6.8 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ/ppm: 170.4, 151.0, 149.3, 148.8, 146.9, 143.7, 139.5, 132.6, 131.3, 130.9, 130.6, 129.4, 128.3, 128.2, 122.9, 120.1, 117.0, 113.4, 112.1, 100.5, 76.9, 56.1, 38.1, 18.0, 15.3。
IR (kBr, σ/cm-1):3426, 3007, 1687, 1630, 1520, 1430, 1340, 846, 764。
2.2.3 目标化合物(RP)的合成称取产物Ⅱ(2 g,3 mmol)和少量K2CO3加入到盛有乙酸乙酯的三颈瓶中,N2保护。滴加1.5 mL过量3-氯丙烯,回流10 h,TLC跟踪反应进程,反应结束后除去溶剂,将粗产品用二氯甲烷/乙酸乙酯作为洗脱液进行柱分离,得荧光探针化合物[10] (RP)。产率60.3 %。
1H NMR (CDCl3, 400 MHz) δ/ppm: 8.39 (s, 1H), 7.84 (d, 1H, J = 8.0 Hz), 7.58 (m, 1H), 7.46 (d, 1H, J = 7.8 Hz), 7.34 (m, 2H), 6.88 (d, 1H, J = 8.6 Hz), 7.18 (m, 1H), 6.92 (s, 1H), 6.79 (s, 1H), 6.14 (s, 1H), 6.07 (m, 1H), 5.57 (d, J = 6.2 Hz, 1H), 5.41 (m, 2H), 5.31 (m, 1H), 4.68 (d, 1H, J = 6.2 Hz), 4.24 (d, J = 6.2 Hz, 1H), 4.07 (q, J = 7.0 Hz, 2H), 3.83 (s, 3H), 3.45 (q, J = 6.8 Hz, 2H), 2.17 (s, 3H), 2.12 (s, 3H), 1.41 (t, J = 7.0 Hz, 3H), 1.28 (t, J = 6.8 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ/ppm: 170.4, 150.2, 149.9, 148.8, 146.9, 143.7, 139.5, 133.5, 132.6, 131.3, 130.9, 130.6, 129.4, 128.3, 128.2, 122.9, 120.1, 118.2, 113.4, 111.9, 111.7, 100.5, 76.9, 70.5, 56.1, 38.1, 18.0, 15.3。IR(kBr, σ/cm-1):3216, 3035, 1665, 1627, 1511, 1434, 1332, 873, 753。
2.3 分析测试方法探针RP储备液(1.00×10-4 mol·L-1):称取0.602 g的RP,用少量乙醇溶解,用1:3乙醇/水(V/V)溶液定容于100 mL容量瓶中,4℃冰箱冷藏保存,测量时稀释至所需浓度。
配制浓度为1.00×10-2 mol·L-1的金属离子溶液:用分析天平准确称取相应金属(Cu2+、Hg2+、Pb2+、Cr3+、Cd2+、Fe3+、Co2+、Bi3+、K+、Na+、Ag+)硝酸盐固体,去离子水溶解并定容。
准确移取3.00 mL,浓度为1×10-5 mol·L-1的RP溶液,测其荧光光谱。分别向上述体系中,移取相同体积、浓度为1.00×10-2 mol·L-1的待测金属离子,摇匀,放置3~5 min,激发波长为343 nm,记录689 nm荧光强度。狭缝宽度为5 nm,均在室温下实验。
3 结果与讨论 3.1 荧光探针的光化学性能以紫外的最大吸收波长343 nm为激发波长,扫描其发射荧光光谱,图 1所示激发-发射光谱可知,荧光探针RP在1:3乙醇/水(V/V)中的荧光发射波长392 nm,而且在689 nm处有一个更强的发射峰。
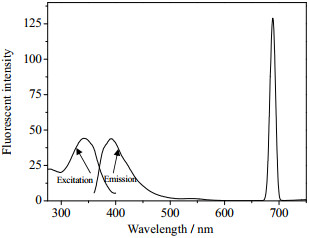
|
图 1 探针RP的荧光激发-发射光谱 Fig.1 Excitation and emission spectra of the probe RP (ethanol/water=1/3, V/V) |
探针不同溶剂中的光化学性质测试结果见表 1所示。
|
|
表 1 荧光探针在不同溶剂中的光化学性质测试结果 Table 1 Photochemical data of the fluorescent probe in different solvents |
荧光量子产率(ΦF)和荧光能量产率(EF)表征荧光物质对光的吸收和发射荧光的能力[11];Stokes shift(
由表 1可知:合成的荧光探针RP在不同的溶剂中的吸收波长在335~345 nm,荧光发射波长在382~422 nm,在溶剂二氯甲烷中,紫外吸收和荧光发射波长明显发生红移。在乙醇/水溶液中的荧光量子产率(ΦF)和荧光能量产率(EF)最大,分别为0.2518和0.2042,说明在醇/水溶液中,探针RP对光吸收和发射荧光的能力明显高于其他溶剂。故实验选定:1:3乙醇/水(V/V)作为实验介质。
3.2 浓度和pH值对探针荧光光谱的影响配制不同浓度和pH值(稀HNO3,NaOH调节)的探针RP溶液,分别测定其荧光强度。结果见图 2。
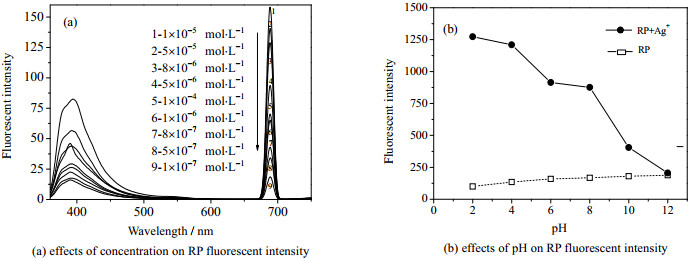
|
图 2 浓度和pH对RP荧光强度影响 Fig.2 Effects of concentration and pH on RP fluorescent intensity |
由图 2(a)可知,随着探针RP浓度的增大,在392 nm和689 nm处其荧光强度都增大,当浓度达到1×10-5 mol·L-1时,荧光强度达到最大,再增加探针溶液浓度,荧光强度随之降低。图 2(b)显示,随着pH变化,探针RP溶液荧光强度没有明显改变。但当加入Ag+,荧光强度发生明显变化。在pH < 4时,探针RP主要以开环形式存在,由于靠近苯环的酰胺氮原子发生质子化,导致分子内电荷转移,与醚键氧原子相对的碳原子变成sp2杂化,碳氮键断裂,使整个分子形成一个大共轭体系,产生强烈的荧光;而在pH为5~9时,探针RP主要以螺环形式存在,与醚键氧原子相对的碳原子是sp3杂化,阻止了整个分子形成一个大共轭体系,荧光相对弱而变化平缓[13];pH > 10,席夫碱C=N双键在较高的pH值中受损,所以探针分子螺环结构很难被打开,从而导致体系荧光猝灭。可见在较宽的pH范围内,探针对Ag+响应不受干扰。故实验选定探针最适浓度为1×10-5 mol·L-1,在较宽的pH范围内,特别是近中性条件下对Ag+的检测。
3.3 探针RP对金属离子选择性及竞争实验探针对金属离子的选择性,通过在最适条件下,向1×10-5 mol·L-1 RP 1:3乙醇/H2O(V/V)溶液,加入等体积、浓度为0.01 mol·L-1的不同金属(Cu2+, Hg2+, Pb2+, Cr3+, Cd2+, Fe3+, Co2+, Bi3+, K+, Na+, Ag+)溶液,测定其荧光强度。通过测定上述溶液中,分别加入等当量数的响应离子时荧光强度变化,考察其它金属离子共存时,对探针响应信号的影响[14]。实验结果见图 3。
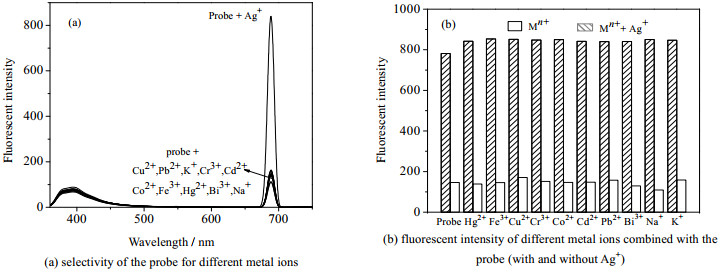
|
图 3 探针RP对金属离子的选择性及竞争实验 Fig.3 Metal ion selectivity and competitive adsorption of the RP probe |
由图 3(a)知,加入不同金属离子(Cu2+、Hg2+、Pb2+、Cr3+、Cd2+、Fe3+、Co2+、Bi3+、K+、Na+)后,探针RP在392 nm和689 nm处的荧光光谱都没有显著变化,说明其它检测的金属离子与探针RP均无明显响应。但加入Ag+后,导致探针溶液在689 nm处的相对荧光强度增加850倍以上。说明探针RP对Ag+有良好的选择识别能力。由图 3(b),在其它金属离子存在条件下,再加入等当量数的Ag+,在689 nm,同样会引起荧光剧烈增强,探针RP对Ag+的识别几乎不受到干扰。这表明合成的探针RP可高选择性的识别Ag+,并具有较强抗干扰能力。
3.4 Ag+浓度对探针RP荧光强度的影响移取3 mL浓度为1×10-5 mol·L-1RP溶液于比色皿中,用微量注射器逐渐加入0.01 mol·L-1Ag+溶液,测定其荧光强度,考查Ag+浓度为0~72.87 mmol·L-1,对RP荧光强度的影响及相应线性关系见图 4。
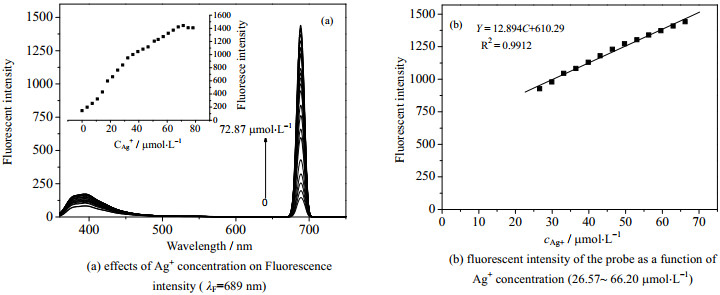
|
图 4 Ag+浓度对RP荧光强度的影响及相应线性关系 Fig.4 Effects of Ag+ concentration on fluorescence intensity and their linear fitting results |
由图 4(a)可知:在689 nm处,随着Ag+浓度的增加,RP的荧光强度不断增加,当Ag+浓度增加到66.20 mmol·L-1时,荧光强度增加变得缓慢甚至下降。由图 4(b)可知,RP荧光强度与Ag+浓度在26.57~66.20 mmol·L-1,呈现出良好的线性关系;相关系数R2 = 0.9912;用3倍于10次测定空白溶液的标准偏差计算,检出限达到16.09 mmol·L-1。
3.5 探针RP与Ag+的结合模式及识别机理推测根据等摩尔连续变化法[15],保持RP和Ag+体系的总浓度为10 mmol·L-1,连续改变Ag+的摩尔分数从0.1~1.0,测其荧光强度,绘制((I-I0)/I0)~XAg+曲线。如图 5所示。
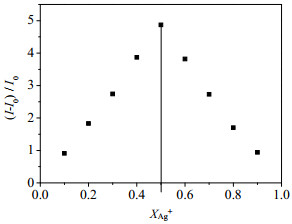
|
图 5 RP与Ag+的络合曲线 Fig.5 Job's plot of RP and Ag+(I0 is the fluorescence intensity of the blank probe; I is the fluorescence intensity of the probe with different Ag+ mole fractions) |
由图 5,随着Ag+摩尔分数的不断变化,探针RP在689 nm处的荧光强度随之变化。当Ag+的摩尔分数为0.5时,探针溶液荧光响应强度最大,表明探针RP与Ag+是以1:1化学计量比进行络合。
RP作为Ag+选择性荧光探针,主要基于罗丹明类化合物螺酰胺环的“off-on”机理[16]。
如图 6所示,在加入Ag+之前,探针分子在罗内酰胺螺环的闭环状态下,由于PET效应导致荧光猝灭,无明显的荧光发射,表现出较弱荧光。当加入Ag+后,受金属离子诱导使原有分子的螺内酰胺环结构打开,探针螺环部分碳氧双键的氧原子、亚氨基的氮原子与Ag+进行配合,形成一个五元的噁二唑结构,光诱导电子转移PET效应被禁阻,使得原本荧光较弱的探针溶液呈现罗丹明的特征吸收和非常强的荧光发射,体现出off-on型的荧光信号。本实验将探针罗丹明6G酰肼,引入芳香醛和烯丙基结构,增强探针分子配体部分的刚性,使其更易与Ag+作用而开环,缩短响应时间。
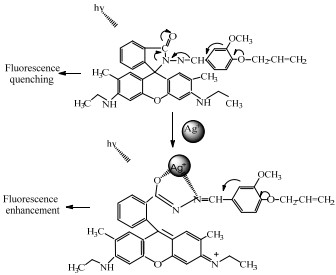
|
图 6 Ag+催化开环反应的响应机理 Fig.6 Mechanism of Ag+ catalyzed ring-opening reaction |
基于金属离子Ag+诱导罗丹明螺内酰胺开环反应特性,合成了罗丹明酰肼类增强型荧光探针,该探针在1:3乙醇/H2O (V/V)溶液中,对Ag+具有良好的络合能力,使其在检测过程中不受其它常见金属离子的干扰,加入银离子后探针溶液的荧光信号增幅可以达到850倍,与银离子是以1:1的方式结合,实现了探针分子对Ag+的高选择性和高灵敏度的荧光检测。在689 nm处的荧光强度与Ag+浓度(26.57~66.20 mmol·L-1)呈良好线性相关,对Ag+的检测限可达16.09 mmol·L-1。可定量检测该范围Ag+含量,对研究该探针化合物在生物体以及环境中的Ag+识别检测,具有一定的指导意义。
| [1] | Zhang Y B, Cheng Z Z, Li H. Determination of ultra-trace gold, silver, platinum and palladium in geochemical samples by inductively coupled plasma-mass spectroscopy combined with the thiourea resin preconcentration[J]. Chinese Journal of Analysis Laboratory, 2006, 26(7): 105-108. |
| [2] | Lin Y H. Determination of trace silver in geological samples with graphite furnace atomic absorption spectrometry[J]. Shandong Industrial Technology, 2015(2): 311-314. |
| [3] | Huang S W, Li J S, Liang A H, et al. Highly sensitive and selective detection of thrombin by aptamer-modified nanosilver resonance scattering spectral probe[J]. Acta Chimica Sinica, 2011, 69(2): 183-189. |
| [4] | Li H, Zhong W Y, Xu D K. Preparation of biotinylated silver nanoparticles and its application of visual detection method for protein chip[J]. Chemical Journal of Chinese Universities, 2010, 31(11): 2184-2189. |
| [5] | Xu Z X, Li H B, Chang X L, et al. Study on a new nano fluorescence probe towards silver ions[J]. Journal of Analytical Sciernce, 2007, 23(4): 453-456. DOI:10.2116/analsci.23.453. |
| [6] | Lv J Q, Lu J L, Zhou X W, et al. Novel Ag+-selective electrode with calix arene derivative as ionophore[J]. Journal of Analytical Sciernce, 2003, 19(1): 30-32. |
| [7] | Zhou Y, Zhou H, Ma T S, et al. A new schiff base basedon vanillin and naphthalimide as a fluorescent probe for Ag+ in aqueous solution[J]. Spectrochimica Acta Part A, 2012, 88(3): 56-59. |
| [8] | Yang Y K, Yook K J, Tae J. A rhodamine-based fluorescent and colorimetric chemodosimeter for the rapid detection of Hg2+ ions in aqueous media[J]. Journal of the American Chemical Society, 2005, 127(48): 16760-16761. DOI:10.1021/ja054855t. |
| [9] | Qi B J, Wang Y L, Yang L, et al. Preparation and property of fluorescent probe H-V for copper ion based on rhodamine B[J]. Journal of Zhengzhou Normal Education, 2015, 4(6): 21-24. |
| [10] | Li H L, Fan J L, Liu X J, et al. Rhodamine-based fluorescence probe for Pd2+ detection[J]. Chemical Journal of Chinese Universities, 2010, 31(9): 1725-1728. |
| [11] | Vladimir B, Temenushka N, Konstantinov A. Fluorescent 4-(2, 2, 6, 6-tetramethylpiperidin-4-ylamino)-1, 8-naphthalimide pH chemosensor based on photoinduced electron transfer[J]. Sens, Actuators B, 2007, 123(2): 869-876. DOI:10.1016/j.snb.2006.10.035. |
| [12] | Chovelon J M, Grabchev I. A novel fluorescent sensor for metal cations and protons based of bis-1, 8-naphthalimide[J]. Spectrochimica Acta Part A, 2007, 67(1): 87-91. DOI:10.1016/j.saa.2006.06.037. |
| [13] | Yuang Y H, Jia S M, Tian M Z, et al. Synthesis of Cu2+ fluorescent probe based on rhodamine and its application[J]. Irradiation Journal of Shanxi Datong University, 2013, 29(4): 34-36, 39. |
| [14] | Meng W F, Yang M P, Cheng Z, et al. Synthesis of novel rhodamine B fluorescent probe and recognition study to Fe3+[J]. Chinese Journal of Organic Chemistry, 2014, 34(2): 398-402. DOI:10.6023/cjoc201307039. |
| [15] | Renny J S, Tomasevich L L, Tallmadge E H, et al. Method of continuous variations:applications of job plots to the study of molecular associations in organometallic chemistry[J]. Angewandte Chemie International Edition, 2013, 52(46): 11998-12013. DOI:10.1002/anie.201304157. |
| [16] | Zhang X, Shiraishi Y, Takayuki H. Cu(Ⅱ) selective green fluorescence of a rhodamine diacetic acid conjugate[J]. Organic Letters, 2007, 9(24): 5039-5042. DOI:10.1021/ol7022714. |




