脂肪酶(EC 3.1.1.3)是催化长链甘油和脂肪酸水解的一类酶。基于脂肪酶对酸解、水解、酯化和酯交换等各种反应具有独特的催化活性,被广泛应用于石油化工、食品加工、制浆造纸、污水处理、制药工程等领域[1]。然而,酶的空间结构极易受高温、高盐、极端pH等因素的影响,阻碍了其在许多领域的实际应用,利用分子修饰技术制备适合工业应用的新型酶制剂具有广阔的前景[2-3]。猪胰脂肪酶(PPL)因其价格低廉,并且在生物催化中具有高的对映选择性而被广泛用于工业领域,该酶由448个氨基酸残基组成,含有丝氨酸-天冬氨酸-组氨酸(Ser153-Asp177-His264)组成的催化三联体,其中包括22个赖氨酸[4-5],众多可供修饰的游离赖氨酸残基使PPL的化学修饰具有广泛的应用前景。当前对PPL的化学修饰采用的是一些常规修饰剂如表面活性剂、酸酐等[6-7],这些修饰剂很难同时大幅改善PPL的各种酶学性能,尤其是对映体选择性提升的例子更是十分有限。如熊亚红等[7]用邻苯二甲酸(PA)对PPL进行化学修饰,PA-PPL耐酸碱性明显提高,在50 ℃下的热稳定性提高了1倍,但水解活性仅提高了25%。Evran等[8]通过在z-脯氨酸的羧基和脂肪酶的天然氨基之间形成酰胺键来共价修饰PPL,修饰酶对pH的耐受性明显提高,在pH 10.0条件培育20 min后仍保留有90% 酶活,在50 ℃下的热稳定性提高0.2倍,但是水解活性同样仅提高了24%。作为一种新型的绿色溶剂,离子液体因其独特的性质和可设计性被广泛应用于酶催化领域[9-10]。本课题组用咪唑、胆碱等不同类型功能化离子液体对脂肪酶进行修饰改造,结果表明,离子液体作为改性剂可以同时提高脂肪酶的水解活性、稳定性和选择性等催化性能[11-14]。近年来,对于氨基酸离子液体的研究越来越多,氨基酸及其衍生物是离子液体前体最丰富的天然来源[15-16]。基于之前的工作,本研究采用一系列侧链带有不同疏水烷基的L-脯氨酸离子液体对PPL进行化学修饰,预期实现PPL包括水解活性、稳定性、有机溶剂耐受性、对映体选择性等酶学性能的全面提升。
2 实验(材料与方法) 2.1 试剂与仪器试剂:猪胰脂肪酶(PPL)、三硝基苯磺酸(5%,g⋅(100 mL)−1)皆购自Sigma-aldrich;橄榄油;BCA试剂盒购自Pierce化学品公司;N, N-羰基二咪唑(CDI)、α-苯乙醇、溴乙烷、溴代正丁烷、溴代正辛烷、溴代正十二烷皆购自Aladdin;四氟硼酸铵、甲醇、丙酮、十二水合磷酸氢二钠、二水合磷酸二氢钠皆购自国药集团化学试剂有限公司;乙酸乙烯酯、异丙醇、正己烷、二甲基亚砜(DMSO)皆购自上海凌峰化学试剂有限公司;以上试剂皆为分析纯。生化试剂:阿拉伯树胶粉购自国药集团化学试剂有限公司;牛血清蛋白购自Aladdin;Triton-X100购自南京凯默尔生物科技中心。
仪器:电子分析天平(BAS224S),北京赛多利斯仪器系统有限公司;荧光分光光度计(F-7000),日本Hitachi公司;圆二色谱仪(J-1500,JASCO),高效液相色谱(UltiMate3000,Dionex),真空冷冻干燥机(SCIENTZ-12N),宁波新芝生物科技股份有限公司;低温高速离心机(TCL-16MS),上海卢湘仪离心机仪器有限公司。
2.2 离子液体合成的一般步骤离子液体的合成以及阴离子交换参考之前的报道[17],在70 ℃条件下,以乙腈为溶剂,L-脯氨酸(0.1 mol)和1-溴烷烃(0.3 mol)在100 mL圆底烧瓶中混合反应2 d。过滤后,蒸馏除去溶剂,用乙醚对原料进行多次洗涤,经柱层析纯化后(CHCl3、EtOH体积比为20:1),真空干燥5 h得到阴离子为Br−的离子液体。
以氯仿为溶剂,取[ProC8]-Br 0.02 mol和磷酸二氢钠(或四氟硼酸铵) 0.02 mol,在室温下搅拌4 h。过滤后除去无机盐,蒸馏出溶剂,经柱层析分离后,得到阴离子为H2PO4−和BF4−的离子液体,硝酸银滴定表明反应液中含Br−的离子液体杂质已经全部除去,离子液体命名如图 1所示。
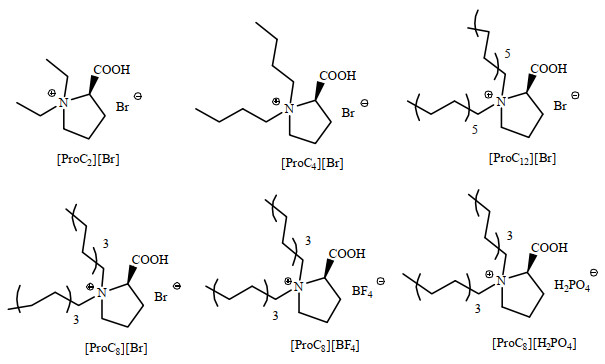
|
图 1 脯氨酸离子液体结构 Fig.1 Structure of proline ionic liquid |
在4 ℃的条件下,20 mL的PPL溶液离心20 min,去除不溶性杂质。使用10 kDa透析袋透析上清液48 h,透析后的酶液低温保存。将1 mmol脯氨酸离子液体和等物质的量的CDI加入2 mL DMSO溶液中,室温搅拌2 h,得到活化后的脯氨酸离子液体。将上述得到的离子液体100 μL加入纯化的酶溶液5 mL中,4 ℃搅拌8 h,反应混合物透析后得到修饰酶。采用三硝基苯磺酸法测定改性程度[18]。修饰后的酶记为[ProC2][Br]-PPL、[ProC4][Br]-PPL、[ProC8][Br]-PPL、[ProC12][Br]-PPL、[ProC8][BF4]-PPL、[ProC8][H2PO4]-PPL。
2.4 酶活测定PPL水解活性通过橄榄油乳化法测定。将50 mL橄榄油与等体积14% 的阿拉伯胶水溶液混合,配制成底物溶液。随后取5 mL底物溶液和5 mL磷酸盐缓冲液(0.2 mol⋅L−1,pH为6.0~8.0)放入锥形瓶中,在35~50 ℃保温10 min。将适量的游离或改性PPL加入底物溶液开始水解反应,在35~50 ℃,120 r⋅min−1下反应10 min。最后加入10 mL丙酮、乙醇体积比为1:1的混合溶液,终止水解反应。采用0.05 mol⋅L−1的NaOH溶液滴定水解产生的脂肪酸。酶活定义为每分钟产生1 μmol脂肪酸所需要的酶量。
2.5 温度和pH对酶的影响在37 ℃,pH 6.0~8.0,pH每隔0.5设置一个梯度,测定天然酶和修饰酶的酶活性。根据上述在37 ℃下测定的酶活性数据,设置不同的温度梯度(30~70 ℃)测定天然酶和修饰酶在最优pH条件下的水解活性。
2.6 热稳定性测定将天然酶和修饰酶分别置于50 ℃保存,在各自最适宜条件下每30 min测定一次酶活,残余活性以相对于各自的原始活性的百分比表示。
2.7 甲醇和二甲基亚砜耐受性的测定将天然酶和修饰酶分别在体积分数为0%~50% 的甲醇和二甲基亚砜中保存2 h,并在各自的最佳条件下测定酶活性。
2.8 光谱分析室温下,用F-7000光谱仪测定了天然酶和修饰酶的荧光光谱曲线。待测样品在室温下稀释至相同质量浓度(100 μg⋅mL−1)。设置荧光光度计的激发波长为295 nm,扫描波长范围为280~400 nm。
将天然酶和修饰酶在室温下稀释至100 μg⋅L−1。用J-820分光光度计进行圆二色谱实验,扫描速度为50 nm⋅min−1,扫描波长为190~250 nm。用CDpro软件分析酶蛋白的二级结构。
2.9 动力学参数测定在原酶和修饰酶的最适宜条件下,底物质量浓度9~30 mg⋅mL−1,测定天然酶和修饰酶的动力学参数,其中催化效率Kcat⋅Km−1,采用Lineweaver-Burk双倒数作图测定。
2.10 对映体选择性测定利用α-苯乙醇转酯化拆分反应作为反应模型如图 2所示,研究修饰前后PPL催化该反应的对映体选择性变化。首先将原酶与修饰酶用冷冻干燥机冻干,制成酶粉,将酶粉置于50 mL的离心管中,加入苯乙醇和乙酸乙烯酯(物质的量比为1:2),用正己烷作溶剂。在37 ℃,150 r⋅min−1的条件下反应3 h。反应结束,利用高效液相色谱进行测定,计算出转化率、对映体过剩值ee值、对映体选择率E值等。每种样品做3组平行实验。图 3~7中所有数据均为3个平行试验的平均值。
| $ e{e_R} = \frac{{R - S}}{{R + S}} \times 100\% $ | (1) |
| $ e{e_S} = \frac{{S - R}}{{S + R}} \times 100\% $ | (2) |
| $ CR=\frac{{{c}_{R, 0}}-{{c}_{R, \text{r}}}}{{{c}_{R, 0}}}\times 100%$ | (3) |
| $ CS=\frac{{{c}_{S, 0}}-{{c}_{S, \text{r}}}}{{{c}_{S, 0}}}\times 100% $ | (4) |
| $ {{C}_{\text{t}}}=\frac{{{c}_{\text{t}, 0}}-{{c}_{\text{t}, R}}}{{{c}_{\text{t}, 0}}}\times 100% $ | (5) |
| $ E=\ln \left[1-C_{\mathrm{t}}\left(1+e e_R\right)\right]/\ln \left[1-C_{\mathrm{t}}\left(1-e e_R\right)\right] $ | (6) |
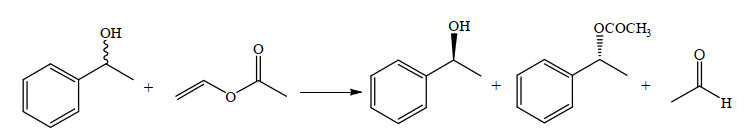
|
图 2 酶促(R, S)-α-苯基乙醇酯交换反应 Fig.2 Enzymatic (R, S)-α-phenyl ethanol transesterification reaction |
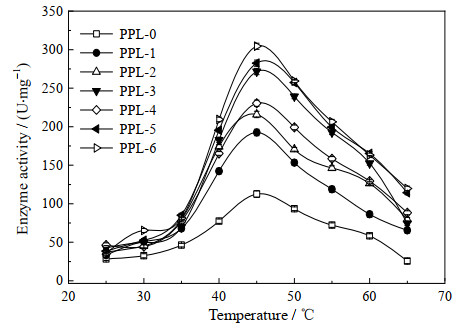
|
图 3 温度对酶活的影响 Fig.3 Effect of temperature on enzyme activity |
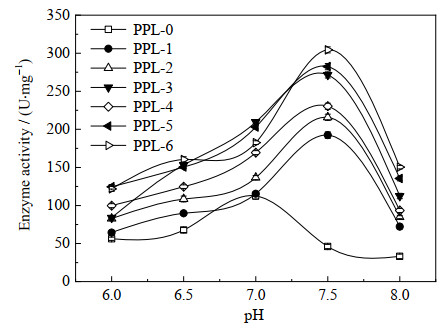
|
图 4 pH对酶活的影响 Fig.4 Effect of pH on enzyme activity |
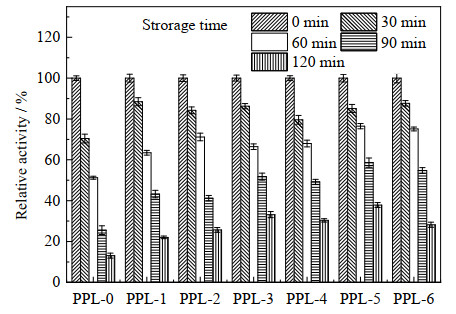
|
图 5 PPLs热稳定性 Fig.5 Thermal stability of PPLs |
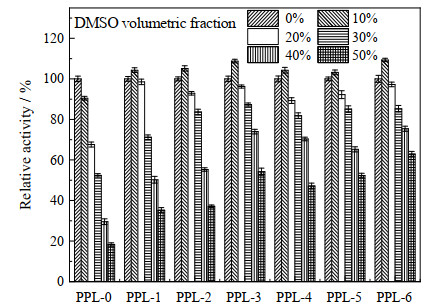
|
图 6 DMSO体积分数对酶活的影响 Fig.6 Effect of DMSO concentration on enzyme activity |
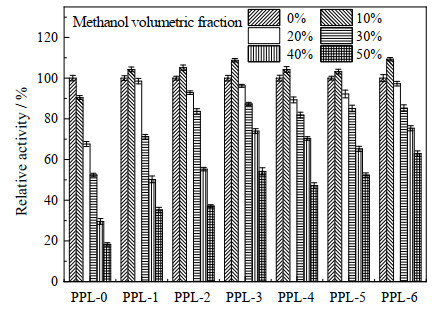
|
图 7 甲醇体积分数对酶活的影响 Fig.7 Effect of methanol concentration on enzyme activity |
式中:eeR和eeS分别为R-对映体和S-对映体过剩值;R和S分别为R-对映体和S-对映体;Ct、CR、CS分别是总、(R)-α-苯乙醇、(S)-α-苯乙醇的转化率;
一般来说,酶的共价修饰效果与修饰剂的大小、构型以及亲疏水性密切相关[19],表 1展示了原酶和修饰酶的修饰度和最适条件下的水解活力。PPL一共有22个游离的赖氨酸残基,不同离子液体修饰后的PPL修饰度差异较大,Doumèche等[20]报道,引入较小空间位阻的修饰剂,能够提高修饰程度,这也是[ProC2][Br]-PPL有一个最高修饰度的原因。本研究所有修饰酶的酶活性较天然酶都有不同程度的增加,效果最好的[ProC8][H2PO4]-PPL的酶活提升至原酶的2.7倍,明显高于其他课题组用z-脯氨酸及邻苯二甲酸酐修饰PPL后酶活提升的幅度[7-8]。Hofmeister效应将离子分为K型和C型,kosmotropic离子具有较高的表面电荷和较强的水合能力,chaotropic离子则相反[21-22]。H2PO4−通常被认为是一种K型离子,特殊的离子效应表明当含有相同阳离子的时候,更加K型的阴离子有助于获得更高的活力[11, 22]。总体来说,修饰酶的水解活性随着离子液体链长的增加逐渐增大,这可能是因为修饰剂的引入可以增强活性中心周围的疏水性,稳定盖子结构打开状态,有利于底物进入蛋白口袋空腔催化位点,从而更大程度提升酶活。值得注意的是,尽管修饰剂[ProC8][Br]疏水性不如[ProC12][Br],但是仍然有更高的酶活,这可能是修饰度与离子液体本身性质对酶综合影响的结果。
|
|
表 1 原酶和修饰酶的最适酶活和修饰度 Table 1 Hydrolytic activity and degree of native and modified enzymes |
采用橄榄油乳化法在25~65 ℃研究了温度对PPL水解活性的影响,如图 3所示,化学修饰并没有引起酶最适温度的变化,尽管如此,脯氨酸离子液体对PPL的活性提升是明显的,所有修饰酶都表现出比原酶更高的水解活性,尤其是酶发挥活性的温度区间。在25~35 ℃,原酶和修饰酶的水解活性差异不大,之后修饰酶的活性迅速提升,尤其是[ProC8]-PPL和[ProC12]-PPL提升最为明显,这可能与脯氨酸离子液体长链疏水结构有关,较长的烷基链能为酶蛋白提供一个相对疏水环境,同时增强PPL的刚性结构,进而避免酶蛋白活性中心直接暴露在高温体系中而失活。在65 ℃时,原酶几乎失活,而大部分修饰酶都还保持一个较高的活性。化学修饰能够在一定程度上改变酶蛋白的构象,这种改变可能会导致酶的最适的反应条件发生改变。在不同pH值下,天然和改性PPL的相对活性变化情况见图 4,经过离子液体修饰后的PPL的最适pH向碱性范围移动,这通常是由于改性后的酶正电荷降低引起的。如Xue等[23]用顺丁烯二酸酐和苯四甲酸二酐修饰菠萝蛋白酶,最适pH由7变为9,Nwagu等[24]用邻苯二甲酸酐对淀粉酶进行修饰改性,改性后的酶最适pH由5变为7,这表明修饰酶能够适应更宽的pH范围。
3.3 热稳定性目前,PPL的工业应用受到大多数生物工艺过程的苛刻条件的限制,如高温、极端的pH值和不同的有机溶剂,酶的高热稳定性一直是工业生物过程成功的关键因素,因为反应速率随温度呈指数增长,直到酶的变性点[25]。脯氨酸是一种刚性天然氨基酸,有研究表明,在蛋白质中引入脯氨酸残基可以有效的降低去折叠时的熵,从而提高蛋白质的热稳定性和活性[26-27]。如图 5所示,在50 ℃保存2 h后,修饰酶的热稳定性比游离酶提高了0.7~1.9倍,高于通过z-脯氨酸及邻苯二甲酸酐修饰的0.2倍和1倍[7-8]。其原因可能是离子液体共价连接在PPL上改变了酶的自然构象,减少了酶分子内部基团的热振动,从而提高了酶的热稳定性[28-29]。这也可能与离子液体长链疏水基团形成的疏水环境有关,这种疏水环境可以保护酶的活性中心不被高温破坏。
3.4 有机溶剂耐受性酶的溶剂稳定性一直是近年来的研究热点,有机溶剂为非水溶性底物提供了高溶解度,能够有效提高酶促反应速度。然而,由于酶本身的性质,有机溶剂同样能够在一定程度下破坏酶的构象,因此,提高脂肪酶对有机溶剂的耐受性可以有效拓宽脂肪酶在实际环境中的应用范围[30-31]。由于强极性溶剂容易剥夺酶蛋白表面的水分子,从而使酶失活,研究选取较为常用强极性质子溶剂甲醇与非质子溶剂DMSO为代表考察了原酶与修饰酶对有机溶剂的耐受性。如图 6、7所示,课题组之前以N-乙酰-脯氨酸作为手性源制备4种离子液体对PPL进行化学修饰,修饰效果最好的修饰酶在体积分数为50% 的DMSO中仍有44.8% 的酶活[32]。本研究中,所有修饰酶在低浓度的DMSO中都有激活作用,随着DMSO体积分数的增加,[ProC8][H2PO4]-PPL受影响最小,在体积分数为50% 的DMSO中仍保留60% 以上的酶活。改性后的酶在低体积分数(0~20%)的甲醇溶液中的相对酶活性与原酶相差不大。当甲醇体积分数超过20% 时,原酶的酶活性迅速下降,当甲醇体积分数达到50% 时,原酶的酶活性仅为原酶的15% 左右,所有修饰酶保留30% 以上的酶活,与在DMSO中相同的是,[ProC8][H2PO4]-PPL具有最好的耐受性。这可能是因为其具有更多的K型离子,具有更高的电荷密度和更强的水合能力,使修饰酶更容易形成活性水合构象,更好地防止甲醇分子对酶蛋白结构的破坏。
3.5 动力学参数以橄榄油为底物,测定了脂肪酶的动力学参数,催化参数Vmax、Kcat、Km和催化效率Kcat⋅Km−1,列于表 2。可见所有修饰酶的Km值均略低于天然酶,即随着引入离子液体链长的增加,Km值逐渐减小,这可能是因为长链脯氨酸离子液体具有较强的疏水性,它的引入改变了活性中心附近的疏水环境,使得底物与活性中心的亲和力增加,此外长链脯氨酸离子液体的引入增加了酶蛋白的刚性结构,使得修饰酶较大程度上保持了PPL的天然活性构象[33]。不过具有更强疏水性的[ProC12][Br]-PPL的Km值反而更高,这可能是由于离子液体[ProC12][Br]具有更大的空间位阻,从而阻碍了酶对底物的特异性结合,尽管如此,该酶的催化效率也比天然酶高2.5倍。
|
|
表 2 动力学参数 Table 2 Kinetic parameters of PPLs |
酶的化学修饰可以改善其活性或者稳定性,化学修饰导致酶对映选择性改变的例子是有限的,对映选择性是酶在生物转化反应中最有价值的特征之一。表 3展示了游离酶和修饰酶催化α-苯乙醇转酯化的对映体选择性,所有修饰酶的选择率和转化率都比原酶要高。有报道称对脂肪酶进行疏水性修饰可以显著提升其酯水解对映体选择性,这可能是由于在改性脂肪酶中,由于带电荷的赖氨酸残基被疏水基团取代而使其表面疏水簇的增加以及正电荷的减少,从而改变脂肪酶的构象及柔性[34]。在本研究中,E值不仅取决于修饰基团的性质,还取决于修饰程度,[ProC8][Br]-PPL具有最高的选择性,达到13.2,这表明离子液体修饰是提高脂肪酶对映体选择性的有效手段。
|
|
表 3 α-苯乙醇转酯化反应参数 Table 3 Parameters of esterification reaction of α-phenyl ethanol |
固有荧光是蛋白质三级结构变化的公认的标志,与蛋白质相关的光谱变化提供了其稳定性与活性的信息[35-36]。含有荧光团残基的蛋白质,如PPL(Trp、Tyr或Phe)结构的变化可以通过最大荧光强度和最大发射波长的变化来反映,如图 8所示,与游离酶相比,所有修饰酶的荧光强度都有不同程度的降低,并且荧光强度降低越多,酶活提升越大,PPL在水相中的初始最大吸收波长在337 nm,经过脯氨酸离子液体修饰后,最大吸收波长出现了蓝移,这表明酶的构象变得更加紧凑和稳定[37]。
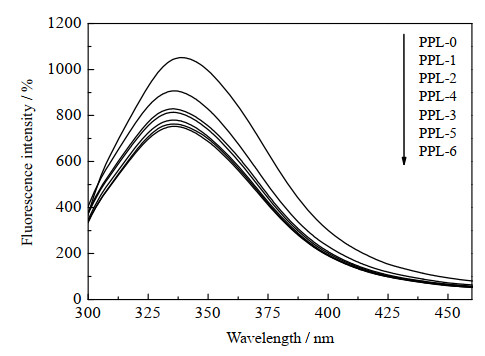
|
图 8 PPLs荧光光谱 Fig.8 Fluorescence spectra of PPLs |
利用CDpro程序测定了蛋白的二级结构(α-螺旋、β-折叠、β-转角、无规卷曲)。如表 4所示,改性PPL的α-螺旋含量降低,β-sheet含量增加,说明蛋白质二级结构趋于稳定。Pan等[38]研究了BCL脂肪酶在不同溶剂中的酯化活性及构象变化,认为BCL脂肪酶二级结构中α-螺旋含量的降低将导致活性位点的开放趋势。从而促进底物进入活性位点,提高酶的活性,这也与本研究中酶活的变化一致。这些结果表明疏水性脯氨酸离子液体成功共价连接到脂肪酶上,并引起了其构象的变化,这种影响有助于改善酶的活性与稳定性。
|
|
表 4 PPL二级结构含量 Table 4 Content of PPL secondary structure |
酶工程的主要目标之一是生产活性较高并稳定的酶,本研究分别采用6种不同链长的脯氨酸离子液体对PPL进行修饰改性,酶的活性和稳定性均得到较好的提升,这主要与其表面疏水环境的变化有关。通过荧光光谱和圆二色谱进一步解析了酶学性能变化的机理,修饰酶的荧光强度越低,活性越高,而二级结构中α-螺旋的降低也是活性提升的原因。
| [1] |
ADETUNJI A I, OLANIRAN A O. Production strategies and biotechnological relevance of microbial lipases: a review[J]. Brazilian Journal of Microbiology, 2021, 52(3): 1257-1269. DOI:10.1007/s42770-021-00503-5 |
| [2] |
YANG W K, ZHU L J, CUI Y C, et al. Improvement of site-directed protein−polymer conjugates: High bioactivity and stability using a soft chain-transfer agent[J]. ACS Applied Materials & Interfaces, 2016, 8(25): 15967-15974. |
| [3] |
PAGAR A D, PATIL M D, FLOOD D T, et al. Recent advances in biocatalysis with chemical modification and expanded amino acid alphabet[J]. Chemical Reviews, 121(10): 6173-6245. DOI:10.1021/acs.chemrev.0c01201 |
| [4] |
CHEN Z S, WU Y D, HAO J H, et al. Molecular dynamic simulation of the porcine pancreatic lipase in non-aqueous organic solvents[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 676. DOI:10.3389/fbioe.2020.00676 |
| [5] |
LI X H, PENG X N, WANG Q R, et al. Effective detoxification of patulin from aqueous solutions by immobilized porcine pancreatic lipase[J]. Food Control, 2017, 78: 48-56. DOI:10.1016/j.foodcont.2017.02.048 |
| [6] |
杨敏, 杨国龙, 杨力会, 等. 无溶剂体系下表面活性剂修饰的猪胰脂酶催化酯交换反应的研究[J]. 食品工业科技, 2014, 35(12): 176-179. YANG M, YANG G L, YANG L H, et al. Study on the interesterification catalyzed by surfactants modified porcine pancreas lipase in solvent free system[J]. Science and Technology of Food Industry, 2014, 35(12): 176-179. DOI:10.13386/j.issn1002-0306.2014.12.029 |
| [7] |
熊亚红, 苏健鸿, 刘小平. 邻苯二甲酸酐修饰脂肪酶的性能研究[J]. 华南农业大学学报, 2011, 32(2): 122-124. XIONG Y H, SU J H, LIU X P. Study on the property of porcine pancreas lipase modified with phthalic anhydride[J]. Journal of South China Agricultural University, 2011, 32(2): 122-124. DOI:10.3969/j.issn.1001-411X.2011.02.030 |
| [8] |
EVRAN S, TELEFONCU A. Modification of porcine pancreatic lipase with Z‐proline[J]. Preparative Biochemistry and Biotechnology, 2007, 35(3): 191-201. |
| [9] |
BROGAN A P S, BUI-LE L, HALLETT J P. Non-aqueous homogenous biocatalytic conversion of polysaccharides in ionic liquids using chemically modified glucosidase[J]. Nature Chemistry, 2018, 10(8): 859-865. DOI:10.1038/s41557-018-0088-6 |
| [10] |
吴虹, 娄文勇, 宗敏华. 含离子液体介质中脂肪酶高效催化对羟基苯甘氨酸甲酯不对称氨解[J]. 高校化学工程学报, 2007, 21(3): 481-487. WU H, LOU W Y, ZONG M H. Asymmetric ammonolysis of D, L-p-hydroxyphenylglycine methyl ester catalyzed by lipase in an ionic-liquid-containing system[J]. Journal of Chemical Engineering of Chinese Universities, 2007, 21(3): 481-487. DOI:10.3321/j.issn:1003-9015.2007.03.021 |
| [11] |
JIA R, HU Y, LIU L, et al. Enhancing catalytic performance of porcine pancreatic lipase by covalent modification using functional ionic liquids[J]. ACS Catalysis, 2013, 3(9): 1976-1983. DOI:10.1021/cs400404f |
| [12] |
LI X J, ZHANG C, LI S, et al. Improving catalytic performance of Candida rugosa lipase by chemical modification with polyethylene glycol functional ionic liquids[J]. Industrial & Engineering Chemistry Research, 2015, 54(33): 8072-8079. |
| [13] |
XU C, SUO H B, XUE Y, et al. Experimental and theoretical evidence of enhanced catalytic performance of lipase B from Candida antarctica acquired by the chemical modification with amino acid ionic liquids[J]. Molecular Catalysis, 2021, 501: 111355. DOI:10.1016/j.mcat.2020.111355 |
| [14] |
XU C, YIN X H, ZHANG C, et al. Improving catalytic performance of Burkholderiacepacia lipase by chemical modification with functional ionic liquids[J]. Chemical Research in Chinese Universities, 2018, 34(2): 279-284. DOI:10.1007/s40242-018-7246-7 |
| [15] |
CARREIRA A R F, ROCHA S N, SILVA F A E, et al. Amino-acid-based chiral ionic liquids characterization and application in aqueous biphasic systems[J]. Fluid Phase Equilibria, 2021, 542: 113091. |
| [16] |
高明, 孙丽伟, 唐韶坤. 氨基酸功能化离子液体聚合物用于高效CO2吸附[J]. 高校化学工程学报, 2021, 35(1): 164-171. GAO M, SUN L W, TANG S K. Preparation of an amino acid-functionalized polymeric ionic liquid for efficient CO2 adsorption[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(1): 164-171. |
| [17] |
ZHANG L, ZHANG H B, LUO H D, et al. Novel chiral ionic liquid (CIL) assisted selectivity enhancement to (L)-proline catalyzed asymmetric aldol reactions[J]. Journal of the Brazilian Chemical Society, 2011, 22(9): 1736-1741. DOI:10.1590/S0103-50532011000900016 |
| [18] |
SNYDER S L, SOBOCINSKI P Z. An improved 2, 4, 6-trinitrobenzenesulfonic acid method for the determination of amines[J]. Analytical Biochemistry, 1975, 64(1): 284-288. DOI:10.1016/0003-2697(75)90431-5 |
| [19] |
LONGO M A, COMBES D. Influence of surface hydrophilic: hydrophobic balance on enzyme properties[J]. Journal of Biotechnology, 1997, 58(1): 21-32. DOI:10.1016/S0168-1656(97)00120-X |
| [20] |
BEKHOUCHE M, DOUMÈCHE B, BLUM L J. Chemical modifications by ionic liquid-inspired cations improve the activity and the stability of formate dehydrogenase in [MMIm][Me2PO4][J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 65(1/2/3/4): 73-78. |
| [21] |
SAKAI K, SATO Y, OKADA M, et al. Enhanced activity and stability of protein-glutaminase by Hofmeister effects[J]. Molecular Catalysis, 2022, 517: 112054. DOI:10.1016/j.mcat.2021.112054 |
| [22] |
TAO Y H, MA J M, HUANG C X, et al. Effects of the Hofmeister anion series salts on the rheological properties of Sesbania cannabina galactomannan[J]. International Journal of Biological Macromolecules, 2021, 188: 350-358. DOI:10.1016/j.ijbiomac.2021.08.030 |
| [23] |
XUE Y, WU C Y, BRANFORD-WHITE C J, et al. Chemical modification of stem bromelain with anhydride groups to enhance its stability and catalytic activity[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 63(3/4): 188-193. |
| [24] |
NWAGU T N, OKOLO B, AOYAGI H, et al. Chemical modification with phthalic anhydride and chitosan: Viableoptions for the stabilization of raw starch digesting amylase from Aspergillus carbonarius[J]. International Journal of Biological Macromolecules, 2017, 99: 641-647. DOI:10.1016/j.ijbiomac.2017.03.022 |
| [25] |
WANG R, WANG S, XU Y, et al. Enhancing the thermostability of Rhizopus chinensis lipase by rational design and MD simulations[J]. International Journal of Biological Macromolecules, 2020, 160: 1189-1200. DOI:10.1016/j.ijbiomac.2020.05.243 |
| [26] |
XIE Y, AN J, YANG G Y, et al. Enhanced enzyme kinetic stability by increasing rigidity within the active site[J]. Journal of Biological Chemistry, 2014, 289(11): 7994-8006. DOI:10.1074/jbc.M113.536045 |
| [27] |
GOIHBERG E, DYM O, TEL-OR S, et al. A single proline substitution is critical for the thermostabilization of Clostridium beijerinckii alcohol dehydrogenase[J]. Proteins Structure Function and Bioinformatic, 2006, 66(1): 196-204. DOI:10.1002/prot.21170 |
| [28] |
LU M Y, GAO Z X, XING S Q, et al. Purification, characterization, and chemical modification of Bacillus velezensis SN-14 fibrinolytic enzyme[J]. International Journal of Biological Macromolecules, 2021, 177: 601-609. DOI:10.1016/j.ijbiomac.2021.02.167 |
| [29] |
张川, 张鲁嘉, 张洋, 等. 基于分子模拟的离子液体修饰Porcine Pancreas脂肪酶催化性能和稳定性的相关研究[J]. 化学学报, 2016, 74(1): 74-80. ZHANG C, ZHANG L J, ZHANG Y, et al. Study on the stability and enzymatic property improvement of porcine pancreas lipase modified by ionic liquids using molecular simulation[J]. Acta Chimica Sinica, 2016, 74(1): 74-80. |
| [30] |
KAJIWARA S, KOMATSU K, YAMADA R, et al. Modification of lipase from Candida cylindracea with dextran using the borane-pyridine complex to improve organic solvent stability[J]. Journal of Biotechnology, 2019, 296: 1-6. DOI:10.1016/j.jbiotec.2019.02.009 |
| [31] |
KAJIWARA S, KOMATSU K, YAMADA R, et al. Improvement of the organic solvent stability of a commercial lipase by chemical modification with dextran[J]. Biochemical Engineering Journal, 2019, 142: 1-6. DOI:10.1016/j.bej.2018.11.003 |
| [32] |
徐超, 薛誉, 陈虹月, 等. 手性脯氨酸类离子液体化学修饰猪胰脂肪酶催化性能研究[J]. 化工学报, 2019, 70(6): 2221-2228. XU C, XUE Y, CHEN H Y, et al. Study on catalytic properties of porcine pancreatic lipase modified by chiral proline ionic liquids[J]. CIESC Journal, 2019, 70(6): 2221-2228. |
| [33] |
TINOCO T, DUHALT R V. Chemical modification of cytochrome C improves their catalytic properties in oxidation of polycyclic aromatic hydrocarbons[J]. Enzyme and Microbial Technology, 1998, 22(1): 8-12. DOI:10.1016/S0141-0229(97)00073-2 |
| [34] |
UEJI S I, UEDA A, TANAKA H, et al. Chemical modification of lipases with various hydrophobic groups improves their enantioselectivity in hydrolytic reactions[J]. Biotechnology Letters, 2003, 25(1): 83-87. DOI:10.1023/A:1021761508338 |
| [35] |
BAKER S N, MCCLESKEY T M, PANDEY S, et al. Fluorescence studies of protein thermostability in ionic liquids[J]. Chemical Communications, 2004(8): 940-941. DOI:10.1039/b401304m |
| [36] |
KWOK A, CAMACHO I S, WINTER S, et al. A thermodynamic model for interpreting tryptophan excitation-energy-dependent fluorescence spectra provides insight into protein conformational sampling and stability[J]. Frontiers in Molecular Biosciences, 2021, 3: 778244. |
| [37] |
CHEN N, ZHANG C Y, DONG X Y, et al. Activation and stabilization of lipase by grafting copolymer of hydrophobic and zwitterionic monomers onto the enzyme[J]. Biochemical Engineering Journal, 2020, 158: 107557. DOI:10.1016/j.bej.2020.107557 |
| [38] |
PAN S, LIU X, XIE Y D, et al. Esterification activity and conformation studies of Burkholderia cepacia lipase in conventional organic solvents, ionic liquids and their co-solvent mixture media[J]. Bioresource Technology, 2010, 101(24): 9822-9824. DOI:10.1016/j.biortech.2010.07.107 |




