水凝胶是一种三维网状结构的亲水聚合物,其独特的结构使其在水基环境下能够吸收大量的水,自身溶胀而不溶解,且其保水性能十分优越,溶胀后的水凝胶在受到外界压力时也不会流失水分。水凝胶的原材料可以是亲水性或水溶性的单体或聚合物,常用单体为结构中含有双键的丙烯酸类、丙烯酰胺类,聚合物则分为天然高分子、合成高分子两类,其中前者多为淀粉、明胶、海藻酸盐等及其衍生物,而后者多为聚乙烯醇、F127等。凝胶会对物理刺激信号(温度、光、压力、电场强度、离子强度等)、化学刺激信号(pH、离子、化学物质等)做出响应进而改变其溶胀状态。此外,在凝胶制备过程中,其制备参数如单体浓度、交联剂含量等会影响凝胶结构,所以光照时间、光引发剂比例、交联剂、单体浓度、NaCl浓度、盐种类、温度、pH等都会影响凝胶在水中的溶胀行为[1~3]。鉴于水凝胶独特的性质,其已被运用于林业保水[4]、组织工程[5]、药物释放[6]等领域。
近年来,工业的发展也带来了重金属离子污染问题,但这些重金属离子不能被自然降解,导致其在生物链中不断富集,对生物造成伤害。在处理重金属离子的众多方法中,吸附法简单有效且经济可行,马立成等制备的Cu2+印迹磁性壳聚糖微球对Cu2+具有较高的选择吸附性能,可以从含铜离子废水中有效地分离出Cu2+,且能再生-重复使用[7]。贺小进等使用Ni2+离子为模板剂制备的新型球状Ni2+模板壳聚糖螯合树脂,提高了树脂对Ni2+、Cu2+、Zn2+的吸附容量,是一种较好的金属离子吸附剂[8]。此外,水凝胶作为吸附剂也已被用于重金属离子处理领域[9, 10]。如Huang等制备出一种可生物降解的β-环糊精类水凝胶,其对Pb2+和Cd2+的最大吸附量可达210.6和98.88 mg·g-1[11]。Elizabeth等使用丙烯酰胺水凝胶在pH为3和5条件下吸附Cd2+、Cu2+、Pb2+、Ni2+、Zn2+,发现不同pH下水凝胶对金属离子的吸附能力不同,实验条件下其对重金属离子的最大吸附能力出现在pH为5的Pb2+吸附实验中,为12 mg·g-1[12]。而关于其他重金属离子如Mn2+、Cr2+、As3+的吸附亦有文献报道[13]。以上结果说明水凝胶对溶液中的金属离子具有很好的吸附效果,可用于环境中水质的净化。
本文拟以DA-P123水凝胶为研究对象,考察其对Cu2+、Fe3+、Zn2+的吸附,并观察废水中BSA对水凝胶吸附和脱附金属离子能力的影响。由于原料易得、制备方法简单,且能够将吸附的金属离子脱附,DA-P123水凝胶可作为金属离子吸附剂用于工业中的重金属废水处理,以保护环境。
2 实验方法 2.1 实验材料Pluronic P123 (HO(CH2CH2O)20(CH2CH(CH3)O)70(CH2CH2O)20H),磺基甜苯碱甲基丙烯酸酯(SBMA),Irgacure 2959 (光引发剂),丙烯酰氯,三乙胺(TEA),牛血清白蛋白(BSA),四氢呋喃(THF),NaCl,CaCl2,CuSO4·5H2O,FeCl3·6H2O,ZnSO4·7H2O,去离子水,CDCl3。
2.2 DA-P123的制备及表征将13 g P123和50 mL THF加入锥形瓶中,待P123搅拌溶解后,体系置于0℃冰浴条件下。加入1.4 mL TEA后,以0.5 mL·min-1的速度滴加完由15 mL THF稀释的1.62 mL丙烯酰氯后密封体系。在0℃条件下继续反应1 h后,将体系缓慢升温至室温状态,继续反应24 h。通过离心除去三乙胺盐酸盐(TEA·HCl)后,旋蒸除去溶剂THF,得到产物DA-P123.通过FTIR和1HNMR分析DA-P123的结构。
2.3 水凝胶的制备取一定量的DA-P123和SBMA单体溶解于水中,加入一定量的光引发剂(12 mg·mL-1),然后置于自制的PDMS模具中,在500 W紫外光下照射(光源与样品的距离为10 cm)。一段时间后取出水凝胶并将其置于去离子水中,以除去其中未反应的单体和其他杂质,然后烘干备用。
2.4 凝胶的溶胀因素在比较影响因素时,固定其他因素,改变单一因素,通过改变水凝胶的单体浓度、光照时间制备性质不同的DA-P123水凝胶,用来观察水凝胶本身性质对水凝胶溶胀的影响因素。将上述单体浓度30% (W/V)、光照时间(30 min)等固定后,制备不同比例P(DA-P123-co-SBMA)共聚水凝胶(如SBMA:DA-P123 = 1:1时,制备水凝胶的初始溶液中SBMA和DA-P1123的固体含量均为15%),并研究NaCl浓度、盐种类、温度作为外部因素对水凝胶溶胀的影响。将已知干重为m0的水凝胶置于去离子水或盐溶液中,放置于实验设定温度下,溶胀完成后取出水凝胶,用吸水纸擦掉水凝胶表面水分,称出此时水凝胶重量m1。其溶胀率SR计算公式为:
| ${\rm{SR}} = \frac{{{m_1} - {m_0}}}{{{m_0}}}$ | (1) |
使用CuSO4·5H2O、FeCl3·6H2O、ZnSO4·7H2O配制金属离子浓度为12 g·L-1的金属离子溶液,用盐酸和去离子水配置pH分别为1、3、5、7的液体。将已知干重的DA-P123水凝胶放入8.55 mL不同pH的液体中,然后取450 μL浓度为12 g·L-1的金属离子溶液加入上述液体中,从而形成不同pH、浓度为0.6g×L-1的金属离子溶液。吸附24 h后取出溶液,测得溶液体积并使用原子吸收分光光度计测得溶液中金属离子浓度,即可算出凝胶吸附金属离子量U(Uptake),其计算公式见(2)。为了测定溶液中BSA对水凝胶吸附金属离子能力的影响,考察了pH为7,1 g×L-1BSA溶液中水凝胶吸附Fe3+的情况,其步骤同上。
| $U = \frac{{{C_0}{V_0} - {C_1}{V_1}}}{{{m_0}}}$ | (2) |
为了测定水凝胶在强酸条件下脱附金属离子的能力,将pH为7条件下进行Fe3+吸附实验后的水凝胶置于9 mL 1 mol·L-1的HCl溶液中,12 h后取出溶液测得体积V,并测出溶液中的Fe3+浓度C。其脱附率D (desorption ratio)计算公式为:
| $D = \frac{{C \times V}}{{U \times {m_0}}} \times 100\% $ | (3) |
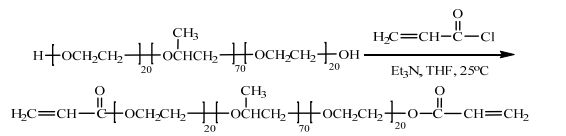
通过丙烯酰氯与P123末端羟基的反应可以得到大分子单体DA-P123,其反应步骤如图 1所示。
|
图 1 DA-P123的合成步骤 Fig.1 Synthesis route of DA-P123 |
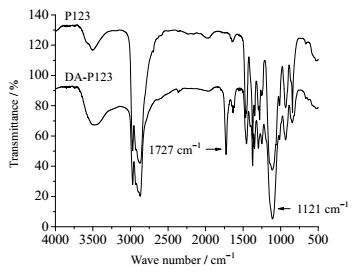
由于丙烯酰氯与羟基反应会生成羰基,所以可以通过FTIR观察其吸收峰,以表征产物结构。其结果如图 2所示。图 2中1121 cm-1处的强吸收峰为P123中-C-O-C-键的伸缩振动,比较P123和DA-P123的红外谱图可以看出1121 cm-1处的吸收峰在反应前后并没有改变,而DA-P123多出了一个很明显的峰,即羰基吸收峰(1727 cm-1,这个峰并不是酰氯残留,酰氯的峰小于1725 cm-1),表明P123末端-OH已经与丙烯酰氯发生反应。而3490 cm-1处的宽吸收峰则可能是由于后处理中残留的少量水分。
|
图 2 P123和DA-P123的红外谱图 Fig.2 FTIR spectra of P123 and DA-P123 |
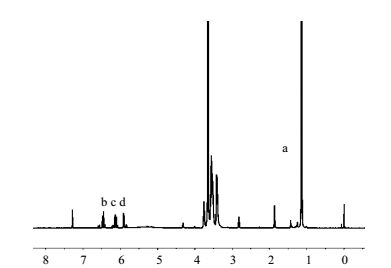
为了测定DA-P123中的-OH的取代度,将DA-P123溶解在CDCl3中,通过核磁获得其结构信息。从图 3可以看出,5.85~6.45 ppm处(b、c、d)三个相邻的峰归属于末端的双键,而1.07~1.19 ppm (a)处归属于P123中的-CH3基团,表明丙烯酰氯已经与P123末端的羟基发生了反应,5.85~6.45 ppm处三组峰的面积之和与1.07~1.19 ppm处的峰面积进行对比,通过计算即可得到其官能团取代度。其取代度为90%,说明取代反应进行得较完全。
|
图 3 DA-P123的核磁谱图 Fig.3 1HNMR spectrum of DA-P123 |
为了测定水凝胶溶胀的影响因素,分别改变水凝胶自身性质以及外部环境观察水凝胶的溶胀效应。其自身性质会因为不同单体比例、固含量、光照时间、光引发剂比例而改变,即这些因素可以影响水凝胶的结构,从而影响水凝胶的溶胀行为。而外部因素则是通过改变温度、pH、溶液中盐的浓度、溶液中盐的种类等因素影响凝胶在水溶液中的变化。因此,考察了单体浓度、光照时间、温度、盐浓度和盐种类对凝胶溶胀行为的改变。
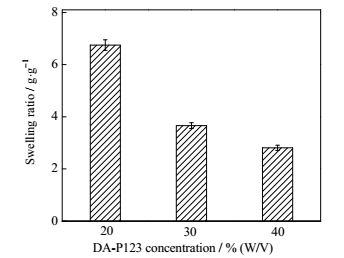
3.2.1 单体浓度的影响为了比较DA-P123单体浓度对水凝胶溶胀率的影响,制备了三种不同浓度的溶液,其浓度分别为:20%(W/V)、30%(W/V)和40%(W/V),并通过紫外光照射形成凝胶。将其置于去离子水中,观察其溶胀率,其结果见图 4。
|
图 4 三种单体浓度下DA-P123凝胶的溶胀率(UV = 30 min) Fig.4 Swelling ratios of the hydrogel with three different monomer concentrations |
从图 4看出,25℃下单体浓度为20%时水凝胶的溶胀率最高,然后随着溶液中单体浓度的增加而逐渐下降。其原因可能是浓度高的溶液中,其聚合物胶束堆积的更紧密,而溶液在紫外照射之前的初始堆积状态决定了产物凝胶的交联密度,从而影响其溶胀行为,所以浓度大时,凝胶交联紧密,结构较完善,吸水性能下降。如LEE等制备的F127凝胶,当浓度从15%上升至25%时,其溶胀率从21降至13[14]。
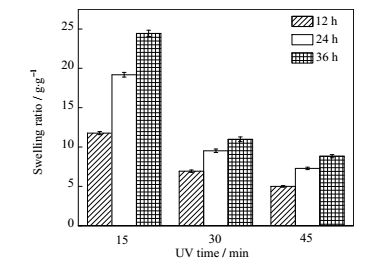
3.2.2 光照时间的影响光引发剂在紫外光作用下,产生自由基,从而引发溶液中的单体反应,当分子量足够大后,就能形成不溶于水的凝胶。光照时间的延长能够使水凝胶的结构更完善,其网络连接的更紧密。因此观察了不同光照时间对水凝胶溶胀率的影响,其结果见图 5。图中看出4℃下当光照时间从15 min增加为30 min,其溶胀率几乎下降了一半,而从30 min延长至45 min,溶胀率下降则没有那么剧烈。说明凝胶在15 min左右刚好形成,但此时形成的水凝胶强度较差,而光照时间逐渐延长至30 min后,凝胶结构基本完善,此后,继续增加光照时间,其结构紧密程度变化不大,表现为凝胶溶胀率的之间的小差异。而延长水凝胶的溶胀时间则更容易发现水凝胶溶胀率的差异,光照时间越短,其溶胀率随时间变化的幅度越明显。
|
图 5 不同光照时间下DA-P123凝胶的溶胀率(W/V = 30%) Fig.5 Swelling ratios of the hydrogel with different UV times |
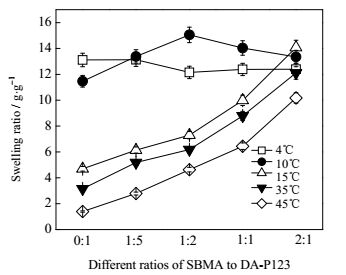
DA-P123作为温敏性物质,由其制备形成的水凝胶在不同的温度下会表现出不同的溶胀行为。考察了不同温度下水凝胶的溶胀率差异,其结果见图 6。
|
图 6 不同组分共聚水凝胶在不同温度下的溶胀率 Fig.6 Swelling ratios of the hydrogel with different components under different temperatures |
从图 6可以看出,当不含SBMA时,凝胶的溶胀率随温度的升高下降,这是因为低温时亲水的DA-P123通过氢键作用将水分子吸入水凝胶网络中,而当温度升高后,DA-P123中的PPO链段会变得疏水,使得氢键作用减弱,吸入凝胶的水则被释放出来。而在同一温度下,溶胀率随SBMA含量的增加而增加,其原因是SBMA比DA-P123更亲水,其能通过与水分子之间的氢键结合吸收更多的水。但在4℃时,其溶胀率表现为逐渐下降,可能是因为此时SBMA的两性离子基团表现分子内和分子间静电作用,而当温度升高时,则表现为和水分子的氢键结合作用[15],如Yang等发现其SBMA纯凝胶其溶胀率从4℃时的2.13上升为60℃时的2.88[16]。
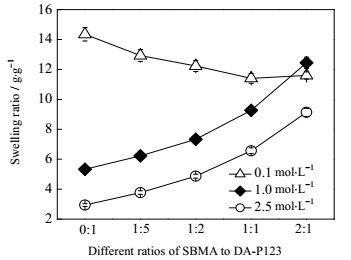
3.2.4 NaCl浓度的影响SBMA在盐溶液中表现出抗聚电解质性质,考察了不同含量的SBMA对水凝胶在不同浓度NaCl溶液中溶胀行为的改变。从图 7中可以看出,高浓度下,其规律表现一致,即随着SBMA含量的增加,其凝胶的溶胀率逐渐增加,在低浓度下则随着SBMA含量的增加逐渐降低。而在同一比例下,盐浓度高时,其凝胶的溶胀率较小。其原因可能是盐离子与水之间的作用形成脱水转移,造成DA-P123水凝胶溶胀减少,而由于溶液中的盐离子阻挡了SBMA段中带有相反电荷两性离子基团的相互吸引作用,使复合凝胶的溶胀随SBMA含量的增加而增加。这一现象与Chang等制备的P(NIPAAm-co-SBMA)凝胶在氯化钠盐溶液中的溶胀表现类似,其制备的NIPAAm纯凝胶在2.5 mol·L-1氯化钠盐溶液溶胀率最低,几乎不溶胀,而SBMA凝胶则随盐溶液浓度的升高溶胀更多,表现出抗聚电解质行为[17]。
|
图 7 不同组分共聚水凝胶在不同浓度NaCl溶液中的溶胀率 Fig.7 Swelling ratios of the hydrogel with different components under different concentrations of NaCl solution |
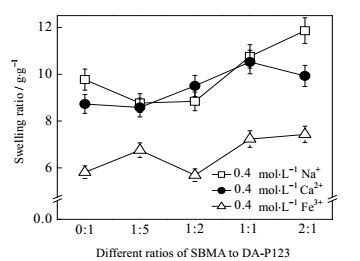
为了测量不同阳离子种类对水凝胶溶胀行为的改变,考察了水凝胶在Na+、Ca2+和Fe3+溶液中的溶胀行为,其结果见图 8。从右图可以看出,在Na+和Ca2+溶液中,同一种凝胶的溶胀率没有明显差异,但在Fe3+溶液中,凝胶的溶胀由于凝胶网络的收缩受到了很大程度的抑制,水分子进入凝胶内部难度增加,其溶胀吸水作用相比于前两种显得不强。而随着凝胶中SBMA含量的增加,在同种离子溶液中,凝胶的溶胀率逐渐增加,说明SBMA的存在能够增加凝胶的抗盐作用,在溶液中存在其他离子时,也能很好地在溶液中伸展,从而使得凝胶溶胀。这一趋势与去离子水溶胀实验中的趋势刚好相反。说明SBMA与盐的作用,增加了水分子进入凝胶内部的机会,使得凝胶能够吸收更对的水分,表现为凝胶的溶胀率逐渐增加。
|
图 8 不同组分共聚水凝胶在不同盐溶液中的溶胀率 Fig.8 Swelling ratios of the hydrogel with different components under different saline solutions |
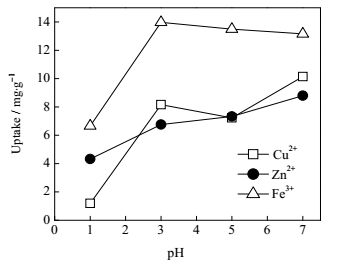
在观察盐种类对水凝胶溶胀的影响时发现,凝胶对Fe3+具有吸附作用,且DA-P123水凝胶对金属离子的吸附作用最明显,于是将其用于金属离子的吸附。从图 9可以看出,强酸条件下,水凝胶对金属离子的吸附较少,水凝胶对Cu2+和Zn2+吸附随着pH的升高逐渐增加,到pH为7时,其吸附量达到最大值,而水凝胶对Fe3+的吸附则是在pH为3时达到最大值,之后缓慢下降。其对Fe3+、Cu2+、Zn2+的最大吸附量分别为13.97、10.13、8.79 mg·g-1。表明其对Fe3+、Cu2+、Zn2+的吸附能力为Fe3+>Cu2+>Zn2+。DA-P123水凝胶对Fe3+、Cu2+、Zn2+的吸附与其他材料的对比见表 1。相比于大多数文献,本文制备的DA-P123水凝胶在金属离子吸附能力上具备一定的优势,说明其有望作为金属离子吸附剂用于环境保护。
|
图 9 不同pH下不同重金属离子的吸附量 Fig.9 Adsorption of different heavy metal ions under different pH |
| 表 1 不同吸附剂对重金属离子吸附能力比较 Table 1 Comparison of heavy metal ion adsorption capacities of different sorbents |
由于废水中含有少量的蛋白质等有机物,因此为了评估废水中有机物对水凝胶吸附金属离子能力的影响,使用BSA作为模型蛋白质,考察了水凝胶在1 g×L-1BSA溶液中吸附Fe3+的能力。图 9中凝胶在强酸条件下对金属离子的弱吸附作用表明可以通过强酸条件将吸附的金属离子脱附,从而使水凝胶再生。而使用强酸使水凝胶吸附的金属离子脱附从而富集已有文献报道,Ayman M. Atta等发现2 mol·L-1的HCl对P(AM/AMPS)共聚水凝胶吸附的Cd2+的脱附率大于97%[23]。因此使用1 mol·L-1的HCl对水凝胶吸附的Fe3+进行脱附实验。其结果列于表 2。
| 表 2 BSA溶液中Fe3+的吸附及脱附 Table 2 Adsorption and desorption of Fe3+ in BSA solution |
从表 2可以看出,水凝胶在去离子水中和BSA溶液中对Fe3+的吸附能力基本没有差异,说明废水中的BSA不会对水凝胶吸附金属离子的能力造成影响。实验中通过使用1mol·L-1的HCl基本能将凝胶吸附的金属离子脱附,其脱附率分别为95%和92%,说明其具有良好的吸附-脱附能力。此实验表明此类凝胶可以作为一种新型的金属离子吸附剂,其可以用于处理废水中含有的少量金属离子,从而达到净化水,保护环境的目的。
4 结论通过封端反应制备了末端为双键的大分子单体DA-P123,并通过红外和核磁判定产物。考察了不同因素对DA-P123水凝胶溶胀行为的影响,发现单体浓度增加、光照时间延长以及温度升高都会导致DA-P123水凝胶溶胀减少,而SBMA的加入使DA-P123水凝胶在温度升高和盐浓度升高时依然能保持较好的吸水能力。DA-P123水凝胶对金属离子Fe3+的吸附效果最明显,且溶液中的BSA并不影响水凝胶对金属离子的吸附能力。通过使用1 mol·L-1的HCl可以使金属离子脱附,从而使水凝胶再生。
符号说明:
| C | -金属离子浓度,mg×L-1 | V | -金属离子溶液体积,L |
| D | -脱附率,% | 下标 | |
| m | -凝胶质量,g | 0 | -干燥的凝胶 |
| SR | -凝胶溶胀率,g×g-1 | 1 | -溶胀后的凝胶 |
| U | -金属离子吸附量,mg×g-1 |
| [1] | Chun K W, Lee J B, Kim S H, et al. Controlled release of plasmid DNA from photo-cross-linked pluronic hydrogels[J]. Biomaterials , 2005, 26(16): 3319-3326. DOI:10.1016/j.biomaterials.2004.07.055. |
| [2] | Sannino A, Esposito A, De R A, et al. Biomedical application of a superabsorbent hydrogel for body water elimination in the treatment of edemas[J]. Journal of Biomedical Materials Research Part A , 2003, 67(3): 1016-1024. |
| [3] | Ali E H, Shawky H A, Rehim H A A E, et al. Synthesis and characterization of PVP/AAc copolymer hydrogel and its applications in the removal of heavy metals from aqueous solution[J]. European Polymer Journal , 2003, 39(12): 2337-2344. DOI:10.1016/S0014-3057(03)00150-2. |
| [4] | Sohrab F. Evaluation of hydrogel application on soil water retention characteristics[J]. Journal of Plant Nutrition , 2007, 31(2): 317-331. |
| [5] | Giammanco G E, Carrion B, Coleman R M, et al. Photoresponsive polysaccharide-based hydrogels with tunable mechanical properties for cartilage tissue engineering[J]. ACS Applied Materials & Interfaces , 2016, 8(23): 14423-14429. |
| [6] | Kim M R, Park T G. Temperature-responsive and degradable hyaluronic acid/pluronic composite hydrogels for controlled release of human growth hormone[J]. Journal of Controlled Release Official Journal of the Controlled Release Society , 2002, 80(1-3): 69-77. DOI:10.1016/S0168-3659(01)00557-0. |
| [7] | MA Li-cheng(马立成), ZHENG Qi(郑其), CHE Xiao-kui(车小奎), et al. Characterization and properties of Cu2+ ion-imprinted magnetic chitosan beads and their Cu2+ adsorption performance(Cu2+印迹磁性壳聚糖微球的表征及吸附性能)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(1): 174-181. |
| [8] | HE Xiao-jin(贺小进), ZHANG Bing-ling(张冰凌), TAN Tian-wei(谭天伟), et al. Study on adsorption properties to metal ion and physical properties of bead Ni2+ templated chitosan chelated resins(球形Ni2+模板壳聚糖树脂吸附性能及物性研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2001, 15(1): 23-28. |
| [9] | Soleyman R, Pourjavadi A, Monfared A, et al. Novel salep-based chelating hydrogel for heavy metal removal from aqueous solutions[J]. Polymers for Advanced Technologies , 2016, 27(8): 999-1005. DOI:10.1002/pat.v27.8. |
| [10] | Karbarz M, Pyrzynska K, Romanski J, et al. New poly(-δ-acryloyl ornithine) gels cross-linked with N, N'-methylene-bisacrylamide. Sorption properties[J]. Polymer , 2010, 51(14): 2959-2964. DOI:10.1016/j.polymer.2010.05.023. |
| [11] | Huang Z, Wu Q, Liu S, et al. A novel biodegradable β-cyclodextrin-based hydrogel for the removal of heavy metal ions[J]. Carbohydrate Polymers , 2013, 97(2): 496-501. DOI:10.1016/j.carbpol.2013.04.047. |
| [12] | Elgueta E, Sánchez J, Dax D, et al. Functionalized galactoglucomannan-based hydrogels for the removal of metal cations from aqueous solutions[J]. Journal of Applied Polymer Science , 2016, 133(41): 44093. |
| [13] | Chowdhury M N K, Ismail A F, Beg M D H, et al. Polyvinyl alcohol/polysaccharide hydrogel graft materials for arsenic and heavy metal removal[J]. New Journal of Chemistry , 2015, 39(7): 5823-5832. DOI:10.1039/C5NJ00509D. |
| [14] | Lee J B, Yoon J J, Lee D S, et al. Photo-crosslinkable, thermo-sensitive and biodegradable pluronic hydrogels for sustained release of protein[J]. Journal of Biomaterials Science Polymer Edition , 2004, 15(12): 1571-1583. DOI:10.1163/1568562042459751. |
| [15] | Chang Y, Shu S H, Shih Y J, et al. Hemocompatible mixed-charge copolymer brushes of pseudozwitterionic surfaces resistant to nonspecific plasma protein fouling[J]. Langmuir , 2010, 26(5): 3522-3530. DOI:10.1021/la903172j. |
| [16] | Yang B, Wang C, Zhang Y, et al. Thermoresponsive poly(N-vinylcaprolactam-co-sulfobetaine methacrylate) Zwitterionic hydrogel exhibiting switchable anti-biofouling and cytocompatibility[J]. Polymer Chemistry , 2015, 6(18): 3431-3442. DOI:10.1039/C5PY00123D. |
| [17] | Chang Y, Yandi W, Chen W Y, et al. Tunable bioadhesive copolymer hydrogels of thermoresponsive poly(N-isopropyl acrylamide) containing Zwitterionic polysulfobetaine[J]. Biomacromolecules , 2010, 11(4): 1101-1110. DOI:10.1021/bm100093g. |
| [18] | Tsekova K, Christova D, Todorova D, et al. Removal of Cu, Co(Ⅱ) and Fe(Ⅲ) ions from ternary solution by free and entrapped in PVA-hydrogel biomass of[J]. Biotechnology & Biotechnological Equipment , 2011, 25(sup1): 41-46. |
| [19] | Stafiej A, Pyrzynska K. Solid phase extraction of metal ions using carbon nanotubes[J]. Microchemical Journal , 2008, 89(1): 29-33. DOI:10.1016/j.microc.2007.11.001. |
| [20] | Aykara T, İnam R. Determination of the competitive adsorption of heavy metal ions on poly(n-vinyl-2-pyrrolidone/acrylic acid) hydrogels by differential pulse polarography[J]. Journal of Applied Polymer Science , 2010, 89(8): 2013-2018. |
| [21] | İnam R, Gümüş Y, aykara T. Competitive removal of Pb2+, Cd2+, and Zn2+ by poly(acrylamide-co-maleic acid) hydrogels/differential pulse polarographic determination[J]. Journal of Applied Polymer Science , 2010, 94(6): 2401-2406. |
| [22] | Sharma N, Tiwari A. Kinetic and thermodynamic studies of Zn adsorption onto superparamagnetic poly(styrene-co-acrylic acid) hydrogel[J]. Synthesis and Reactivity in Inorganic, Metal-Organic, and Nano-Metal Chemistry , 2016, 46(4): 608-616. DOI:10.1080/15533174.2014.988797. |
| [23] | Atta A M, Ismail H S, Elsaaed A M. Application of anionic acrylamide-based hydrogels in the removal of heavy metals from waste water[J]. Journal of Applied Polymer Science , 2011, 123(4): 2500-2510. |




