2. 浙江大学衢州研究院, 浙江 衢州 324000
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China
随着现代工业的迅速发展,石油化工、化学制药、纺织印染、食品加工以及人类的日常活动使得自然水体中持续检测到难降解有机污染物[1]。一些难降解有机污染物如药品、抗菌剂、激素、除草剂、杀虫剂等对生态和人类健康产生不可忽视的威胁[2-4]。与传统水处理方法(例如絮凝、沉淀、过滤等)相比,高级氧化技术能够更高效地降解有机污染物,因此被广泛应用在污水和饮用水的处理中。硫酸根自由基(SO4•−)拥有较高的氧化还原电位(2.5~3.1 V),并能够快速氧化具有共轭键的有机污染物(二级动力学反应速率1010 (mol⋅L−1⋅s)−1 > k > 108 (mol⋅L−1⋅s)−1[5-7]。一般情况下,SO4•−是通过活化单过硫酸盐(peroxymonosulfate,PMS)或过硫酸盐(persulfate,PS)产生的,其中常见的活化手段包括紫外光(ultraviolet,UV)[8]、热[6,9]、超声[10]、电化学方法[11]、过渡金属[12]、磷酸根[6]等等。虽然过渡金属及掺杂过渡金属的催化剂材料能够高效催化PMS和PS产生SO4•−,但是残留的/析出的过渡金属离子会在污水处理流程中由于pH的变化而沉淀,对后续水处理/配水产生困难,并可能造成二次污染。为了解决这些缺陷,近年来使用碳材料活化PMS/PS来降解新兴污染物得到研究人员的关注。碳材料能够有效地通过表面的官能团(如醌、羟基等)催化PMS/PS,通过自由基途径或者非自由基途径降解污染物。如Tang等[13]利用具有氧原子团的边缘缺陷的中孔碳材料成功活化PS降解2, 4-二氯苯酚。Ren等[14]深入分析了碳纳米管上不同的含氧官能团对于活化过二硫酸盐降解苯酚的机制。Sun等[15]利用氮改性的碳纳米管活化PMS氧化苯酚溶液也取得良好的效果。无论是中孔碳材料还是碳纳米管等,这些材料的成本较高,难于获得。另外由于大多数材料作为阴极具有较低的析氢电势,产氢反应为阴极的主要反应,因此无法有效活化PS[16]。石墨材料具有较高的析氢电势,这为石墨材料作为阴极电活化PS提供可能,并且反应过程中石墨材料没有金属析出的问题。相比于石墨烯、碳纳米管等其他碳材料,石墨纸(graphite paper,GP)的成本较低,可回收性较强。
本研究以GP为阴极电活化PS(electrochemical activation of persulfate,EC/PS)降解难降解有机污染物阿特拉津(atrazine,ATZ)。研究电流、电极面积以及初始PS浓度对于ATZ降解效率的影响,并对反应过程中的活性物质及ATZ降解产物及过程进行分析,以期为石墨电极在实际废水处理过程中电催化PS去除难降解有机污染物的应用提供理论机理和技术支持。
2 实验(材料与方法) 2.1 试剂与仪器使用的试剂均为分析级(> 98%),叔丁醇(tert-butyl alcohol,TBA)购于Aladdin公司(中国);甲醇(methanol,MeOH)购于上海实验试剂有限公司;商用GP(1 mm厚度)购于内蒙古碳电厂;淬灭实验中所用的2, 2, 6, 6-四甲基哌啶(2, 2, 6, 6-Teramethylpiperidine,TEMP)与5, 5-二甲基-1-吡咯啉-N-氧化物(5, 5-dimethyl-1-pyrroline N-oxide,DMPO)购于上海艾览化工科技有限公司。
2.2 实验装置与方法 2.2.1 GP的预处理及表征取GP在丙酮溶液中超声90 min,用超纯水冲洗,再浸入超纯水中继续超声90 min,最后将GP取出,60 ℃下烘干,备用。
GP的电化学活性表面积(electrochemical active surface area, EASA)根据Randles-Sevcik公式计算得出,使用5 mmol⋅L−1 K3[Fe(CN)6]作为可逆氧化探针,pH = 4,以预处理后的GP为工作电极,碳棒为对电极,Ag/AgCl为参比电极(饱和KCl,0.199 V vs 标准H2电极)。在电化学工作站上的三电极电池中执行线性扫描电压测量(linear sweep voltammetry,LSV),扫描范围为+1.2~ −1.2 V,扫描速度为5 mV·s−1。含氧官能团的测定采用傅里叶变化红外光谱(Fourier transform infrared spectroscopy,FTIR)进行表征,扫描范围:4 000 ~ 500 cm−1,波数精度0.01 cm−1。
2.2.2 ATZ去除的体系对比如图 1所示在100 mL单腔室反应容器中进行电化学活化PS降解ATZ体系的对比实验,反应溶液由30 mmol⋅L−1 Na2SO4作为电解质(增强溶液的导电性),浓度为2.3 µmol⋅L−1的ATZ作为目标污染物,下同。在无外加电源且不添加PS时,探究GP对ATZ的吸附效果;在无外加电源但PS浓度为1 mmol⋅L−1时,探究GP活化PS对ATZ的降解效果;在加电但不添加PS时,探究GP作为阴极,电氧化降解ATZ的降解效果;在加电且添加PS浓度为1 mmol⋅L−1时,探究GP作为阴极活化PS对ATZ的降解效果。当有外加电源时,使用不锈钢丝网作为阳极,使用Ag/AgCl参比电极。阳极和阴极之间的距离为3.0 cm,其几何表面尺寸为1 cm × 3 cm。所有批量实验都是使用电化学工作站以恒电流模式进行的。由磁搅拌器连续混合。取样时,立刻向样品中加入Na2S2O3来淬灭样品中残留的PS,Na2S2O3与PS的量比为1:1。所有实验在室温((25 ± 1) ℃)下重复3次。ATZ的浓度用高效液相色谱测定。
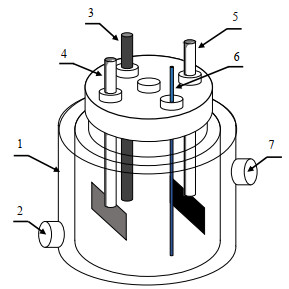
|
图 1 实验装置示意图 Fig.1 Schematic diagram of the experimental apparatus 1. jacketed reactor 2. influent 3. reference electrode 4. counter-electrode 5. working electrode 6. sampling port 7. effluent |
通过控制单一变量探究电流、GP面积以及初始PS浓度对ATZ降解效果的影响。所有批量实验都是使用电化学工作站以恒电流模式进行。
2.2.4 自由基的分析与电子顺磁共振实验按照2.2.3节中操作流程搭建反应装置,控制电化学工作站设定工作电流为2.2.3节中最佳电流,为确定系统中的活性物种,使用多种不同浓度的自由基清除剂(MeOH、TBA)进行淬火实验。为了排除O2在系统中的贡献,在反应之前在反应溶液中持续通入N2(> 99.99%)30 min。
电子顺磁共振(electron paramagnetic spectroscopy,EPR)实验用来检测电化学活化PS体系中的自由基种类,检测时不加ATZ。通过检测羟基自由基(•OH)与SO4•−和DMPO反应分别生成的DMPO-OH和DMPO-SO4来确定这2种自由基的存在。样品制备是将1 mL反应溶液与0.2 mL DMPO溶液(1.1 mol⋅L−1)混合。通过检测1O2与TEMP反应生成的TEMPO来确定这个自由基的存在。样品制备是将1mL反应溶液与0.05 mL TEMP溶液混合(5.8 mol⋅L−1)。20 s后,混合后的溶液转移到2 mL毛细管中,立刻用顺磁共振波谱仪(EMX A300,Germany)测量。测量参数如下:微波桥功率20.4 mW,微波桥频率9.8 GHz,中间场强3 507.9 G,扫描宽度120 G,调制频率100 kHz。
2.2.5 产物分析按照2.2.3中操作流程搭建反应装置,反应条件:ATZ初始浓度为4.6 µmol⋅L−1,PS初始浓度为0.5 m mol⋅L−1,Na2SO4浓度为30 mmol⋅L−1,阴极电流为−2 mA,电极几何面积为1 cm×3 cm,初始pH为5.6。分别在30、60、90、120、150、180 min取样,取样后,立刻向样品中加入0.1 mL乙醇以淬灭样品中残留的活性物质。
用UPLC(Waters, USA)-TOF-MS液相质谱仪(AB SCIEX 5600plu,USA)测量产物。
3 结果与讨论 3.1 GP的表征对GP材料进行了表征,EASA及FTIR检测结果分别如图 2、3所示。图 2中,I为电流,mA;E为参比于参比电极为Ag/AgCl的电极电势,V。由图 2发现材料的表观面积与EASA并不相等,出现该现象是因为GP边缘以及缺陷的存在对其EASA是有影响的。
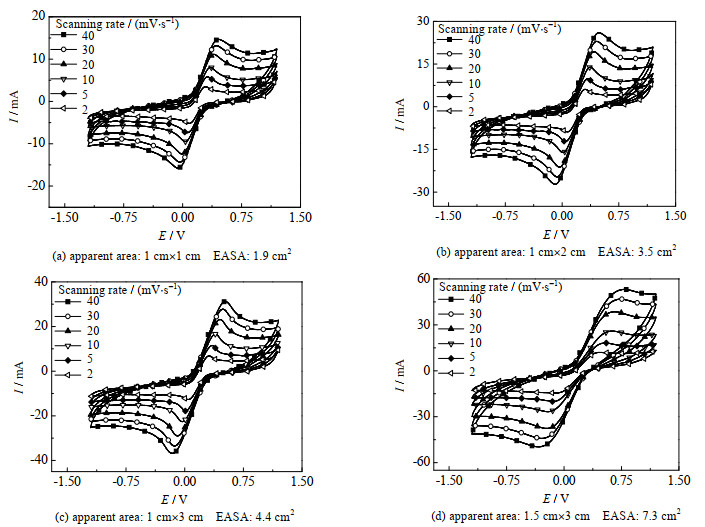
|
图 2 不同表观面积下GP的EASA Fig.2 EASA of GP under different apparent areas |
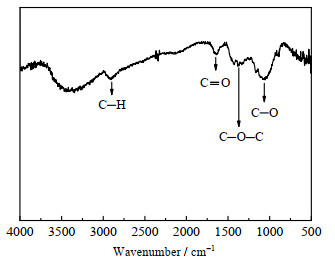
|
图 3 GP的红外谱图 Fig.3 FTIR spectrum of GP |
边缘以及缺陷导致的表面积增大,有助于增加材料的吸附效果,这对于材料活化PS降解ATZ具有十分积极的作用。Liu等[17]利用水合肼处理碳毡增加了碳毡的表面缺陷,用处理后的碳毡处理左氧氟沙星,实验证明处理后的碳毡对左氧氟沙星的降解效率大大提高。
图 3为傅里叶变化红外光谱测试应用于GP的表面官能团。如图,在2 900~3 000 cm−1处的谱带证明碳材料终端C─H键的存在;在1 725 cm−1处的谱带证明碳材料终端C═O键的存在;在1 000、1 390 cm−1处的谱带证明碳材料终端C─O键和C─O─C的存在。众多研究表明,含氧官能团如羟基(C─OH)、羰基(C═O),会影响碳材料的催化活性[14, 18]。
3.2 体系对比图 4为单独GP浸入且无电时、GP与PS在无通电时、单独GP加电时以及GP作为阴极加入PS且通电的ATZ降解图。图中,c/c0为不同时间时的ATZ浓度与初始ATZ浓度的比值。由图可知当GP单独浸入体系但是无PS及外加电源时,ATZ浓度有一定下降,这是因为GP对ATZ具有一定的吸附作用,60 min可吸附26% 的ATZ。当无外加电源时,GP可活化PS降解ATZ,60 min可去除42% 的ATZ,该现象是因为碳材料可以直接活化PS,产生相应的活化物质如SO4•−,继而降解ATZ[13]。当GP作为阴极时(不锈钢丝网作为阳极),控制电流为−2 mA,当无PS时,60 min ATZ的降解率有36%,结果说明因GP阴极上的电还原以及不锈钢丝网表面的电氧化可以降解一定量的ATZ。由图可知,当向体系中添加浓度为1 mmol⋅L−1的PS,控制电流−2 mA时,ATZ可以在50 min内被完全降解,这是因为在GP作为阴极的电化学体系中,PS得电子后可以被活化为SO4•−,一方面生成的SO4•−可以直接降解ATZ[19],另一方面SO4•−又可以与水进行反应生成•OH,•OH也可以与ATZ反应实现ATZ的降解[20]。经过4个体系的对比,结果说明用GP作为阴极的电化学活化PS体系可以有效降解ATZ污染物。
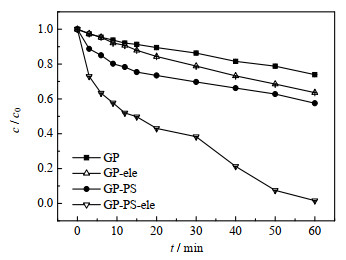
|
图 4 GP降解ATZ的体系对比 Fig.4 Comparison of different systems for ATZ degradation by GP |
图 5分别为电流、GP面积以及初始PS浓度对ATZ在EC/PS体系中降解的浓度变化以及表观动力学常数kobs的影响。
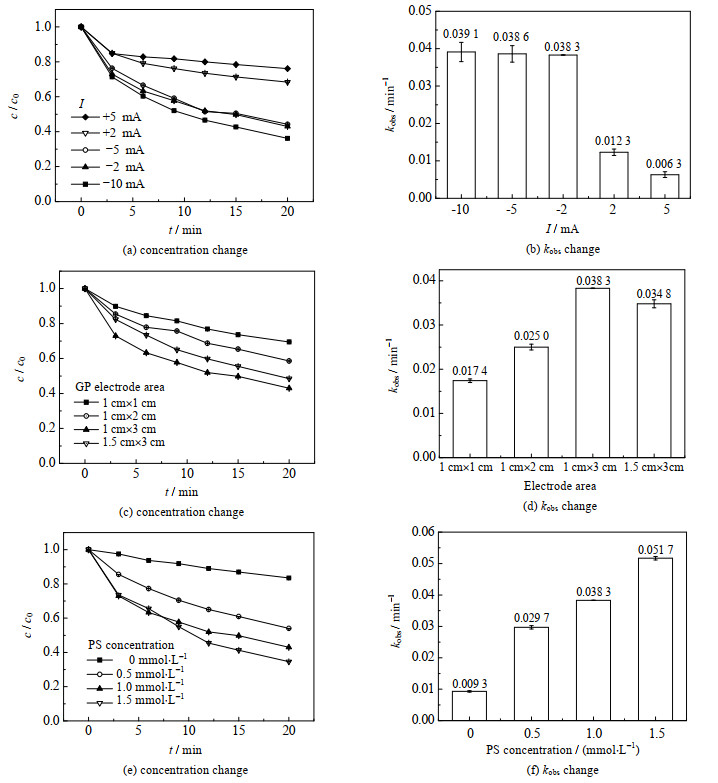
|
图 5 电流、GP的面积以及初始PS浓度对ATZ在EC/PS体系中降解的浓度变化以及kobs的影响 Fig.5 Effects of current intensity, GP area and initial PS concentration on concentration change and kobs of ATZ degradation in the EC/PS system |
图 5(a)和5(b)分别为电流从−10 mA增加至+5 mA的过程中,ATZ在EC/PS体系中降解的速率以及kobs随电流改变而改变的示意图。当电流从−10 mA ~ +5 mA时,kobs随着电流的增高逐渐降低,当电流低于−2 mA时,GP的kobs变化逐渐变得平缓。发生此现象的原因主要是随着电流的降低(由+5 mA向−2 mA逐渐降低),GP作为阴极的电极上富集的电子量也逐渐增多,电子量的增多将有利于PS从阴极得到电子,从而使PS活化产生较多的SO4•−[21]。但随着电流继续降低(由−2 mA向−10 mA逐渐降低),会导致阳极产生大量的O2,并且O2会参与电极副反应与污染物竞争自由基,导致ATZ的降解速率增长趋势几乎不再变化。另外,当电流低于−2 mA时,可能会导致ATZ在阳极的氧化程度增加,生成较多的低聚物,这些多聚物被GP吸附后,将影响ATZ的降解[21]。
图 5(c)和5(d)分别为GP面积对ATZ在EC/PS体系中降解的浓度变化以及kobs的影响示意图,由图可知kobs随着GP面积的增大逐渐增大,但当GP面积大于1 cm× 3 cm时,GP的kobs变化逐渐变得平缓。说明此时GP的面积已经不是影响ATZ降解的主要因素。推测此时即使作为阴极的GP既能提供较多的活性位点,但由于PS浓度的限制,产生的SO4•−活性物质的浓度将不再有较大变化,因此导致即使再增加GP的面积,也不会使得ATZ的降解效率有较明显的提升,接下来的PS浓度对ATZ降解效果的影响的实验很好地验证了该猜想。
图 5(e)和5(f)为初始PS浓度对ATZ在EC/PS体系中降解的浓度变化以及kobs的影响示意图,由图可知kobs随着初始PS浓度的增高逐渐增高,说明当电流以及GP面积为最佳值时,初始PS浓度成为影响ATZ降解的主要因素。出现该现象的原因是随着初始PS的量的增加,作为阴极的GP可以活化更多的PS,产生更多的SO4•−,继而降解更多的ATZ。
3.4 自由基的抑制实验以及EPR实验为了鉴定GP作为阴极的EC/PS体系中的自由基的种类以及各种自由基对ATZ降解的贡献,本研究采用甲醇以及叔丁醇作为自由基淬灭剂,其中甲醇与•OH以及SO4•−的二级反应速率常数分别可以达到9.7×108以及2.5×107 (mol⋅L−1⋅s)−1[22],叔丁醇与•OH和SO4•−的二级反应速率常数分别可以达到(4~9.1)×105和(3.8~7.6)×108 (mol⋅L−1⋅s)−1 [12]。
图 6比较了当采取不同的自由基捕获剂时,ATZ在GP作为阴极的EC/PS体系中的浓度变化以及降解效率kobs。由甲醇与•OH以及SO4•−的二级反应速率常数可知,MeOH与•OH和SO4•−的反应速率都很快,因此向体系中加入甲醇后会抑制这2种自由基。而叔丁醇与•OH的二级反应速率常数远大于叔丁醇与SO4•−的二级反应速率常数,因此TBA与•OH反应速度远大于与SO4•−的反应速度,当向体系中加入TBA时会抑制大部分的•OH自由基,少量的SO4•−。N2 Purge表示向反应溶液中持续通入氮气,表示反应体系中无溶解氧。由图 6可知,对于GP作为阴极的EC/PS体系,加入自由基抑制剂,可以明显抑制ATZ的降解,但不同的自由基抑制剂以及不同浓度的自由基抑制剂对ATZ降解的抑制效果不同。通过对比不难看出,对于GP作为阴极的EC/PS体系,•OH以及SO4•−对ATZ的降解均有贡献,但是起主要作用的是•OH自由基,存在一部分SO4•−和O2•−,并且O2会参与电极副反应与污染物竞争自由基。
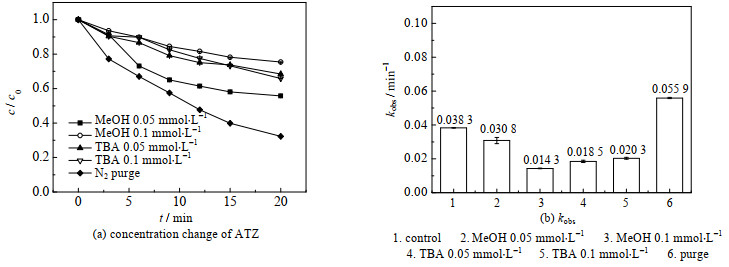
|
图 6 在不同自由基捕获剂存在情况下,ATZ在EC/PS中的浓度变化以及kobs Fig.6 Concentration profiles of ATZ and kobs in EC/PS under different free radical trapping agents |
为了进一步鉴定体系中的自由基种类,分别以DMPO与TEMP为自由基捕获剂,其中DMPO与•OH自由基结合后经EPR测试,会出现一个1:2:2:1的四重峰信号,TEMP与1O2结合后,在EPR检测中表现出特征三重峰[23]。图 7为EPR检测GP作为阴极的EC/PS体系中的自由基。由图 7(a)可知,在GP作为阴极的EC/PS体系中,反应前可以看到有较不明显的羟基自由基的特征峰,这是因为在无加电时PS发生了轻微的水解[24],而与反应前相比反应中羟基自由基与1O2的特征峰强度均明显增加,结果证明GP作为阴极的EC/PS体系中存在羟基自由基与1O2。另外当以DMPO为自由基捕获剂时,图 7(a)中可以看到反应前与反应中出现6个强度相同的峰,这是由DMPO和碳中心自由基的加合物所显示的特征峰,该现象在其他研究中也有相同的现象[23, 25]。其中以碳为中心的自由基加合物可能源于高反应性自由基(如•OH)对含碳化合物的攻击[26]。另外,SO4•−也可以氧化含碳化合物生成碳中心自由基[23]。
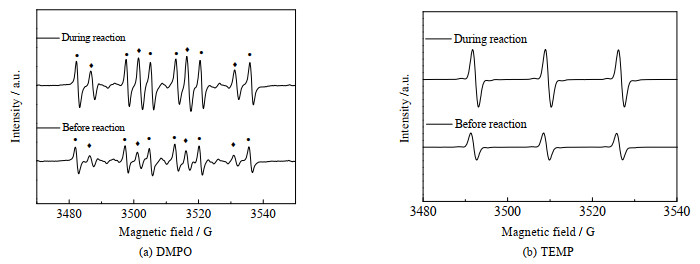
|
图 7 用DMPO和TEMP检测GP作为阴极的EC/PS体系中的自由基 Fig.7 Free radicals in the EC/PS system with GP as cathode detected by DMPO and TEMP |
表 1为以GP作为阴极的EC/PS体系中ATZ的降解产物(transformation products,TPs)。由实验结果发现,由于在不同的停留时间(residence time,RT)均检测到了质荷比m/z=214.085 4的质子化分子离子[M+H]+,因此分别标记为TP214a和TP214b。结合文献,推测ATZ的降解途径如图 8所示,包括侧链(乙基)上的氧化过程(a),侧链(异丙基)上的氧化过程(b),脱氯-羟基化过程(c)。有些产物是由这3种降解途径共同作用形成的,例如TP174(DIA)和TP172以及TP146和TP128。
|
|
表 1 ATZ在以GP作为阴极的EC/PS体系中的降解产物 Table 1 TPs of ATZ in the EC/PS system with GP as the cathode |
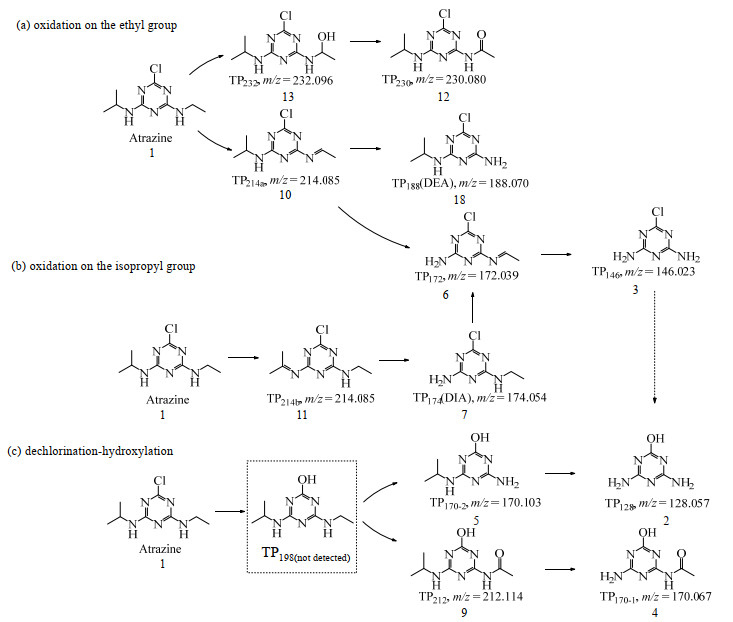
|
图 8 ATZ的降解途径 Fig.8 Degradation pathway of ATZ |
对于侧链(乙基)上的氧化过程(a),首先ATZ经过侧链乙基上的羟基化过程以及烯烃化过程分别生成TP232和TP214a,侧链乙基上的羟基化过程是由于•OH的攻击生成了C中心的自由基,并且可以被进一步氧化成醌类产物TP230。而ATZ烯烃化过程生成的TP214a则经脱烷基化过程分别生成TP172和TP188,TP172进一步脱烷基化生成TP146。对于脱氯-羟基化过程(c),脱氯-羟基化途径通过3步生成了产物TP198和TP128。第1步,ATZ和•OH/SO4•−通过电子转移生成了一个自由基正离子[[C8H14ClN5]•+]。第2步,C5原子与H2O通过亲核反应形成了一个─OH加成物。第3步,这个─OH加成物的C─Cl键异裂,形成脱氯-羟基化产物。其中TP198迅速经过脱烷基化过程分别生成TP170-2和TP212。然后继续经过脱烷基化过程分别生成TP170-1和TP128。
4 结论本研究利用析氢电势较高的GP作为阴极,可以有效活化PS产生自由基•OH、SO4•−、O2•−和1O2。GP作为EC/PS体系的工作电极时,一定范围内电流的降低(+5 ~ −2 mA)、电极面积的增加(1.0 ~3.0 cm2)以及初始PS浓度的提升(0 ~ 1.5 mmol⋅L−1)有利于PS的活化,产生更多的活性物质,利于ATZ降解。
| [1] |
崔少波, 崔咪芬, 陈献, 等. 催化氧化1, 2-二氯乙烷动力学及绝热式固定床模拟[J]. 高校化学工程学报, 2020, 34(1): 125-135. CUI S B, CUI M F, CHEN X, et al. Kinetics and adiabatic fixed-bed simulation of catalytic oxidation of 1, 2-dichloroethane[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(1): 125-135. DOI:10.3969/j.issn.1003-9015.2020.01.016 |
| [2] |
BENOTTI M J, TRENHOLM R A, VANDERFORD B J, et al. Pharmaceuticals and endocrine disrupting compounds in U.S. drinking water[J]. Environmental Science & Technology, 2009, 43(3): 597-603. |
| [3] |
RICHARDSON S D, TERNES T A. Water analysis: Emerging contaminants and current issues[J]. Analytical Chemistry, 2014, 86(6): 2813-2848. DOI:10.1021/ac500508t |
| [4] |
苏志伟, 陈鲁川, 雷乐成, 等. BDD电极氧化降解SDBS的研究[J]. 高校化学工程学报, 2020, 34(6): 1545-1550. SU Z W, CHEN L C, LEI L C, et al. Study on oxidative degradation of SDBS by BDD electrode[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(6): 1545-1550. DOI:10.3969/j.issn.1003-9015.2020.06.027 |
| [5] |
HE X X, DE LA CRUZ A A, DIONYSIOU D D. Destruction of cyanobacterial toxin cylindrospermopsin by hydroxyl radicals and sulfate radicals using UV-254 nm activation of hydrogen peroxide, persulfate and peroxymonosulfate[J]. Journal of Photochemistry and Photobiology a-Chemistry, 2013, 251: 160-166. DOI:10.1016/j.jphotochem.2012.09.017 |
| [6] |
YANG S Y, WANG P, YANG X, et al. Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat, UV and anions with common oxidants: Persulfate, peroxymonosulfate and hydrogen peroxide[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 552-558. |
| [7] |
LIN H, WU J, ZHANG H. Degradation of clofibric acid in aqueous solution by an EC/Fe3+/PMS process[J]. Chemical Engineering Journal, 2014, 244(1): 514-521. |
| [8] |
DUAN X, HE X, WANG D, et al. Decomposition of iodinated pharmaceuticals by UV-254 nm-assisted advanced oxidation processes[J]. Journal of Hazardous Materials, 2017, 323(S1): 489-499. |
| [9] |
ANTONIOU M G, DE LA CRUZ A A, DIONYSIOU D D. Degradation of microcystin-LR using sulfate radicals generated through photolysis, thermolysis and e- transfer mechanisms[J]. Applied Catalysis B-Environmental, 2010, 96(3/4): 290-298. |
| [10] |
CHEN W S, SU Y C. Removal of dinitrotoluenes in wastewater by sono-activated persulfate[J]. Ultrasonics Sonochemistry, 2012, 19(4): 921-927. DOI:10.1016/j.ultsonch.2011.12.012 |
| [11] |
CHEN W S, JHOU Y C, HUANG C P. Mineralization of dinitrotoluenes in industrial wastewater by electro-activated persulfate oxidation[J]. Chemical Engineering Journal, 2014, 252: 166-172. DOI:10.1016/j.cej.2014.05.033 |
| [12] |
ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13): 3705-3712. |
| [13] |
TANG L, LIU Y, WANG J, et al. Enhanced activation process of persulfate by mesoporous carbon for degradation of aqueous organic pollutants: Electron transfer mechanism[J]. Applied Catalysis B: Environmental, 2018, 231: 1-10. DOI:10.1016/j.apcatb.2018.02.059 |
| [14] |
REN W, XIONG L, NIE G, et al. Insights into the electron-transfer regime of peroxydisulfate activation on carbon nanotubes: The role of oxygen functional groups[J]. Environmental Science & Technology, 2020, 54(2): 1267-1275. |
| [15] |
SUN H, KWAN C, SUVOROVA A, et al. Catalytic oxidation of organic pollutants on pristine and surface nitrogen-modified carbon nanotubes with sulfate radicals[J]. Applied Catalysis B: Environmental, 2014, 154-155: 134-141. DOI:10.1016/j.apcatb.2014.02.012 |
| [16] |
BU L, DING J, ZHU N, et al. Unraveling different mechanisms of persulfate activation by graphite felt anode and cathode to destruct contaminants of emerging concern[J]. Applied Catalysis B: Environmental, 2019, 253: 140-148. DOI:10.1016/j.apcatb.2019.04.030 |
| [17] |
LIU X, YANG D, ZHOU Y, et al. Electrocatalytic properties of N-doped graphite felt in electro-Fenton process and degradation mechanism of levofloxacin[J]. Chemosphere, 2017, 182: 306-315. DOI:10.1016/j.chemosphere.2017.05.035 |
| [18] |
INDRAWIRAWAN S, SUN H, DUAN X, et al. Nanocarbons in different structural dimensions (0-3D) for phenol adsorption and metal-free catalytic oxidation[J]. Applied Catalysis B: Environmental, 2015, 179: 352-362. DOI:10.1016/j.apcatb.2015.05.049 |
| [19] |
JIANG Z, LI J, JIANG D, et al. Removal of atrazine by biochar-supported zero-valent iron catalyzed persulfate oxidation: Reactivity, radical production and transformation pathway[J]. Environmental Research, 2020, 184: 109260. DOI:10.1016/j.envres.2020.109260 |
| [20] |
JIANG Q, ZHANG Y, JIANG S, et al. Graphene-like carbon sheet-supported nZVI for efficient atrazine oxidation degradation by persulfate activation[J]. Chemical Engineering Journal, 2021, 403: 126309. DOI:10.1016/j.cej.2020.126309 |
| [21] |
赵纯, 丁昊杰, 程诺, 等. 阴极电场活化过硫酸盐原位再生饱和活性炭纤维[J]. 哈尔滨工业大学学报, 2021, 53(5): 9-15. ZHAO C, DING H J, CHENG N, et al. In situ regeneration of saturated activated carbon fibers by cathodic electric field activated persulfate process[J]. Journal of Harbin Institute of Technology, 2021, 53(5): 9-15. |
| [22] |
XU X, ZHANG Y, ZHOU S, et al. Activation of persulfate by MnOOH: Degradation of organic compounds by nonradical mechanism[J]. Chemosphere, 2021, 272: 129629. DOI:10.1016/j.chemosphere.2021.129629 |
| [23] |
YAN S, SHI Y, TAO Y, et al. Enhanced persulfate-mediated photocatalytic oxidation of bisphenol A using bioelectricity and a g-C3N4/Fe2O3 heterojunction[J]. Chemical Engineering Journal, 2019, 359: 933-943. DOI:10.1016/j.cej.2018.11.093 |
| [24] |
TAN C, JIAN X, DONG Y, et al. Activation of peroxymonosulfate by a novel EGCE@Fe3O4 nanocomposite: Free radical reactions and implication for the degradation of sulfadiazine[J]. Chemical Engineering Journal, 2019, 359: 594-603. DOI:10.1016/j.cej.2018.11.178 |
| [25] |
DONG G, AI Z, ZHANG L. Total aerobic destruction of azo contaminants with nanoscale zero-valent copper at neutral pH: Promotion effect of in-situ generated carbon center radicals[J]. Water research, 2014, 66: 22-30. DOI:10.1016/j.watres.2014.08.011 |
| [26] |
PIGNATELLO J J, OLIVEROS E, MACKAY A. Advanced oxidation processes for organic contaminant destruction based on the fenton reaction and related chemistry[J]. Critical Reviews in Environmental Science and Technology, 2006, 36(1): 1-84. DOI:10.1080/10643380500326564 |




