硫化镉(CdS)是一种重要的Ⅱ-Ⅵ族半导体材料,具有独特的光电化学性能,广泛应用于光化学电池和储能器件,在太阳能转化[1]、光催化[2]、非线性光学、发光材料[3]、生物检测[4]、电子器件等许多领域有着广泛的应用,而其性能与晶粒尺寸、形状等密切相关[5]。杂化材料由于协同效应获得独特性能[6],因而得到广泛的重视。杂化材料制备方法主要有溶胶-凝胶法[7]、共混法、非均相聚合法。非均相聚合[8-9](传统乳液聚合、细乳液聚合和微乳液聚合等)中,反相细乳液每个液滴相当于一个纳米反应器,制备粒径小且单分散性好,使用的乳化剂量较少而具有独特的优势。研究通过硫酸镉-聚丙烯酰胺(CdSO4-PAM)乳胶粒子吸收硫化钠(Na2S)细乳液液滴方法制备CdS-PAM乳胶粒子,形成包容CdS纳米(< 2 nm)颗粒稳定的乳胶粒子,并且发现CdS-PAM具有良好光催化性能。
2 实验部分 2.1 原料与试剂丙烯酰胺(AM):化学纯,上海凌峰化学试剂有限公司;CdSO4·8/3H2O:化学纯,国药集团化学试剂有限公司;Na2S·9H2O:分析纯,无锡市亚盛化工有限公司;过硫酸铵(APS):分析纯,江苏强盛功能化学股份有限公司;环己烷:分析纯,江苏强盛功能化学股份有限公司;失水山梨醇单油酸酯(Span 80):化学纯,国药集团化学试剂有限公司;无水乙醇:分析纯,国药集团化学试剂有限公司;亚甲基蓝:分析纯,上海润捷化学试剂有限公司。
2.2 CdS-PAM杂化粒子的制备典型CdSO4-PAM乳胶粒子的制备:称取2 g AM、0.100 g CdSO4·8/3H2O和0.080 g APS溶于8 g去离子水中制成水相;称取1.6 g Span 80溶于40 g环己烷中,磁力搅拌10 min,制成油相。将水相缓慢加入油相中,磁力搅拌预乳化15 min;后将预乳液超声5 min,移入四口烧瓶中慢速搅拌,在N2保护下,升温至65 ℃反应4 h,得到CdSO4-PAM乳液。
典型Na2S细乳液的制备:称取0.094 g Na2S·9H2O溶于8 g去离子水中,制成水相。称取1.6 g Span 80溶于40 g环己烷中,磁力搅拌10 min,制成油相。将水相缓慢倒入油相中,磁力搅拌预乳化15 min,后将预乳液超声5 min,得到Na2S细乳液。
典型CdS-PAM杂化粒子的制备:将硫化钠细乳液缓慢加入到CdSO4-PAM乳液中,升温至45 ℃在搅拌作用下保温密闭反应3 h,即得到所需的CdS-PAM杂化粒子。
2.3 测试与表征由英国的Mastersizer 2000型马尔文激光粒度仪进行液滴或乳胶粒子的Z均粒径及分布测试;乳胶粒子形貌观察采用日本JEM-2100型高分辨透射电子显微镜进行;CdS晶体结构采用美国Bruker公司生产的X射线单晶衍射仪测定;样品紫外吸收采用日本岛津的紫外可见分光光度计。样品光催化性能以测定亚甲基蓝溶液浓度变化进行表征:将制备的硫化镉粉末0.1 g加入7 mg·L-1的50 mL亚甲基蓝溶液中,200 W钨灯作为光源,每0.5 h取样测定其紫外吸收强度,通过对照标准曲 线得到亚甲基蓝溶液浓度,降解率由式(1)计算:
| $ {D_{\rm{t}}}{\rm{ = }}\frac{{{C_0}-{C_{\rm{t}}}}}{{{C_0}}} \times 100{\rm{\% }} $ | (1) |
表 1为形成CdS-PAM杂化粒子过程中的粒径及其分布数据,图 1为形成CdS-PAM杂化粒子过程中的粒径和粒径分布图。
|
|
表 1 不同反应温度和时间形成CdS-PAM杂化粒子的粒径及其分布(PDI) Table 1 Size and distribution (PDI) of CdS-PAM hybrid particles obtained with different reaction temperatures and times |
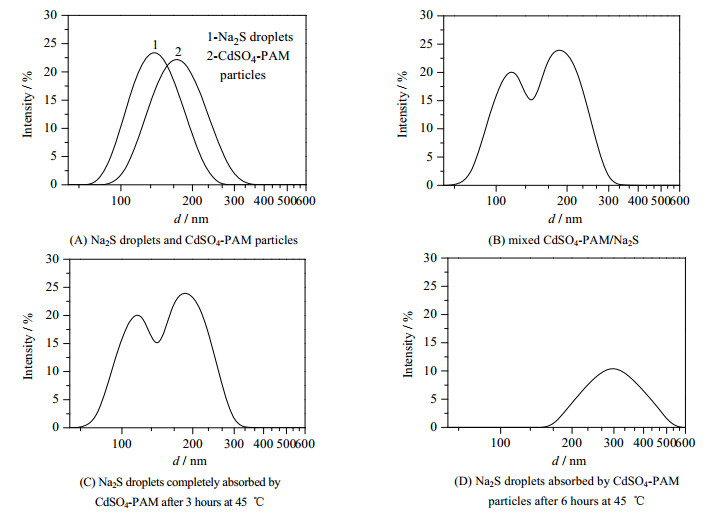
|
图 1 CdS-PAM杂化粒子形成过程中粒径分布图 Fig.1 Size distribution of CdS-PAM particles during formation processes |
由表 1和图 1(A)可知,CdSO4-PAM乳胶粒子的Z均粒径为167.9 nm,PDI为0.04;Na2S液滴的Z均粒径为139.3 nm,PDI为0.03;如图 1(B),当在25 ℃下,CdSO4-PAM粒子和Na2S液滴刚开始混合时,CdS-PAM杂化粒子的粒径分布图中出现双峰,说明此时Na2S液滴基本没有被乳胶粒子吸收;当在25 ℃下经过3 h,CdS-PAM杂化粒子的粒径分布图中仍然出现双峰,说明CdSO4-PAM乳胶粒子没有进一步吸收Na2S液滴。由这两组数据证明了在25 ℃下,随着时间的增加,CdSO4-PAM乳胶粒子吸收Na2S液滴程度基本不变。
如图 1(C)所示,由45 ℃经过3 h,CdSO4-PAM粒子的粒径分布图中双峰消失,出现单峰,粒径减小为188.6 nm,PDI为0.07,粒径分布较窄,说明45 ℃温度CdSO4-PAM乳胶粒子完全吸收了Na2S液滴。在45 ℃经过6 h,粒径增大为303.0 nm,PDI增大为0.36,可能形成的CdS-PAM杂化粒子形成部分凝并(图 1(D))。由于45 ℃条件水相在环己烷溶解度提高[10],稳定的CdSO4-PAM乳胶粒子会逐渐通过油相吸收Na2S液滴,液滴逐渐变小,最后得到稳定的CdS-PAM反相细乳液。以下制备CdS-PAM反相细乳液实验均采用45 ℃吸收3 h的条件。
图 2为经典配方(表 2,Exp No. 3)制备得到的CdSO4-PAM和CdS-PAM粒子TEM图。

|
图 2 CdSO4-PAM粒子和CdS-PAM杂化粒子的TEM图 Fig.2 TEM micrographs of CdSO4-PAM and CdS-PAM hybrid particles |
|
|
表 2 不同硫酸镉/硫化钠用量对形成CdSO4-PAM和CdS-PAM粒径和分布数据 Table 2 Size and distribution of CdSO4-PAM and CdS-PAM particles obtained with different CdSO4 and Na2S hydrate amounts |
图 2(A)为CdSO4-PAM乳胶粒子的TEM图,CdSO4-PAM乳胶粒子粒径150 nm左右,比DLS数据略有缩小,可能和TEM制样和测试条件有关;图 2(B)为CdS-PAM杂化粒子,由图可知CdS包容在PAM乳胶粒子中,右上角小图为HRTEM图,图中硫化镉颗粒均匀,粒径小于2 nm。
3.2 水合硫酸镉/硫化钠用量对形成CdS-PAM杂化粒子的影响表 2为不同水合硫酸镉/硫化钠用量对形成CdSO4-PAM和CdS-PAM粒子粒径和分布的数据。
由表 2可知,当水合CdSO4/Na2S用量在0.200 g/0.187 g时,NT(f)/ NT(p)约等于1,聚合前后粒子数目基本不变,证明Na2S基本被CdSO4-PAM乳胶粒子所吸收。当水合CdSO4/Na2S用量在0.500 g/0.468 g时,PDI逐渐增大,甚至出现双峰。说明随着硫酸镉用量的增加,对Na2S液滴的吸收逐渐减弱,导致吸收不完全。这是由于随着水合CdSO4/Na2S用量增加,导致分散相渗透压变大,CdSO4-PAM乳胶粒子和Na2S液滴稳定性提高,CdSO4-PAM乳胶粒子吸收Na2S液滴存在障碍。
3.3 水合CdSO4/Na2S用量对CdS-PAM杂化粒子形貌的影响图 3为Exp No. 4制备CdS-PAM样品对应TEM图。

|
图 3 由Exp No.4形成的CdS-PAM杂化粒子TEM图 Fig.3 TEM micrograph of CdS-PAM hybrid particles obtained from Exp No.4 |
当水合CdSO4/Na2S用量增加到0.200 g/0.187 g(Exp No. 4)时,由图 3可以看出乳胶粒子包容的CdS颗粒尺寸明显增大,达到了10 nm左右,且颗粒分散性变差。
3.4 硫化镉纳米颗粒XRD和能谱(EDS)表征图 4为Exp No. 3形成的硫化镉颗粒XRD图。
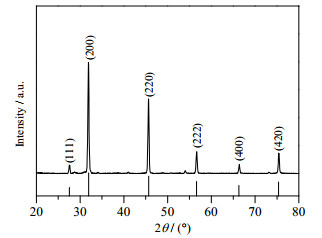
|
图 4 硫化镉晶体的XRD图 Fig.4 XRD pattern of CdS crystal |
由图 4可知,在27.5°、31.9°、45.6°、56.6°、66.4°和75.4°处出现明显的特征衍射峰,与硫化镉标准卡PDF-65-8873的特征衍射峰位置相一致,从而证明制备的为硫化镉晶体。这些特征衍射峰分别与硫化镉的(111)、(200)、(220)、(222)、(400)、(420)六个晶面相对应,说明制备的样品为立方晶型。图中除硫化镉的衍射峰外,没有出现其他的衍射峰,因此制备的样品比较纯。所得的衍射图谱中特征衍射峰强而且尖锐,表明硫化镉的结晶性较好且晶粒生长完整。
图 5为Exp No. 3形成的CdS-PAM杂化粒子的EDS图,表 3为Exp No. 3形成的CdS-PAM杂化粒子的EDS中各元素含量数据表。
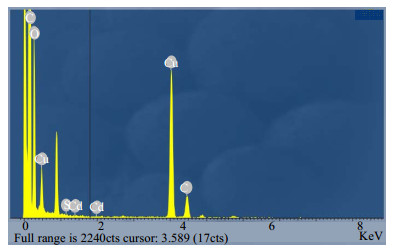
|
图 5 CdS-PAM杂化粒子的EDS Fig.5 EDS profile of CdS-PAM hybrid particles |
|
|
表 3 CdS-PAM杂化粒子的EDS中各元素含量 Table 3 Elemental contents of CdS-PAM hybrid particles |
由图 5和表 3可知,样品中Cd和S的原子表为1:1,符合硫化镉分子中Cd和S的原子比,并且所占的百分比都为0.01,所占的比例都很小,说明制备出的样品为硫化镉纳米颗粒。而其中C元素可能来源于铜网上的碳膜以及PAM微球,O元素可能来源于铜网上残余的乙醇溶剂和PAM微球,N元素则来源于PAM微球,Cu元素则可能来源于铜网,相对来说所占的百分含量比较多。图谱中并未出现其他的杂峰,说明制备的样品比较纯。
3.5 CdS-PAM杂化粒子的光催化性能图 6(A)和(B)为Exp No. 3形成的CdS-PAM杂化粒子加入亚甲基蓝溶液后,经钨灯照射,亚甲基蓝溶液紫外光谱图和光降解图。
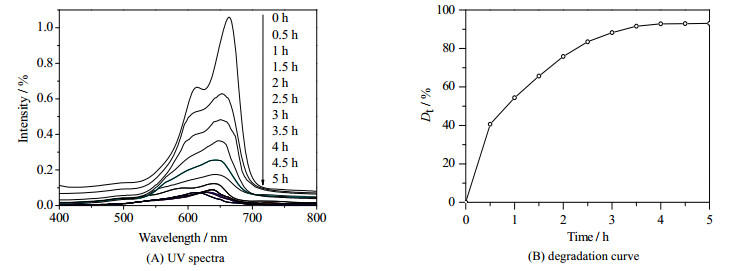
|
图 6 加入硫化镉的亚甲基蓝溶液的紫外光谱图和降解率曲线 Fig.6 UV spectra and degradation curve of CdS-PAM solutions containing methylthionine chloride |
由图 6(A)可知,亚甲基蓝溶液的吸收强度逐渐减小,初始的吸收强度为1.000,而经过5 h后,吸收强度减小为0.074,亚甲基蓝基本降解,由降解率曲线图 6(B)可知,在反应的前3 h内,降解率曲线比较陡峭,在这段期间亚甲基蓝溶液的降解率变化十分明显,在3 h后,降解率曲线基本趋于平缓,说明降解率缓慢增大,最终达到最大值93.0%,说明制备的CdS-PAM杂化粒子具有较好的光催化性能。
4 结论通过反相细乳液法制备了CdS-PAM杂化纳米粒子。在常温下,随着时间的增加,CdSO4-PAM乳胶粒子吸收Na2S液滴程度基本不变;而温度升高更加有利于CdSO4-PAM乳胶粒子吸收Na2S液滴,最终形成CdS-PAM杂化粒子。随着水合CdSO4/Na2S用量增加,得到的CdS-PAM杂化粒子粒径逐渐减小,CdSO4-PAM乳胶粒子对Na2S液滴吸收更加困难。以0.100 g/0.094 g水合CdSO4/Na2S制备的CdS-PAM杂化粒子具有较好的光催化性能,光降解率可达到93.0%。
符号说明:
|
|
| [1] |
蔡亚平, 李卫, 冯良桓, 等. 化学水浴法制备大面积CdS薄膜及其光伏应用[J]. 物理学报, 2009, 58(1): 438-443. CAI Y P, LI W, FENG L H, et al. Preparation of large area CdS thin film and its application in photovoltaic cells[J]. Acta Physica Sinica, 2009, 58(1): 438-443. DOI:10.3321/j.issn:1000-3290.2009.01.068 |
| [2] |
GARG P, KUMAR S, CHOUDHURI I, et al. Hexagonal planar CdS monolayer sheet for visible light photocatalysis[J]. Journal of Chemical Physics, 2016, 120(13): 7052-7060. |
| [3] |
QIAN X, QIN D, BAI Y, et al. Photosensitization of TiO2 nanoparticulate thin film eletrodes by CdS nanoparticles[J]. Journal of Solid State Electrochemistry, 2001, 5(7-8): 562-567. DOI:10.1007/s100080000179 |
| [4] |
陈旭东, 王新波, 范莉, 等. CdS纳米晶与多肤分子相互作用研究[J]. 化学学报, 2005, 63(17): 1600-1606. CHEN X D, WANG X B, FAN L, et al. Investigation on interaction between CdS nanocrystals and peptides[J]. Acta Chimica Sinica, 2005, 63(17): 1600-1606. DOI:10.3321/j.issn:0567-7351.2005.17.010 |
| [5] |
CHEN R R, HAN B, YANG L. Cotrollable synthesis and characterization of CdS quantum dots by a microemulsion-mediated hydrothermal method[J]. Journal of Luminescence, 2016, 172: 197-200. DOI:10.1016/j.jlumin.2015.12.006 |
| [6] |
ZERAATI A S, MIRKHANI S A, SUNDARARAJ U. Enhanced dielectric performance of polymer nanocomposites based on CNT/MnO2 nanowire hybrid nanostructure[J]. Journal of Physical Chemistry C, 2017, 121(15): 8327-8334. DOI:10.1021/acs.jpcc.7b01539 |
| [7] |
HAY J N, RAVAL H M. Synthesis of organic-inorganic hybrids via the non-hydrolytic sol-gel process[J]. Chemistry of Materials, 2001, 13(10): 1-10. |
| [8] |
CAO Z H, CHEN Q, CHEN H N, et al. Preparation of polymeric/inorganic nanocomposite particles in miniemulsions:l. Particle formation mechanism in systems stabilized with sodium dodecyl sulfate[J]. Colloids & Surfaces A:Physicochemical & Engineering Aspects, 2017, 516: 199-210. |
| [9] |
ZHANG Z Q, XIE B, DING J N, et al. Preparation of CdFe2O4-polymeric nanoparticles by inverse miniemulsion and its film properties[J]. Colloids & Surfaces A:Physicochemical and Engineering Aspects, 2016, 495: 100-109. |
| [10] |
MARCHE C, FERRONATO C, HEMPTINNE J C D, et al. Apparatus for the determination of water solubility in hydrocarbon:toluene and alkylcyclohexanes (C6 to C8) from 30 to 180℃[J]. Journal of Chemical & Engineering Data, 2006, 51(2): 355-359. |




