2. 北京食品营养与人类健康高精尖创新中心,北京 100193
2. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology and Business University, Beijing 100193, China
中国白酒的历史可追溯至6 000年前,是世界上最早的蒸馏酒之一[1]。虽然西方人认为中国白酒是“东方伏特加”,但与伏特加酒这种几乎由水和乙醇勾兑而成的酒不同,传统的中国白酒经固态发酵而得,含有超过1 000种的微量成分,包括有机酸、多酚、萜烯、吡嗪和硫化物等[2],其中很多具有较高的生物活性。
随着人们对健康越来越重视,饮酒对人体健康的损伤研究逐渐成为热点。西方的流行病学研究表明,长期大量饮用伏特加酒对人体造成了极大的伤害。2014年,《Lancet》的报道跟踪了俄罗斯15.1万成年人的饮酒状况。结果发现,对于35–54岁年龄段的人,每周饮用1.5 L以上时20年死亡风险为35%,远高于每周饮用小于0.5 L人群的死亡风险(16 %) [3],且大部分死于乙醇导致的肝损伤、心血管病和癌症等[3]。大量饮用伏特加酒导致俄罗斯男子的寿命极低,2009年其男子平均寿命只有62.8岁,约1/4在55岁之前死亡[4]。而对于中国白酒,鲜有其严重危害健康的报道。1993年,贵州遵义医院对每天饮茅台酒250 g、酒龄超过10年的40余名茅台酒厂职工进行专项体检,其中包括饮酒长达37年的数名职工,发现无一因饮酒而影响肝功能,之后8年随访仍未发现肝脏问题[5]。易旭等[6]发现适量饮用中国白酒的大鼠能够抵抗乙醇与二乙基亚硝胺的协同作用,显著减轻肝脏病变。刘银等[7]通过大鼠白酒灌服实验,发现适量中国白酒对脂肪代谢有一定改善作用。此外,近年来的研究发现竹叶青酒能提高小鼠的免疫功能和抗氧化水平[8],具有保肝功能[9]。然而,这些研究有的样本数少,有的采用的剂量小且作用时间短,均难以科学地阐释中国白酒的健康性。
与传统的贴壁培养相比,三维培养的人源性肝细胞能够更加准确地模拟肝脏微环境,肝功能表达更高,因此对乙醇的刺激响应更加接近人体肝脏[10-13]。其中,聚球体是三维培养中组织化程度较高的形式之一。与三维灌流培养、生物反应器等复杂的培养方式相比,肝细胞聚球体的实验周期短,所需的细胞数量较少,实验平行性更好,更适合于外源物(包括中国白酒)的高效评价[14]。因此,本文实验采用人肝癌细胞和人肝星形细胞共培养,形成肝细胞聚球体,用于评价4种中国白酒和2种伏特加酒对肝细胞活性和功能的影响情况。该研究方法避免了动物实验引起的伦理和种属差异问题,有望成为评价中国白酒健康特性的新工具。
2 材料与方法 2.1 材料与试剂中国白酒和伏特加酒样由北京工商大学惠赠。酒样信息如下:一号中国白酒(CL1)产地安徽亳州,为浓香型白酒;二号中国白酒(CL2)产地山东淄博,为芝麻香型白酒;三号中国白酒(CL3)产地四川泸州,为浓香型白酒;四号中国白酒(CL4)产地四川泸州,为浓香型白酒;一号伏特加(Vodka1)和二号伏特加(Vodka2)分别出产于波兰和瑞典。
普朗尼克F127、丙烯酰氯、双氢罗丹明123、四甲基偶氮唑蓝(MTT),美国sigma公司;胎牛血清、二甲亚砜、磷酸缓冲液(PBS)、DMEM培养基、双抗,美国Thermo Fisher公司;艳固佳259,瑞士汽巴公司;乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒,宁波赛克生物技术有限公司;尿素测试盒(二乙酰肟比色法),南京建成生物工程研究所;人白蛋白酶联免疫试剂盒,美国Bethyl Laboratories公司;牛跟腱胶原,无锡贝迪生物工程有限公司;其余药品与试剂均为国产分析纯。
2.2 主要仪器与设备二氧化碳细胞培养箱(Thermo Forma 3111),美国Thermo Fisher公司;酶标仪(SpectraMax M3),美国美谷分子公司;岛津气相色谱仪GC-2010,日本岛津公司;氧化还原电极LE-501,瑞士Mettler Toledo公司。
2.3 方法 2.3.1 三维组织化肝细胞模型的建立双丙烯酰化普朗尼克F127(F127-DA)的制备参照文献[15]。接枝率超过90%的F127-DA用于后续实验。取一定量的F127-DA单体,溶解于水中,加入一定量的光引发剂,然后置于3D打印的模板中,在紫外光中照射15 min后,取出水凝胶(1 cm×1 cm×0.4 cm,上有直径和深度均为1 mm的正六边形孔阵列),将其置于去离子水中,以除去其中未反应的单体和其他杂质。在后续细胞操作前,进行灭菌使用。
人肝癌细胞系(human hepatocellular carcinoma cell line, HepG2)和人肝星形细胞(human hepatic stellate cell line, LX-2)于含体积分数10%胎牛血清的DMEM培养液中进行常规传代培养,培养箱温度37 ℃,CO2体积分数为5%。取对数生长期细胞,将人肝癌细胞HepG2和人肝星形LX-2以3:1的比例接种于F127-DA水凝胶中,使细胞密度为4×106个/水凝胶,置于24孔板,在质量浓度为40 μg·mL-1牛跟腱胶原的DMEM培养液中培养。培养48 h后,换入含酒样的培养液,根据不同酒样本身的乙醇含量,调整最终培养液的乙醇浓度均为700 mmol·L-1),pH均调整为7.4。实验采用乙醇浓度的确定基于3D体外培养聚球体的细胞耐受度远远高于2D培养和体内环境的研究[21]。阴性对照组和乙醇、酒样组分别置于2块24孔板中,密封防止乙醇挥发,放置培养箱中温育48 h。
2.3.2 酒样的乙醇浓度、抗氧化活性和氧化还原电位的测定采用气相色谱测定酒样的乙醇浓度。气相色谱条件:进样口温度220 ℃,载气为He,流速0.5 mL·min-1,分流比37:1,进样量0.8 μL;色谱柱:DB-WAXETR(30 m×0.25 mm×0.25 μm);色谱柱升温程序:初始温度60 ℃,恒温3 min,以3.5 ℃·min-1升温至100 ℃,恒温2 min,以20 ℃·min-1升温至180 ℃,恒温3 min。
采用福林酚法测定酒样中多酚类物质的质量浓度(total phenols content, TPC)。具体方法参考文献[16],以没食子酸作为标样制作标准曲线,抗氧化活性用没食子酸当量(gallic acid equivalent, GAE)表示。
采用氧化还原电极测定酒样的氧化还原电位(oxidation-reduction potential, ORP)。
2.3.3 酒样对三维培养肝细胞的效果评价酒样对肝细胞活率的影响:采用MTT和LDH法测定肝细胞活率,具体操作方法按试剂盒说明进书行。
肝细胞分泌白蛋白和尿素的测定:收集酒样处理后的培养基,离心取上清液。采用ELISA试剂盒测定培养基白蛋白浓度,采用二乙酰一肟法测定尿素浓度。具体操作方法按试剂盒说明书进行。
细胞内氧自由基(reactive oxygen species,ROS)水平的检测:采用双氢罗丹明123染料检测肝细胞聚球体内ROS。将聚球体从水凝胶芯片中轻轻吹打出,迅速置于双氢罗丹明123浓度为10 μmol·L-1的PBS中,37 ℃温育30 min。PBS溶液洗涤细胞3次后,用荧光酶标仪读取荧光值,激发波长为488 nm,发射波长为535 nm。
2.4 统计学处理所有实验重复3次,每次实验设置3个平行样。用SPSS 17.0软件对数据进行结果统计分析,以P < 0.05表示结果有显著性差异。
3 结果 3.1 不同酒样对肝细胞聚球体形态和活率的影响将人肝癌细胞和肝星形细胞共培养48 h后,细胞在水凝胶芯片中形成聚球体。从图 1(a)中可以看出,2种细胞形成的肝聚球体边缘光滑,大小均一(直径约为500 μm)。酒样和乙醇处理48 h后,肝细胞聚球体略有松散,球体边缘变得粗糙,可见部分细胞散落,而中国白酒组和伏特加酒组之间肝聚球体形态没有明显区别(图 1c~i)。此外,阴性对照组的肝细胞聚球体形态基本没有发生变化(图 1(b))。

|
图 1 不同酒样对肝细胞聚球体形态的影响 Fig.1 Effects of different liquors on morphology of hepatic spheroids |
乙醇和酒样处理组聚球体的细胞活率由LDH漏出率和MTT代谢率表示。图 2中,a表示与阴性对照组相比有显著性差异(P < 0.05,下同)。从图 2(a)节可以看到,与阴性对照组相比,乙醇和酒样引起了显著的LDH泄漏,且其漏出率之间没有明显差异,均约为25%。MTT法测定结果与LDH漏出率的结果比较一致(图 2(b)),乙醇和酒样组的MTT值均比阴性对照组有显著的降低,且酒样组之间没有显著差异。该结果说明,乙醇、中国白酒和伏特加酒都导致了肝细胞聚球体活率的降低,其毒性差异不明显。
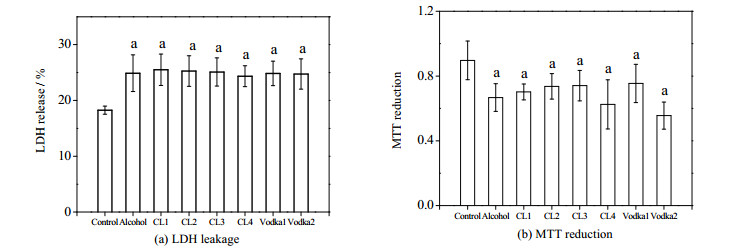
|
图 2 不同酒样对肝细胞聚球体活率的影响 Fig.2 Effects of various liquors on cell viability of hepatic spheroids |
图 3为不同酒样对肝细胞聚球体功能表达的影响,图 3中,b表示与乙醇组相比差异显著(P < 0.05,下同)。如图 3(a)所示,与阴性对照组相比,酒样处理后的肝细胞白蛋白分泌显著下降,但程度不同。CL1和CL3处理组的白蛋白质量浓度最高,分别高于乙醇组26.4 %和24.7 %。而2种伏特加酒处理组的白蛋白质量浓度为871.15和762.52 ng·mL-1)与乙醇组(827.19 ng·mL-1)没有明显区别。
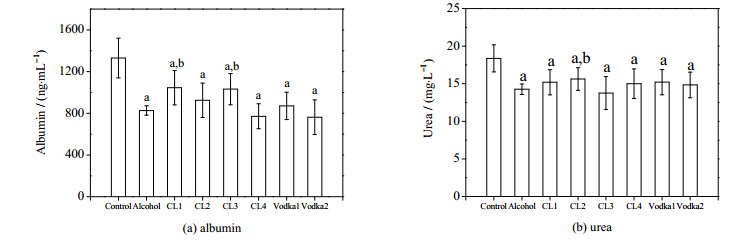
|
图 3 不同酒样对肝细胞聚球体功能表达的影响 Fig.3 Effects of various liquors on functions of hepatic spheroids |
由图 3(b)可知,各种酒样均导致肝细胞的尿素质量浓度显著降低,其中CL2处理组的尿素质量浓度最高,为15.6 mg·L-1,明显高于乙醇组(14.3 mg·L-1)。
3.3 不同酒样对肝细胞聚球体ROS含量的影响如图 4所示,与阴性对照组相比,乙醇、中国白酒和伏特加酒处理48 h显著增加了细胞内的ROS,其中,乙醇组和伏特加酒组的ROS的荧光强度增加了40%以上。而CL1和CL4处理组的ROS最低,测得荧光强度分别比乙醇组低15.6 %和28.1 %。

|
图 4 不同酒样对肝细胞聚球体胞内ROS水平的影响 Fig.4 Effects of various liquors on ROS expression of hepatic spheroids |
如表 1所示为中国白酒和伏特加的酒的性质参数,表 1中,
|
|
表 1 中国白酒和伏特加酒的性质参数 Table 1 Parameters of Chinese liquors and Vodkas |
众所周知,乙醇具有显著的肝脏毒性。乙醇被摄入人体后,90%由肝脏代谢,并诱导产生大量氧自由基,引起肝细胞膜的脂质过氧化,从而导致丙二醛(MDA)含量的升高以及还原性谷胱甘肽(GSH)的下降[17-19]。乙醇也会引起肝功能的损伤[20-21],例如导致重要的肝细胞合成功能——尿素和白蛋白分泌量的下降[22]。最终,乙醇导致了肝细胞的自噬和凋亡[23]。采用构建的肝细胞聚球体模型,本研究也类似的观察到了乙醇对肝细胞活率、氧自由基和功能的影响。
本研究发现,伏特加酒对肝细胞的毒性作用与乙醇没有差别。这是因为伏特加酒中的非酒精成分很少,主要是杂醇油和乙酸等无生物活性的成分[34]。而中国白酒对肝细胞的毒性比乙醇小,推测与其丰富的微量成分有关(占乙醇含量的1 %~2.5 %)。根据已有报道,这些微量成分包括萜烯类化合物,呋喃类、吡嗪类、有机酸类和酚类等挥发性化合物,以及氨基酸和多肽等非挥发性化合物[24-29]。它们具有抗氧化性[24-25]和保护肝功能等作用[27-29],因此削弱了乙醇本身导致的肝细胞损伤。近年来,一些中国学者提出了“中国白酒不是烈酒(liquor)”的观点[30, 33],本文的研究结果有力地支持了该观点。
此外,不同类型中国白酒对肝细胞的作用也存在区别,这可能是因为其微量成分的种类和含量有所区别[33]。CL1和CL4这2种中国白酒的抗氧化活性更强,可能含有相对较多的愈创木酚、没食子酸、麦芽酚和其他抗氧化成分(如亚油酸和亚麻酸)等[31],从而降低了ROS的生成(见图 4)。杨涛等[32]发现中国白酒中含有的四甲基吡嗪(TTMP)对急性肝损伤有保护作用。浓香型白酒(CL1和CL3)中的吡嗪含量高于芝麻香型白酒(CL2)[2],这解释了其缓解乙醇引起肝功能损伤的效果,使其白蛋白分泌量较乙醇处理组高(如图 3(a))。
5 结论本研究采用人肝癌细胞系和人肝星形细胞系共培养,构建了三维培养的肝细胞聚球体。将其用于评价4种中国白酒和2种伏特加酒对肝细胞的作用,结果发现,2种中国白酒(CL1和CL4)抑制了乙醇引起的氧自由基升高, 所测荧光强度分别比乙醇组低15.6 %和28.1 %;而3种中国白酒(CL1、CL2和CL3)导致的肝功能损伤较乙醇处理组小,CL1和CL3组肝白蛋白质量浓度分别比乙醇组高26.4 %和24.7 %,CL2组尿素质量浓度为15.6 mg·L-1,高于乙醇组(14.3 mg·L-1)。其较小的肝毒性可能与其含有的酚类、吡嗪类、萜烯类和活性肽类等丰富的生物活性成分有关。相比而言,伏特加酒与乙醇对肝细胞的毒性没有显著差别,说明其不具有减小乙醇肝损伤的功能。本文建立的研究方法为中国白酒的健康特性评价提供了一种有效的手段,有助于中国白酒产业的健康化发展。
| [1] |
YAO F, YI B, SHEN C, et al. Chemical analysis of the chinese liquor luzhoulaojiao by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J]. Science Report, 2015, 5: 9553-9558. DOI:10.1038/srep09553 |
| [2] |
徐岩, 范文来, 葛向阳, 等. 科学认识中国白酒中的生物活性成分[J]. 酿酒科技, 2013(9): 1-6. XU Y, FAN W L, GE X Y, et al. Scientific recognition of biofunctional components in Chinese liquors[J]. Liquor-Making Science & Technology, 2013(9): 1-6. |
| [3] |
ZARIDZE D, LEWINGTON S, BORODA A, et al. Alcohol and mortality in Russia: prospective observational study of 151 000 adults[J]. Lancet, 2014, 383(9927): 1465-1473. DOI:10.1016/S0140-6736(13)62247-3 |
| [4] |
TOMKINS S, COLLIER T, ORALOV A, et al. Hazardous alcohol consumption is a major factor in male premature mortality in a typical russian city: prospective cohort study 2003–2009[J]. Plos One, 2012, 7(2): e30274-e30279. DOI:10.1371/journal.pone.0030274 |
| [5] |
邹海晏, 梁明锋, 郝欣. 白酒, 经常适量饮用增进健康——为发展原生态酱香型酒鼓与呼[J]. 酿酒, 2008, 35(6): 32-34. ZOU H Y, LIANG M F, HAO X. Appropriate liquor drinking being benefit for health:encouragement for the development of the original ecological maotai-flavor Liquor[J]. Liquor-Making, 2008, 35(6): 32-34. |
| [6] |
易旭, 程明亮, 赵雪珂, 等. 蒸馏白酒对二乙基亚硝胺引发小鼠肝细胞超微结构及金属硫蛋白表达的影响[J]. 广东医学, 2016, 37(z1): 5-8. YI X, CHENG M L, ZHAO X K, et al. Effects of distilled liquor on the ultrastructure and expression of metallothionein in mouse hepatocytes induced by diethylnitrosamine[J]. Guangdong Medical Journal, 2016, 37(z1): 5-8. |
| [7] |
刘银, 周玲旭, 杨官荣, 等. 白酒对大鼠血脂及脂代谢关键酶影响的研究[J]. 现代预防医学, 2017, 44(22): 125-129. LIU Y, ZHOU L X, YANG G R, et al. Effect of liquors on serum lipid and key enzymes in lipid metabolism of rats[J]. Modern Preventive Medicine, 2017, 44(22): 125-129. |
| [8] |
GAO H Y, LI G Y, HUANG J, et al. Protective effects of Zhuyeqing liquor on the immune function of normal and immunosuppressed mice in vivo[J]. Bmc Complementary & Alternative Medicine, 2013, 13(1): 252-258. |
| [9] |
GAO H Y, HUANG J, WANG H Y, et al. Protective effect of Zhuyeqing liquor, a Chinese traditional health liquor, on acute alcohol-induced liver injury in mice[J]. Journal of Inflammation, 2013, 10(1): 30-30. |
| [10] |
ROGOZHNIKOV D, O'BRIEN P J, ELAHIPANAH S, et al. Scaffold free bio-orthogonal assembly of 3-dimensional cardiac tissue via cell surface engineering[J]. Science Report, 2016, 6: 39806-39816. DOI:10.1038/srep39806 |
| [11] |
WELLS R G. The role of matrix stiffness in regulating cell behavior[J]. Hepatology, 2010, 47(4): 1394-1400. |
| [12] |
GÓMEZ-LECHÓN M J, JOVER R, DONATO T, et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix[J]. Journal of Cellular Physiology, 1998, 177(4): 553-562. DOI:10.1002/(SICI)1097-4652(199812)177:4<553::AID-JCP6>3.0.CO;2-F |
| [13] |
SEMLER E J, RANUCCI C S, MOGHE P V. Mechanochemical manipulation of hepatocyte aggregation can selectively induce or repress liver-specific function[J]. Biotechnology & Bioengineering, 2000, 69(4): 359-369. |
| [14] |
GODOY P, HEWITT N J, ALBRECHT U, et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME[J]. Archives of Toxicology, 2013, 87(8): 1315-1530. DOI:10.1007/s00204-013-1078-5 |
| [15] |
SOSNIK A, COHN D, SAN R J, et al. Crosslinkable PEO-PPO-PEO-based reverse thermo-responsive gels as potentially injectable materials[J]. Journal of Biomaterials Science, Polymer Edition, 2003, 14(3): 227-239. DOI:10.1163/156856203763572680 |
| [16] |
闫永芳, 孙钧, 孟天真, 等. 枇杷花提取物抗氧化活性研究[J]. 食品工业科技, 2012(1): 122-124. YAN Y F, SUN J, MENG T Z, et al. Antioxidant capacities of loquat flower extracts using different solvents[J]. Science and Technology of Food Industry, 2012(1): 122-124. |
| [17] |
ADDOLORATO G. Effects of short-term moderate alcohol administration on oxidative stress and nutritional status in healthy males[J]. Appetite, 2008, 50(1): 50-56. DOI:10.1016/j.appet.2007.05.008 |
| [18] |
LIEBER C S. Metabolism of alcohol[J]. Clinics in Liver Disease, 2005, 9(1): 1-35. DOI:10.1016/j.cld.2004.10.005 |
| [19] |
DEY A, CEDERBAUM A I. Alcohol and oxidative liver injury[J]. Hepatology, 2010, 43(S1): S63-S74. |
| [20] |
郭健, 蒋琳. 尿素测定的方法学进展和临床应用[J]. 中华检验医学杂志, 2008, 31(6): 717-720. GUO J, JIANG L. Methodological progress and clinical application of urea determination[J]. Chinese Journal of Laboratory Medicine, 2008, 31(6): 717-720. DOI:10.3321/j.issn:1009-9158.2008.06.033 |
| [21] |
LEE J, CHOI B, NO D Y, et al. A 3D alcoholic liver disease model on a chip[J]. Integrative Biology Quantitative Biosciences from Nano to Macro, 2016, 8(3): 302-308. DOI:10.1039/C5IB00298B |
| [22] |
杨波, 刘宝林, 沈力. 两种体外人肝细胞的不同培养方式的比较研究[J]. 中国生物医学工程学报, 2012, 31(6): 941-945. YANG B, LIU B L, SHEN L. Comparison of two different in vitro primary human hepatocytes culture[J]. Chinese Journal of Biomedical Engineering, 2012, 31(6): 941-945. DOI:10.3969/j.issn.0258-8021.2012.06.020 |
| [23] |
POTZ B A, LAWANDY I J, Clements R T, et al. Alcohol modulates autophagy and apoptosis in pig liver tissue[J]. Journal of Surgical Research, 2016, 203(1): 154-162. DOI:10.1016/j.jss.2016.03.009 |
| [24] |
ZHAO D, SUN J, SUN B, et al. Intracellular antioxidant effect of vanillin, 4-methylguaiacol and 4-ethylguaiacol: three components in Chinese Baijiu[J]. Rsc Advances, 2017, 7(73): 46395-46405. DOI:10.1039/C7RA09302K |
| [25] |
WU J, HUO J, HUANG M, et al. Structural characterization of a tetrapeptide from Sesame flavor-type Baijiu and its preventive effects against AAPH-induced oxidative stress in HepG2 cells[J]. Journal of Agricultural & Food Chemistry, 2017, 65(48): 10495-10504. |
| [26] |
郅岩, 吴群, 徐岩. 传统白酒中生物活性物质脂肽类化合物及其产生机制[J]. 酿酒技, 2017(10): 17-23. ZHI Y, WU Q, XU Y. Identification and formation mechanism of lipopeptides in Baijiu[J]. Liquor-Making Science & Technology, 2017(10): 17-23. |
| [27] |
范文来, 徐岩. 白酒中重要的功能化合物萜烯综述[J]. 酿酒, 2013(6): 11-16. FAN W L, XU Y. Review of important functional compounds terpenes in Baijiu (Chinese liquor)[J]. Liquor Making, 2013(6): 11-16. DOI:10.3969/j.issn.1002-8110.2013.06.008 |
| [28] |
徐占成, 唐清兰, 徐姿静. 利用现代科技揭秘剑南春中有益于人体健康的生理活性物质[J]. 酿酒科技, 2010(1): 121-123. XU Z C, TANG Q L, XU Z J. The use of modern techniques to reveal bioactive substances in jian'nanchun liquor helpful for peoples' health[J]. Liquor-Making Science & Technology, 2010(1): 121-123. |
| [29] |
张治刚, 王永亮. 白酒健康与健康白酒综述[J]. 中国酿造, 2017, 36(5): 13-16. ZHANG Z G, WANG Y L. Review of Baijiu health and healthy Baijiu[J]. China Brewing, 2017, 36(5): 13-16. |
| [30] |
孙宝国, 李贺贺, 胡萧梅, 等. 健康白酒的发展趋势[J]. 中国食品学报, 2016, 16(8): 1-6. SUN B G, LI H H, HU X M, et al. The development trend of healthy Baijiu[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(8): 1-6. |
| [31] |
霍嘉颖, 黄明泉, 孙宝国, 等. 中国白酒中功能因子研究进展[J]. 酿酒科技, 2017(9): 17-23. HUO J Y, HUANG M Q, SUN B G, et al. Research progress in functional factors in Baijiu[J]. Liquor-Making Science & Technology, 2017(9): 17-23. |
| [32] |
杨涛, 李国友, 吴林蔚, 等. 中国白酒健康因子的研究及其产生菌选育和在生产中的应用(Ⅰ)中国白酒健康因子的研究[J]. 酿酒科技, 2010(12): 65-69. YANG T, LI G Y, WU L W, et al. Research on health factor in liquor & breeding of health factor-producing bacteria and its application in liquor production(Ⅰ) Research on health factors in Chinese liquor[J]. Liquor-Making Science & Technology, 2010(12): 65-69. |
| [33] |
LIU H, SUN B. Effect of fermentation processing on the flavor of Baijiu[J]. Journal of Agricultural & Food Chemistry, 2018, 66(22): 5425-5432. |
| [34] |
NG L K, HUPÉ MICHEL, HARNOIS J, et al. Characterisation of commercial vodkas by solid-phase microextraction and gas chromatography/mass spectrometry analysis[J]. Journal of the Science of Food and Agriculture, 1996, 70(3): 380-388. DOI:10.1002/(SICI)1097-0010(199603)70:3<380::AID-JSFA517>3.0.CO;2-M |




