2. 重庆化工职业学院,重庆 401220;
3. 国家消防及阻燃产品质量监督检验中心(重庆),重庆 401121;
4. 长江师范学院 化学化工学院,重庆 408100
2. School of Chemistry and Chemical Engineering, Chongqing Chemical Industry Vocational College, Chongqing 401220, China;
3. National Fire and Flame Retardant Product Quality Supervision and Inspection Center(Chongqing), Chongqing 401121, China;
4. School of Chemistry and Chemical Engineering, Yangtze Normal University, Chongqing 408100, China
2, 4-二氨基甲苯(2, 4-TDA)又名甲苯二胺,是合成甲苯二异氰酸酯(TDI)的重要原料[1-2],也是一种应用广泛的化学中间体。二硝基甲苯(2, 4-DNT)液相加氢是2, 4-TDA最常用的合成方法[3-13],最常用的催化剂有Pd/C、Pt/C、雷尼镍等。本文采用的2, 4-TDA制备方法在液相法的基础上对于溶剂的选择进行了改进,同时也对研究所用催化剂进行了优选。使用浸渍沉淀法制备负载型Ni/HY催化剂[14-15],该催化剂价格低廉、稳定性较高,对2, 4-DNT加氢制2, 4-TDA反应的催化活性更高。此外,由于质子溶剂和反应物,中间产物以及目的产物有较强的氢键相互作用,可以极化以及活化N=O,而且有助于产物从催化剂表面脱附,并且2, 4-DNT在极性质子型溶剂中加氢的表现最好,提出选用乙醇作为溶剂。在负载型催化剂与乙醇溶剂的反应条件下,考察了搅拌速度、温度、氢气压力对工艺条件对2, 4-DNT的转化率和2, 4-TDA产率的影响。并研究反应的本征动力学,拟合确定动力学模型中的反应动力学参数,计算得到反应活化能和反应的吸附热。
2 实验部分 2.1 化学试剂与反应原料高纯氢气和高纯氮气,重庆群力气体有限公司;HY分子筛,工业级,南开大学催化剂厂;2, 4-二硝基甲苯,化学纯,阿拉丁试剂公司;无水乙醇,分析纯,重庆川东化工(集团)有限公司。
2.2 催化剂制备Ni/HY催化剂采用浸渍沉淀法制备,先将10 g HY分子筛(比表面积为408.93 m2·g -1,SiO2为69.9%(wt),Al2O3为24.3%(wt) 500℃焙烧4 h,再加入到100 mL浓度为1 mol·L-1的硝酸镍水溶液中,333 K条件下搅拌1 h,然后滴加浓度为1 mol·L-1的(NH4)2CO3溶液100 mL,持续搅拌老化22 h,将溶液过滤、用蒸馏水多次洗涤催化剂产品至中性,置于90℃烘箱内干燥24 h后进行研磨,筛取80~100目催化剂备用[16]。将试样磨细溶解在王水中烘干后溶解在水中,用原子吸收光谱法分析测试表明制备催化剂的Ni含量为39%,平均比表面积为:345 m2·g-1。
催化剂在使用前置于管式炉中还原,先在高纯氮气吹扫下升温至600℃ (升温速率为4℃·min-1),然后通入高纯氢气(气体流量100 mL·min-1)恒温还原6 h,还原后的催化剂在高纯氮气的保护下降至常温,取出备用。
2.3 加氢反应实验反应装置为巩义市英峪高科仪器厂高压反应釜,将定量2, 4-DNT溶于300 mL无水乙醇后加入Ni/HY催化剂,室温下用氮气、氢气、氮气依次置换反应釜中的空气,然后关闭放空阀,将反应釜加热至设定温度并调节氢压至设定压力,待反应温度及压力稳定后开启搅拌,计时并定时取样。
用天美GC-7890气相色谱分析反应产物中各组分的浓度,色谱条件为:离子火焰(FID)检测器,SE54毛细管柱(0.32 mm×0.5 μm×30 m),柱温180℃,进样器温度280℃,检测器温度260℃,分流比为50:1[17]。初始温度50℃,以10℃·min-1升至260℃,保持5 min。
色谱分析过程,以2, 4-DNT为内标物,测定了各组分的校正因子fi,并根据各组分的峰面积计算了各组分的摩尔含量(式(1))。
| $ {y_i} = {A_i} \cdot \frac{{{f_i}}}{{{A_{{\rm{DNT}}}}}} $ | (1) |
式中Ai和ADNT分别为组分i和2, 4-DNT的峰面积。而后根据式(2)计算2, 4-DNT的转化率(X);式(3)计算了各产物的收率(Yi),式(4)计算了各产物的选择性(Si)。
| $ X = 1 - \frac{1}{{1 + \sum {i{y_i}} }} \times 100\% $ | (2) |
| $ {Y_i} = \frac{{{y_i}}}{{1 + \sum {i{y_i}} }} \times 100\% $ | (3) |
| $ {S_i} = \frac{{{Y_i}}}{X} $ | (4) |
2, 4-DNT邻位与对位的硝基均可加氢生成氨基,因此2, 4-TDA的加氢反应有两条路线(图 1),一条路线为邻位硝基首先加氢生成2-氨基-4-硝基甲苯(2A4NT),然后对位硝基加氢生成目标产物2, 4-TDA;另一条路线为对位硝基首先加氢生成4-氨基-2-硝基甲苯(4A2NT),然后邻位硝基加氢生成目标产物2, 4-TDA。
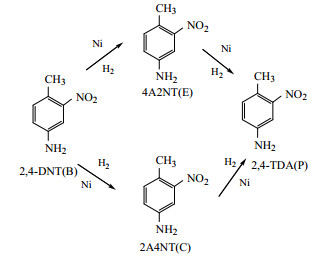
|
图 1 2, 4-DNT的加氢反应历程 Fig.1 Reaction scheme for 2, 4-DNT hydrogenation |
图 2所示的反应过程各组分浓度随时间的变化也证实了上述反应历程。该图显示2, 4-DNT加氢生成中间产物的反应速率相较于中间产物加氢生成最终产物的反应速率更快,在反应进行40 min后,2, 4-DNT的转化率达到99%以上,但从40到200 min的过程中,中间产物才能完全转化为目的产物。两个中间产物的浓度都在在反应40时达到最大值,而反应过程中4A2NT的生成量明显大于2A4NT,这是由于处于邻位的硝基受到甲基的位阻效应,较对位的硝基而言不易加氢生成氨基。

|
图 2 反应过程各组分浓度分布随时间的变化 Fig.2 Profiles of concentration distribution of reactants and products Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; reaction temperature: 343 K |
在反应温度为363 K,氢压为2.2 MPa,催化剂粒径为80~100目的条件下,考察了不同搅拌速度对反应速率的影响。由图 3可知,2, 4-DNT加氢反应速率随搅拌速度的增加而加快,直到搅拌速度大于600 r·min-1后,反应速率不再随搅拌速度的增加而变化,此时可认为催化反应中外扩散的影响基本消除,因此本文以下实验都是在搅拌速度为700 r·min-1的条件下进行。
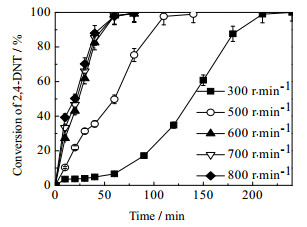
|
图 3 搅拌速度对加氢反应速率的影响。 Fig.3 Effects of stirring speeds on 2, 4-DNT hydrogenation rates Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; reaction temperature: 363 K; reactant concentration: 0.0915 mol·L-1 |
在催化剂粒径为80~100目,反应温度363 K,氢气压力2.2 MPa,转速700 r·min-1的反应条件下,考察了不同反应物浓度下,反应物的转化率及产物的收率随反应时间的变化。结果如图 4和图 5可知,反应物初始浓度的增加对2, 4-DNT的转化率的影响不大,但是对第二步反应的进行有较大影响。从图 6可知,当反应物初始浓度较高时,反应进行到40 min后,2, 4-DNT已经完全反应,同时生成了大量的中间产物4A2NT,随后,直到反应进行到200 min时,中间产物才完全加氢生成目的产物。
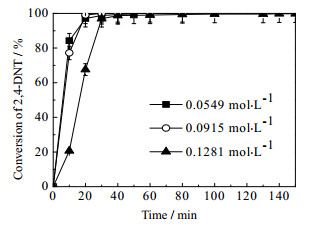
|
图 4 反应物初始浓度对二硝基甲苯反应的影响 Fig.4 Effects of reactant concentrations on 2, 4-DNT conversion Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; reaction temperature: 363 K; stirring rate:700 r·min-1 |
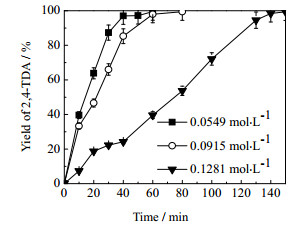
|
图 5 反应物初始浓度对TDA收率的影响 Fig.5 Effects of reactant concentrations on 2, 4-DNT yields Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; reaction temperature: 363 K; stirring rate:700 r·min-1 |
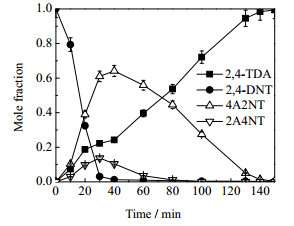
|
图 6 反应初始浓度为0.1281 mol·L-1时各物质浓度分布 Fig.6 Concentration distributions of different chemicals at initial concentration of 0.1281 mol·L-1 Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; reaction temperature: 363 K; stirring rate: 700 r·min-1 |
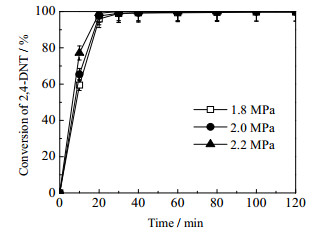
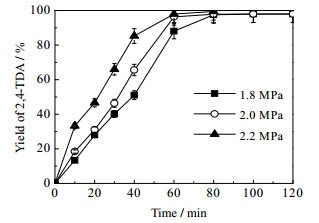
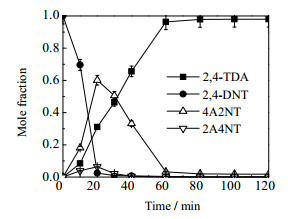
反应氢气压力是影响反应的又一重要因素,氢压增加可能会使反应速率增加,但同时也会影响目的产物的选择性。而从图 7和8的结果可知当反应氢压为1.8、2.0和2.2 MPa时,氢压对2, 4-DNT转化率随时间的变化影响不大,但对2, 4-TDA收率随时间的变化却有一定的影响,即随着压力的增大,达到平衡收率的时间越短。由图 9压力为1.8 MPa时各组分浓度分布图可知,压力的增加主要促进了中间产物转化为最终产物的速率,而对目的产物的选择性没有明显影响,主要中间产物为4A2NT。
|
图 7 不同压力对二硝基甲苯转化率的影响 Fig.7 Effects of hydrogen pressure on 2, 4-DNT conversion Reaction conditions: ethanol solvent: 300 mL; reaction temperature: 363 K; stirring rate: 700 r·min-1; reactant concentration: 0.0915 mol·L-1 |
|
图 8 不同压力对TDA收率的影响 Fig.8 Effects of hydrogen pressure on 2, 4-DNT yields Reaction conditions: ethanol solvent: 300 mL; reaction temperature: 363 K; stirring rate:700 r·min-1; reactant concentration: 0.0915 mol·L-1 |
|
图 9 氢气压力为1.8 MPa时各物质浓度分布 Fig.9 Chemical concentration distributions at hydrogen pressure of 1.8 MPa Reaction conditions: ethanol solvent: 300 mL; reaction temperature: 363 K; stirring rate: 700 r·min-1; reactant concentration: 0.0915 mol·L-1 |
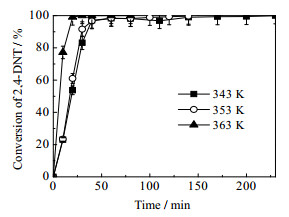
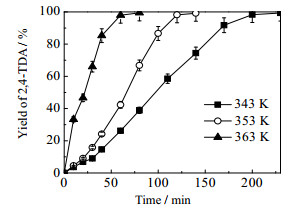
反应温度是影响二硝基甲苯加氢的重要因素之一,对于催化反应体系,反应温度升高可能获得更高的反应速率。由图 10和图 11的实验结果可知,温度的增加对于2, 4-DNT转化率随时间变化并不明显,但反应温度对TDA的收率随时间变化影响较大,温度升高TDA生成速率明显加快。结合图 12,343 K各组分浓度分布图可知,反应40 min时反应物的转化率已基本达到100%,在第二步反应中,温度的升高主要影响中间产物转化成目标产物的反应速率,为了加快DNT完全转化为TDA,可以适当的升高反应温度。
|
图 10 不同温度对二硝基甲苯转化率的影响 Fig.10 Effects of reaction temperatures on 2, 4-DNT conversion Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; stirring rate: 700 r·min-1; reactant concentration: 0.0915 mol·L-1 |
|
图 11 不同温度对TDA收率的影响 Fig.11 Effects of reaction temperature on 2, 4-DNT yield Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; stirring rate: 700 r·min-1; reactant concentration: 0.0915 mol·L-1 |

|
图 12 反应温度为70℃时各物质浓度分布 Fig.12 Chemical concentration distributions at 70℃ Reaction conditions: catalyst dosage: 0.5 g; ethanol solvent: 300 mL; hydrogen pressure: 2.2 MPa; stirring rate: 700 r·min-1; reactant concentration: 0.0915 mol·L-1 |
采用Langmuir-Hinshelwood模型,可写出如下机理模型:
化合物i反应生成j的速率:
| $ {r_{ij}} = \frac{v}{{{w_{{\rm{CAT}}}}}}\frac{{{\rm{d}}{c_i}}}{{{\rm{d}}t}} = {k_{ij}}{\theta _i}{\theta _{\rm{H}}} $ | (5) |
其中
化合物i的表面覆盖率为:
| $ {\theta _i} = \frac{{{K_i}{c_i}}}{{1 + \sum {{K_i}{c_i}} }} $ | (6) |
吸附氢分子的表面覆盖率为:
| $ {\theta _{\rm{H}}} = \frac{{{K_{\rm{H}}}c_{{{\rm{H}}_{\rm{2}}}}^*}}{{1 + \sum {{K_{\rm{H}}}c_{{{\rm{H}}_{\rm{2}}}}^*} }} $ | (7) |
联合方程(5)(6)(7),可得如下反应速率方程:
| $ {r_{ij}} = \frac{v}{{{w_{{\rm{CAT}}}}}}\frac{{{\rm{d}}{c_i}}}{{{\rm{d}}t}} = \frac{{{k_{ij}}{K_i}{c_i}}}{{1 + \sum {{K_i}{c_i}} }}\frac{{{K_{\rm{H}}}c_{{{\rm{H}}_{\rm{2}}}}^*}}{{1 + \sum {{K_{\rm{H}}}} c_{{{\rm{H}}_{\rm{2}}}}^*}} $ | (8) |
由于溶剂/反应底物的比值较大,可认为反应产物的浓度变化时溶解在溶剂中的氢气浓度保持不变。此外,在本文的实验条件下,
| $ {k_{ij}}\frac{{{K_{\rm{H}}}c_{{{\rm{H}}_{\rm{2}}}}^{\rm{*}}}}{{1 + \sum {{K_{\rm{H}}}} c_{{{\rm{H}}_{\rm{2}}}}^*}} = k_{ij}^* $ | (9) |
反应速率方程可化为:
| $ {r_{ij}} = \frac{v}{{{w_{{\rm{CAT}}}}}}\frac{{{\rm{d}}{c_i}}}{{{\rm{d}}t}} = \frac{{k_{ij}^*{K_i}{c_i}}}{{1 + \sum {{K_i}{c_i}} }} $ | (10) |
| $ \frac{{{\rm{dB}}}}{{{\rm{d}}t}} = - {r_1} - {r_2} = - \frac{{\left( {k_1^* + k_2^*} \right){K_{\rm{B}}}{c_{\rm{B}}}}}{{1 + {K_{\rm{B}}}{c_{\rm{B}}} + {K_{\rm{E}}}{c_{\rm{E}}} + {K_{\rm{C}}}{c_{\rm{C}}} + {K_{\rm{P}}}{c_{\rm{P}}}}} $ | (11) |
| $ \frac{{{\rm{dE}}}}{{{\rm{d}}t}} = {r_1} - {r_4} = \frac{{k_1^*{K_{\rm{B}}}{c_{\rm{B}}} - k_4^*{K_{\rm{E}}}{c_{\rm{E}}}}}{{1 + {K_{\rm{B}}}{c_{\rm{B}}} + {K_{\rm{E}}}{c_{\rm{E}}} + {K_{\rm{C}}}{c_{\rm{C}}} + {K_{\rm{P}}}{c_{\rm{P}}}}} $ | (12) |
| $ \frac{{{\rm{dC}}}}{{{\rm{d}}t}} = {r_2} - {r_3} = \frac{{k_2^*{K_{\rm{B}}}{c_{\rm{B}}} - k_3^*{K_{\rm{C}}}{c_{\rm{C}}}}}{{1 + {K_{\rm{B}}}{c_{\rm{B}}} + {K_{\rm{E}}}{c_{\rm{E}}} + {K_{\rm{C}}}{c_{\rm{C}}} + {K_{\rm{P}}}{c_{\rm{P}}}}} $ | (13) |
| $ \frac{{{\rm{dP}}}}{{{\rm{d}}t}} = {r_3} + {r_4} = \frac{{k_4^*{K_{\rm{E}}}{c_{\rm{E}}} + k_3^*{K_{\rm{C}}}{c_{\rm{C}}}}}{{1 + {K_{\rm{B}}}{c_{\rm{B}}} + {K_{\rm{E}}}{c_{\rm{E}}} + {K_{\rm{C}}}{c_{\rm{C}}} + {K_{\rm{P}}}{c_{\rm{P}}}}} $ | (14) |
B为反应物2, 4-DNT,C为中间产物2A4NT,E为中间产物4A2NT,P为目的产物2, 4-TDA。
由2, 4-DNT到4A2NT反应速率记为r1;由2, 4-DNT到2A4NT反应速率记为r2;由2A4NT到2, 4-TDA反应速率记为r3;由4A2NT到2, 4-TDA反应速率记为r4。
4.2 模型参数回归由反应工艺条件影响可知,当反应速率达到600 r·min-1,催化剂粒径为80~100目时,2, 4-DNT加氢反应进入本征区。2, 4-DNT加氢生成目的产物2, 4-TDA的反应速率主要由第二步反应中间产物生成最终产物的速率决定,因此,动力学实验选择的工艺条件为700 r·min-1,催化剂粒径80~100目,催化剂质量0.5 g,反应物初始质量5 g,溶剂乙醇体积300 mL,氢气压力2.2 MPa,反应温度343、353、363 K。采用matlab对反应路径的方程组进行参数回归。结果如表 1。
|
|
表 1 模型回归参数 Table 1 Parameters for kinetic models |
反应速率常数和吸附常数的对数对温度的倒数作图,可以看出在研究的温度343、353、363 K下,模型计算结果与实验结果相符合。由阿伦尼乌斯公式可求出相应反应的活化能及吸附热。活化能和吸附热范围内,lnki和1/T有较好的线性关系,相关指数分别为0.9712,0.9816,0.9933,0.9395;lnki和1/T也有较好的线性关系,相关指数分别为0.9708,0.9714,0.9602,0.9779。表 1中k1 > k2,表明2, 4-DNT生成4A2NT的速率大于生成2A4NT。结合表 1中k3 > k4,也可以说明在试验的过程中4A2NT的量要大于2A4NT的量,与实验结果刚好相符。由阿伦尼乌斯公式计算出各反应活化能列于表 2中。
|
|
表 2 催化反应活化能及吸附热 Table 2 Reaction activation energies and absorption heat values |
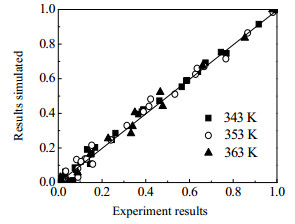
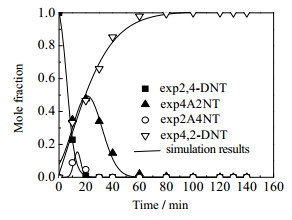
为了验证模型计算结果是否与实际相符,比较了不同的温度下实验值与模型计算值的大小,如图 13所示。从图中可以看出实验值与模型计算值之间有较好的相关性。图 14为353 K温度下,各物质浓度分布比例的实验结果与模型计算结果比较,从图中也可看出相关性较好。
|
图 13 实验结果与模型计算结果的比较 Fig.13 Comparison of experimental and simulation results at different temperatures |
|
图 14 353 K实验结果与模型计算结果的比较 Fig.14 Comparison of experimental and simulation results at 353 K |
本文通过对2, 4-DNT加氢工艺条件,反应机理及动力学的研究,得出结论如下:
(1) 反应温度,氢气压力及反应物浓度的改变对中间产物转化为最终产物的反应速率影响较大。
(2) 当搅拌速度大于600 r·min-1时,反应进入本征区。
(3) 2, 4-DNT生成4A2NT的活化能为31.3 kJ·mol-1、2, 4-DNT生成2A4NT的活化能为28.7 kJ·mol-1、2A4NT反应生成2, 4-TDA活化能为31.0 kJ·mol-1、4A2NT生成2, 4-TDA的活化能为26.4 kJ·mol-1。上述反应的吸附热分别约为-30.0、-15.0、-16.8、-9.3 kJ·mol-1。得到如上动力学参数,对于实际生产有一定的指导意义。
| [1] | HU Xiao-yong(胡孝勇), GUO Si-yuan(郭祀远), CHEN Huan-qin(陈焕钦). TDI in thin film evaporation separation of polyurethane curing agent(薄膜蒸发分离聚氨酯固化剂中的TDI)[J]. Journal of South China University of Technology(Natural Science Edition)(华南理工大学学报(自然科学版)), 2008, 36(3): 12-15. DOI:10.3321/j.issn:1000-565X.2008.03.003. |
| [2] | MA De-qiang(马德强), SONG Jin-hong(宋锦宏), DING Jian-sheng(丁建生). Production and consumptions of organic isocyanates(有机异氰酸酯的生产及市场消费状况)[J]. Chemical Industry and Engineering Progress(化工进展), 2007, 26(5): 743-749. DOI:10.3321/j.issn:1000-6613.2007.05.027. |
| [3] | MA Jian-jun(马建军), SI Hai-juan(司海娟), YANG Lei(杨磊). Research progress of hydrogenation technology of dinitrotoluene(二硝基甲苯加氢工艺研究进展)[J]. Chemical Industry and Engineering Progress(化工进展), 2008, 27(6): 844-848. DOI:10.3321/j.issn:1000-6613.2008.06.009. |
| [4] | LI Yu-gang(李玉刚), KONG Ling-qi(孔令启), YANG Xia(杨霞). Object and bottlenecks analysis for toluene diamine plant retrofit(甲苯二胺装置扩产改造的目标与瓶颈分析)[J]. Chemical Engineering(化学工程), 2005, 33(5): 57-60. DOI:10.3969/j.issn.1005-9954.2005.05.015. |
| [5] | MA Dan(马丹), WANG Gui-rong(王桂荣), WANG Yan-ji(王延吉). Research progress in preparation of toluene two amine by reduction of two nitro toluene(二硝基甲苯还原制备甲苯二胺的研究进展)[J]. Speciality Petrochemicals(精细石油化工), 2007, 24(6): 87-91. DOI:10.3969/j.issn.1003-9384.2007.06.021. |
| [6] | HUANG Pei(黄培), WANG Peng-peng(王朋朋), HUANG Li-ping(黄丽萍). Development of the preparation methods for aromaticamine by reduction of aromaticnitro compounds(硝基化合物还原制备芳香胺工艺研究进展)[J]. Journal of Nanjing University of Technology(南京工业大学学报(自然科学版)), 2007, 29(4): 101-106. DOI:10.3969/j.issn.1671-7627.2007.04.023. |
| [7] | Kreutzer M T, Kapteijn F, Moulijn J A. Fast gas-liquid-solid reactions in monoliths:a case study of nitro-aromatic hydrogenation[J]. Catalysis Today, 2005, 105(3-4): 421-428. DOI:10.1016/j.cattod.2005.06.028. |
| [8] | Rajashekharam M V, Chaudhari R V. Hydrogenation of 2, 4-dinitrotoluene using a supported Ni catalyst:reaction kinetics and semibatch slurry reactor nodeling[J]. Industrial & Engineering Chemistry Research, 1999, 38(3): 906-915. |
| [9] | Janssen H J, Kruithof A J, Steghuis G J. Kinetics of the catalytic hydrogenation of 2, 4-dinitrotoluene. 1. Experiments, reaction scheme, and catalyst activity[J]. Industrial & Engineering Chemistry Research, 1990, 29(5): 1822-1829. |
| [10] | Janssen H J, Kruithof A J, Steghuis G J. Kinetics of the catalytic hydrogenation of 2, 4-dinitrotoluene. 2. Modeling of the reaction rates and catalyst activity[J]. Industrial & Engineering Chemistry Research, 1990, 29(9): 1822-1829. |
| [11] | Rajashekharam M V, Nikalje D D, Rengaswamy jaganathan A. hydrogenation of 2, 4-dinitrotoluene using a Pd/Al2O3 catalyst in a slurry reactor:a molecular level approach to kinetic modeling and nonisothermal effects[J]. Industrial & Engineering Chemistry Research, 1997, 36(3): 592-604. |
| [12] | Neri G, Musolino M G, Milone C. Kinetic modeling of 2, 4-dinitrotoluene hydrogenation over Pd/C[J]. Industrial & Engineering Chemistry Research, 1995, 34(7): 2226-2231. |
| [13] | Rahman A, Jonnalagadda S B. Swift and selective reduction of nitroaromatics to aromatic amines with Ni-boride-silica catalysts system at low temperature[J]. Catalysis Letters, 2008, 123(3-4): 264-268. DOI:10.1007/s10562-008-9417-5. |
| [14] | LI Gui-xian(李贵贤), REN Bin(任斌), JI Dong(季东). Study on synthesis of aniline compounds by hydrogenation of highly active Ni/HY catalyst(高活性Ni/HY催化剂加氢催化合成苯胺类化合物的研究)[J]. Journal of Molecular Catalysis (China)(分子催化), 2012, 26(2): 116-120. |
| [15] | Ren B, Zhao M, Dong L. Catalytic hydrogenation of 2, 4-dinitroethylbenzene to 2, 4-diaminoethylbenzene over Ni/HY catalysts:the solvent effect[J]. Catalysis Communications, 2014, 50(14): 92-96. |
| [16] | ZHANG Xue-mei (张雪梅). Synthesis on liquid phase hydrogenation of 2, 4-DNT to 2, 4-TDA over Ni/HY catalyst (催化剂在2, 4-DNT液相加氢催化合成2, 4-TDA反应的研究)[D]. Lanzhou (兰州): Lanzhou University of Techwology (兰州理工大学), 2011. |
| [17] | ZHANG Xue-mei(张雪梅), LI Gui-xian(李贵贤), GAO Yun-yan(高云艳). Effects of support on the nickel-based catalysts for hydrogenation of 2, 4-dinitrotoluene(载体对镍基催化剂催化2, 4-二硝基甲苯加氢反应的影响)[J]. Acta Petrolei Sinica (Petroleum Processing Section)(石油学报(石油加工)), 2012, 28(2): 231-235. |




