2,3,5-三甲基-1,4-对苯醌(TMQ)是生产维生素E的重要中间体。在众多的合成工艺[1]中,TMP氧化生产TMQ工艺因其生产流程简单、生产成本低、收率高等优点而备受研究者青睐[2],成为生产TMQ的主要路线。传统合成方法是将TMP磺化后经MnO2氧化得到TMQ,但该生产过程产生大量工业废水,严重影响环境。氧气作为TMP氧化过程绿色环保氧化剂使此工艺成为当前研究热点[3]。氧气氧化TMP制备TMQ催化剂种类较多[4~7],其中CuCl2价廉易得,应用广泛。本课题组黄海平[8]在氧气为氧化剂、CuCl2/ FeCl3为催化剂的反应条件下研究气液两相反应网络,但气液两相反应过程存在催化剂与反应产物分离困难问题,难以工业化。 Hirose等人[9]使用CuCl2/过渡金属盐催化剂水溶液制备TMQ,反应完成后通过静置分层回收利用混合金属盐水溶液,减少了重金属离子的排放,因此气液液三相催化氧化的方法更宜工业化。
TMP气液液三相催化氧化制备TMQ的过程是一个复杂反应过程,反应中形成多种产物影响主产物收率。Shimizu等[10]研究发现CuCl2催化时,氯离子与原料可以形成氯代三甲基苯酚(Cl-TMP),这种物质随反应时间延长减少并最终消失,作者判断Cl-TMP为反应中间产物。Kholdeeva等[11]研究发现反应过程中会形成二聚物2,2,3,3,6,6-六甲基-4,4-联苯二酚(BP),且不随时间减少,应为反应副产物。黄海平在气液两相研究中也检测到Cl-TMP和BP[8]。但这些副产物的产生机理和抑制方法报道极少。为确保主产物收率,研究反应网络及各种因素对反应产物的影响非常必要。
本文以CuCl2/FeCl3水溶液为催化剂水相,TMP-正己醇溶液为反应油相,对反应产物进行结构鉴定和定量分析,并据此推测反应网络,同时考察反应时间、反应温度、催化剂用量和FeCl3·6H2O催化剂加入量对反应产物组成的影响,为工业上TMP催化氧化制备TMQ的工艺优化提供理论依据。
2 实验部分 2.1 原料2,3,6-三甲基苯酚,工业品级,浙江新和成股份有限公司;正己醇,试剂级,国药集团化学试剂有限公司;三氯化铁-六水,分析纯,国药集团化学试剂有限公司;二氯化铜-二水,分析纯,国药集团化学试剂有限公司;苯甲酸乙酯,分析纯,国药集团化学试剂有限公司。
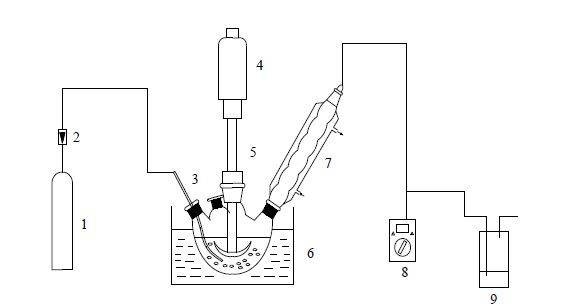
2.2 反应装置及操作步骤本文实验装置如图 1所示。纯氧由转子流量计控制流量导入反应器,反应尾气经洗气瓶洗涤后排出。
|
图 1 实验装置示意图 Fig.1 Schematic diagram of the experimental setup 1. oxygen cylinder 2. flow meter 3. catheter 4~5. stirring motor 6. oil bath 7. condenser pipe 8. oxygen detector 9. gas-washing bottle |
配制相同体积的催化剂水溶液与反应物正己醇溶液后通入氧气反应。实验在常压恒温搅拌下进行,油相与水相在混合之前分别预热至设定温度。采用气相色谱(GC)、质谱(MS)、气相色谱-质谱(GC-MS)、高效液相色谱(HPLC-DAD)与液相色谱-质谱(HPLC-MS)进行产物结构鉴定和定性分析,定时取样用气相色谱跟踪定量分析,以苯甲酸乙酯为内标物。反应完成后,体系通过静置分层分离催化剂水相。
2.3 TMP反应产物分析 2.3.1 GC-MS对产物定性分析(1) 2,3,6-三甲基-4-氯苯酚(Cl-TMP)
GC-MS (EI) m/z(相对强度):170(86,[M]+),172(28,[M+2]+),155(16,[M-CH3]+),135(100,[M-Cl]+),91(25,[M-2CH2-Cl-O]+)
(2) 2,3,5-三甲基-1,4-对苯二酚(TMHQ)
GC-MS (EI) m/z(相对强度):152(100,[M]+),151(24,[M-H]+),137(68,[M-CH3]+)。
(3) 2,2,3,3,5,5-六甲基-4,4-联苯二酚(BP)
GC-MS (EI) m/z(相对强度):270(100,[M]+),255(57,[M-CH3]+),240(61,[M-2CH3]+),225(15,[M-3CH3]+),210(3,[M-4CH3]+)。
(4) 2,3,6-三甲基-4-(2,3,6-三甲基苯氧基)苯酚(PP)
GC-MS (EI) m/z(相对强度):270(100,[M]+),255(5,[M-CH3]+),225(4,[M-3CH3]+),208(5,[M-3CH3-OH]+),136(63,[M-C6H(CH3)3O]+),135(59,[M- C6H(CH3)3OH]+),121(21,[M-C6H(CH3)3OH-CH2]+),105(10,[M- C6H(CH3)3OH-CH2-O]+),91(32,[M-C6H(CH3)3OH-2CH2-O]+)。
2.3.2 MS对产物的定性分析(1Z)-2,2',3,3',5,5'-六甲基-1,1'-联(环己-2,5-二烯-1-亚基)-4,4'-二酮(BQ)
MS (ESI)m/z : 269([MH]+)
2.3.3 HPLC-MS和DAD对产物的定性分析邻-(2,2,2,3,3,3,5,5,5-九甲基)三联苯-4,4,4-三醇(TP)
HPLC-MS(ESI)m/z:405([MH]+),269([M-C6H(CH3)3OH]+);HPLC-DAD: (λ = 202 nm,λ = 284 nm,λ = 303 nm)。
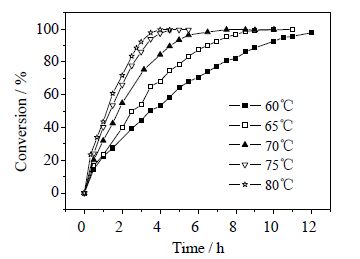
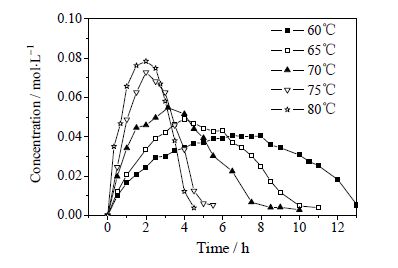
3 结果与讨论 3.1 反应温度的影响在催化剂水相60 mL(CuCl2·2H2O浓度为12.67%(wt),FeCl3·6H2O浓度为20.12%(wt)),油相TMP正己醇溶液60 mL(TMP浓度为24.15%(wt)),纯氧流量为20 mL⋅min-1,搅拌转速为400 r⋅min-1的条件下,改变反应温度(60、65、70、75、80℃)进行实验,结果如图 2和图 3所示。
|
图 2 不同温度下TMP 转化率的变化 Fig.2 TMP conversion rates under different temperatures |
|
图 3 不同温度下Cl-TMP 浓度的变化 Fig.3 Cl-TMP concentration profiles under different temperatures |
由图 2和图 3可见,反应温度越高,反应速率越快。反应产物Cl-TMP随反应时间延长先增加后减少,应为反应中间产物。Cl-TMP在反应过程中能达到的最高浓度随温度升高而增大,同时达到峰值的时间提前。这是由于温度升高时油相中氯离子溶解度增加,中间产物Cl-TMP生成量增加;同时随温度升高TMP·生成速率较快,导致TMP·和氯离子反应速率也加快,因此达到峰值时间提前。Cl-TMP作为反应中间产物最终会转化成主产物TMQ,通过温度升高促进Cl-TMP的生成可以提高主产物选择性。
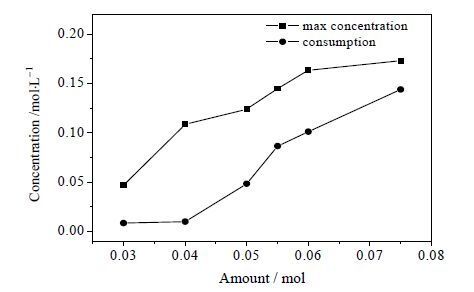
3.2 催化剂用量的影响在油相TMP正己醇溶液60 mL(TMP浓度为24.15%(wt)),催化剂水相60 mL,氧气流量为20 mL⋅min-1,搅拌转速为400 r⋅min-1,反应温度为70℃,CuCl2·2H2O和FeCl3·6H2O的摩尔比为1:1的条件下,改变催化剂用量(0.03、0.04、0.05、0.055、0.06、0.075 mol)进行实验,结果如表 1和图 4所示。图 4中最高含量是指中间产物在反应体系中达到的最高浓度;消耗量指产物BP达到最高浓度后进一步氧化反应消耗量。
| 表 1 不同催化剂用量下的Cl–TMP 最高浓度 Table 1 Maximum concentrations of Cl-TMP obtained under different amounts of catalyst |
|
图 4 不同催化剂用量下BP 的最高含量和消耗量 Fig.4 Maximum concentration and consumption profilesof BP under different amounts of catalyst |
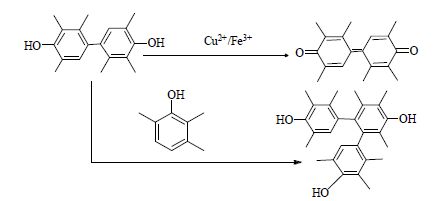
由表 1和图 4中结果可以看出,催化剂用量对反应产物Cl-TMP和BP的浓度影响显著。随着催化剂用量增加,中间产物Cl-TMP的最高含量增加。催化剂用量增加反应体系中氯离子含量也增加,从而Cl-TMP浓度增加。催化剂用量增加能够形成更多TMP·,BP最高浓度增加。催化剂用量较大时(> 0.04 mol) BP在反应后期会被消耗,且其消耗量随着催化剂用量增加而增加。催化剂CuCl2·2H2O/FeCl3·6H2O具有氧化性,BP在高浓度催化剂作用下能够进一步氧化,氧化产物(1Z)-2,2',3,3',5,5'-六甲基-1,1'-联(环己-2,5-二烯-1-亚基)-4,4'-二酮可由MS检测。同时微量的三聚产物邻-(2,2,2,3,3,3,5,5,5-九甲基)三联苯-4,4,4-三醇在HPLC和HPLC-MS中出现,该产物可能由TMP和BP反应形成。上述分析表明催化剂用量较大时BP为反应中间产物。催化剂用量小于0.04 mol时,BP浓度在反应前期随时间延长而增加,最终趋于稳定值,可视为反应副产物。上述反应途径如图 5所示。
|
图 5 BP 的反应网络 Fig.5 Reaction routes of BP |
实验研究发现,当反应体系中只有CuCl2·2H2O作催化剂时,反应速率较快,反应2 h后原料转化率可达99%,但主产物TMQ选择性较低只有70.39%。当反应体系中只有FeCl3·6H2O作催化剂时,反应速率很慢,要使原料转化率达99% 需反应18 h以上。为探究FeCl3·6H2O催化剂对反应的催化作用,设计固定CuCl2·2H2O催化剂用量,改变FeCl3·6H2O催化剂用量实验。
在油相TMP正己醇溶液60 mL (TMP浓度为24.15%(wt)),催化剂水相60 mL,氧气流量为20 mL⋅min-1,搅拌转速为400 r⋅min-1,反应温度为70℃,CuCl2·2H2O催化剂用量为0.05 mol的条件下,改变FeCl3·6H2O催化剂用量(0、0.01、0.02、0.03、0.04、0.05 mol)进行实验,结果如表 2和图 6所示。
| 表 2 不同FeCl3⋅6H2O 加入量下TMQ 的选择性 Table 2 Selectivity of TMQ under different amounts of FeCl3⋅6H2O |
|
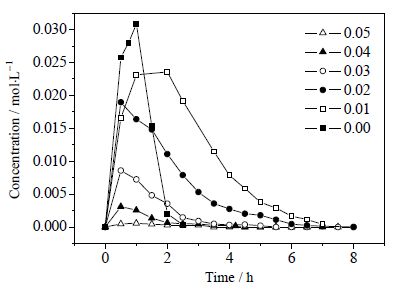
图 6 不同FeCl3·6H2O 催化剂用量下PP 浓度随时间的变化 Fig.6 PP concentration profiles under different amounts of FeCl3·6H2O |
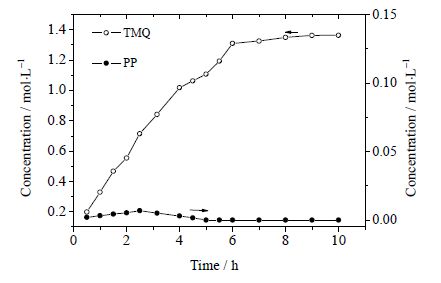
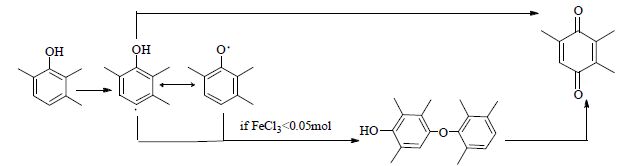
由表 2可知,加入助催化剂FeCl3·6H2O后主产物TMQ的选择性提高近10%,认为铜铁催化剂存在协同催化效应。由图 6可知,反应产物PP随反应时间延长先增加后减少,应为反应中间产物。由图 7可知,TMQ在PP浓度下降之后依然上升,推断PP还会进一步氧化成TMQ。铁盐催化剂对中间产物PP的影响显著,PP浓度随铁盐催化剂用量增加而下降,说明铁盐会抑制中间产物PP的形成。FeCl3中Fe3+ 氧化TMP的同时还原为Fe2+,Fe2+ 含有4个未成对电子很容易与氧结合:O2的π*z和π*x轨道中的未成对电子与高自旋Fe2+ 的dzz和dzx轨道中的未成对电子相互偶合,活化氧分子[12~14],使更多的活性氧分子和反应体系中的TMP·反应生成TMQ。从而提高TMQ的选择性,减少二聚产物PP生成。在铜盐催化体系中加入助催化剂铁盐可以提高主产物选择性。FeCl3含量小于0.05 mol时,反应体系中存在较多TMP·,TMP·通过自由基转移形成苯氧自由基RO·,TMP·和RO·两者之间C-O耦合则可生成PP。FeCl3含量较高时(>0.05 mol),中间产物PP含量很低,对主产物产率的影响可以忽略。图 8为PP生成TMQ的反应网络。
|
图 7 TMQ 和PP 浓度随时间的变化 Fig.7 Concentration variation of TMQ and PP as a function of reaction time |
|
图 8 PP 反应成TMQ 的反应网络 Fig.8 The reaction network from PP to TMQ |
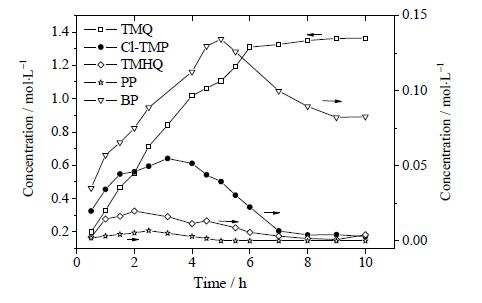
在催化剂水相60 mL(CuCl2·2H2O浓度为12.67%(wt),FeCl3·6H2O浓度为20.12%(wt)),油相TMP正己醇溶液60 mL(TMP浓度为24.15%(wt)),反应温度为70℃,搅拌转速为400 r⋅min-1,纯氧流量为20 mL⋅min-1时考察TMP气-液-液三相催化氧化反应产物浓度随反应时间的变化情况,结果如图 9所示。
|
图 9 TMP 反应主要产物浓度随时间变化 Fig.9 Concentration profiles of reaction products as a function of reaction time |
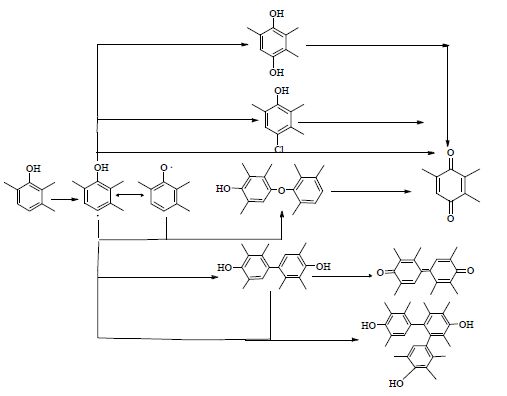
由图 9可知,TMP气液液三相催化氧化的主要反应产物有:TMQ、Cl-TMP、TMHQ、PP、BP。其中Cl-TMP、TMHQ、PP随反应时间呈先增加后减少趋势,推测它们为反应中间产物。TMQ浓度随反应时间呈现单调增加趋势,到反应后期趋于稳定值,且在中间产物Cl-TMP、TMHQ、PP浓度下降之后依然上升,推断TMQ不仅由TMP直接反应生成,也是中间产物Cl-TMP、TMHQ、PP进一步氧化的产物。而BP浓度随时间增大到最大值后下降,最终趋于稳定值。BP浓度下降的原因是较高浓度催化剂作用下进一步氧化。酚类物质催化氧化形成醌类物质的反应为自由基反应过程[15, 16],本文中在水相催化剂CuCl2·2H2O/FeCl3·6H2O作用下TMP生成自由基TMP·,同时TMP·自身发生自由基转移形成苯氧自由基RO·。因此TMP气液液三相催化氧化过程是先形成TMP·,继而发生TMP反应生成TMQ、TMHQ、 Cl-TMP以及BP和PP的五个平行反应,Cl-TMP、PP和TMHQ可以进一步转变为产物,它们为反应中间产物。推测反应网络如图 10所示。反应过程的化学反应方程式如(1)~(10)所示。
|
图 10 TMP 生成TMQ 的反应网络 Fig.10 The reaction network from TMP to TMQ |
| $\text{TMP +}{{\text{O}}_{\text{2}}}\text{ }\underrightarrow{\text{Cat}}\text{ TMQ+ }{{\text{H}}_{\text{2}}}\text{O}\left( 主 \right)$ | (1) |
| $\text{TMP +CuC}{{\text{l}}_{\text{2}}}\text{ + 1/2}{{\text{O}}_{\text{2}}}\text{ }\underrightarrow{\text{Cat}}\text{Cl-TMP + Cu(OH)Cl}\left( 副 \right)$ | (2) |
| $\text{Cl-TMP + 1/2}{{\text{O}}_{\text{2}}}\text{ }\underrightarrow{\text{Cat}}\text{TMQ+ HCl}\left( 副 \right)$ | (3) |
| $\text{2TMP + 1/2}{{\text{O}}_{\text{2}}}\underrightarrow{\text{Cat}}\text{ BP + }{{\text{H}}_{\text{2}}}\text{O}\left( 副 \right)$ | (4) |
| $\text{PP + }{{\text{H}}_{\text{2}}}\text{O}\underrightarrow{\text{Cat }}\text{2TMQ + }{{\text{H}}_{\text{2}}}\text{O}\left( \text{ 副} \right)$ | (5) |
| $\text{TMP +1/2}{{\text{O}}_{\text{2}}}\text{ }\underrightarrow{\text{Cat}}\text{TMHQ }\left( 副 \right)$ | (6) |
| $\text{TMHQ + 1/2}{{\text{O}}_{\text{2}}}\underrightarrow{\text{Cat}}\text{ TMQ + }{{\text{H}}_{\text{2}}}\text{O}\left( 副 \right)$ | (7) |
| $2\text{TMP+ 1/2}{{\text{O}}_{\text{2}}}\underrightarrow{\text{Cat}}\text{ BP + }{{\text{H}}_{\text{2}}}\text{O}\left( 副 \right)$ | (8) |
| $\text{BP+ 1/2}{{\text{O}}_{\text{2}}}\text{ }\underrightarrow{\text{Cat}}\text{ BQ + }{{\text{H}}_{\text{2}}}\text{O}\left( 副 \right)$ | (9) |
| $\text{TMP + BP + 1/2}{{\text{O}}_{\text{2}}}\text{ }\underrightarrow{\text{Cat}}\text{ TP}+{{\text{H}}_{\text{2}}}\text{O}\left( 副 \right)$ | (10) |
(1) TMP气-液-液三相催化氧化制备TMQ反应过程中有2,3,6-三甲基-4-氯苯酚、2,3,5-三甲基-1,4-对苯二酚、2,2,3,3,5,5-六甲基-4,4-联苯二酚和2,3,6-三甲基-1,4,-对苯酚等多种中间产物和副产物生成。根据各物质之间相互关系,本文提出一个包含平行和连串反应的反应网络。
(2) 在CuCl2催化体系中加入助催化剂FeCl3,FeCl3对氧分子更好的活化作用可以促进TMP的氧化反应,减少二聚,使主产物TMQ的选择性由70.39%提高到82.91%。
(3) CuCl2/FeCl3摩尔比为1:1的条件下,催化剂用量大于0.04 mol时,BP为反应中间产物,会被进一步氧化成(1Z)-2,2',3,3',5,5'-六甲基-1,1'-联(环己-2,5-二烯-1-亚基)-4,4'-二酮;催化剂用量小于0.04 mol时,BP浓度随时间延长先增加,最终趋于稳定值,可视为反应副产物。
| [1] | YANG Jun-juan(杨俊娟), LI Xi-ying(李西营), LIU Yong(刘勇) . Research progress for manufacturing 2,3,5-trimethlyhygroq uinone(2,3,5-三甲基氢醌制备工艺研究进展)[J]. Chemical Research(化学研究) , 2011, 22 (4) : 94-99 |
| [2] | Sllimizu M, Takehira K, Hayakawa T. Method for the preparation of 2,3,5-trimethylbenzoquinone:US Patent, 5245059[P]. 1993-09-14. |
| [3] | Kholdeeva O A, Trukhan N N . A new environmentally friendly method for the production of 2,3,5-trimethyl-p-benzoquinone[J]. Catalysis Today , 2002, 75 (1) : 203-209 |
| [4] | WU Ming-zhu(吴明珠), LI Ying(李应), HUANG Xiang-zhong(黄相中) . Photo-oxidation of 2,3,5-trimethylphenol to 2,3,5-trimethylbenzoquinone using CuO/AC catalyst(活性炭负载CuO光催化氧化2,3,5-三甲基苯酚到2,3,5-三甲基苯醌)[J]. Applied Chemical Enigineering(应用化工) , 2014, 43 (3) : 456-459 |
| [5] | WANG Xian-pei(王宪沛), YANG Rui-yun(杨瑞云), LI Wen(李文) . Ionic liquid catalytic oxidation of 2,3,6-trimethylphenol to 2,3,5-trimethyl-1,4-benzoquinone(离子液体催化氧化2,3,6-三甲基苯酚合成2,3,5-三甲基苯醌)[J]. Industrial Catalysis(工业催化) , 2013, 21 (8) : 73-75 |
| [6] | Palacio M, Villabrille P I, Romanelli G . Preparation, characterization and use of V2O5-TiO2 mixed xerogels as catalysts for sustainable oxidation with hydrogen peroxide of 2,3,6-trimethylphenol[J]. Applied Catalysis A:General , 2012, 417 |
| [7] | Kholdeeva O A, Iyanchikova I D, Guidotti M . How to reach 100% selectivity in H2O2-based oxidation of 2,3,6-trimethylphenol to trimethyl-p-benzoquinone over Ti,Si-catalysts[J]. Catalysis Today , 2009, 141 (3) : 330-336 |
| [8] | HUANG Hai-ping (黄海平). Study on 2,3,6-trimethylphenol ooxidation catalyzed by CuCl2/FeCl3 (CuCl2/FeCl3 催化2,3,6-三甲基苯 酚氧化反应过程研究) [D]. Hangzhou (杭州): Zhejiang University (浙江大学), 2015. |
| [9] | Hirose N, Hamamura K,Inai Y, et al. Process for preparing 2,3,5-trimethylbenzoquinone:US Patent, 5,104,996[P]. 1992-04-14. |
| [10] | Shimizu M, Watanabe Y, Orita H . Synthesis of alkyl substituted p-benzoquinones from the corresponding phenols using molecular oxygen catalyzed by copper (II) chloride-amine hydrochloride systems[J]. Bulletin of the Chemical Society of Japan , 1992, 65 (6) : 1522-1526 DOI:10.1246/bcsj.65.1522 |
| [11] | Kholdeeva O A, Golovin A V, Maksimovskaya R I . Oxidation of 2,3,6-trimethylphenol in the presence of molybdovanadophoric heteropoly acids[J]. Journal of Molecular Catalysis , 1992, 75 (3) : 235-244 DOI:10.1016/0304-5102(92)80128-4 |
| [12] | TANG Qing-hu(汤清虎), WANG Jing(王京), HUANG Xiao-na(黄晓娜) . Preparation of benzaldehyde by oxidating benzyl alcohol with MnK/Al2O3 catalyst in liquid-phase(MnK/Al2O3催化苯甲醇液相氧化制苯甲醛)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28 (6) : 1360-1365 |
| [13] | WANG Wei-jie (王维㛃). Studies on the aerobic oxidation of p-cresol to p-hydroxybenzaldehyde catalyzed by metalloporphyrins (金 属卟啉催化氧化邻/对甲酚制邻/对羟基苯甲醛的研究) [D]. Beijing (北京): Beijing University of Technology (北京工业大学), 2013. http://cdmd.cnki.com.cn/article/cdmd-10005-1013047213.htm |
| [14] | Pieter J S, Julia S W . Transition-metal ions in zeolites:coordination and activation of oxidation[J]. Inorganic Chemistry , 2010, 49 (8) : 3573-3583 DOI:10.1021/ic901814f |
| [15] | Sun H, Harms K, Sundermeyer J . Aerobic oxidation of 2,3,6-trimethylphenol to trimethyl-1,4-benzoquinone with copper (II) chloride as catalyst in ionic liquid and structure of the active species[J]. Journal of the American Chemical Society , 2004, 126 (31) : 9550-9551 DOI:10.1021/ja0391964 |
| [16] | Partenheimer W . Methodology and scope of metal/bromide autoxidation of hydrocarbons[J]. Catalysis Today , 1995, 23 (2) : 69-158 DOI:10.1016/0920-5861(94)00138-R |




