2. 天津理工大学 化学化工学院,天津 300384
2. College of Chemistry and Chemical Engineering, Tianjin University of Technology, Tianjin 300384, China
聚乙二醇(PEG)是一用途极为广泛的聚醚高分子化合物,它可应用于医药、卫生、食品、化工等众多领域[1]。PEG与生物体组织液具有良好的相容性,可被生物体快速排出体外而不产生任何毒副作用,因此被广泛应用于生物体系[2~4]。PEG作为成相聚合物可被用于双水相亲和分配分离过程,该分离过程具有分离条件温和、与生物质兼容性好等优势[5]。此外,PEG具有温敏性,其水合能力随温度升高而下降,由亲水变为疏水,基于PEG可构建温敏材料,并应用于分离、催化等领域[6]。
在实际应用中,通过端羟基取代引入功能化基团,如:对甲苯磺酸酯基、氨基、羧基、醛基等,可大幅度扩大聚乙二醇的应用范围[7]。然而,PEG端羟基的化学稳定性较强,不易被其它功能基团取代。因此,往往需要对PEG端羟基活化,以利于其进一步与功能基团偶联。由于氯基团具有良好的离去性,容易在偶极非质子溶剂中被功能基团取代,合成氯代聚乙二醇(PEGCl)成为合成多种功能化PEG的重要步骤[8]。刘敏等[9]通过氯代反应合成了PEGCl,然后通过PEGCl与叠氮化钠反应生成了叠氮基取代聚乙二醇,进一步加氢后得到了氨基取代聚乙二醇。Wu等[10]通过PEGCl与咪唑钠反应生成了咪唑基取代聚乙二醇,并进一步合成了咪唑基温敏离子液体。
用于聚乙二醇端羟基氯代反应的试剂主要有卢卡斯试剂(HCl-ZnCl2)、五氯化磷以及二氯亚砜等。其中以二氯亚砜为氯代试剂进行PEG氯化反应时,具有条件温和,产率高等优点[11]。二氯亚砜与聚乙二醇反应过程中,会释放氯化氢、二氧化硫等酸性物质,加入缚酸剂(吡啶、三乙胺等)可促进反应向正向进行,从而提高端羟基的取代率。该反应过程为强放热反应,而二氯亚砜具有强氧化性,若反应条件控制不当则易生成大量副产物,降低聚乙二醇利用率[12]。目前以吡啶为缚酸剂,二氯亚砜为氯化试剂对不同聚合度的聚乙二醇进行端羟基取代的过程尚无较全面的条件优化研究,本文研究了以二氯亚砜为氯化试剂合成氯代聚乙二醇的过程,系统考察了缚酸剂用量、反应温度、反应时间和聚乙二醇聚合度对聚乙二醇转化率和氯代聚乙二醇收率的影响。
2 实验部分 2.1 实验试剂聚乙二醇(PEG),天津市福晨化学试剂厂,平均相对分子量分别为200、400、600和800。二氯亚砜,分析纯,汕头市西陇化工有限公司。吡啶,分析纯,天津市福晨化学试剂厂。邻苯二甲酸酐,分析纯,上海化学试剂有限公司。甲苯、氢氧化钾均为分析纯,北京化工厂。
2.2 实验过程在进行氯化反应前,分别对PEG、甲苯和吡啶进行预处理以脱除药品中的微量水分。PEG的预处理条件为70℃下真空干燥12 h。采用金属钠回流的方法脱除甲苯溶剂中的微量水分。在吡啶中加入少量氢氧化钾并回流2 h,之后蒸馏出无水吡啶备用。
本研究的氯化反应过程如下。在氮气气氛保护下,依次向250 mL的三口烧瓶中加入一定量的无水吡啶、30 mmol PEG和100 mL无水甲苯,升温至预设温度后向三口烧瓶中缓慢滴加180 mmol二氯亚砜,并恒温反应一定时间。反应过程中反应体系由最初的无色溶液变成白色乳状液,最终成为上下分层的两相体系,上层是浅黄色甲苯溶液,下层是红褐色油状物质。将上层溶液直接过滤除去氯化吡啶,得到黄色溶液。用甲苯分三次洗涤下层油状物质,将得到的黄色洗涤液和与上层所得溶液混合。用旋转蒸发仪蒸馏除去上述黄色溶液中的二氯亚砜以及大部分甲苯,冷却后过滤除去白色沉淀(氯化吡啶)。蒸馏除去全部甲苯后得到深黄色透明液体,即为PEGCl产品。
采用测定原料PEG和产品PEGCl羟值的方法确定PEG端羟基取代率和PEGCl收率。羟值测试方法如下:称取一定质量干燥的PEG或者PEGCl样品,加入5 mL邻苯二甲酸酐吡啶溶液(140 g邻苯二甲酸酐/1 L吡啶),在油浴中回流反应1 h。加入30 mL去离子水和10滴2 g·L-1的酚酞,用0.05 mol·L-1氢氧化钾水溶液滴定至粉红色,且保持30 s不变色,记录消耗的氢氧化钾水溶液的体积。在不加入样品的情况下,做空白试验,记录消耗的氢氧化钾水溶液的体积。羟值的计算方法见式(1);通过测定PEGCl产品中剩余的羟基含量推算PEG的转化率X,计算方法见式(2);称量洗涤后的下层油状物和产品PEGCl的质量,以备计算PEGCl的收率Y,收率计算方法见式(3)。
| $ C=\frac{{{C}_{\rm{OH}}}({{V}_{0}}-V)}{m} $ | (1) |
| $ X=(1-\frac{C\times {{m}_{1}}}{2N})\times 100\% $ | (2) |
| $ Y=(\frac{{{m}_{1}}-C\times {{m}_{1}}\times {{M}_{0}}/2}{{{M}_{1}}\times N})\times 100\% $ | (3) |
式中:C为样品中羟基含量(mol·g-1);COH为氢氧化钾水溶液的浓度(mol·L-1);V0为空白实验消耗氢氧化钾水溶液的体积(L);V为样品消耗氢氧化钾水溶液的体积(L);m为羟值测定过程中取样质量(g);m1为实验所得产物的总质量(g);N为氯化实验中加入的PEG的物质的量(mol);M0为PEG的平均分子量(g·mol-1);M1为根据PEG的平均分子量推算的PEGCl的平均分子量(g·mol-1)。
2.3 样品表征采用日本JOEL公司的JOEL JNM-ECA600型600兆脉冲傅立叶变换核磁共振谱仪分别测定不同分子量的PEG及PEGCl的1H-NMR,以确定原料及产物的结构组成,TMS为内标,CDCl3为溶剂。采用美国Nicolet公司的Nexus 670型红外光谱仪对PEG及PEGCl进行红外光谱测定,扫描次数150次,分辨率4 cm-1。
3 结果与讨论 3.1 结构分析图 1是四种不同聚合度的PEG和PEGCl的红外光谱图。在3373 cm-1处的强吸收峰是分子中O-H的伸缩振动吸收峰,1646 cm-1处的吸收峰是O-H的弯曲振动吸收峰,这两个吸收峰证明了羟基结构。2876 cm-1处的吸收峰是C-H伸缩振动吸收峰,1458、1351和1250 cm-1处的吸收峰是C-H特征吸收峰,证明了C-H结构[13]。1118 cm-1处的吸收峰是C-O伸缩振动吸收峰,940 cm-1处的吸收峰是C-O-C的特征吸收峰,这两个峰表明了醚键结构[14]。对比PEG和PEGCl的FTIR谱图可知,PEGCl的红外光谱中,羟基的吸收峰趋近于零,表明原料PEG的端羟基转化较为完全。并且,PEGCl的红外光谱图保留了PEG红外光谱图中除羟基峰外的所有吸收峰,这表明PEG氯化过程没有对PEG的主体结构造成破坏。
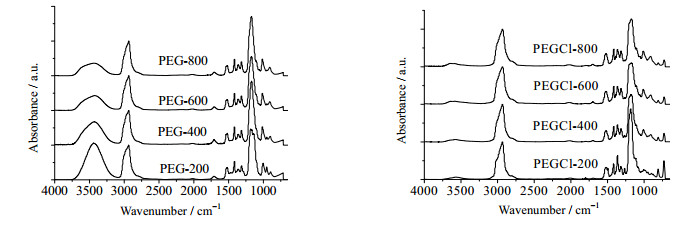
|
图 1 聚乙二醇(左)和氯代聚乙二醇(右)的红外光谱图 Fig.1 FTIR spectra of PEG (left) and PEGCl (right) |
为了进一步鉴定所得产品的结构,对比了PEG和PEGCl的核磁共振氢谱图,此处仅以平均分子量为200的样品为代表进行解释(见图 2)。PEG-200和PEGCl-200的核磁共振氢谱图中不同化学环境的氢的化学位移归属如下:PEG-200:δ 3.6029 (q,4H,2CH2),3.6636~3.6750 [m,8H,(OCH2CH2)n],3.7174 (m,4H,2CH2OH),4.0438 (s,2H,OH);PEGCl-200:δ 3.6659~3.6292 [m,15H,2CH2,(OCH2CH2)n],3.7529 (s,4H,2CH2Cl)[15, 16]。由此可知,所得样品为氯代聚乙二醇,并且氯代聚乙二醇的1H-NMR谱图中没有杂峰,这表明所得氯代聚乙二醇具有较高的纯度。
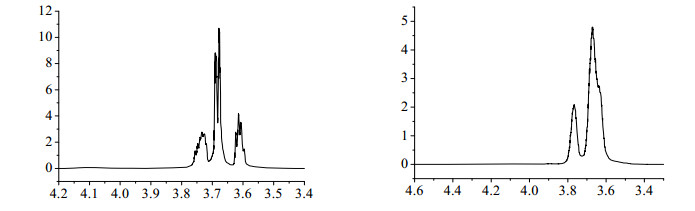
|
图 2 平均分子量为200的PEG (左)和PEGCl (右)的1H-NMR谱图 Fig.2 1H-NMR spectra of PEG (left) and PEGCl (right) with average molecular weight of 200 |
深入分析二氯亚砜与PEG的反应机理,可为调控反应过程提供理论依据。二氯亚砜与PEG的反应机理见图 3。在反应过程中,PEG首先与二氯亚砜生成氯代亚硫酸酯,并分解出氯化氢。然后氯代亚硫酸酯分解为紧密离子对,-Cl作为离去基团(-OSOCl)中的一部分,向正碳离子进攻,即“内返”,得到PEGCl。当弱亲核试剂吡啶作为此反应的催化剂加入到反应体系后,会与氯代亚硫酸酯络合生成含有氯负离子的络合物,而且会与反应过程中生成的氯化氢生成含有氯负离子的盐酸盐。这些氯负离子会进攻端基处正电性较强的碳原子,从而加速氯化物的生成。另外,吡啶与氯化氢反应生成的吡啶盐酸盐会形成沉淀,这有利于反应向正方向进行。反应过程中亦会发生副反应,氯代亚硫酸酯与PEG反应生成大分子共聚物。
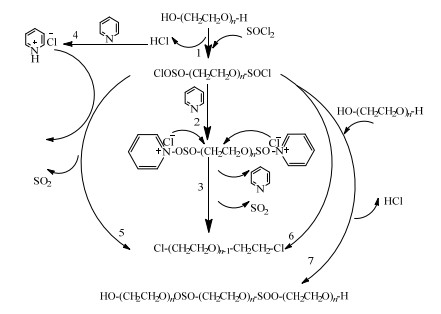
|
图 3 吡啶催化聚乙二醇与二氯亚砜反应机理示意图 Fig.3 Reaction mechanism of PEG and thionyl chloride catalyzed by pyridin |
由反应机理可知,吡啶在此反应体系中既作为催化剂,加速反应,又作为盐酸络合剂,络合氯化氢而形成沉淀析出,从而使化学平衡移动,推动反应向正方向进行。吡啶的加入量在很大程度上将影响羟基的转化,吡啶用量对羟基转化的影响见图 4。其中,二氯亚砜与聚乙二醇的摩尔比为6:1,反应时间24 h,反应温度30℃。由图 4可见,在吡啶与PEG的摩尔比在2~6,羟基转化率随吡啶投加量的增大而逐渐增大,吡啶与PEG的摩尔比为6时,PEG几乎全部转化。这是因为在此配比范围内,吡啶用量的增大有利于自由氯负离子和吡啶盐的生成,促进了PEG的转化。
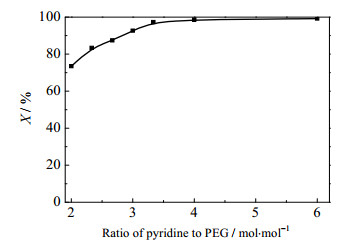
|
图 4 吡啶投加量对PEG转化率的影响 Fig.4 Effects of feeding ratio of pyridine to PEG on PEGl conversion |
在实验过程中发现,在初始滴加二氯亚砜时,反应溶液的温度快速上升,这表明该反应总体为放热反应。因此,控制热量扩散及反应温度对反应过程有较大影响。在二氯亚砜、吡啶和聚乙二醇的摩尔比为6:6:1,反应时间为24 h时,由图 5可以看出,随着反应温度的升高,PEG转化率逐渐升高,并在55℃时达到100%。当反应温度低于40℃时,PEGCl的收率随着反应温度的升高而逐渐升高;当反应温度高于40℃时,PEGCl的收率随着反应温度的升高逐渐降低。这主要是因为,较高的反应温度导致生成了较多的副产物。当反应温度为40℃时,PEGCl具有最高收率,但此时尚有部分PEG未完全反应,因此综合考虑,反应温度应确定在35~45℃,以保证目的产物有较高的收率。
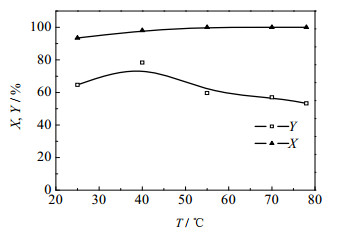
|
图 5 反应温度对PEG转化率和PEGCl收率的影响 Fig.5 Effects of reaction temperature on PEG conversion and PEGCl yield |
图 6为反应时间对PEG转化率和PEGCl收率的影响,其中二氯亚砜、吡啶和聚乙二醇的摩尔比为6:6:1,温度为45℃。由图可以看出,随时间的增长,各分子量PEG的转化率逐渐增大,PEGCl收率在一定时间达到最高之后缓慢降低。PEG-200在24 h时转化率达到96%,PEGCl收率在9 h时达到最高。PEG-400在24 h时转化率达到98%,9 h时PEGCl收率最高。PEG-600转化率和PEGCl收率在9 h时最高。PEG-800在3 h时转化率已达100%,此时的PEGCl收率最高。对比四种不同分子量PEG的转化速率可以发现,随着PEG分子量的增大,PEG氯化反应速率相应加快。这可能是因为,当投加相同物质的量的PEG时,PEG的分子量越大,其包含的-CH2CH2O-片断越多,而该极性片断易与二氯亚砜、吡啶等极性分子结合,这导致了PEG反应区域内反应物浓度局部增大,从而引起PEG氯化反应速率一定程度的提高。PEGCl的收率呈现先增大后降低的趋势,PEGCl收率的提高主要是由PEG转化率大幅度提高引起;其升高至顶峰后逐渐降低主要是因为PEG与PEG的氯代硫酸酯发生聚合反应而生成高分子类副产物。
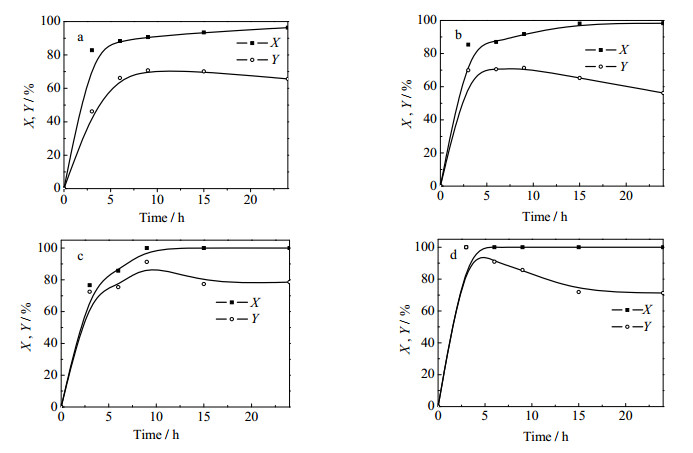
|
图 6 反应时间对PEG转化率和PEGCl收率的影响 Fig.6 Effect of reaction time on PEG conversion and PEGCl yield a. PEG-200 b.PEG-400 c. PEG-600 d. PEG-800 |
(1) 红外光谱和核磁共振氢谱分析结果表明,PEG氯代反应过程未对PEG的主体结构造成破坏;PEGCl的核磁共振氢谱中未出现杂峰,表明所合成的PEGCl具有较高的纯度。
(2) 吡啶作为催化剂和缚酸剂,其投加量对PEG转化率影响较大,当吡啶与PEG的摩尔比为6:1,在30℃下反应24 h后PEG几乎全部转化。
(3) PEG与二氯亚砜反应过程为放热反应,过高的反应温度会导致较多的副产物生成和较低的PEGCl收率,将反应温度控制在35~45℃,可以保证PEGCl具有较高的收率。
(4) 不同平均分子量的PEG表现出不同的转化速率,在PEG平均分子量介于200~800时,PEG的平均分子量越大,其转化速率越高。
符号说明:
| C | —羟值含量,mol·g-1 | V | —体积,L |
| COH | —氢氧化钾水溶液的浓度,mol·L-1 | X | —转化率 |
| M | —平均分子量,g·mol-1 | Y | —收率 |
| m | —质量,g | 下标 | |
| N | —物质的量,mol | OH | —氢氧化钾水溶液 |
| [1] | Wenande E, Garvey L H. Immediate-type hypersensitivity to polyethylene glycols: a review[J]. Clinical & Experimental Allergy , 2016, 46(7): 907-922. |
| [2] | Katre N V, Knauf M J, Laird W J. Chemical modification of recombinant interleukin 2 by polyethylene glycol increases its potency in the murine Meth a sarcoma model[J]. Proceedings of the National Academy of Sciences , 1987, 84(6): 1487-1491. DOI:10.1073/pnas.84.6.1487. |
| [3] | LI Tao(李涛). Market and application of multi-purpose polyethylene glycol products(多用途聚乙二醇产品的市场和应用)[J]. Technology & Economics in Petrochemicals(石油化工技术与经济) , 2010, 26(2): 24-28. |
| [4] | Zhang X Y, Fu C K, Feng L, et al. PEGylation and polyPEGylation of nanodiamond[J]. Polymer , 2012, 53(15): 3178-3184. DOI:10.1016/j.polymer.2012.05.029. |
| [5] | Hatti-Kaul R. Aqueous two-phase systems-a general overview[J]. Molecular Biotechnology , 2001, 19(3): 269-277. DOI:10.1385/MB:19:3. |
| [6] | ZHANG Jin(张进), CUI Shang-ping(崔尚平), XI Zheng(席征), et al. Research progress in terminal hydroxyl modification of polyethylene glycol(聚乙二醇的端羟基改性研究进展)[J]. Chemical Propellants & Polymeric Materials(化学推进剂与高分子材料) , 2015, 13(2): 46-50. |
| [7] | XIONG Cheng-dong(熊成东), WANG Ya-hui(王亚辉), YUAN Ming-long(袁明龙), et al. Progress in synthesis of polyethylene glycol derivatives(聚乙二醇衍生物的合成研究进展)[J]. Polymer Bulletin(高分子通报) , 2000(1): 39-45. |
| [8] | ZHANG Han-yu(张晗昱), ZHAI Jin-xian(翟进贤), QU Zheng-yang(曲正阳), et al. Synthesis and characterization of azido-terminated polyethylene glycols(端叠氮基聚乙二醇的合成与表征)[J]. Chinese Journal of Explosives & Propellants(火炸药学报) , 2011, 34(6): 45-47. |
| [9] | LIU Min(刘敏), XU Wen(徐雯), ZHU Ye-huan(朱叶欢), et al. Preparation and purification of amino-terminated poly(ethylene glycol)(双氨基聚乙二醇的制备及分离纯化)[J]. Chinese Journal of Pharmaceuticals(中国医药工业杂志) , 2007, 38(6): 423-426. |
| [10] | Wu Q, Wan H L, Li H S, et al. Bifunctional temperature-sensitive amphiphilic acidic ionic liquids for preparation of biodiesel[J]. Catalysis Today , 2013, 200(1): 74-79. |
| [11] | XING Qi-yi(邢其毅), PEI Wei-wei(裴伟伟), XU Rui-qiu(徐瑞秋), et al. Basic organic chemistry(基础有机化学)[M].Beijing(北京): Peking University Press(北京大学出版社), 2016. |
| [12] | LU Jin(陆瑾), LIN Dong-qiang(林东强), YAO Shan-jing(姚善泾). Improvement on thionyl chloride method to activate hydroxyl group of polymer for affinity partition(亲和分配基质羟基二氯亚砜法活化工艺的改进)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2004, 55(7): 1179-1182. |
| [13] | Ohkoshi M. FTIR-PAS study of light-induced changes in the surface of acetylated or polyethylene glycol-impregnated wood[J]. Journal of Wood Science , 2002, 48(5): 394-401. DOI:10.1007/BF00770699. |
| [14] | Pramono K E, Utomo S B, Wulandan V, et al. FTIR studies on the effect of concentration of polyethylene glycol on polimerization of Shellac[J]. Journal of Physics: Conference Series , 2016, 776(1): 1-8. |
| [15] | WU Mei-yu(吴美玉), YONG Zhong-gen(雍忠根). 1H-NMR determine molecular weight of polyether polyols-molecular weight determination of polyethylene glycol(1H-NMR测定聚醚多元醇分子量--聚乙二醇分子量测)[J]. Acta Polymerica Sinica(高分子学报) , 1985, 1(6): 457-459. |
| [16] | Payyappilly S, Dhara S, Chattopadhyay S. Thermoresponsive biodegradable PEG-PCL-PEG based injectable hydrogel for pulsatile insulin delivery[J]. Journal of Biomedical Materials Research Part A , 2014, 102(5): 1500-1509. DOI:10.1002/jbm.a.34800. |




