2. 陕西省眼科研究所,陕西 西安 710002;
3. 西安外事学院 医学院,陕西 西安 710077;
4. 商洛学院 医药与生物工程学院,陕西 商洛 726000
2. Shaanxi Institute of Ophthalmology, Xi'an 710002, China;
3. Medical College, Xi'an International University, Xi'an 710077, China;
4. College of Biology Pharmacy and Food Engineering, Shangluo University, Shangluo 726000, China
近年来,海藻酸盐微胶囊作为固定化载体在组织工程、药物递送及控制释放等领域引起极大关注[1, 2]。海藻酸钠(sodium alginate,SA)分子由古罗糖醛酸(G)和甘露糖醛酸(M)单元组成,生物相容性优异,可在温和条件下与Ca2+交联形成具有三维网孔结构的水凝胶,为微囊化细胞提供生长增殖的三维支架[3],为药物释放提供扩散通道[4],也为微球表面控释膜的形成提供反应场所[5]。但Comaposada等[6]研究表明仅当G单元含量较高时,Ca2+交联的海藻酸盐凝胶机械强度较为理想,而当M单元含量较高时,凝胶结构疏松,机械强度差,表明Ca2+与SA的交联反应具有选择性。Baysal等[7]研究发现,海藻酸钙凝胶的稳定性较弱,在没有聚电解质复合膜保护的前提下,环境溶液中的柠檬酸根能竞争性螯合海藻酸钙分子中的Ca2+而使凝胶迅速解聚。
由于Ca-Alg凝胶存在机械强度较低、易于解聚且缓控释能力较差等问题,研究者对其他金属离子交联剂亦产生了浓厚兴趣。研究发现,Zn2+、Ba2+、Mn2+、Sr2+等二价金属离子也可以与SA反应形成水凝胶[8, 9]。Liu等[10]发现,采用Ba2+、Sr2+、Ca2+、Zn2+交联的海藻酸盐凝胶均具有良好的细胞相容性,且Zn2+、Ba2+交联的凝胶具有更为理想的结构稳定性及生物相容性。Mørch等[11]报道了Ba2+、Sr2+、Ca2+与SA分子中G、M糖单元的交联性能,发现Ba2+与G、M单元均可以交联,而Sr2+选择性交联G单元,Ca2+选择性交联G和少量GM单元。但迄今为止,文献报道多为对凝胶现象和性能的描述,关于Zn2+、Ba2+与海藻酸盐的交联机理尚缺乏深入研究,对交联机理与凝胶结构、性能之间的关系也缺乏清晰认识。由于不同二价金属离子与SA分子之间的交联机制不同,因此形成的海藻酸盐凝胶基质结构可能会存在显著差异,这不仅可能影响药物分子在凝胶内部的传质行为,也可能影响凝胶表面控释膜的形成及其控制传输性能。
针对上述问题,本文拟从理论和实验两方面探究Ba2+、Zn2+、Ca2+对海藻酸盐凝胶结构及其传质性能的影响。应用价键理论分析三种金属离子与SA分子的交联机理,海藻酸钡(barium alginate, Ba-Alg)、海藻酸锌(zinc alginate,Zn-Alg)和海藻酸钙(calcium alginate,Ca-Alg)三种凝胶微球为研究对象,采用扫描电子显微镜(SEM)、电感耦合等离子体发射光谱仪(ICP)、热失重分析仪(TGA)等表征手段为交联机理研究提供实验依据。以牛血清白蛋白(bovine serum albumin,BSA)为模型分子评价凝胶结构与扩散性能的相关性;进而采用CLSM研究异硫氰酸荧光酯(fluorescein isothiocyanate,FITC)标记的壳聚糖(chitosan,CS)分子在三种凝胶中的扩散协同成膜反应行为。
2 实验部分 2.1 实验材料与仪器海藻酸钠(黏度200 mPa·s (1%,20℃),CP,国药集团化学试剂有限公司);氯化钙、氯化钡、氯化锌(AR,天津市科密欧试剂有限公司);壳聚糖(平均分子量70 kDa,脱乙酰度≥ 95%,CP,河南润诚化工产品有限公司);牛血清白蛋白(纯度99%,北京索莱宝科技有限公司);异硫氰酸荧光素(AR,Sigma公司);其他试剂均为AR。
脉冲电场发生器(自制);微量注射泵(浙江大学医学仪器有限公司);Motic TE2000倒置显微镜(西安千欣仪器有限公司);Carl Zeiss SIGMA扫描电子显微镜(德国卡尔·蔡司股份公司);ULTIMA2电感耦合全谱等离子体发射光谱仪(法国HORIBA Jobin Yvon公司);FV1000激光共聚焦显微镜(日本奥林巴斯株式会社);UV-3600紫外分光光度计(日本岛津仪器公司);TG209F1热重分析仪(德国耐驰仪器有限公司)。
2.2 海藻酸盐凝胶微球的制备量取8 g·L-1 SA原料液10 mL,4℃保存过夜。利用脉冲电场发生器,将SA原料液通过微量注射泵分别滴入20 g·L-1的BaCl2、ZnCl2、CaCl2溶液中,交联固化60 min。采用去离子水充分润洗微球,保证凝胶中未交联的金属离子置换完全,分别得到Ba-Alg、Zn-Alg和Ca-Alg凝胶微球。
2.3 浓硝酸法制备凝胶消解溶液分别称量400 mg干燥至恒重的Ba-Alg、Zn-Alg和Ca-Alg凝胶微球,加入65%~68%浓硝酸8 mL。在加热磁力搅拌器上升温至90℃,直至凝胶完全消解为澄清溶液且挥发至0.5 mL,用去离子水定容至100 mL,备用。
2.4 交联凝胶的形貌与结构表征 2.4.1 凝胶微球大体形貌观测及粒径分布表征采用生物倒置显微镜观察微球形貌,image J软件随机统计100颗微球的直径并绘制粒径分布图。
2.4.2 凝胶的微观形貌与结构表征通过Carl Zeiss SIGMA扫描电子显微镜(SEM)在3 kV加速电压下观测表面喷金的Ba-Alg、Zn-Alg和Ca-Alg冻干凝胶微观截面形貌,并进行能谱(EDS)分析。利用image J软件随机统计SEM图像中各凝胶截面孔道的孔径并绘制孔径分布图。
2.5 凝胶中交联金属离子含量测定采用ULTIMA2电感耦合全谱等离子体发射光谱仪(ICP)分别测定Ba-Alg、Zn-Alg和Ca-Alg凝胶消解液中Ba2+、Zn2+、Ca2+的含量,即参与交联反应的金属离子含量。
2.6 凝胶热稳定性的表征采用TG209F1热重分析仪(TGA)测定Ba-Alg、Zn-Alg和Ca-Alg冷冻干燥凝胶的热失重曲线,温度为20~800℃,升温速率10℃·min-1,氮气吹扫速率100 mL·min-1。
2.7 凝胶干燥速率的测定将Ba-Alg、Zn-Alg和Ca-Alg凝胶微球表面水分吸干后分别称取重量,记为W0。将微球置于37℃恒温气浴摇床中,隔时取出并迅速称重,记为Wi。凝胶微球完全干燥时的重量记为Wd。根据式(1)计算三种凝胶在不同时刻的含水率WCi (%),绘制干燥曲线。
| $ {\rm{W}}{{\rm{C}}_{\rm{i}}}(\% ) = \frac{{{W_{\rm{i}}} - {W_{\rm{d}}}}}{{{W_0}}} \times 100\% $ | (1) |
式中,Wi为凝胶微球在测量点的重量,g;W0为凝胶微球的初始重量,g;Wd为凝胶微球的干重,g。
2.8 BSA在凝胶中扩散性能的测定向8支含有4 mL、1.0 g·L-1 BSA溶液的试管中,分别加入等量(800 mg)的Ba-Alg凝胶微球,室温条件进行平行扩散实验。按照试管编号顺序,隔时从一份试管中移取上清液2 mL,采用紫外分光光度计在波长280 nm处测定吸光度值A280。利用实验测定的BSA溶液标准曲线(A280 = 0.0006269Ci+0.01024,R2 = 0.999),根据式(2)计算主体溶液中BSA浓度随时间的变化量及凝胶对BSA的即时吸附量qt,并绘制扩散曲线。Zn-Alg和Ca-Alg凝胶微球实验方法同上。
| $ {q_{\rm{t}}} = \frac{{V({C_0} - {C_{\rm{i}}})}}{m} $ | (2) |
式中,qt为溶质分子的即时吸附量,mg·g-1;C0和Ci分别为主体溶液的初始浓度和即时浓度,mg·L-1;m为凝胶的质量,g;V为主体溶液的体积,L。
2.9 FITC标记壳聚糖(FITC-CS)的制备方法以1%(V)醋酸为溶剂,配制5 g·L-1 CS溶液,用3 mol·L-1 NaOH溶液调节CS溶液的pH = 10~12,去离子水定容至100 mL备用。精确称取0.0091 g FITC粉末并溶于2 mL二甲基亚砜中,再加入18 mL、pH = 7.4的PBS溶液,混合均匀后加入到上述配制好的CS溶液中,在室温、150 r·min-1摇床条件下避光反应12 h。反应结束后,3000 r·min-1离心10 min,收集沉淀,用PBS溶液反复洗涤沉淀至上清在492 nm处无吸收。将沉淀真空干燥。以1% (V)醋酸为溶剂,配制所需浓度的FITC-CS溶液。
2.10 FITC-CS在凝胶微球中的扩散协同成膜反应适量凝胶微球置于10 mL具刻度试管中,加入于微球堆积体积4倍的FITC-CS溶液。将试管置于200 r·min-1、37℃恒温摇床中避光反应30 min后,120目筛网过滤微球并用PBS (pH = 7.2)溶液洗涤至滤液在492 nm处无吸收,分别得到Ba-Alg/FITC-CS、Zn-Alg/FITC-CS和Ca-Alg/FITC-CS三种表面形成了聚电解质复合膜(polyelectrolyte complex membrane, PEM)的荧光标记凝胶微球。
2.11 微球表面聚电解质膜厚度及荧光强度的测定采用CLSM观测Ba-Alg/FITC-CS、Zn-Alg/FITC-CS和Ca-Alg/FITC-CS微球上荧光分布,即沿CS扩散路径形成的聚电解质复合膜的形貌。利用image J软件测量微球表面的膜厚度,沿凝胶直径方向测量荧光强度的变化情况。
3 实验结果与讨论 3.1 基于价键理论的交联机理分析尽管SA分子中的糖残基单元的5-位碳原子上存在解离羧根(5-COO-),但是Ba2+、Zn2+、Ca2+并非通过离子键与SA反应形成凝胶。根据价键理论,中心原子成键轨道的性质决定配位数[12],而中心原子的电子构型对参与成键的杂化轨道形成十分重要。如,Zn2+的5个3d轨道处于全充满状态,适合1个4s和3个4p轨道经sp3杂化形成4个成键轨道,指向正四面体的四个角[13]。因此,Zn2+与SA形成4配位化合物,具有正四面体构型。
1973年,Grant等[14]首次提出了Ca2+与SA与的“egg-box”模型。薛伟明等[15]提出SA与Ca2+形成“egg-box”的交联机理,即1个Ca2+与SA分子链段中2个GG片段通过与5-COO-和2-OH形成4个配位键进而形成配合物,因此Ca2+的配位数为4。结合表 1中配位数与成键杂化轨道和配合物构型的关系,可知Ca2+可能与配合物以d3s或dsp2方式杂化成键,形成正四面体或平面正方形构型。由于Ca2+的离子半径(0.1 nm)大于Zn2+ (0.074 nm),根据表 2的中心离子半径和配体半径比值(rM/rL)与配位数的关系,推断Ca2+最可能以dsp2方式杂化,形成平面正方形构型。中心离子的半径越大,在引力允许的条件下,其周围可容纳的配体越多,配位数越大,与Ca2+和Zn2+相比,Ba2+的离子半径(0.135 nm)最大,其配位数可能为5、6、7或8,而常见配位化合物配位数以4或6居多,故而推测Ba2+的配位数可能为6。配位数为6的中心原子或离子有spd4和sp3d2两种杂化方式,分别为三角棱柱和正八面体构型,结合表 2中rM/rL与配位数的关系,推断Ba2+与配体的构型为正八面体,即sp3d2杂化。
|
|
表 1 配位数与成键杂化轨道和配合物构型的关系[16] Table 1 Relationship between coordination number/bonding hybridized orbital and coordination configuration[16] |
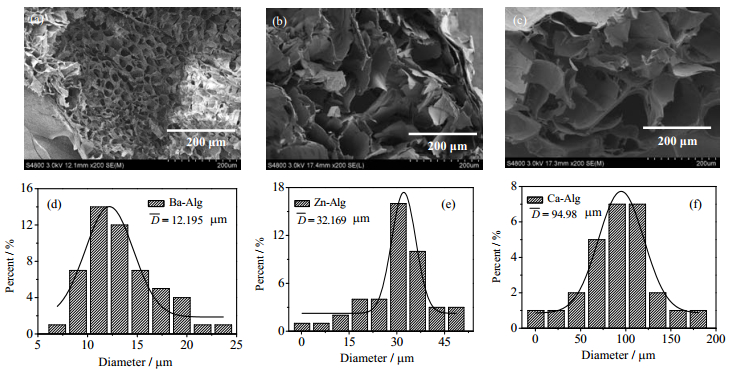
图 1(a)~(c)分别为Ba-Alg、Zn-Alg和Ca-Alg凝胶断面SEM图,显示三种凝胶均具有三维网孔结构,Ba-Alg凝胶结构最为致密,而Ca-Alg凝胶结构最为疏松。相应三种凝胶的平均孔径分别为12.2、32.2和95.0 μm,如图 1(d)~(f)所示。
|
图 1 海藻酸盐凝胶断面扫描电镜图(×200)及其孔径分布图 Fig.1 SEM micrographs of alginate gels (×200) and their corresponding pore size distribution profiles, acceleration voltage: 3 kV (a), (d) Ba-Alg gel (b), (e) Zn-Alg gel (c), (f) Ca-Alg gel |
结果表明,Ba2+与SA的交联密度远大于Zn2+和Ca2+。这是由于Ba2+与SA为6配位,因此一个Ba2+可带动6个糖残基单元(G或M)构型变化,交联位点多,凝胶结构致密;Zn2+通过4个配位键与SA分子中的G或M糖残基交联并形成正四面体构型,交联位点少于Ba2+;由于Ca2+的杂化轨道构型为平面正方形,只可与SA分子中两个相邻的GG片段中的2-OH和5-COO-在一个平面上形成4个配位键,极大限制了交联位点的数量,凝胶结构最为疏松。
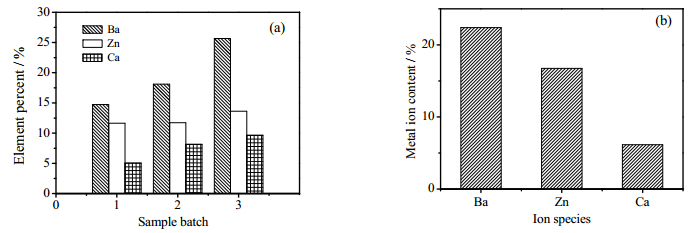
3.3 交联金属离子在凝胶中的含量分布为定量表征参与交联反应的金属离子在凝胶中的含量分布,采用EDS和ICP测定了三种凝胶中金属元素百分比含量。图 2(a)所示三批次EDS测定结果表明,三种凝胶中交联金属元素含量顺序均为:Ba > Zn > Ca;图 2(b)所示ICP测定结果表明,三种凝胶中交联金属离子含量分别为22.4%、16.74%和6.16%,即Ba2+ > Zn2+ > Ca2+。
|
图 2 海藻酸盐凝胶中交联金属离子含量测定结果 Fig.2 Metal ion contents in crosslinked alginate gels (a) EDS (b) ICP |
根据价键理论分析结果,Ba2+通过sp3d2轨道杂化方式形成6个配位键与SA分子中的G单元和M单元进行交联反应,反应位点多,参与交联的中心离子数量多。尽管只有4个配位键,Zn2+通过sp3杂化轨道形成的正四面体配位构型使之亦能够非选择性地与G单元和M单元进行交联反应,参与反应的离子数量较多。而Ca2+的平面四方形dsp2杂化轨道构型限制其只能与SA分子中的GG嵌段发生交联反应,单位质量凝胶中的Ca2+含量最少。
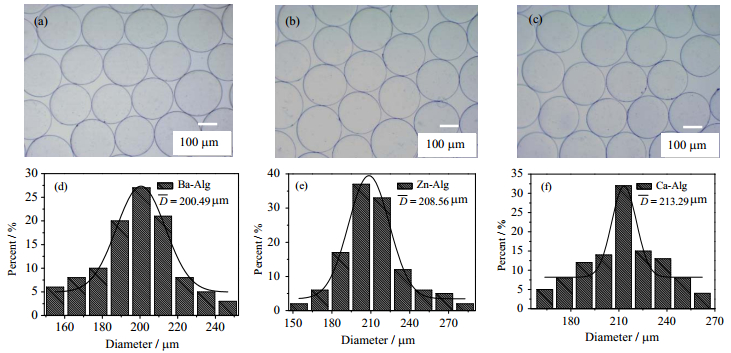
3.4 金属离子交联剂对凝胶微球形态的影响三种金属离子交联的海藻酸盐凝胶微球的光学形态和粒径分布如图 3所示。结果表明,采用Ba2+、Zn2+、Ca2+为交联剂制备的凝胶微球球形度好、表面光滑、粒径分布均匀、单分散性优良。在相同制备条件下,三种微球平均粒径分别为DBa-Alg = 200.5 μm、DZn-Alg = 208.6 μm和DCa-Alg = 213.3 μm,表明不同的金属离子交联剂导致凝胶粒径存在差异。
|
图 3 不同金属离子交联的海藻酸盐微球光学显微形态(×40)及其粒径分布 Fig.3 Morphology (×40) and size distribution of alginate microspheres crosslinked by various metal ions (a), (d) Ba-Alg gel (b), (e) Zn-Alg gel (c), (f) Ca-Alg gel |
由于Ba2+与SA分子链中的G、M糖残基配位结合能力强、交联位点数量多,SA液滴在BaCl2溶液中进行凝胶转化过程中,致密凝胶骨架的形成使微球具有沿径向向内收缩的较大应力,微球粒径较小;相比之下,Ca2+与SA分子交联位点少,SA液滴在凝胶化过程中形成疏松骨架,微球收缩应力小,粒径相对较大。该结果为研究金属离子交联机理提供了实验依据。
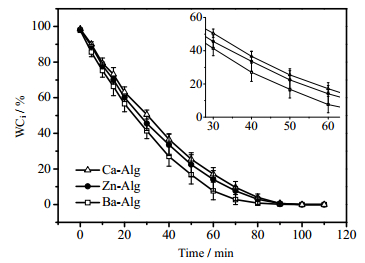
3.5 凝胶结构对干燥速率的影响凝胶的干燥速率与凝胶结构紧密联系。图 4为Ba-Alg、Zn-Alg和Ca-Alg三种凝胶的含水率随时间变化关系曲线,曲线的斜率表示凝胶的干燥速率。三种凝胶初始的平均含水率依次为97.8%、98.1%和98.5%;至50 min时,含水率分别减少为16.7%、22.4%和25.5%。因此,凝胶干燥速率由快到慢依次为Ba-Alg、Zn-Alg和Ca-Alg。
|
图 4 金属离子交联剂对海藻酸盐凝胶干燥速率的影响 Fig.4 Effects of metal ion crosslinkers on drying rates of alginate gels |
结合SEM实验结果可知,Ba-Alg凝胶最为致密,且孔道细长而窄小,而Ca-Alg凝胶结构最为疏松,孔道空间最大,因此凝胶中的相对含水量的大小为Ca-Alg > Zn-Alg > Ba-Alg,随着蒸发时间的延长,Ba-Alg最先达到平衡。因此凝胶的干燥速率进一步证明不同离子交联产生的凝胶结构具有差异性。
3.6 金属离子交联剂对凝胶热稳定性的影响TGA可以评估聚合物热稳定性及其降解方式[17]。图 5(a),(b)和(c)分别为Ba-Alg、Zn-Alg和Ca-Alg凝胶的热失重图。由图可知,Ba-Alg、Zn-Alg和Ca-Alg凝胶的热失重在第三、四阶段存在差异。第一步热失重过程发生在40~180℃,该过程为海藻酸盐凝胶失去结合水并伴随部分糖苷键的断裂,Ba-Alg、Zn-Alg和Ca-Alg的失重率分别为7.82%、9.79%和12.07%,说明三种金属离子交联形成的凝胶骨架致密程度对水分结合能力具有影响;第二个热失重阶段发生在180~400℃,Ba-Alg、Zn-Alg和Ca-Alg的分解温度分别为245.1、249.1和251.49℃,且失重率分别为33.63%、39.30%和48.82%,该过程为海藻酸盐凝胶裂解为较稳定的中间产物,对应糖苷键的断裂,相邻羟基以水分子的形式脱去,由于三种凝胶糖苷键碳位相似但数量不同,因此其热分解温度相近,骨架结构更为致密的Ba-Alg凝胶糖苷键数量更多,失重率最低;第三步发生在400~600℃,Ba-Alg和Zn-Alg凝胶的失重率分别为9.55%和9.63%,Ca-Alg凝胶没有明显的失重峰,该阶段对应中间产物的进一步分解,并脱羧放出CO2,产物部分碳化;第四阶段发生在600~800℃,对应碳化物进一步氧化分解并最终生成BaO、ZnO和CaO,其中Ba-Alg凝胶热解已达稳定,Zn-Alg和Ca-Alg凝胶仍有明显的热分解,产物相对质量比分别为49.01 %、25.77 %和24.94 %,金属元素Ba、Zn和Ca所占比重分别为43.89 %、20.70 %和17.82 %。
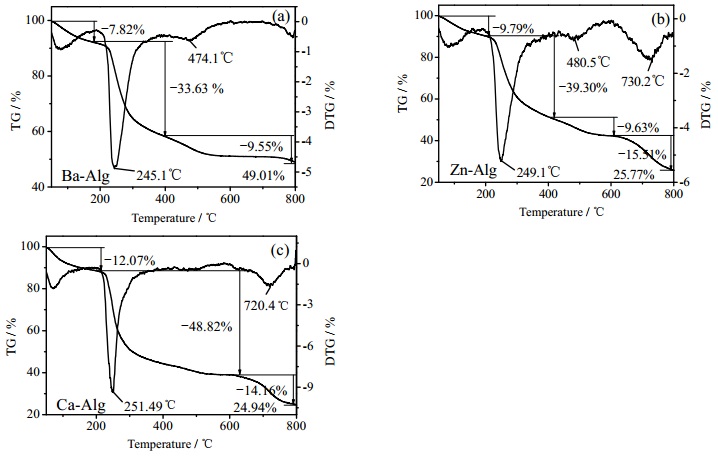
|
图 5 海藻酸盐凝胶热失重图谱 Fig.5 TGA profiles of different alginate gels (a) Ba-Alg gel (b) Zn-Alg gel (c) Ca-Alg gel |
可见,Ba-Alg热失重程度最小且600℃后结构更为稳定,表明Ba-Alg的凝胶骨架结构最致密,而Zn-Alg和Ca-Alg凝胶的热解程度相近。从最终产物中金属元素占比可见,Ba与O的配位数最多,而Zn、Ca与O的配位数相近,这与杂化轨道理论分析结果相一致。
3.7 BSA在不同金属离子交联凝胶中的扩散行为以BSA (Mw = 67 kDa)为模型分子,通过研究BSA在三种交联凝胶中的扩散行为,进一步关联不同金属离子交联剂对凝胶结构形成的影响。假设BSA为球形刚性大分子,在扩散过程中不与海藻酸盐凝胶发生化学反应,那么,基于凝胶网孔尺寸效应的内扩散过程将成为扩散的速率控制步骤。图 6为BSA在三种凝胶中的即时扩散量(qt)随时间变化的过程。结果表明,当扩散时间为50 min时,BSA在三种凝胶中的扩散基本达到动态平衡。此时,BSA在Ba-Alg、Zn-Alg和Ca-Alg凝胶中的吸附量分别为0.269、0.362和0.457 mg·g-1,表明三种金属离子交联形成的凝胶结构存在差异,Ba-Alg对BSA的扩散阻力最大,Ca-Alg的扩散阻力最小。
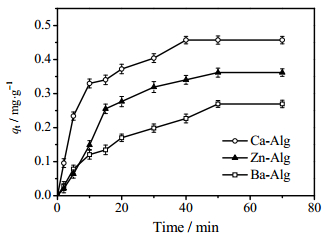
|
图 6 金属离子交联剂对BSA在海藻酸盐凝胶中扩散行为的影响 Fig.6 Effects of metal ion crosslinkers on diffusion behaviors of BSA in alginate gels |
图 7为采用CLSM观测的FITC-CS分子在凝胶微球中的扩散协同成膜反应状态,扩散时间均为30 min。结果表明,在Ba-Alg/CS、Zn-Alg/CS和Ca-Alg/CS凝胶微球表面上,形成的聚电解质复合膜的荧光强度分别为98.9、77.0和65.8 a.u,膜厚度分别为15.17、8.97和7.41 μm。
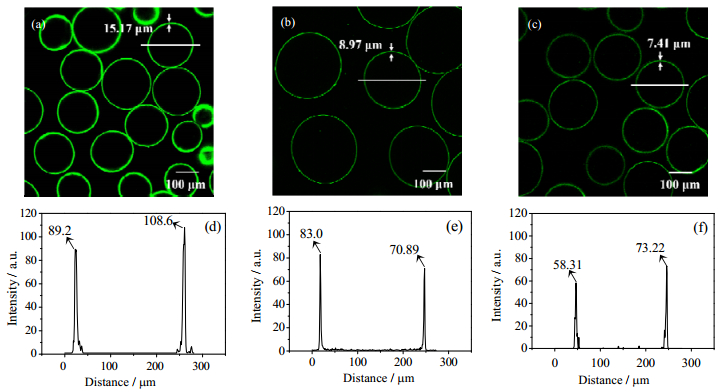
|
图 7 海藻酸盐微球的激光共聚焦荧光图像和膜层厚度; 微球直径的荧光强度图谱 Fig.7 CLSM fluorescent images and membrane thickness measurement of alginate microspheres together with fluorescent intensity profiles along the white line across the microspheres (a), (d) Ba-Alg/CS gel (b), (e) Zn-Alg/CS gel (c), (f) Ca-Alg/CS gel |
与BSA在凝胶中进行的单纯扩散行为不同,由于CS分子的糖残基上存在2-位质子化氨基而海藻酸盐分子的糖残基上存在5-位解离羧根,因此CS向海藻酸盐凝胶中扩散时伴随着静电络合反应并在凝胶表面形成一层半透性聚电解质复合膜。在CS的扩散过程中,Ba-Alg凝胶的致密骨架结构为CS提供了丰富的静电络合反应位点,CS在凝胶微球表面结合数量多,有利于沿微球径向形成厚且致密连续的膜层;相比之下,Ca-Alg凝胶的疏松大孔结构不能在扩散界面上为CS提供成膜反应的连续支撑骨架,微球表面的半透膜薄且存在缺陷,如图 7(c)所示。这一实验现象进一步为Ba2+、Zn2+、Ca2+与海藻酸盐分子的交联机理研究提供了实验支撑。
4 结论采用Ba2+、Zn2+、Ca2+为交联剂,制备具有不同凝胶基质结构的海藻酸盐凝胶,确定了三种金属离子通过配位键和海藻酸钠形成交联结构的机理,其中,配位数分别为6、4、4,杂化方式分别为sp3d2、sp3、dsp2。实验结果表明,Ca2+、Zn2+、Ba2+与SA联后,凝胶中结合的金属元素含量依次增加,凝胶结构趋于致密且热稳定性增加,对牛血清白蛋白分子的扩散阻力依次增大,致密的凝胶结构有利于壳聚糖在凝胶表面形成稳定连续的膜层。凝胶结构差异性不仅对微球中被包封组分的传质行为具有显著影响,而且对微球表面控释膜的形成及其控制传质能力亦具有调制作用。本文工作可为制备性能适宜的海藻酸盐凝胶微球提供了理论基础和调控方案。
| [1] | Chen K Y, Zeng S Y. Preparation and characterization of quaternized chitosan coated alginate microspheres for blue dextran delivery[J]. Polymers, 2017, 9(6): 1-12. |
| [2] | Wu X, Sun X, Pan M, et al. Sustained drug release from chitosan@alginate microspheres with porous core and closed outer surface pore structure[J]. Journal of Controlled Release, 2017, 259: E40-E40. DOI:10.1016/j.jconrel.2017.03.105. |
| [3] | Cuadros T R, Erices A A, Aguilera J M. Porous matrix of calcium alginate/gelatin with enhanced properties as scaffold for cell culture[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2015, 46: 331-342. DOI:10.1016/j.jmbbm.2014.08.026. |
| [4] | Sergeeva A S, Gorin D A, Volodkin D V. In-situ assembly of Ca-alginate gels with controlled pore loading/release capability[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2015, 31(39): 10813-10821. |
| [5] | Yu W, Lin J, Liu X, et al. Quantitative characterization of membrane formation process of alginate-chitosan microcapsules by GPC[J]. Journal of Membrane Science, 2010, 346(2): 296-301. DOI:10.1016/j.memsci.2009.09.049. |
| [6] | Comaposada J, Gou P, Marcos B, et al. Physical properties of sodium alginate solutions and edible wet calcium alginate coatings[J]. LWT-Food Science and Technology, 2015, 64(1): 212-219. DOI:10.1016/j.lwt.2015.05.043. |
| [7] | Baysal K, Arouguz A Z, Adiguzel Z, et al. Chitosan/alginate crosslinked hydrogels:preparation, characterization and application for cell growth purposes[J]. International Journal of Biological Macromolecules, 2013, 59(4): 342-348. |
| [8] | Huynh U T, Lerbret A, Neiers F, et al. Binding of divalent cations to polygalacturonate:a mechanism driven by the hydration water[J]. Journal of Physical Chemistry B, 2017, 120(5): 1021-1032. |
| [9] | Kaygusuz H, Evingur G A, Pekcan O, et al. Surfactant and metal ion effects on the mechanical properties of alginate hydrogels[J]. International Journal of Biological Macromolecules, 2016, 92: 220-224. DOI:10.1016/j.ijbiomac.2016.07.004. |
| [10] | Liu Y, Tong Y, Wang S, et al. Influence of different divalent metal ions on the properties of alginate microcapsules and microencapsulated cells[J]. Journal of Sol-Gel Science and Technology, 2013, 67(1): 66-76. DOI:10.1007/s10971-013-3051-4. |
| [11] | M rch Y A, Donati I, Strand B L, et al. Effect of Ca2+, Ba2+, and Sr2+ on alginate microbeads[J]. Biomacromolecules, 2006, 7(5): 1471-1480. DOI:10.1021/bm060010d. |
| [12] | Agulhon P, Markova V, Robitzer M, et al. Structure of alginate gels:interaction of diuronate units with divalent cations from density functional calculations[J]. Biomacromolecules, 2012, 13(6): 1899-907. DOI:10.1021/bm300420z. |
| [13] | GUO Yan-hua(郭艳华). A method for judging the spatial configuration of coordination compounds with coordination number of four(配位数为四的配合物空间构型的判断方法)[J]. Journal of Continuing Higher Education(高等继续教育学报), 2003, 16(1): 35-37. DOI:10.3969/j.issn.1006-7353.2003.01.012. |
| [14] | Grant G T, Morris E R, Rees D A, et al. Biological interactions between polysaccharides and divalent cations:the egg-box model[J]. FEBS Letters, 1973, 32(1): 195-198. DOI:10.1016/0014-5793(73)80770-7. |
| [15] | XUE Wei-ming(薛伟明), YU Wei-ting(于炜婷), LIU Xiu-dong(刘袖洞). Chemical method of breaking the cell-loaded sodium alginate/chitosan microcapsules(载细胞海藻酸钠/壳聚糖微胶囊的化学破囊方法研究)[J]. Chemical Journal of Chinese Universities(高等学校化学学报), 2004, 25(7): 1342-1346. DOI:10.3321/j.issn:0251-0790.2004.07.027. |
| [16] | JIN Dou-man(金斗满). Methods in investigation of coordination chemistry(配位化学研究方法)[M].Beijing(北京): Science Press(科学出版社), 1996: 25-83. |
| [17] | Zhang J, Ji Q, Wang F, et al. Effects of divalent metal ions on the flame retardancy and pyrolysis products of alginate fibers[J]. Polymer Degradation & Stability, 2012, 97(6): 1034-1040. |




