2. 黑龙江工程学院 土木与建筑工程学院,黑龙江 哈尔滨 150050
2. College of Civil and Architectural Engineering, Heilongjiang Institute of Technology, Harbin 150050, China
随着水生态环境中广泛检测出抗生素类药物,引起了人们对水生态系统以及人类健康的日益关注[1]。其中,磺胺甲恶唑(SMX)作为一种广谱磺胺类抗生素是我国最常用的一类抗生素[2],长期暴露于此物质中可导致人与生物机体产生抗药性,SMX在低含量的情况下,毒性并不显著,但长期摄入,会损害肾脏,降低机体免疫力[3],且大量残余的SMX经过长年的累积会对地表水及地下水造成较为严重的损坏且这种损害不可修复。除此之外,如果微生物长期存在于痕量抗生素环境中就会通过不同途径破坏生态环境的多样性[2]并对动物发育造成不利影响。由于SMX的抗菌性,很难被活性污泥吸附或者生物降解。所以在传统活性污泥法处理过程中很难被去除[4],在污水处理厂二沉池出水中能重复检测出较高浓度的SMX。此外,研究表明在饮用水处理中,传统的混凝、沉淀和砂滤同样不能有效地去除SMX[1]。
近年来基于硫酸根自由基(SO4·-)的过硫酸盐高级氧化技术具有良好的发展前景[5],研究表明,UV、热、金属活化过一硫酸盐(PMS)可有效降解水中的SMX。Qi等[6]研究发现,微波活化过硫酸盐产生SO4·-氧化SMX符合假一级动力学模型,且具有较高的反应速率;在130℃的微波作用下,0.5 mmol·L-1的SMX在16 min内完全降解。Antoine等[7]对Fe0活化过硫酸盐体系氧化去除水中SMX的效能进行了研究,结果表明,活化剂Fe0能够促进SO4·-的产生,SMX(39.5 µmol·L-1)的去除率随氧化剂过硫酸盐浓度增加而增大,当过硫酸盐的浓度达到1 mmol·L-1时,反应2 h后SMX的去除率可达到95%。Lin等[8]在用波长为254 nm的紫外光(UV)活化过硫酸钠(SPS)产生SO4·-处理苯酚溶液时发现,在(25±2)℃的环境下,SPS的初始浓度为84 mmol·L-1,苯酚的初始浓度为0.5 mmol·L-1时,反应20 min内UV/SPS体系能够快速将苯酚降解并且降解率能够达到100%。
然而,采用声、光、热等活化过硫酸盐方式存在能耗较高、运行维护困难、不适合大规模生产应用等问题;相比而言,过渡金属离子活化过硫酸盐具有快速、高效和成本低等优势[9]。其中,过渡金属离子Co2+的催化效果最好,目前理论研究较多,但其本身具有的毒性对环境危害不容忽视,所以环境友好方法一直是科研工作者追求的目标。相比而言,Fe2+的环境友好性及高效与低成本性,使其具有广阔的应用前景,成为应用研究中广泛采用的过硫酸盐活化剂。大量针对Fenton与类Fenton氧化体系的研究表明,Fe3+与Fe2+之间的转化过程缓慢,生成Fe3+的量明显导致铁污泥的累积,降低体系的反应效率,成为限制Fe2+/PMS体系氧化效率提高的关键影响因素。
羟胺(NH2OH)作为一种公认的强还原剂,常被用作活性氧化剂的抗氧化剂[10]。研究表明,NH2OH在Fenton和类Fenton体系中可以促进Fe3+和Fe2+之间的快速转化。Chen等[11]发现与传统Fenton技术相比,在体系中加入NH2OH能够有效促进Fe3+向Fe2+的转化,进而加速·OH的形成,增强体系氧化降解有机污染物的能力;同时Zou等[12]也报道了NH2OH能提高Fe2+/PMS体系中Fe3+向Fe2+的转化效率,从而有效促进苯甲酸的降解,该研究发现,反应15 min,在Fe2+/PMS体系中仅能去除6%的苯甲酸,而在Fe2+/NH2OH/PMS体系中苯甲酸的降解率可达80%。然而,现有研究未见NH2OH强化Fe2+/PMS氧化降解SMX的研究。
针对上述分析,本研究提出采用Fe2+/NH2OH联合活化PMS降解SMX,主要考察了该体系对SMX的降解效能,并进一步分析了体系中PMS、SMX、Fe2+浓度及pH、温度等参数变化对降解SMX过程产生的影响。
2 实验(材料和方法) 2.1 实验过程所有实验在外壁由铝箔纸包裹的锥形瓶中进行,锥形瓶置于磁力搅拌器上,反应体积为20 mL,在开始实验前,反应体系用高纯N2吹脱15 min以排除溶液中溶解氧影响,其中SMX浓度为0.01 mmol·L-1,活化剂Fe2+为12.5 µmol·L-1,NH2OH浓度为37.5 µmol·L-1,反应过程中不断进行搅拌,实验在pH=3的条件下进行,反应温度控制在(25±0.5)℃。加入0.1 mmol·L-1的氧化剂PMS,反应开始计时,每隔一段时间取样,立即加入已备好的相同体积的甲醇中以淬灭反应。所有的实验至少重复两次,图中数据为平均值。
2.2 分析方法SMX的浓度使用Waters Alliance E2695高效液相色谱仪(美国沃特斯公司)测量,其液相色谱检测条件为:流动相[甲醇]:[0.3%甲酸] = 30:70,检测波长265 nm,进样量100 µL,流量1.0 mL·min-1,柱温30℃。
2.3 实验药品99.999%过一硫酸氢钾和99.999%磺胺甲恶唑购自美国Sigma公司;硫酸亚铁(分析纯),羟胺(分析纯),氢氧化钠(分析纯)购自天津市致远化学试剂有限公司,碳酸氢钠(分析纯)购自天津博迪化工股份有限公司,叔丁醇(分析纯)购自天津市光复精细化工研究院,甲醇(HPLC)购自天津市科密欧化学试剂有限公司,硫酸(分析纯),北京北化精细化学品有限责任公司,99.999%氮气购自北京市亚南气体有限公司。所有化学试剂在使用之前不再进一步提纯,溶液均采用超纯水配制。
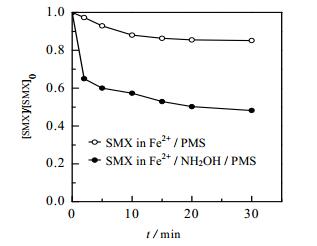
3 结果与讨论 3.1 Fe2+/NH2OH/PMS体系对SMX的氧化去除效能图 1给出了SMX在是否存在NH2OH的Fe2+/PMS体系中降解效能的变化情况。可以看出,反应30 min时,SMX在Fe2+/PMS体系中降解率仅能达到14.7%,而当该体系引入NH2OH后,SMX的降解率可明显提高,相应去除率可达到51.8%。基于Chen[11]和ZOU[12]的研究报道分析,在Fe2+/PMS体系中NH2OH的引入能够促进Fe3+和Fe2+之间的循环,加速Fe3+向Fe2+的转化,从而提高SMX的降解去除率。
|
图 1 Fe2+/NH2OH/PMS体系氧化SMX的效能曲线 Fig.1 Performance curves of the oxidization of SMX by Fe2+/NH2OH/PMS systems [SMX]0 = 10 µmol·L-1, [PMS]0 = 0.1 mmol·L-1, [Fe2+]0 = 12.5 µmol·L-1, [NH2OH]0 = 37.5 µmol·L-1, T = (25±0.5)℃, pH = 3.0 |
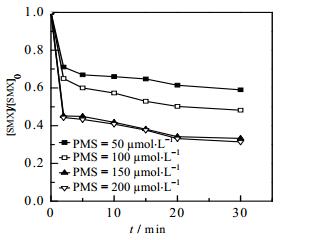
目标物的降解可能会随着氧化剂投量的增加而增大,图 2给出了不同PMS投量对SMX降解效率的影响,可以看出Fe2+/NH2OH/PMS体系降解SMX反应,随着PMS浓度由50 µmol·L-1逐渐增加到150 µmol·L-1,反应30 min内SMX降解效率逐渐增大至66.7%,继续增大PMS浓度至200 µmol·L-1,SMX去除率未见明显增加。出现这种情况的可能原因是,当PMS的投量增加时,体系中活性物种产量将明显增加,一方面,大量的活性物种会发生自由基湮灭反应[13],进而降低SMX去除效率;另一方面,活性物种产量的增加也会增大其与体系中NH2OH的反应发生机率[14],降低Fe3+与Fe2+之间的转化效率,抑制活化过程,间接影响SMX的降解率。
|
图 2 不同PMS浓度对Fe2+/NH2OH/PMS体系降解SMX的影响 Fig.2 Effects of PMS concentration on the degradation of SMX in Fe2+/NH2OH/PMS systems [SMX]0 = 10 µmol·L-1, [Fe2+]0 = 12.5 µmol·L-1, [NH2OH]0 = 37.5 µmol·L-1, T = (25±0.5)℃, pH = 3.0 |
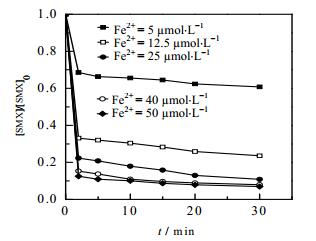
在Fe2+/NH2OH/PMS体系中Fe2+作为促进PMS分解产生SO4·-的活化剂存在,所以Fe2+浓度在一定程度上会直接影响该体系对SMX的降解。图 3给出了不同Fe2+浓度对该体系降解SMX的影响。
|
图 3 不同Fe2+浓度对Fe2+/NH2OH/PMS体系降解SMX的影响 Fig.3 Effects of Fe2+ concentration on the degradation of SMX in Fe2+/NH2OH/PMS systems [SMX]0 = 10 µmol·L-1, [PMS]0 = 0.1 mmol·L-1, [NH2OH]0 = 0.2 mmol·L-1, T = (25±0.5)℃, pH = 3.0 |
从图 3中可以看出,SMX降解效果随着Fe2+浓度的增加而逐渐增大,当Fe2+浓度从5 µmol·L-1增加到40 mmol·L-1,反应30 min内SMX的降解率由39.1%增大到93.2%,继续增大Fe2+浓度至50 mmol·L-1时,SMX降解率未见明显增加。此过程中,当Fe2+浓度为12.5 μmol·L-1,[PMS]0:[Fe2+]0= 2.5:1时,SMX去除率可达到76.3%;相比Ahmed等[15]研究Co2+/PMS体系降解SMX(50μmol·L-1)过程,当[PMS]0: [Co2+]0= 1:1(PMS为250 μmol·L-1)时,SMX去除率为77%,可知在Fe2+浓度较低的情况下,SMX即有较好的降解效率,说明Fe2+活化PMS具有低浓度高促进的作用。值得指出的是,当Fe2+浓度增大到一定程度时(40 mmol·L-1),SMX的降解率升高的并不明显,且SMX未被完全去除,可能的原因是,高浓度的Fe2+有效促进了自由基的产生速率,增加了活性物种的湮灭反应[13]和其与NH2OH反应的发生[14],致使PMS最终被消耗殆尽所致。
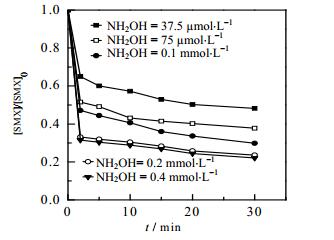
3.4 NH2OH浓度影响研究NH2OH即可以促进Fe2+/PMS体系中Fe3+向Fe2+的转变,也可消耗体系产生的活性物种,从而影响目标物SMX的降解,图 4给出了不同NH2OH浓度对Fe2+/NH2OH/PMS体系降解SMX的影响。由图 4可以看出,随着NH2OH浓度从37.5 µmol·L-1增加至0.4 mmol·L-1时,SMX的降解率明显增大,最高去除率可达77.9%;但对于NH2OH浓度由0.2 mmol·L-1变化为0.4 mmol·L-1时,体系SMX降解率变化不大。这与Zou[12]在研究Fe2+/NH2OH/PMS体系降解苯甲酸时的NH2OH投加量的影响结果是相似的,其原因可能是,一定范围内,随着NH2OH浓度的增加,体系中产生活性物种增多,有效地增加了SMX的降解率,但当NH2OH增加至一定浓度时,考虑其在本研究体系中(pH = 3)以NH3OH+为主要存在形式,NH3OH+与体系活性物种(SO4·-和·OH)具有较高的反应速率(SO4·-,k = 1.5×107 mol-1·L·s-1[14];·OH,k < 5.0×108 mol-1·L·s-1[16]),当NH3OH+的浓度达到一定程度时,体系中短时间内活化产生SO4·-和·OH均能与NH3OH+发生反应[12],通过竞争体系自由基而抑制SMX的降解过程。
|
图 4 不同NH2OH浓度对Fe2+/NH2OH/PMS体系降解SMX的影响 Fig.4 Effects of NH2OH concentration on the degradation of SMX in Fe2+/NH2OH/PMS systems [SMX]0 = 10 µmol·L-1, [PMS]0 = 0.1 mmol·L-1, [Fe2+]0 = 12.5 µmol·L-1, T = (25±0.5)℃, pH=3.0 |
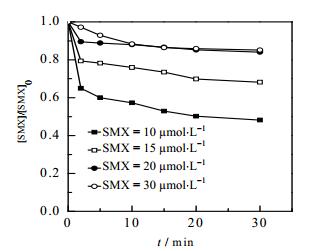
目标物初始浓度的变化会直接影响处理技术对其去除效能,图 5给出了不同SMX浓度对Fe2+/NH2OH/PMS体系降解SMX的影响,可以看出,随着SMX浓度由10 µmol·L-1逐渐增大到20 µmol·L-1,反应30 min内SMX降解率从51.8%逐渐减少到14.9%,继续增大SMX浓度至30 µmol·L-1,SMX降解率不再变化,这与现有报道关于微波活化过硫酸盐氧化SMX[6]和O3氧化SMX[17]的研究结论是一致的。出现这一现象的原因可能是,一方面在体系氧化剂投量一定时,过高的SMX可能会将其完全消耗,进而导致高浓度的SMX去除率较低。另一方面PMS对SMX的降解能力受到一定程度的抑制,总的降解量虽大于低浓度的,但是由于SMX浓度的增加,导致其降解率降低。
|
图 5 不同SMX浓度对Fe2+/NH2OH/PMS体系降解SMX的影响 Fig.5 Effects of SMX concentration on the degradation of SMX in Fe2+/NH2OH/PMS systems [PMS]0 = 0.1 mmol·L-1, [Fe2+]0 = 12.5 µmol·L-1, [NH2OH]0 = 37.5 µmol·L-1, T = (25±0.5)℃, pH = 3.0 |
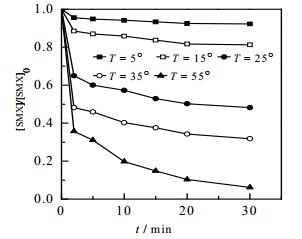
为了考察温度对Fe2+/NH2OH/PMS体系降解SMX的影响,分别在5~55℃进行降解动力学实验。图 6给出了不同温度对该体系降解SMX的影响。可以明显看出,温度对体系降解SMX有非常重要的影响,体系中SMX的降解率随着温度的升高呈明显增大趋势,这与Nie等[18]在研究热活化过硫酸盐氧化氯霉素时得出的研究结论是一致的。随着温度由5℃增大到55℃,反应30 min内,SMX的降解率由7.7%增大到93.8%;且在室温T = 25℃时,体系中产生的活性氧化基团可以降解51.8%的SMX,产生这种现象的原因可能是,由式(1)可知,温度升高促进PMS分解产生更多的SO4·-,强化了体系对SMX的降解效果,且Fe2+活化PMS产生SO4·-和·OH为吸热反应[16],升高温度有利于反应的进行。
|
图 6 不同温度对Fe2+/NH2OH/PMS体系降解SMX的影响 Fig.6 Effects of temperature on the degradation of SMX in Fe2+/NH2OH/PMS system [SMX]0 = 10 µmol·L-1, [PMS]0 = 0.1 mmol·L-1, [Fe2+]0 = 12.5 µmol·L-1, [NH2OH]0 = 37.5µmol·L-1, pH = 3.0 |
| $ {{\rm S}_2}{\rm O}_8^{2 - } + {\rm thermal} \to 2{\rm SO}_4^{\cdot - } $ | (1) |
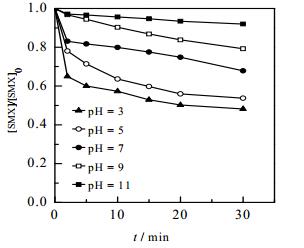
溶液的pH值对化学反应过程有很大的影响,不仅影响目标物与氧化剂的存在形态,也影响金属离子的溶解度,另外溶液的pH值在很大程度上会影响Fe2+/NH2OH/PMS体系中NH2OH的存在形式及在反应体系中所起到的作用[19]。图 7给出了不同pH值对Fe2+/NH2OH/PMS体系降解SMX的影响。可以看出,SMX的降解效果随pH的增大而减小,随着pH由3增加到11的过程中,反应30 min内SMX的降解率由51.8%降低到8.0%。不同pH值下,NH2OH在水溶液中的存在形式不同,直接影响其在氧化体系中所起的作用。当溶液pH小于5.96时,羟胺(pKa= 5.96)在水溶液中以NH3OH+的形式存在,SO4·-和·OH与羟胺的反应速率常数较低(k = 1.5×107 mol-1·L·s-1[14],k < 5.0×108 mol-1·L·s-1[16]),羟胺在体系促进Fe3+/Fe2+循环的作用得以强化[11],因而pH = 3时,体系能够对SMX取得最好的降解效果;当体系pH高于3.0时,体系中Fe2+和Fe3+将形成Fe(OH)2与Fe(OH)3,研究表明Fe(OH)2较Fe2+具有更强的活化PMS能力[20],然而体系中形成的Fe(OH)3沉淀,大大降低了体系中溶解性的铁离子,从而抑制铁离子循环过程,致使SMX降解效率降低;此外,当溶液pH值大于5.96时,羟胺在溶液中以NH2OH形式存在,其与SO4·-和·OH反应能力增强(k = 8.5×108 mol-1·L·s-1[14],k = 9.5×109 mol-1·L·s-1[16]),而此时Fe3+主要以Fe(OH)3沉淀形式存在[21],致使pH = 11时,体系中基本不存在PMS活化需要的金属离子,完全抑制SMX的降解去除。这一研究现象与Zou等[12]研究Fe2+/NH2OH/PMS体系降解苯甲酸时所受pH值的影响结论一致。同时,SMX的离解常数为1.6和5.7[22],当pH = 2.0~3.0时,SMX主要以非质子化形式存在于溶液中,这时不易被SO4·-和·OH氧化。而当pH = 3.0~6.0时,SMX会发生去质子化作用,主要以分子形态和阴离子形态存在于溶液中,与SO4·-和·OH有较高的反应活性。当pH = 6.0~9.0时,SMX中氨基会发生离解,此时SMX主要以阴离子形态为主导,从静电角度而言,阴离子形态的SMX会与SO4•-和·OH之间产生静电斥力,不利于其氧化分解[22]。
|
图 7 不同pH值对Fe2+/NH2OH/PMS体系降解SMX的影响 Fig.7 Effects of pH on the degradation of SMX in Fe2+/NH2OH/PMS systems [SMX]0 = 10 µmol·L-1, [PMS]0 = 0.1 mmol·L-1, [Fe2+]0 = 12.5 µmol·L-1, [NH2OH]0 = 37.5 µmol·L-1, T = (25±0.5)℃ |
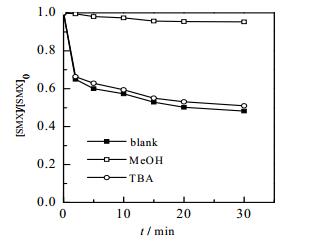
活化PMS产生的活性物种主要有SO4·-、·OH、SO•-三种自由基,为了确定体系自由基进行了甲醇(kSO•-4= 2.5×107 mol-1·L·s-1[14],k·OH = 9.7×106 mol-1·L·s-1[16])、叔丁醇(kSO•-= 8.0×105 mol-1·L·s-1[16],k·OH = 6.0×108 mol-1·L·s-1[14])抑制自由基研究,图 8给出了甲醇、叔丁醇对Fe2+/NH2OH/PMS体系降解SMX的影响。可以看出,叔丁醇对SMX的降解率影响较小,仅抑制了约3%的SMX去除;而甲醇却抑制了近45%的SMX降解,可见,体系中存在的主要活性物种为SO4·-、·OH两种自由基,且SO4·-为主导自由基。
|
图 8 甲醇、叔丁醇对Fe2+/NH2OH/PMS体系降解SMX的影响 Fig.8 Effects of methanol and tert-butanol on the degradation of SMX in Fe2+/NH2OH/PMS systems [SMX]0 = 10 µmol·L-1, [PMS]0 = 0.1mmol·L-1, [Fe2+]0 = 12.5 µmol·L-1, [NH2OH]0= 37.5 µmol·L-1, [CH3OH]0 = 0.2 mmol·L-1, [C(CH3)3OH]0 = 0.2 mmol·L-1, T = (25±0.5)℃, pH = 3.0 |
Fe2+/PMS是一种环境友好型的高级氧化技术,可有效去除水中绝大多数难降解有机污染物,然而由于缓慢的Fe3+向Fe2+转换以及大量的铁泥积累,限制了该技术的推广应用。在本研究Fe2+/NH2OH/PMS体系中,NH2OH的加入,有效地缓解了Fe2+/PMS体系存在的问题,仅投加12.5 µmol·L-1的Fe2+离子即可实现51.8%的SMX (10 µmol·L-1)降解;虽然当SMX浓度过高时,目标物的降解受到了明显的抑制,但在一定范围内随着PMS、Fe2+、NH2OH浓度增大,可有效促进体系对SMX的降解,故可通过调整氧化剂与活化剂的投量解决此问题;pH值的增加会抑制SMX的降解,然而相比单纯芬顿体系通常受到严格的pH值(pH = 3)限制而言,本研究体系所适应的pH范围明显增加(pH = 2.0~6.0),且此范围内较低浓度的Fe2+即可促进PMS迅速降解目标物,而此浓度的Fe2+在水中广泛存在,因此,针对实际SMX污染而言,可通过适当调节体系的pH值,达到最佳目标物去除效果。在Fe2+/NH2OH/PMS体系中,通过快速产生具有强氧化能力的活性物种SO4·-和·OH,大多数难降解有机污染物能够被有效降解,因此在Fe2+/PMS体系中加入羟胺是提高难降解有机污染物降解速率的一种有效水处理方法。
| [1] | Padhye L P, Yao H, Kung'u F T, et al. Year-long evaluation on the occurrence and fate of pharmaceuticals, personal care products, and endocrinedisrupting chemicals in an urban drinking water treatment plant[J]. Water Research , 2014, 51(6): 266-276. |
| [2] | YIN Ren-li (银仁莉). Study on sulfamethoxazoledegradation by ultrasound/ozone oxidation process (超声联合臭氧技术降解磺胺 甲恶唑的研究) [D]. Harbin (哈尔滨): Harbin Institute of Technology (哈尔滨工业大学), 2014. http://cdmd.cnki.com.cn/Article/CDMD-10213-1014083316.htm |
| [3] | WANG Ran(王冉), LIU Tie-zheng(刘铁铮), WANG Tian(王恬). The fate of antibiotics in environment and its ecotoxicoloyg:a review(抗生素在环境中的转归及其生态毒性)[J]. ActaEcologigcSinica(生态学报) , 2006, 26(1): 265-270. |
| [4] | Michael I, Rizzo L, McArdell C S, et al. Urban wastewater treatment plants as hotspots for the release of antibiotics in the environment:a review[J]. Water Research , 2013, 47(3): 957-995. DOI:10.1016/j.watres.2012.11.027. |
| [5] | WANG Ping (王萍). Activation methods of advanced persulfate oxidation (过硫酸盐高级氧化技术活化方法研究) [D]. Qingdao(青岛): Ocean University of China (中国海洋大学), 2010. http://cdmd.cnki.com.cn/article/cdmd-10423-1011029282.htm |
| [6] | Qi C D, Liu X T, Lin C Y. Degradation of sulfamethoxazole by microwave-activated persulfate:kinetics, mechanism and acute toxicity[J]. Chemical Engineering Journal , 2014, 249: 6-14. DOI:10.1016/j.cej.2014.03.086. |
| [7] | Ghauch A, Ayoub G, Naim S. Degradation of sulfamethoxazole by persulfate assisted micrometric Fe0 in aqueous solution[J]. Chemical Engineering Journal , 2013, 228: 1168-1181. DOI:10.1016/j.cej.2013.05.045. |
| [8] | Lin Y T, Liang C J, Chen J H. Feasibility study of ultraviolet activated persulfate oxidation of phenol[J]. Chemosphere , 2011, 82(8): 1168-1172. DOI:10.1016/j.chemosphere.2010.12.027. |
| [9] | YAN Jing-chun (晏井春). Advanced oxidation technologies based on activated persulfate using iron-contained compounds for organic pollutants remediation (含铁化合物活化过硫酸盐及其在有机污染物修复中的应用) [D]. Wuhan (武汉): Huazhong University of Science and Technology (华中科技大学), 2012. http://cdmd.cnki.com.cn/Article/CDMD-10487-1012361863.htm |
| [10] | Krishna M C, DeGraff W, Hankovszky O H, et al. Studies of structure-activity relationship of nitroxide free radicals and their precursors as modifiers against oxidative damage[J]. Journal of Medicinal Chemistry , 1998, 41(18): 3477-3492. DOI:10.1021/jm9802160. |
| [11] | Chen L W, Ma J, Li X C, et al. Strong enhancement on Fenton oxidation by addition of hydroxylamine to accelerate the ferric and ferrous iron cycles[J]. Environmental Science and Technology , 2011, 45(9): 3925-3930. DOI:10.1021/es2002748. |
| [12] | Zou J, Ma J, Chen L W, et al. Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(Ⅲ)/Fe(Ⅱ) cycle with hydroxylamine[J]. Environmental Science and Technology , 2013, 47(20): 11685-11691. DOI:10.1021/es4019145. |
| [13] | Xu X G, Li X Z. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion[J]. Separation and Purification Technology , 2010, 72(1): 105-111. DOI:10.1016/j.seppur.2010.01.012. |
| [14] | Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data , 1988, 17(3): 1027-1284. DOI:10.1063/1.555808. |
| [15] | Ahmed M M, Barbati S, Dourmeng P, et al. Sulfate radical anion oxidation of diclofenac and sulfamethoxazole for water decontamination[J]. Chemical Engineering Journal , 2012, 197: 440-447. DOI:10.1016/j.cej.2012.05.040. |
| [16] | Buxton G V, Greenstock C L, Helman W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution[J]. Journal of Physical and Chemical Reference Data , 1988, 17(2): 513-886. DOI:10.1063/1.555805. |
| [17] | Gao S S, Zhao Z W, Xu Y P, et al. Oxidation of sulfamethoxazole (SMX) by chlorine, ozone and permanganate-a comparative study[J]. Journal of Hazardous Materials , 2014, 274(12): 258-269. |
| [18] | Nie M H, Yang Y, Zhang Z J, et al. Degradation of chloramphenicol by thermally activated persulfate in aqueous solution[J]. Chemical Engineering Journal , 2014, 246: 373-382. DOI:10.1016/j.cej.2014.02.047. |
| [19] | LI Xue-yan (李学艳). Removal of earthy-musty compound 2-methyliosborneol from drinking source water (饮用水源中土霉味 s 物质 2-MIB 去除技术研究) [D]. Harbin (哈尔滨): Harbin Institute of Technology (哈尔滨工业大学), 2007. http://d.wanfangdata.com.cn/Thesis/D274723 |
| [20] | PignatelloJ J, Oliveros E, MacKay A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J]. Critical Reviews in Environmental Science and Technology , 2006, 36(1): 1-84. DOI:10.1080/10643380500326564. |
| [21] | Stefánsson A. Iron(Ⅲ) hydrolysis and solubility at 25℃[J]. Environmental Science and Technology , 2007, 41(17): 6117-6123. DOI:10.1021/es070174h. |
| [22] | Boreen A L, Arnold W A, Mcneill K. Photochemical fate of sulfa drugs in the aquatic environment:sulfa drugs containing five-membered heterocyclic groups[J]. Environmental Science and Technology , 2004, 38(14): 3933-3940. DOI:10.1021/es0353053. |




