铅离子(Pb2+)是一种广泛存在于工业废水中的高毒性重金属污染物,Pb2+与Hg2+、Cd2+、As(III)和Cr(VI)被国家环保部列为5种水体中优先控制排放的重金属污染物[1]。Pb2+通过污染的饮用水和食物在人体中富集,引起中枢神经系统、生殖系统、造血系统和肾、肝、心脏等器官的损伤,铅对儿童智力的损伤尤为显著,且不可逆[2, 3]。因此,含铅废水在排放前必须进行有效处理,目前处理含铅废水的方法主要有化学沉淀法、离子交换法、电化学法、膜分离法和吸附法等[1, 2, 4, 5]。其中吸附法具有材料来源广、成本低廉、节能、操作简单、吸附剂可重复利用等优势,而且适合处理低浓度、大体积的重金属废水[1, 5, 7]。目前活性炭[8]、沸石[9]、壳聚糖[10, 11]等的改性材料,磁性纳米复合材料[12, 13]和聚合物微球材料[2, 3, 6, 7]已广泛用于从水溶液中吸附Pb2+的研究。近年来,具有三维网络结构的粒状聚合物水凝胶材料因吸附速率快、吸附容量大、pH适用范围广、易于实现固液分离和重复利用而在重金属废水处理领域引起了广泛关注[11, 14, 15],但是目前还存在着吸附后废水中重金属离子的残余浓度较高而难以实现达标排放的问题[15, 16]。富含羧基的聚合物材料对重金属离子具有优异的吸附性能,可使低浓度Pb2+离子废水实现达标排放[6, 17]。粒状聚合物的制备方法主要有反相微乳液聚合法、反相悬浮聚合法、分散聚合法和沉淀聚合法等[14],其中反相悬浮法具有反应条件温和、副反应少、反应时间短、产品后处理简单及可直接获得粒径分布在微米到毫米级别的聚合物微球的优势[2, 3, 14, 18]。
本文采用反相悬浮聚合法制备了粒状交联聚丙烯酸钠 (gc-PAANa) 凝胶材料,并对该材料进行了FT-IR,SEM和TGA等表征和吸水率测试,以gc-PAANa为吸附剂研究了静态吸附条件下对Pb2+的吸附性能。
2 实验部分 2.1 实验原料丙烯酸(AA)单体、失水山梨醇单硬脂酸酯(Span60) 、硝酸铅,天津光复精细化工研究所;N,N-亚甲基双丙烯酰胺(MBA),优级纯,上海伊卡生物有限公司;过硫酸钾(KPS),上海强顺化学试剂有限公司;氢氧化钠(NaOH),天津永大化学试剂厂;无水甲醇,成都金山化学试剂厂。以上试剂无特别说明均为分析纯,所用水为蒸馏水。
2.2 gc-PAANa凝胶的制备(1) AA单体的预处理:取150 mL AA单体溶液(1.05 g×mL-1)与1.75 mol NaOH固体配成的溶液缓慢混合后,加入2.0 g 活性炭,在45℃温度下用活性炭吸附2 h,以除去阻聚剂,过滤后用蒸馏水定容,配成中和度为80%、AA浓度为0.315 g×mL-1的AANa单体溶液(500 mL)。
(2) 水相的制备:量取32 mL预处理过的AANa单体溶液,用0.1mol×L-1的NaOH溶液调至pH=10~11。准确称取0.09 g MBA加入到单体溶液中,转移至250 mL锥形瓶中混合均匀得到水相。
(3) 油相的配制:量取120 mL环己烷加入到带有机械搅拌装置、N2导入管和冷凝管的500 mL三口烧瓶中,准确称取0.6 g Span60加入到环己烷中;水浴升温至40oC开动机械搅拌20 min,使分散剂完全溶于环己烷中获得油相。
(4) 聚合反应:将水相与油相混合后,开动机械搅拌以500~600 r×min-1 的转速高速剪切单体溶液30 min,使单体以液滴的形式分散于油相中,然后转速调为200~300 r×min-1;通N2 30 min,水浴升温至55oC后开始缓慢滴加10 mL含0.10 g KPS的引发剂溶液,反应4 h后再升温至65℃,保温2 h;当得到较多的粒状凝胶产品时加入100 mL无水甲醇继续搅拌30 min,之后在甲醇中浸泡12 h,除去聚合物中未反应的交联剂和分散剂。
(5) 产物的后处理:过滤分离得到粒状凝胶产物,水洗3~4次至pH为中性;将水洗后的产物置于60℃鼓风干燥箱中干燥12 h,再置于80℃真空干燥箱中干燥6 h;轻度研磨后过40目筛,得到实验用吸附剂gc-PAANa凝胶。
2.3 吸附实验准确称量一定质量的Pb(NO3)2 (称量前置于110 oC的真空干燥箱中烘干12 h以上),加稀HNO3消解后配成1000 mg×L-1的Pb(NO3)储备液。在pH计下,用蒸馏水稀释到所实验所需要的浓度,并通过缓慢滴加0.1 mol×L-1 的HNO3 和0.1 mol×L-1 的NaOH溶液调节到需要的pH值。所有静态吸附实验均以50 mL一定浓度的Pb(NO3)2与50 mg 吸附剂(吸附剂投加量m/v = 1.0 g×L-1),在100 mL带塞锥形瓶中混合后置于水浴恒温震荡仪中,以120 r×min-1的转速震荡吸附6 h,吸附后用滤纸过滤,收集滤液,稀释一定倍数后用火焰原子吸收光谱仪(FAAS)测定滤液中Pb2+的残余浓度,按下列公式计算gc-PAANa凝胶吸附剂对Pb2+的去除率R(%)和吸附量qe (mg×g-1):
| $R(%)=\frac{{{C}_{0}}-{{C}_{e}}}{{{C}_{0}}}\times 100%$ | (1) |
| ${{q}_{e}}=\frac{({{C}_{0}}-{{C}_{e}})V}{W}$ | (2) |
其中C0,Ce (mg×L-1)分别为Pb2+的初始浓度和吸附后的平衡浓度;W (g)为吸附剂的干重。
吸附剂的再生与重复利用实验:1.0 g×L-1PAANa 对 200 mg×L-1的Pb2+ 溶液在25℃下恒温吸附后6 h后,用20 mL 0.05 mol×L-1 的HCl溶液洗脱20 min,再用5 mL 0.1 mol×L-1 的NaOH溶液再生30 min,最后水洗至中性,再进行下一次吸附,如此进行5次吸附-脱附循环。按公式(1) 计算每次吸附时的吸附率和以公式(3) 计算脱附率Rde(%):
| ${R_{de}}(\% ) = \frac{{{C_{de}}{V_{de}}}}{{({C_0} - {C_e}){V_{ad}}}} \times 100\% $ | (3) |
其中Cde (mg×L-1)为洗脱液中Pb2+浓度;Vad和Vde (mL)分别为吸附液和洗脱液的体积。
2.4 材料表征与测试条件采用日本日立公司生产的场发射S-4800型扫描电子显微镜在PAANa试样表面喷金后观测其表面形态;采用美国Nicolet仪器公司生产的Nicolet iS10以KBr压片法表征PAANa样品的表面官能团;采用瑞士梅特勒-托利多仪器公司生产的TGA-DSC型热分析仪测定PAANa样品的热稳定性;采用日本日立公司生产的AA6300C型火焰原子吸收光谱仪测定吸附前、后Pb2+溶液的吸光度,根据标准曲线吸光度A与浓度C之间的线性关系获得Pb2+的浓度。凝胶溶胀率的测试:称取0.2 g粒状PAANa样品置于200 mL的烧杯中,加入100 mL蒸馏水,每隔一段时间将未被凝胶吸附的水用40目筛网滤去,并用滤纸擦干凝胶表面的水分,记下不同时间段的凝胶增重,直至水凝胶重量基本不再发生变化,按公式SR=(Ws-Wd)/Wd计算水凝胶的溶胀率,(Ws和Wd分别为溶胀凝胶和干凝胶的质量,g)。
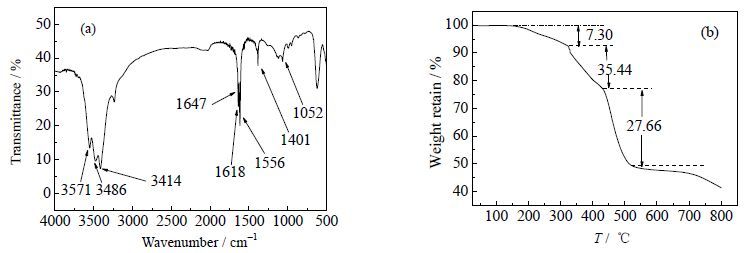
3 结果与讨论 3.1 材料表征结果与分析图 1(a)、(b) 是gc-PAANa干态凝胶放大30倍和450倍的SEM照片,从图(a)可看出,过420 mm筛后的gc-PAANa干凝胶的粒径约为500 mm,且表面有一定数量的微孔,这与制备后期用甲醇对产物中进行洗脱有关。鉴于甲醇能与水互溶且是树脂的非溶剂,结合成孔剂法与相分离法,在后处理中用适量甲醇将水释放出来,使聚合物富集成聚集相,经过滤、烘干除去流动相的同时,在聚合物中形成孔洞;而从图(b)中可看出gc-PAANa干凝胶的外表面比较粗糙,且表面具有一些微孔结构,适合作吸附材料。图 2(a) 是gc-PAANa的红外光谱图,3571~3414 cm-1范围内的宽峰,可归于凝胶上部分结合水的-OH和交联剂(MBA)上酰胺基的N-H键伸缩振动的重叠[19, 20];1647和1556 cm-1处的峰,可分别归于MBA中酰胺基上C=O的伸缩振动[21]和N-H键的弯曲震动[7];1618、1401和1052 cm-1处的峰,可分别归于-COO-的反对称、对称伸缩振动及C-O的伸缩振动[11, 20, 21]。图 2(b) 是交联gc-PAANa的在氮气氛中的热失重曲线,在300℃之前只有很小部分失重,归于gc-PAANa凝胶存在的少量结合水的挥发;gc-PAANa在324~433℃出现第一个较明显的失重台阶,失重达35.44%,归于含氧官能团的分解;随后在433~520℃失重27.66%,归于聚合物骨架的分解和碳化,520℃的缓慢失重归于残留物质的继续碳化[7, 19]。在800℃时gc-PAANa的重量仍然保持了41.34%,说明该gc-PAANa干态凝胶具有较好的热稳定性。

|
图 1 gc-PAANa 干态凝胶的SEM 照片 Fig.1 SEM micrographs of the gc-PAANa gel: (a) 30× (the inserted image is a digital photo of gc-PAANa gel), (b) 450× |
|
图 2 gc-PAANa 样品的FT-IR 图谱 (a) 与 TGA 曲线 (b) Fig.2 FT-IR spectra (a) and TGA curve (b) of the gc- PAANa gel sample |
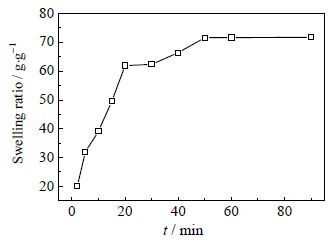
图 3是交联PAANa的溶胀率曲线,由图可知交联gc-PAANa在蒸馏水中有非常快的溶胀速率,在50 min 内即达到了溶胀平衡,平衡溶胀率为71.6 g×g-1。快的溶胀速率和高的溶胀率有利于交联gc-PAANa三维网络结构的扩张,从而促进吸附质扩散和渗透进入凝胶内部的三维网络结构[14]。
|
图 3 gc-PAANa 在不同接触时间下的溶胀率曲线 Fig.3 Swelling ratio of the gc-PAANa gel at different contact times (m = 0.2 g and T = 293 K) |
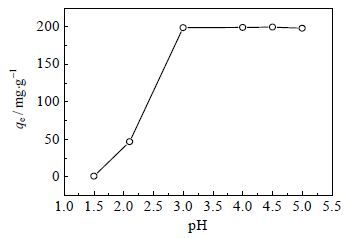
溶液的pH是影响吸附效果的一个重要因素,它不仅影响重金属离子的存在形式,而且决定吸附剂的表面电荷,本文选择pH=1.5~5.0的200 mg×L-1 Pb2+溶液来研究pH的影响。由图 4可知,在pH=1.5时gc-PAANa对Pb2+的平衡吸附量qe几乎为零,溶液的初始pH从1.5增大到3.0的过程中qe增大显著,且在pH=3.0~5.0时,gc-PAANa对Pb2+的平衡吸附量qe均在198 mg×g-1以上,说明该粒状交联gc-PAANa对Pb2+具有较宽的pH适用范围。通过文献调研[5],后续研究采用pH=5.0作为实验条件。
|
图 4 溶液pH 对Pb2+平衡吸附容量的影响 Fig.4 Effects of solution pH on equilibrium adsorption capacity of Pb2+ (Pb2+= 200 mg·L-1, m/v = 1.0 g·L-1, t = 6 h and T = 293 K) |
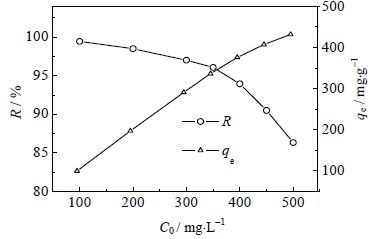
如图 5,当Pb2+的初始浓度低于350 mg×L-1时,Pb2+的去除率R保持在95%以上,之后随着Pb2+的初始浓度继续增大,R出现了明显的下降,但当Pb2+浓度高达500 mg×L-1时,R仍保持86.32%,说明交联gc-PAANa对Pb2+具有非常好的吸附去除效果;而Pb2+的平衡吸附量qe 随Pb2+初始浓度的在100~350 mg×L-1几乎呈线性规律增大,之后qe 的增幅变小,至C0=500 mg×L-1时qe已接近吸附饱和。吸附过程是一个动态平衡,随着浓度增加,吸附和脱附的量都有增加趋势,最终达到平衡。那么,随着浓度增加,qe有增加趋势就不难理解;而对于一定的吸附体系,吸附位点的总量是一定的。随着初始浓度的增加,吸附位点被充分占用,不被吸附的概率越来越大,去除率R自然会越来越小。Arameh Masoumi等[22]通过研究也得到了类似的结果。
|
图 5 Pb2+初始浓度对Pb2+去除率R 和平衡吸附量qe 的影响 Fig.5 Effects of initial Pb2+ concentration on removal efficiency and equilibrium adsorption capacity (pH=5.0, m/v = 1.0 g·L-1, t = 6 h and T = 293 K) |
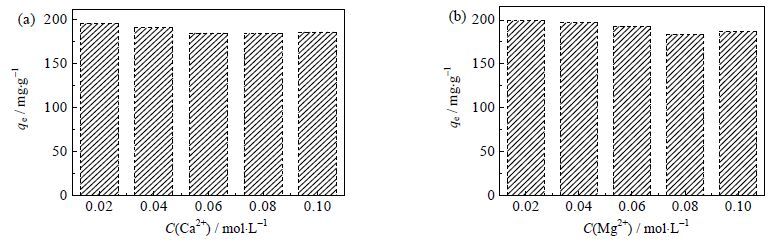
在实际工业重金属废水中常存在较高浓度的Ca2+和Mg2+,不仅影响水质的离子强度,而且可能与重金属离子竞争吸附剂上有限的吸附位点。由图 6可知Ca2+和Mg2+在0.02~0.1 mol×L-1仅对gc-PAANa吸附Pb2+的性能产生了微弱的影响。金属离子竞争吸附位点的强弱程度与其水合半径呈负相关的关系,而Ca2+和Mg2+的水合半径均大于Pb2+的水合离子半径[23],因而共存Ca2+和Mg2+与Pb2+竞争gc-PAANa吸附剂上有限活性位点的作用较弱。
|
图 6 共存Ca2+ (a) 与Mg2+ (b) 的浓度对gc-PAANa 吸附Pb2+的平衡吸附量qe 的影响 Fig.6 Effects of coexist metal ionic concentration on the equilibrium adsorption capacity of Pb2+on gc-PAANa (a) Ca2+ and Mg2+ (b) (Pb2+ 200 mg·L-1, m/v=1.0 g·L-1, t= 6 h and T=293K) |
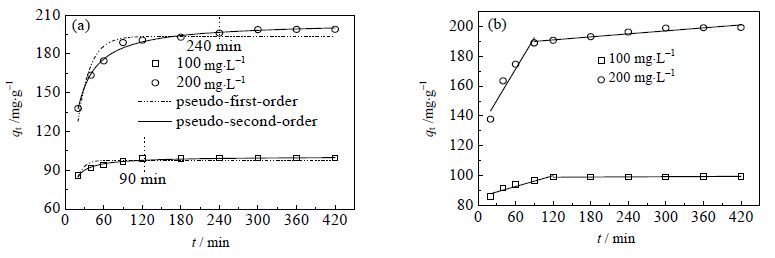
图 7(a)是初始浓度为100 和200 mg×L-1的Pb2+的吸附动力学和准一级、准二级的非线性拟合,由图可知gc-PAANa对两个不同初始浓度的Pb2+的吸附分别在120 和240 min 达到了吸附平衡,表明该gc-PAANa凝胶对Pb2+的吸附具有快速的吸附动力学。
|
图 7 gc-PAANa 吸附Pb2+的准一级、准二级动力学模型(a)与粒内扩散动力学模型(b) Fig.7 Pseudo-first order, pseudo-second order kinetic models (a) and intro-particle kinetic model (b) of Pb2+ adsorption on gc-PAANa (m/v = 1.0 g·L-1, pH = 5.0 and T = 293 K) |
准一级、准二级动力学模型常用来对吸附动力学数据进行拟合,以进一步研究吸附动力学的控制步骤,它们分别对应液膜扩散和表面化学吸附的动力学控制机理。 准一级和准二级的非线性方程如下[5, 7, 17]:
| ${{q}_{t}}={{q}_{e}}(1-\exp (-{{k}_{1}}t))$ | (4) |
| ${{q}_{t}}={{q}_{e}}t/((1/{{q}_{e}}{{k}_{2}})+t)$ | (5) |
其中qt为t时刻(min)所对应的吸附量,mg×g-1;k1 (min-1)和k2 (mg×(g×min)-1)分别是准一级和准二级模型所对应的吸附速率常数。
表 1列出了初始浓度为100和200 mg×L-1 的Pb2+吸附的准一级和准二级动力学模型拟合参数,由表可知准二级模型的相关系数R2均大于准二级模型的,且准二级模型得出的平衡吸附量qe更接近实验得出的qe值。因此gc-PAANa凝胶对Pb2+的吸附符合准二级模型,吸附速率主要受表面化学反应所控制。KL的值随Pb2+初始浓度的增大而变小了,说明gc-PAANa凝胶在吸附浓度较高的Pb2+时吸附速率变慢。
此外,粒内扩散模型也用来分步描述吸附剂对重金属离子的吸附动力学规律。粒内扩散模型的线性方程如下[6, 24]:
| 表 1 gc-PAANa吸附Pb2+的准一级和准二级动力学模型参数 Table 1 Constants of pseudo-first order and pseudo-second order kinetic models of Pb2+ adsorption on gc-PAANa |
| ${{q}_{t}}={{k}_{id}}{{t}^{0.5}}+{{C}_{i}}$ | (6) |
其中ki为粒内扩散模型所对应的吸附速率常数,mg×(g×min1/2)-1;Ci代表边界层系数(mg×g-1)
图 7(b)和表 2分别给出了初始浓度为100和200 mg×L-1的Pb2+吸附的粒内扩散模型描述和相关参数,由图 7(b)可知Pb2+ 的吸附动力学数据与两条斜率不同直线相关,斜率较大的那一部分代表吸附质Pb2+ 通过溶液扩散进入吸附剂表面的过程,斜率较小的那一部分代表吸附质通过吸附剂表面的微孔缓慢进入吸附剂内部进行扩散的过程[19, 24]。粒内扩散模型的速率ki1>ki2 及C1<C2 表明gc-PAANa对溶液中大量Pb2+ 的吸附都发生在吸附的初始阶段,当接近吸附平衡后,才由粒内扩散模型控制吸附速率。然而并没有任何一条粒内扩散模型拟合的直线通过原点,说明粒内扩散模型并不是唯一控制吸附速率的步骤[24]。
| 表 2 PAANa吸附Pb2+的粒内扩散动力学模型参数 Table 2 Constants of intro-particle kinetic model of Pb2+ adsorption on gc- PAANa |
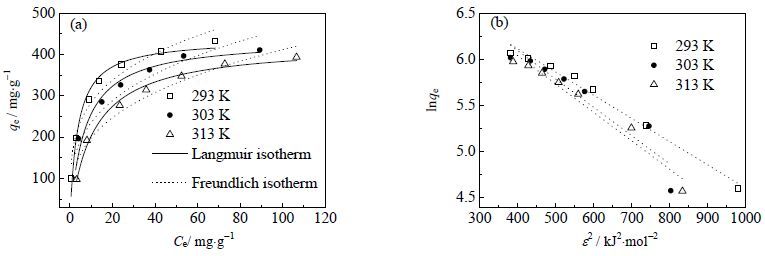
图 8(a) 是3个不同温度下gc-PAANa对Pb2+的吸附等温线,由图可知Pb2+的吸附等温线在293~313 K随温度的升高出现了一定程度的下降,说明293~313 K降低温度有利于gc-PAANa对Pb2+的吸附。为了进一步研究等温吸附的机理,Langmuir 和Freundlich模型常用来对等温吸附数据进行拟合[5, 7, 17],Langmuir等温吸附模型描述的是单分子层吸附,其表达式如下:
|
图 8 gc-PAANa吸附Pb2+的Languir和Freundlich等温吸附模型(a)及D-R 等温吸附模型(b) Fig.8 Langmuir, Freundlich (a) and D-R isotherm models of Pb2+ adsorption on gc-PAANa (pH = 5.0, m/v = 1.0 g·L-1, t = 3 h) |
| ${{q}_{e}}=\frac{{{q}_{m}}{{C}_{e}}}{(1/{{K}_{L}}+{{C}_{e}})}$ | (7) |
其中qm为重金属离子的最大吸附容量,mg×g-1;KL 为与吸附亲和能有关的常数,L×g-1。
Freundlich 模型描述的是发生在非均相界面的多分子层吸附,其表达式如下:
| ${{q}_{e}}={{q}_{F}}\cdot C_{e}^{1/n}$ | (8) |
其中qF为与吸附容量有关的参数,mg×g-1·(L×mg-1)1/n;1/n 为与吸附能有关的常数。
此外,D-R 等温吸附模型通常用来判断吸附是属于物理吸附还是化学吸附,其线性表达式如下[6, 11]:
| $\ln {{q}_{e}}=\ln {{q}_{m}}-\beta {{\varepsilon }^{2}}$ | (9) |
其中qm为D-R模型得出的最大吸附量,mg×g-1;b是与吸附能有关的参数,mol2×kJ-2;为polanyi电势,其表达式如下:
| $\varepsilon =RT\ln (1+1/{{C}_{e}})$ | (10) |
此处R为气体常数,8.314 J×(mol×K)-1,T为绝对温度,K。
平均吸附自由能E (kJ×mol-1) 可由下式计算得出:
| $E=\frac{1}{\sqrt{2\beta }}$ | (11) |
若E < 8 kJ×mol-1,则吸附剂对吸附质的吸附属于物理吸附;若E > 8 kJ×mol-1,则吸附剂对吸附质的吸附属于化学吸附[5, 6, 17]。
表 3 列出了Langmuir,Freundlich和D-R模型得出的参数,可知3个温度下Langmuir的相关系数R2 都大于Freundlich的,因而gc-PAANa对Pb2+的吸附等温线符合Langmuir 模型,为单分子层吸附;而D-R模型得出的3个温度下的平均吸附自由能E= 13.22 kJ×mol-1 > 8 kJ×mol-1,表明gc-PAANa对Pb2+的吸附属于化学吸附。
| 表 3 gc-PAANa 吸附Pb2+的Langmuir, Freundlich和D-R模型参数 Table 3 Constants of Langmuir, Freundlich and D-R isotherm models of Pb2+ adsorption on the gc- PAANa |
为了分析gc-PAANa对Pb2+和Cd2+的吸附热力学行为,一些热力学参数如吉布斯自由能、熵变和焓变可以通过下列线性方程求得[3, 6]:
| $\Delta {{G}^{0}}=-RT\ln {{k}^{0}}$ | (12) |
| $\ln {{k}^{0}}=-\frac{\Delta {{H}^{0}}}{R}\frac{1}{T}+\frac{\Delta {{S}^{0}}}{R}$ | (13) |
其中k0为吸附平衡常数,可由3个不同温度下的ln(qe/Ce)对Ce作图后的截距得到。表 4列出了gc-PAANa吸附Pb2+ 的热力学参数,、为负值说明该gc-PAANa凝胶对Pb2+是一个自发的放热反应,在293~313K降低温度有利于Pb2+的吸附;此外负的值,说明gc-PAANa对Pb2+的吸附过程中固、液界面的混乱自由度减小[6]。
| 表 4 gc-PAANa吸附Pb2+的热力学参数 Table 4 Thermodynamic constants of Pb2+ adsorption on gc-PAANa |
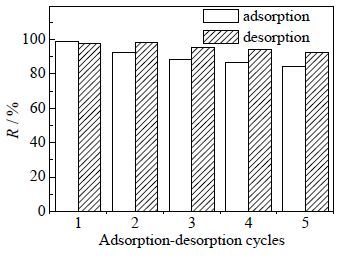
如图 9所示,20 mL 2%(V/V)的HCl溶液可有效从gc-PAANa凝胶上脱附被吸附的Pb2+,解吸率均在92%以上。gc-PAANa凝胶对第一次吸附200 mg×L-1 的Pb2+时,对Pb2+的去除率高达97.52%,用20 mL 2%(V/V)的HCl分4次洗脱和5 mL 0.1mol×L-1 的NaOH再生后,第1次重复利用时对Pb2+的去除率有92.41%,至第4次重复利用时对Pb2+的吸附率仍有84.27%,说明该gc-PAANa凝胶具有较好的重复利用性能。gc-PAANa重复吸附时表现一定程度的下降,可能归于其吸附前还存在一些Pb2+ 未从吸附剂上完全洗脱下来,仍占据着一些吸附位点[7],因为20 mL 2%(V/V) 的HCl解吸时Pb2+并未完全解吸。
|
图 9 gc-PAANa的5次循环吸附-解吸解Pb2+的效率图 Fig.9 Efficiency of Pb2+ adsorption-desorption by gc-PAANa during 5 cycle studies (C0 = 200 mg·L-1, pH = 5.0, m/v = 1.0 g·L-1, T = 293 K) |
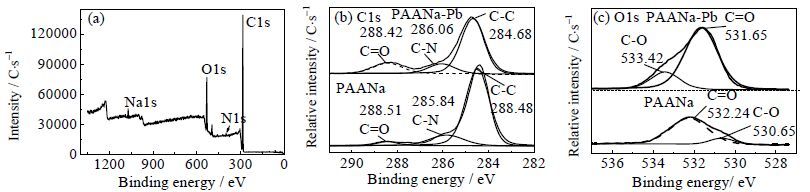
为了进一步研究gc-PAANa对Pb2+的吸附机理,对吸附前、后的gc-PAANa样品进行了XPS表征。如图 10(a)~(c):在吸附前的XPS全谱图中,分别在284、399、530和1079 eV处检测到了C1s、O1s、N1s和Na1s的特征峰,吸附前gc-PAANa的C1s高分辨谱图中(图 10(b)) 288.51、285.84和284.48 eV处的3个峰分别对应C=O、C-N、和C-C的键能,吸附后C-N和C-C键能均出现了较小的增加,这可能是与碳相邻的O原子与Pb2+ 发生了相互作用,导致C原子的电子云密度降低,键能增大[5];吸附前的O1s高分辨谱图中(图 10(c)),532.24与530.65eV处的峰,分别归于C=O和C-O的键能,吸附后C=O的键能变化较小,而C-O的键能则由530.65增加到533.42 eV,C-O的键能增加了2.77 eV,说明,-COO-基团与Pb2+发生内了强烈的螯合作用[17]。因而gc-PAANa对Pb2+的吸附机理为-COO-官能团对Pb2+的螯合作用。
|
图 10 gc-PAANa的XPS全谱图(a),gc- PAANa与gc-PAANa-Pb的XPS C1s(b)及O1s(c)的高分辨图 Fig.10 Full scale XPS spectra of gc-PAANa (a), high resolution XPS spectra of C1s (b) and O1s (c) of gc-PAANa before and after Pb2+ adsorption |
以AANa为功能单体、环己烷为连续相、Span60为分散剂、KPS为引发剂、MBA为交联剂,采用反相悬浮聚合法制备了gc-PAANa凝胶,以该凝胶为吸附剂对水溶液中的Pb2+进行了吸附去除研究。结果表明gc-PAANa凝胶对Pb2+的吸附具有较宽的pH适用性(3.0~5.0) 、较高的吸附去除率、快速的吸附动力学及受共存Ca2+和Mg2+的影响小等特点。gc-PAANa凝胶对Pb2+的吸附动力学符合准二级模型,吸附等温线符合Langmuir模型,298 K下的最大吸附量达到446.98 mg×g-1;在298~318 K,通过D-R等温吸附模型得出的gc-PAANa凝胶对Pb2+的平均吸附自由能介于12.76~14.11 kJ×mol-1,属于化学吸附。吸附热力学研究表明,gc-PAANa凝胶对Pb2+的吸附是一个自发的放热反应。XPS分析表明gc-PAANa凝胶对Pb2+的吸附机理主要归于-COO-对Pb2+的螯合作用。以2%(V/V) 的HCl 为洗脱液可实现PAANa凝胶的再生,gc-PAANa凝胶对200 mg×L-1的Pb2+在第5次循环吸附时仍保持了84.27%的去除率,表明该凝胶作为重金属离子吸附剂有良好的重复利用性能。
| [1] | Gautam R K, Mudhoo A, Lofrano G, et al. Biomass-derived biosorbents for metal ions sequestration:adsorbent modification and activation methods and adsorbent regeneration[J]. Journal of Environmental Chemical Engineering , 2013, 2(1): 239-259. |
| [2] | He J, Lu Y, Luo G, et al. Ca(Ⅱ) imprinted chitosan microspheres:an effective and green adsorbent for the removal of Cu(Ⅱ), Cd(Ⅱ) and Pb(Ⅱ) from aqueous solutions[J]. Chemical Engineering Journal , 2014, 244(10): 202-208. |
| [3] | Ge Y, Qin L, Li Z. Lignin microspheres:an effective and recyclable natural polymer-based adsorbent for lead ion removal[J]. Materials & Design , 2016, 95: 141-147. |
| [4] | MA Chun-fang(马春芳), SHI Yang(时洋), LIU Jian-ping(刘建平), et al. Adsorption of Pb2+ ion with sulfuric acid modified glycyrrhiza residue(硫酸改性甘草废渣生物吸附剂对Pb2+离子的吸附)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(3): 716-723. |
| [5] | Zhou G, Liu C, Tang Y, et al. Sponge-like polysiloxane-graphene oxide gel as a highly efficient and renewable adsorbent for lead and cadmium metals removal from wastewater[J]. Chemical Engineering Journal , 2015, 280: 275-282. DOI:10.1016/j.cej.2015.06.041. |
| [6] | Li X, Qi Y, Li Y, et al. Novel magnetic beads based on sodium alginate gel crosslinked by zirconium(IV) and their effective removal for Pb2+ in aqueous solutions by using a batch and continuous systems[J]. Bioresource Technology , 2013, 142(4): 611-619. |
| [7] | Zhou G, Luo J, Liu C, et al. A highly efficient polyampholyte hydrogel sorbent based fixed-bed process for heavy metal removal in actual industrial effluent[J]. Water Research , 2016, 89: 151-160. DOI:10.1016/j.watres.2015.11.053. |
| [8] | Mohammadi S Z, Karimi M A, Afzali D, et al. Removal of Pb(Ⅱ) from aqueous solutions using activated carbon from sea-buckthorn stones by chemical activation[J]. Desalination , 2010, 262(1-3): 86-93. DOI:10.1016/j.desal.2010.05.048. |
| [9] | WANG Dai-zhi(王代芝), ZHENG Mei-jie(郑美洁). Experimental researches on the treatment of wastewater containing lead modified zeolite(改性沸石处理含铅废水的试验研究)[J]. Ion Exchange and Adsorption(离子交换与吸附) , 2013, 29(2): 159-164. |
| [10] | Zhu Y, Hu J, Wang J. Competitive adsorption of Pb(Ⅱ), Cu(Ⅱ) and Zn(Ⅱ) onto xanthate-modified magnetic chitosan[J]. Journal of Hazardous Materials , 2012, 221~222: 155-161. |
| [11] | Zhu Y F, Zheng Y A, Wang W B, et al. Highly efficient adsorption of Hg(Ⅱ) and Pb(Ⅱ) onto chitosan-based granular adsorbent containing thiourea groups[J]. Journal of Water Process Engineering , 2015, 7: 218-226. DOI:10.1016/j.jwpe.2015.06.010. |
| [12] | Badruddoza A Z M, Shawon Z B Z, Daniel T W J, et al. Fe3O4/cyclodextrin polymer nanocomposites for selective heavy metals removal from industrial wastewater[J]. Carbohydrate Polymers , 2013, 91(1): 322-332. DOI:10.1016/j.carbpol.2012.08.030. |
| [13] | Fan L L, Luo C N, Sun M. Highly selective adsorption of lead ions by water-dispersible magnetic chitosan/graphene oxide composites[J]. Colloids and Surfaces B:Biointerfaces , 2013, 103(1): 523-529. |
| [14] | Zheng Y, Wang A. Superadsorbent with three-dimensional networks:from bulk hydrogel to granular hydrogel[J]. European Polymer Journal , 2015, 72: 661-686. DOI:10.1016/j.eurpolymj.2015.02.031. |
| [15] | Liu P, Jiang L, Zhu L, et al. Novel approach for attapulgite/poly(acrylic acid) (ATP/PAA) nanocomposite microgels as selective adsorbent for Pb(Ⅱ) Ion[J]. Reactive & Functional Polymers , 2014, 74(1): 72-80. |
| [16] | Zhou Y, Fu S, Zhang L, et al. Use of carboxylated cellulose nanofibrils-filled magnetic chitosan hydrogel beads as adsorbents for Pb[J]. Carbohydrate Polymers , 2014, 101(1): 75-82. |
| [17] | Chu L, Liu C, Zhou G, et al. A double network gel as low cost and easy recycle adsorbent:highly efficient removal of Cd(Ⅱ) and Pb(Ⅱ) pollutants from wastewater[J]. Journal of Hazardous Materials , 2015, 300: 153-160. DOI:10.1016/j.jhazmat.2015.06.070. |
| [18] | YANG Ying(杨莹), GAO Bao-jiao(高保娇). Micron-sized crosslinked microspheres of HEMA/NVP/MBA via inverse suspension polymerization method(反相悬浮聚合法制备HEMA/NVP/MBA三元聚合物交联微球)[J]. Chinese Journal of Applied Chemistry(应用化学) , 2008, 25(4): 477-480. |
| [19] | Zhao F, Tang W Z, Zhao D, et al. Adsorption kinetics, isotherms and mechanisms of Cd(Ⅱ), Pb(Ⅱ), Co(Ⅱ) and Ni(Ⅱ) by a modified magnetic polyacrylamide microcomposite adsorbent[J]. Journal of Water Process Engineering , 2014, 4(4): 47-57. |
| [20] | Fan J, Shi Z, Lian M, et al. Mechanically strong graphene oxide/sodium alginate/polyacrylamide nanocomposite hydrogel with improved dye adsorption capacity[J]. Journal of Materials Chemistry A , 2013, 1(25): 7433-7443. DOI:10.1039/c3ta10639j. |
| [21] | Zhu Z Q, Sun H X, Li G X, et al. Preparation of polyacrylamide/graphite oxide superabsorbent nanocomposites with salt tolerance and slow release properties[J]. Journal of Applied Polymer Science , 2013, 129(4): 2328-2334. DOI:10.1002/app.v129.4. |
| [22] | Arameh M, Mousa G. Removal of metal ions from water using nanohydrogel tragacanthgum-g-polyamidoxime:isotherm and kinetic study[J]. Carbohydrate Polymers , 2014, 108(20): 206-215. |
| [23] | Miyaji F, Masuda S, Suyama Y. Adsorption removal of lead and cadmium ions from aqueous solution with coal fly ash-derived zeolite/sepiolite composite[J]. Journal of the Ceramic Society of Japan , 2010, 118(11): 1062-1066. |
| [24] | Tan P, Sun J, Hu Y, et al. Adsorption of Cu2+, Cd2+ and Ni2+ from aqueous single metal solutions on graphene oxide membranes[J]. Journal of Hazardous Materials , 2015, 297: 251-260. DOI:10.1016/j.jhazmat.2015.04.068. |




