2. 郑州富谊联科技有限公司,河南 郑州 450002;
3. 湖北富邦科技股份有限公司,湖北 武汉 430000
2. Zhengzhou Fuyilian Science and Technology Co., Ltd., Zhengzhou 450002, China;
3. Hubei Forbon Technology Co., Ltd., Wuhan 430000, China
磷酸铵锰(NH4MnPO4·H2O)可作为含有大量及微量元素的缓溶性肥料,能补充农作物P、N及Mn营养元素,可作高效且环保型缓释叶面肥使用[1~5]。与常用单一锰肥、磷肥等相比,具有高浓度、缓释等特性,肥效好且可减少肥料施用量[2],符合国家“十三五”规划肥料长期发展要求。同时,磷酸铵锰也可作为制备LiMnPO4的前驱体,其性能对LiMnPO4性能影响较大,通过液相法合成形貌规一、颗粒细小、粒径分布均匀的NH4MnPO4前驱体,可得性能优异LiMnPO4正极材料。Natalia等[6]采用沉积法先制得NH4MnPO4·H2O前驱体,再与LiOH进行固相反应或与LiCl-LiNO3进行离子交换而得LiMnPO4电极材料,同时在C/5下比电容量达到理论容量的30%且前驱体形貌、物性特征不变。此外,高纯度磷酸铵锰还可作软水剂以及食品发酵剂的助剂[7]。因此,磷酸铵锰的热稳定性和分解机理的研究,对其性能和使用效果具有一定的指导意义。本文通过共沉淀法制备了NH4MnPO4·H2O,并通过热分析法研究该产物的热分解过程,结果表明其热分解过程分为两个阶段。本文研究目的是将磷酸铵锰作为微量元素肥料进行工业生产或加入复合肥生产工艺中,需考虑其热稳定性,由于一般复肥生产工艺温度不会超过280℃,故仅对第一阶段热分解过程进行了深入研究,得出其热分解动力学参数,为磷酸铵锰作为缓释肥工业上大规模生产和农业上应用提供有益的理论依据和基础数据。
2 实验部分 2.1 实验药品试剂磷酸,分析纯,天津市科密欧化学试剂有限公司;硫酸锰,分析纯,天津市科密欧化学试剂有限公司;硫酸铵,分析纯,天津市科密欧化学试剂有限公司;氢氧化钠,分析纯,天津市风船化学试剂科技有限公司;硫酸,分析纯,天津市科密欧化学试剂有限公司;去离子水(实验室自制)。
2.2 主要分析仪器XRD分析采用日本RIGAKU公司D/MAX-RB型X-射线衍射仪,测试条件:扫描5.00/60.00/0.02/0.12 (sec),Cu (40 kV、40 mA);粒度分析采用珠海欧美克科技有限公司LS900型激光粒度分析仪;SEM分析采用日本电子JSM-7500F型冷场发射扫描电子显微镜;FTIR分析采用北京光学第二仪器厂WQF-510型红外光谱仪,KBr压片,4000~400 cm-1;热重差热分析采用德国NETZSCH-Gerate ball公司STA449C型热重差热分析仪,氮气气氛为30 mL·min-1,Al2O3坩埚,测试样品量和惰性气体流量考虑并消除了外扩散的影响。
2.3 样品制备制备方法及最优工艺条件见参考文献[8]。
3 结果与讨论 3.1 产物XRD分析图 1为产物XRD衍射谱图。从图 1可看出,其衍射峰尖锐,结晶完整,无杂质峰,对比JCPDS (NO.50-0554)标准卡,可知NH4MnPO4·H2O属正交晶系,与文献[9]报道一致。
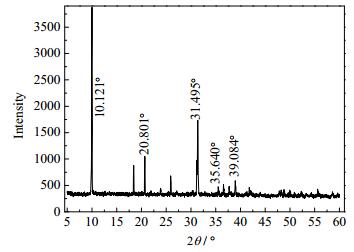
|
图 1 NH4MnPO4·H2O的XRD谱图 Fig.1 XRD pattern of NH4MnPO4·H2O |
对磷酸铵锰粒度分布进行分析,结果表明磷酸铵锰粒度分布很窄且颗粒较细,粒径分布于0.40 ~0.60 μm,D50为0.49 μm,D10为0.40 μm,D90为0.60 μm,属于微米级产品。
3.3 产物扫描电镜分析图 2为本文合成的磷酸铵锰产物电镜扫描图,呈分布均匀的短棒状结构。层厚度均为1 μm左右,这与激光粒度分析结果基本一致,均为微米级产品。

|
图 2 NH4MnPO4·H2O的SEM图 Fig.2 SEM micrograph of NH4MnPO4·H2O |
图 3是产物的FTIR分析图。
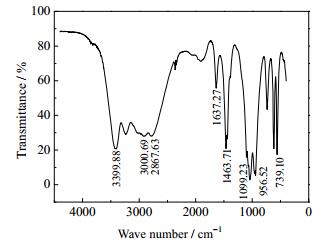
|
图 3 NH4MnPO4·H2O红外光谱图 Fig.3 FTIR spectrum of NH4MnPO4·H2O |
从图 3可知3399.88和1637.27 cm-1属于羟基的振动峰,说明了产物中含有结晶水分子,2867.63~3000.69 cm-1和1463.71 cm-1处的吸收峰归属为N-H键的伸缩振动和反对称伸缩振动[10]。933.38~1128.15 cm-1有强的吸收峰,其吸收峰强且分成几个小峰,反映出PO43-有多种振动形式[11];其中1099.23 cm-1为PO43-四面体的非对称伸缩振动峰;956.52 cm-1为中强的吸收带归属PO43-的弯曲振动吸收峰;配合物在739.10 cm-1出现Mn-O键的特征吸收峰[12],表明配体中氧、锰原子配位。由此可判定,产品是含有结晶水的NH4MnPO4,这与相关文献[9]描述基本上保持一致。
3.5 产物TG/DSC分析图 4是磷酸铵锰在升温速率为20℃·min-1的热重及差热分析曲线。
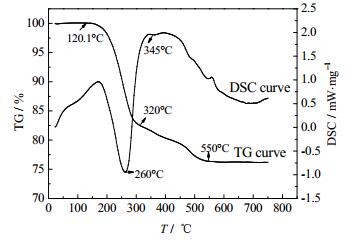
|
图 4 NH4MnPO4·H2O的TG-DSC曲线 Fig.4 TG-DSC curves of NH4MnPO4·H2O |
从TG曲线可以看出:磷酸铵锰的热分解过程存在两个明显的质量损失台阶,第一阶段从加热开始到320℃质量损失约17.69%;第二阶段从320℃到550℃质量损失约为6.14%。推断NH4MnPO4·H2O的热分解过程为:
第一阶段:NH4MnPO4·H2O→MnHPO4+NH3↑+H2O↑
第二阶段:2MnHPO4→Mn2P2O7+ H2O↑
由此可计算出NH4MnPO4·H2O第一阶段的理论失重率为18.81%;第二阶段的理论失重率为5.96%,与实际较吻合。
由DSC曲线可知,磷酸铵锰在第一阶段热解过程中于260℃有明显的吸热峰,说明磷酸铵锰大量脱水脱氨是吸热反应;在第二阶段热解过程中于345℃有放热峰,说明磷酸氢锰脱水生成焦磷酸锰的过程为放热反应。
4 NH4MnPO4·H2O热分解动力学热分解动力学分析方法很多,如Kissinger法[13],Starink法[14],F1ynn-Wall-Ozawa法[15]、Friedman法。Chanaiporn等[16]采用Kissinger法研究了NH4MnPO4·H2O的热分解动力学,将之分为3个阶段,前两个阶段为脱水脱氨阶段,第3阶段为生成焦磷酸锰阶段,并得出三阶段的活化能,但并未对其反应机理进行进一步的研究。本文也采用Kissinger法对第一阶段的活化能进行计算,结果与之接近。在此基础上采用比Kissinger法更高精度的Friedman法和F1ynn-Wall-Ozawa法等来计算磷酸铵锰第一阶段的热分解动力学参数,通过Coats-Redfern法对磷酸铵锰第一阶段热分解反应机理进行研究。
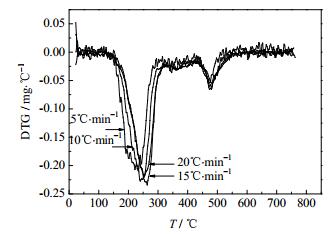
用德国NETZSCH-Gerate ball公司STA449C型热重差热分析仪对制备的NH4MnPO4·H2O进行热重分析,升温速率分别取5、10、15、20℃·min-1。表征结果TG和DTG曲线分别如图 5、图 6所示。
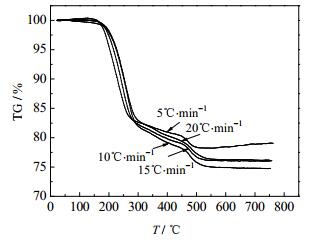
|
图 5 不同升温速率下NH4MnPO4·H2O的TG曲线 Fig.5 TG curves of NH4MnPO4·H2O at various heating rates |
|
图 6 不同升温速率下NH4MnPO4·H2O的DTG曲线 Fig.6 DTG curves of NH4MnPO4·H2O at various heating rates |
根据F1ynn-Wall-Ozawa法理论[15],可得到式(1):
| $ \lg \beta = \lg (\frac{{AE}}{{RG(\alpha )}}) - 2.315 - 0.4567\frac{E}{{RT}} $ | (1) |
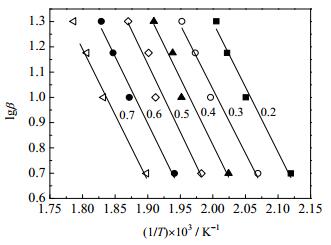
式中:R为气体常数,8.314 J·(mol·K)-1;T为温度,K;E为表观活化能,kJ·mol-1;A为指前因子;α为分解率;β为升温速率,K·min-1。分析TG数据,根据式(1),以1/T×103作为自变量,lgβ作为因变量作图,得到图 7。根据各直线斜率求得NH4MnPO4·H2O第一步热分解的各个活化能和各R2值列于表 1,经计算可得NH4MnPO4·H2O的表观活化能在83.319~98.253 kJ·mol-1。
|
图 7 lgβ与(1/T)×103关系图 Fig.7 Plot of lg(β) vs (1/T) ×103 |
|
|
表 1 F1ynn-Wall-Ozawa法和Friedman法所得热分解第一阶段动力学结果 Table 1 Thermal decomposition dynamics of F1ynn-Wall-Ozawa and Friedman methods |
根据Friedman法理论[17]可得到式(2):
| $ \ln (\frac{{{\rm{d}}\alpha }}{{{\rm{d}}T}}\beta ) = \ln [Af(\alpha )] - \frac{E}{{RT}} $ | (2) |
式中:R为气体常数,8.314 J·(mol·K)-1;T为温度,K;E为表观活化能,kJ·mol-1;A为指前因子;α为分解率;β为升温速率,K·min-1。通过
根据Coats-Redfern[19]积分式,即
| $ \ln [\frac{{G(\alpha )}}{{{T^2}}}] = \ln (\frac{{AR}}{{\beta E}}) - \frac{E}{{RT}} $ | (3) |
式(3)中:R为气体常数,8.314 J·(mol·K)-1;E为表观活化能,kJ·mol-1;A为指前因子;α为分解率;β为升温速率,K·min-1;G(α)为热分解机理函数。
在单重升温速率β的TG曲线上选取若干个点,计算出不同温度T对应的样品相应的分解率α,第一阶段热分解基础数据见表 2。
|
|
表 2 不同升温速率下NH4MnPO4·H2O第一阶段热分解基础数据 Table 2 Data of the first thermal decomposition of NH4MnPO4·H2O at various heating rates |
将表 2所得数据代入常见的30种热分解机理函数[20]中并做出积分法相对应的线性关系,从而得出磷酸铵锰第一阶段热分解表观活化E和指前因子A,结果见表 3(本文仅列出部分计算结果)。
|
|
表 3 Coats-Redfern法拟合部分计算结果 Table 3 Fitting results of the Coats-Redfern method |
通过表 3处理的结果可以看出,Friedman法计算磷酸铵锰第一阶段热分解的表观活化能E = 88.681 kJ·mol-1与2号机理函数求得的活化能最为接近,说明磷酸铵锰第一阶段热分解过程可能符合2号机理函数,属于Valensi方程,为二维扩散,2D机理,G(α)1 = α+(1-α)ln(1-α),f(α)1 = [-ln(1-α)]-1。
四种不同升温速率下,磷酸铵锰第一阶段热分解的平均活化能E1 = 91.533 kJ·mol-1、指前因子A1 = 3.846 ×107 s-1,因此磷酸铵锰第一阶段热分解动力学方程如式(4)所示:
| $ \frac{{{\rm{d}}\alpha }}{{{\rm{d}}T}} = \frac{{3.846 \times {{10}^7}}}{\beta }{{\rm{e}}^{\frac{{ - 91.533}}{{RT}}}}{[ - \ln (1 - \alpha )]^{ - 1}} $ | (4) |
(1) 采用共沉淀法合成了磷酸铵锰,并对其结构等进行了表征。结果表明该产物为NH4MnPO4·H2O,且结晶度高,化学结构完整,颗粒较细,呈短棒状。
(2) TG研究结果表明磷酸铵锰的热分解过程分为两个阶段,利用F1ynn-Wall-Ozawa法和Friedman法研究了磷酸铵锰第一阶段热分解动力学,计算所得磷酸铵锰第一阶段热分解活化能分别为93.201和88.681 kJ·mol-1。热分解活化能较低,第一步热分解反应比较容易进行,且热分解速率较快。
(3) Coats-Redfern法计算得磷酸铵锰第一阶段热分解动力学参数为:E1 = 91.533 kJ·mol-1,A1 = 3.846×107 s-1。其机理函数模型为G(α)1= α+(1-α)ln(1-α),f(α)1 = [-ln(1-α)]-1;热分解动力学方程为:
| $ \frac{{{\rm{d}}\alpha }}{{{\rm{d}}T}} = \frac{{3.846 \times {{10}^7}}}{\beta }{{\rm{e}}^{\frac{{ - 91.533}}{{RT}}}}{[ - \ln (1 - \alpha )]^{ - 1}} $ |
热分解动力学研究对磷酸铵锰反应器的设计及操作运行控制等具有指导意义。
符号说明:
| A —指前因子,s-1 | T —温度,℃,K |
| E —活化能,kJ·mol-1 | α —分解率 |
| f(α) —热分解机理函数微分式 | β —升温速率,℃·min-1,K·min-1 |
| G(α) —热分解机理函数积分式 | 下标 |
| R —气体常数,8.314 J·(mol·K)-1 | p —曲线峰值 |
| R2 —相关系数 | 1 —第一阶段 |
| [1] | LI P, DU Y M, HUANG L B, et al. Preparation and characterization of manganese and iron compounds as potential control-release foliar fertilizers[J]. Open Access Journal, 2014, 4(3): 746-753. |
| [2] | WANG Rui (王瑞), WANG Ren-zong (王仁宗), LIU Yu (刘裕), et al. A method for synthesis of slow-release manganese fertilizer (一种缓释锰肥的合成方法): CN201410268404. 9[P]. 2014-06-17. |
| [3] | FAN Yan-jin (樊艳金). Synthesis of phosphates via solid-state reaction and study on their properties (低热固相法合成磷酸盐系列纳米材料及其性能研究)[D]. Nanning (南宁):Guangxi University (广西大学), 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1319402 |
| [4] | FENG De-xue (冯德学), CHANG Xing-hua (常兴华), WANG Jin-yun (王金云), et al. Manganese-containing phosphoric acid diamine fertilizer (含锰的磷酸二铵肥): CN103693999 A[P]. 2014-04-02. |
| [5] | Bridger G L, Salutsky M L, Starostka R W. Micronutrient sources, netal ammonium phosphates as fertilizers[J]. Micronutrient sources, 1962, 10(3): 181-188. |
| [6] | Natalia N B, Helmut E. Precursor-based synthesis and electrochemical performance of LiMnPO4[J]. Journal of Alloys and Compounds, 2008, 464(1-2): 259-264. DOI:10.1016/j.jallcom.2007.09.118. |
| [7] | SHEN Pan-wen(申泮文), WANG Ji-tao(王积涛). Compound dictionary(化合物词典)[M].Shanghai(上海): Shanghai Lexicographical(上海辞书出版社), 2002: 220-221. |
| [8] | HOU Cui-hong(侯翠红), WANG Yan(王燕), WANG Hao-bin(王好斌), et al. Preparation and property study of manganese ammonium phosphate(磷酸铵锰的制备及性能研究)[J]. Industrial Minerals & Processing(化工矿物与加工), 2017, 46(1): 19-22. |
| [9] | ZHOU Ze-guang(周泽广), YUAN Ai-qun(袁爱群), BAI Li-juan(白丽娟), et al. Influence of synthesis routes on particle morphology of NH4MPO4·H2O (M=Mn, Fe, Co, Ni, Cu)(合成方法对NH4MPO4·H2O (M=Mn, Fe, Co, Ni, Cu)颗粒形貌的影响)[J]. Applied Chemical Industry(应用化工), 2007, 36(3): 217-221. DOI:10.3969/j.issn.1671-3206.2007.03.003. |
| [10] | Stefov V, Soptrajanov B, Kuzmanovski I, et al. Infrared and Raman spectra of magnesium ammonium phosphate hexahydrate (struvite) and its isomorphous analogues. Ⅲ. Spectra of protiated and partially deuterated magnesium ammonium phosphate hexahydrate[J]. Journal of Molecular Structure, 2005, 752(1/2/3): 60-67. |
| [11] | Violeta G. K.. Vibrational behavior of the phosphates ions in dittmarite-type compounds M"M""PO4·H2O (M"=K+, NH4+; M""=Mn2+, Co2+, Ni2+)[J]. Spectrochimica Acta, Part A, 2007, 66(2): 413-418. DOI:10.1016/j.saa.2006.03.015. |
| [12] | SUI Xi-na (隋锡娜). Study of synthesis, structure and properties of iron, manganese and copper complexes containing nitrogen bidentate ligands (含氮双齿配体铁、锰、铜配合物的合成、结构和性能研究)[D]. Beijing (北京):Capital Normal University (首都师范大学), 2008:36-39. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1390655 |
| [13] | Kissinger H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706. DOI:10.1021/ac60131a045. |
| [14] | Starink M J. A new method for the derivation of activation energies from experiments performed at constant heating rate[J]. Thermochim Acta, 1995, 258(1): 309-323. |
| [15] | Flynn J H, Wall L A. A quick, direct method for the determination of activation energy from thermogravimetric data[J]. Journal of Polymer Science Part B:Polymer Letters, 1966, 4(5): 323-328. DOI:10.1002/pol.1966.110040504. |
| [16] | Chanaiporn D, Pittayagorn N, Sujittra Y. Some thermodynamic functions and kinetics of thermal decomposition of NH4MnPO4·H2O in nitrogen atmosphere[J]. Journal of Thermal Analysis and Calorimetry, 2010, 100(1): 117-124. DOI:10.1007/s10973-009-0017-4. |
| [17] | HU Rong-zu(胡荣祖), SHI Qi-zhen(史启祯). Thermal analysis kinetics(热分析动力学)[M].Beijing(北京): Science Press(科学出版社), 2001: 100. |
| [18] | GUAN Chun-xiu(关春秀), CHEN Dong-hua(陈栋华). A description of thermal analysis kinetics of dehydration of ammonium oxalate monohydrate(一水合草酸铵脱水的热分析动力学)[J]. Journal of South-Central University for Nationalities (Nature Science Edition)(中南民族大学学报:自然科学版), 2004, 23(1): 14-17. |
| [19] | Coats A W, Redfern J P. Kinetic parameters from thermogravimetric data[J]. Nature, 1964, 201(4914): 68-69. DOI:10.1038/201068a0. |
| [20] | ZHOU Cai-rong(周彩荣), SHI Xiao-hua(石晓华), WANG Hai-feng(王海峰), et al. Thermal decomposition and the non-isothermal decomposition kinetic of DL-2-naproxen(DL-2-萘普生热分解过程和非等温热分解动力学研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2011, 25(3): 442-446. DOI:10.3969/j.issn.1003-9015.2011.03.015. |




