无机盐作为人体及食物中必不可少的元素,在体内主要以离子形式存在,具有维持生物体生命活动、渗透压平衡、酸碱平衡等功能[1]。迄今为止,已有不少文献报道指出无机盐浓度过高时,对微生物产生抑制和毒害作用[2-4]。实际上,无机盐的抗菌历史非常悠久,用于埃及木乃伊的保存是最好的实例之一[5]。
早在40多年前,已有学者研究了NaCl的抑菌作用[6]。近年来,关于无机盐的抗菌效能研究越来越丰富[7-8],而对无机盐抗菌作用机理的研究并不深入,仅有个别研究从菌种活性与表面Zeta电位及红外光谱的关系方面考察了Mg2+对嗜酸氧化亚铁硫杆菌(At.f)氧化活性的影响机制。结果表明,在20 g·L-1的Mg2+作用下,细胞壁成分中的羧酸基和磷酸基等官能团发生交联反应,不仅破坏了细胞壁骨架结构,而且改变了官能团的电离或水解平衡,使菌体表面所带电荷量发生变化,导致At.f生长受限,氧化活性降低,这是迄今为止该类研究的最新认识[9]。此外,光谱学实验[10]和计算机理论模拟[11]研究表明,Ca2+与细胞膜脂质层间的相互作用能够导致细胞膜结构重塑。由此,从物理模型的电荷作用角度给出了无机盐抗菌机理缘于其对细胞膜结构的破坏。但是,基于无机盐及其阳离子电荷浓度、离子半径系列变化对抗菌效果的影响规律,及展开无机盐抗菌作用精细过程的机理描述方面,至今尚缺少深入明确研究。
鉴于此,本文以大肠杆菌(E.coli)为受试菌种,选择5种具有不同阳离子价态,即不同电荷数和离子半径的无机盐,采用平皿计数法,考察无机盐的作用浓度、电荷浓度及离子半径等因素对抗菌性能的影响规律;通过菌体表面Zeta电位测定、红外光谱分析、扫描电镜观察等手段,研究无机盐抗菌作用的精细过程,建立作用机理模型。所得结果不仅可进一步揭示不同价态无机盐阳离子的抗菌性能和作用机理,而且可为其他高电荷阳离子大分子聚电解质的抗菌机理研究提供有益的理论和实验基础。
2 实验方法 2.1 菌种和培养基大肠杆菌:DH5α,南京理工大学环境与生物工程学院;营养琼脂:国药集团化学试剂有限公司。
2.2 试剂与仪器脂多糖:L2880,Sigma公司;微孔滤膜:孔径0.22 μm,上海兴亚净化材料厂。
无机盐:NaCl、LiCl、CaCl2、MgCl2、AlCl3,均为分析纯试剂;戊二醛:C5H8O2(w = 50%),电镜专用,阿拉丁试剂(上海)有限公司。
LS-35HD数码显示自动型立式压力蒸汽灭菌器:江阴滨江医疗设备有限公司;SW-CJ-1CU洁净工作台:苏州安泰空气技术有限公司;80 L数显生化培养箱:常州华奥仪器制造有限公司;THZ-25大容量恒温振荡器:常州诺基仪器有限公司;BCD-186KB冰箱:青岛海尔股份有限公司;L600离心机:湖南湘仪有限公司;JS94H微电泳仪:上海中晨数字技术设备有限公司;NICOLETIS10傅里叶红外光谱仪:美国赛默飞世尔科技有限公司;SU8010日立新型高分辨率场发射扫描电镜:日本日立公司。
2.3 实验方法 2.3.1 菌悬液浓度及无机盐选择根据课题组已有抗菌性能研究基础[12],配制菌悬液浓度为105个·mL-1的中污染水进行抗菌实验。
NaCl、LiCl、CaCl2、MgCl2、AlCl3是常用无机盐,选择其作为1价、2价、3价阳离子无机盐的代表,具有典型性和可比性。
2.3.2 抗菌性能实验室温下,在5组已灭菌的100 mL三角瓶中,分别加入50 mL菌含量为105个·mL-1的菌悬液,将不同作用浓度(即无机盐投加浓度或剂量,单位为mol·L-1)或电荷浓度(即单位体积菌悬液中所加入的无机盐中阳离子所带总正电荷的物质的量,单位为mol·L-1)的每种无机盐溶液分别加到各自的一组三角瓶中,另外单独分装一瓶菌悬液不加无机盐。将所有加无机盐的三角瓶置于振荡器中振荡(140 r·min-1,5 min),使其分散均匀。放置24 h后,取样测定所有三角瓶中的菌含量。以未加无机盐的三角瓶中的菌含量为空白对照,按下式计算各无机盐的抗菌率[12]。以上实验重复进行3次,取抗菌率的平均值。
抗菌率/ % = (空白样菌含量-实验样菌含量)/空白样菌含量×100%
2.3.3 作用机理实验(1) Zeta电位测定
Zeta电位可近似地表示悬浮颗粒在液体中表面所带净电荷产生的电位,可用作对颗粒之间相互静电排斥力或吸引力强度的度量。参照文献方法[13],测定2.3.2节中无机盐作用24 h前后所有菌悬液的Zeta电位,考察菌体表面电位值的变化情况。
(2) 红外光谱分析
红外光谱可反映分子中官能团或化学键的信息。参照文献方法[14],采用已灭菌的微孔滤膜,过滤2.3.2节中无机盐作用24 h后有代表性的(不同价态、不同作用浓度)菌悬液,自然晾干后进行红外光谱扫描,分析无机盐作用前后菌悬液滤出物的红外光谱,得到有关细胞表面化合物的官能团或化学键的变化情况。
(3) 扫描电镜观察
扫描电镜可显示样品表面的各种形貌特征。参照文献方法[15],离心(4 000 r·min-1,3 min)2.3.2节中无机盐作用24 h后有代表性的(不同价态、最大作用浓度)菌悬液,收集菌细胞,弃去含有无机盐的上清液,加入4%戊二醛固定液,经冷冻真空干燥、镀金后,观察无机盐作用前后菌体表面形态的变化情况。
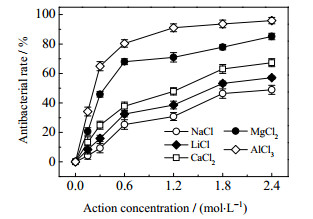
3 结果与讨论 3.1 无机盐及其阳离子抗菌性能评价 3.1.1 无机盐作用浓度对抗菌率的影响由于受AlCl3溶解度限制,选择NaCl、LiCl、CaCl2、MgCl2、AlCl3对大肠杆菌的作用浓度分别为0.15~2.4 mol·L-1,按照2.3.2节步骤进行抗菌实验,测定各无机盐作用24 h后的抗菌率,结果如图 1所示。
|
图 1 无机盐作用浓度对抗菌率的影响 Fig.1 Effects of inorganic salt concentration on antibacterial efficiency |
由图 1可见,当NaCl、LiCl、CaCl2、MgCl2、AlCl3的作用浓度为0.15~2.4 mol·L-1时,其24 h抗菌率随作用浓度的增大而增大,最大抗菌率分别为48.92%、57.14%、67.35%、85.12%、95.92%,即相同作用浓度条件下,无机盐抗菌效能强弱顺序表现为AlCl3 > MgCl2 > CaCl2 > LiCl > NaCl。此结果体现了盐的作用浓度越大、阳离子价态越高,抗菌作用效能越强的一般规律。
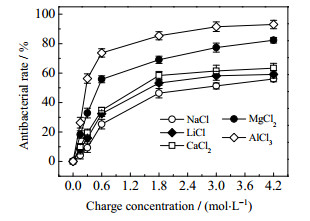
3.1.2 阳离子电荷浓度及其半径对抗菌率的影响为了考察无机盐的电荷浓度对抗菌效果的影响规律,调节盐浓度,控制NaCl、LiCl、CaCl2、MgCl2、AlCl3的电荷浓度分别为0.15~4.2 mol·L-1 (相当于盐的作用浓度分别为1价盐0.15~4.2 mol·L-1,2价盐0.075~2.1 mol·L-1,3价盐0.05~1.4 mol·L-1),按照2.3.2节步骤进行抗菌实验,测定各无机盐作用24 h后的抗菌率,结果如图 2所示。
|
图 2 无机盐电荷浓度对抗菌率的影响 Fig.2 Effects of inorganic salt charge concentration on antibacterial efficiency |
由图 2可见,当NaCl、LiCl、CaCl2、MgCl2、AlCl3的电荷浓度为0.15~4.2 mol·L-1时,其24 h抗菌率随电荷浓度的增大而增大,最大抗菌率分别为56.03%、59.14%、63.36%、82.34%、93.02%,即抗菌效果表现为AlCl3 > MgCl2 > CaCl2 > LiCl > NaCl,这个规律与无机盐作用浓度的影响规律一致。实质上,无机盐作用浓度增大时,其电荷浓度相应增大,两者对增加无机盐抗菌效果的一致性是容易理解的[16]。
值得注意的是,高价阳离子盐不仅在相同作用浓度下,而且在相同阳离子电荷浓度下具有更强的抗菌性能。如仅从阳离子电荷浓度来看,当盐浓度相同时,高价阳离子盐在反应液中比低价阳离子盐的电荷浓度大往往极易被认为是其抗菌性能更好的原因之一。然而,这里通过对阳离子电荷浓度影响规律的考察不难发现,在相同电荷浓度下,高价阳离子虽然其盐浓度仅为低价阳离子盐浓度的1/2或者1/3,其仍具有更强的抗菌性。此外,由图 1、2还可以发现,在相同电荷浓度条件下,对于同一主族元素的无机盐阳离子,其电荷数相同时,抗菌率随阳离子半径的减小而增大,抗菌效果表现为LiCl > NaCl、MgCl2 > CaCl2。
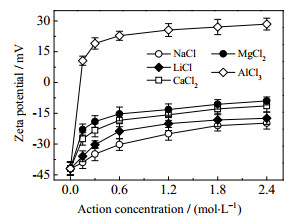
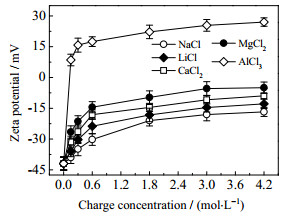
3.2 作用机理实验研究 3.2.1 Zeta电位测定选择NaCl、LiCl、CaCl2、MgCl2、AlCl3的作用浓度分别为0.15~2.4 mol·L-1,电荷浓度分别为0.15~4.21 mol·L-1按照2.3.3 (1)节步骤,测定各无机盐作用24 h前后菌悬液的Zeta电位,结果如图 3、4所示。
|
图 3 无机盐作用浓度对Zeta电位的影响 Fig.3 Effects of inorganic salt concentration on Zeta potential |
|
图 4 无机盐电荷浓度对Zeta电位的影响 Fig.4 Effects of inorganic salt charge concentration on Zeta potential |
由图 3、4可见,大肠杆菌表面Zeta电位随无机盐作用浓度、电荷浓度、阳离子价态的增大而增大,随离子半径的增大而减小。各无机盐在0~0.3 mol·L-1的作用浓度、电荷浓度范围内,大肠杆菌表面Zeta电位值迅速增大;随着作用浓度、电荷浓度的继续增大,Zeta电位值增幅明显减小,当作用浓度、电荷浓度分别达到2.4、4.2 mol·L-1时,Zeta电位值变化趋于平缓。由此可见,各无机盐与菌体发生了电中和作用,且作用浓度或电荷浓度随电位值的变化规律与作用浓度或电荷浓度随抗菌率的变化规律成正相关。
值得注意的是,加入极低浓度AlCl3后,大肠杆菌悬液的Zeta电位由负值迅速变正且快速增大,实测结果表明约在10-4 mol·L-1左右的作用浓度时,Zeta电位值已越过零电位点变为正值;而加入其他无机盐后的Zeta电位值在实验范围内所有作用浓度下均不能变为正值,且看不出其值有越过零电位点的趋势。由此说明,AlCl3与菌体发生的电中和作用不仅最为强烈,而且可能隐含不同的作用机制。
此外,对于价态小于等于2的离子,其溶液可近似看作中性,而对于高价态的AlCl3来说,显然不是这样。为此,分别测定了0.15、2.4、10-4 mol·L-1的AlCl3(最小、最大、零电位点等3个作用浓度)及0.1 mol·L-1的HCl (滴加于菌悬液,直至其pH值达到与加入3个浓度的AlCl3作用时的pH值相同或相近)作用于菌悬液时的pH值和Zeta电位,以考察pH值对Zeta电位产生的影响。结果表明,引起菌体表面Zeta电位由负到正变化的主要因素是AlCl3电离出来的Al3+,即高价阳离子对菌体表面的电中和作用,而不是H+的作用。因此,抗菌实验中pH值的变化对Zeta电位的测定确有影响,但对无机盐阳离子对菌体电中和作用的趋势和基本规律无明显影响。
3.2.2 红外光谱分析(1) 无机盐作用后大肠杆菌红外光谱
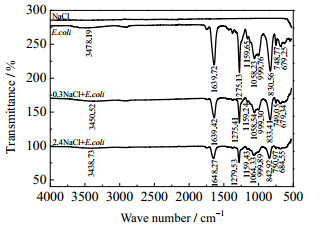
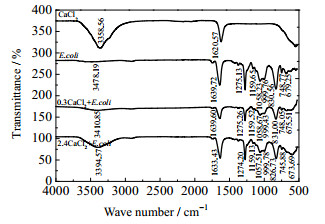
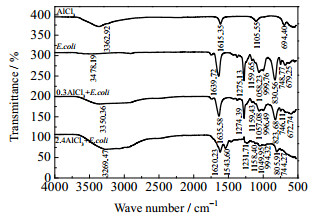
由3.2.1节可知,宏观上大肠杆菌表面Zeta电位随无机盐的投加发生了变化。为了进一步研究微观上大肠杆菌表面官能团发生的实质性变化,按照2.3.3 (2)节步骤,分析作用浓度分别为0、0.3、2.4 mol·L-1的NaCl、CaCl2、AlCl3作用前后大肠杆菌的红外光谱,如图 5~7所示。
|
图 5 不同浓度的NaCl作用前后E.coli表面红外光谱 Fig.5 IR spectra of E.coli surface before and after treatment of NaCl with different concentrations |
|
图 6 不同浓度的CaCl2作用前后E.coli表面红外光谱 Fig.6 IR spectra of E.coli surface before and after treatment of CaCl2 with different concentrations |
|
图 7 不同浓度的AlCl3作用前后E.coli表面红外光谱 Fig.7 IR spectra of E.coli surface before and after treatment of AlCl3 with different concentrations |
分析图 5~7的红外光谱,并结合已有研究中大肠杆菌表面官能团红外光谱特征峰信息[9, 17],可对比无机盐作用前后大肠杆菌表面官能团红外光谱特征峰的变化情况,获取有关信息,如表 1所示(其中,─O─H包括─COOH和─OPO(OH)2上的羟基)。
|
|
表 1 无机盐作用前后大肠杆菌表面官能团红外光谱特征峰变化情况 Table 1 Variation of IR peaks of functional groups on E. coli surface before and after inorganic salt treatment |
表 1显示了无机盐作用前后大肠杆菌表面各官能团红外光谱特征峰的变化情况,具体来说:在0.3、2.4 mol·L-1 NaCl或CaCl2作用下,除了v-O-H伸缩振动峰值有小偏移或较大偏移外,其他特征峰均无明显变化;在0.3 mol·L-1 AlCl3作用下,除了v-O-H伸缩振动峰值有大偏移,且峰形变为平峰外,其他特征峰均无明显变化;而在2.4 mol·L-1 AlCl3作用下,情况明显不同。其中,v-O-H伸缩振动峰值有很大偏移,且峰形变为大平峰;v-C=O伸缩振动峰值有小偏移,且由单峰裂分为双峰;v-O-H、v-C=O弯曲振动峰和v-P=O伸缩振动峰强度明显减弱,接近消失;v-C-H弯曲振动峰值有小偏移;v-CH2-伸缩振动峰由双峰变为单峰。可见,高浓度、高价态的AlCl3与大肠杆菌表面官能团发生作用的形式和程度明显存在多样性。
(2) 无机盐作用后脂多糖红外光谱
已有研究表明,革兰氏阴性菌细胞壁成分复杂,具有多层结构,主要为外膜和肽聚糖层。其中,外膜为革兰氏阴性菌所独有,位于细胞壁最外层,由脂多糖(LPS)、脂质双层和脂蛋白组成。其中,LPS在细胞壁外膜表面的脂质双层中覆盖率达到90%以上[18]。因此,LPS被认为是革兰氏阴性菌细胞壁外膜的主要成分[19]。鉴于此,本文考虑选用LPS为作用对象,进一步考察无机盐抗菌作用的精细过程。
按照大肠杆菌细胞干重及LPS在干重细胞中的含量,经折算可得到LPS在实验所用105个·mL-1菌悬液中的浓度约为0.05 μg·mL-1。配制0.05 μg·mL-1的LPS溶液,分别与0、0.3、2.4 mol·L-1的NaCl、CaCl2、AlCl3作用,分析作用前后LPS的红外光谱,如图 8~10所示。
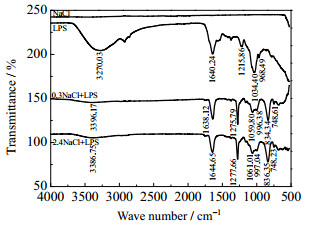
|
图 8 不同浓度的NaCl作用前后LPS红外光谱 Fig.8 IR spectra of LPS before and after treatment of NaCl with different concentrations |
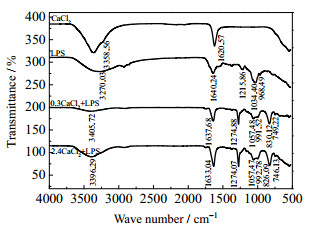
|
图 9 不同浓度的Cacl2作用前后LPS红外光谱 Fig.9 IR spectra of LPS before and after treatment of CaCl2 with different concentrations |
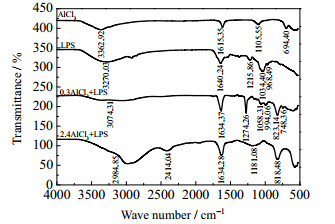
|
图 10 不同浓度的AlCl3作用前后LPS红外光谱 Fig.10 IR spectra of LPS before and after treatment of AlCl3 with different concentrations |
分析图 8~10的红外光谱,已知LPS中含有─COOH、─OPO(OH)2及其酯或盐等官能团[20],可对比无机盐作用前后LPS中官能团红外光谱特征峰的变化情况,获取有关信息,如表 2所示(其中,─O─H包括─COOH和─OPO(OH)2上的羟基)。
|
|
表 2 无机盐作用前后LPS中官能团红外光谱特征峰变化情况 Table 2 Variation of IR peaks of functional groups in LPS before and after inorganic salt treatment |
表 2显示了无机盐作用前后LPS中各官能团红外光谱特征峰的变化情况,具体来说:在0.3、2.4 mol·L-1 NaCl、CaCl2或0.3 mol·L-1 AlCl3作用下,v-O-H伸缩振动峰值有大偏移或很大偏移,v-O-H弯曲振动峰值有较大偏移,v-P=O伸缩振动峰值有小偏移,但峰形均无明显变化;v-C-H弯曲振动和v-CH2-伸缩振动均新出现单峰;v-C=O伸缩振动峰无明显变化。而在2.4 mol·L-1 AlCl3作用下,情况明显不同。其中,原v-O-H伸缩振动峰消失,新出现双峰;原v-O-H弯曲振动峰和v-P=O伸缩振动峰消失,混合变为平峰;v-C-H弯曲振动新出现单峰,v-C=O、v-CH2-伸缩振动峰无明显变化。可见,高浓度、高价态的AlCl3与LPS发生作用的形式和程度同样明显存在多样性。
已有研究表明,对于大肠杆菌,多数盐阳离子被吸附在LPS分子中部核心多糖区域[21],阳离子可以在这个区域内桥连相邻两个LPS分子的磷酸(酯/盐)基,从而稳定LPS分子的排列。因此,在合适的盐浓度下,无机盐阳离子是稳定LPS分子层的关键[22]。对比表 1、2实验结果及分析,同样反映了浓度和价态是影响无机盐阳离子作用效果的关键。特别地,0.3、2.4 mol·L-1 NaCl、CaCl2或0.3 mol·L-1 AlCl3分别与大肠杆菌表面官能团和LPS中官能团作用时,情况基本相同,即v-O-H伸缩振动峰均可发生或大或小的偏移,说明1价、2价无机盐及0.3 mol·L-1的3价无机盐与─O─H基之间存在较弱的络合作用;v-C=O伸缩振动峰均无明显变化;v-P=O伸缩振动峰均天生为双峰,说明磷酸(酯/盐)基处于LPS上两个不同位置。然而,2.4 mol·L-1 AlCl3分别与大肠杆菌表面官能团和LPS中官能团作用时,情况完全不同。首先,v-O-H、v-P=O伸缩振动峰和v-O-H弯曲振动峰均发生了显著变化,说明2.4 mol·L-1 AlCl3与磷酸(酯/盐)基之间存在较强的络合作用,可发生交联反应。其次,v-C=O伸缩振动峰的变化有所不同,当与大肠杆菌作用时,推测2.4 mol·L-1的AlCl3破坏了细胞壁外膜结构后,聚集排列的LPS分子功能受损,导致脱落,使得原本致密有序的羧酸(酯/盐)基尽可能裸露出来,大大增加了与磷酸(酯/盐)基竞争Al3+进一步发生反应的机率,所以v-C=O伸缩振动峰值有小偏移,且由单峰裂分为双峰;当与LPS溶液作用时,由于LPS分子自由分散存在,其羧酸(酯/盐)基排列杂乱无章,与磷酸(酯/盐)基竞争Al3+发生反应的机率远小于磷酸(酯/盐)基与Al3+发生反应的机率,所以v-C=O伸缩振动的峰值和峰形均无明显变化。
(3) Zeta电位与红外光谱变化解析
表 1、2显示了官能团及特征峰的变化规律,对照3.2.1节电位测定结果及相关讨论,发现两者之间有紧密联系,即高浓度、高价态的无机盐对─OPO(OH)2、─COOH的作用效果最为明显。为此,以Na+、Ca2+、Al3+为1价、2价、3价无机盐阳离子的代表,分别与LPS中以─OPO(OH)2为代表的阴离子进行关联。假设m mol·L-1阳离子(M(1~3)+)与磷酸基发生反应,生成n mol·L-1磷酸盐,归纳以阳离子为核心的初级反应生成物及其Zeta电位和红外光谱的变化情况,如表 3所示。
|
|
表 3 无机盐阳离子和磷酸盐的初级反应生成物及其Zeta电位、红外光谱的变化 Table 3 Products of primary reaction between inorganic salt cations and phosphate and their Zeta potential and IR spectra |
由表 3可见,Zeta电位测定和红外光谱分析结果密切相关,一一对应。但是,Zeta电位体现的是菌体个体表面电位及其变化,为反电荷之间的电中和作用,属于物理作用;而红外光谱分析不仅显示了化学键的弱作用(络合:位移变化),而且还体现了化学键的强作用(峰形:旧键消失和新键生成),与电位值大幅度越过零电位点相对应,属于物理和化学的共同作用。
3.2.3 扫描电镜观察(1) 观察结果
为了进一步观察无机盐作用前后大肠杆菌细胞表面形态的变化,按照2.3.3节(3)的步骤,观察浓度为2.4 mol·L-1的NaCl、LiCl、CaCl2、MgCl2、AlCl3分别作用24 h后菌体表面形态的变化,如图 11所示。

|
图 11 大肠杆菌扫描电镜照片 Fig.11 SEM micrographs of E. coli |
由图 11可见,(a)为正常生长的大肠杆菌,呈典型杆状结构,菌体饱满,表面光滑,形状规则,边界清晰,图中较短的为新生细胞,较长的为即将分裂增殖的细胞。(b)、(c)为1价盐作用后的大肠杆菌,此时可观察到部分菌体发生皱缩、变形,菌体表面略显粗糙,其中LiCl作用后的菌体(c)表面皱缩或变形的程度及数量明显多于NaCl作用后的菌体(b)。(d)、(e)为2价盐作用后的大肠杆菌,与(b)、(c)明显不同的是,一方面,菌体表面皱缩、变形程度较小,细胞壁相对于1价盐作用后基本完整;另一方面,却出现大量泡沫状絮体,可观察到其组成颗粒较细小,其中MgCl2作用后的菌体(e)比CaCl2作用后的菌体(d)被较多泡沫状絮体包裹,且结构略显紧密。(f)为3价盐AlCl3作用后的大肠杆菌,此时菌体表面皱缩、变形程度极大,虽未明显可见细胞壁的破损,但其塌陷或瘪缩扭曲程度严重;此外,尽管菌体表面的絮体量不太多,但呈现立体颗粒大团状,且结构紧致密实。
(2) 渗透压作用
由图 11还可见,大肠杆菌在各无机盐作用下,其表面均有不同程度的皱缩、变形或塌陷。但是,上述基于Zeta电位和红外光谱得到的电中和作用和菌体表面官能团与阳离子作用的分析,并不能圆满解释这一现象。考虑到由于菌体处于盐溶液中,盐对菌体的渗透压作用所带来的影响不容忽视[23]。按照适用于稀溶液的van’t Hoff公式(Π = ic=B=RT)[24],设在25 ℃室温下,当以NaCl、CaCl2、AlCl3为代表的1价、2价、3价无机盐的作用浓度为0.3 mol·L-1 (稀溶液)时,iNaCl = 2、iCaCl2 = 3、iAlCl3 = 4,则盐溶液的渗透压分别为ΠNaCl = 1.49 kPa、ΠCaCl2 = 2.23 kPa、ΠAlCl3 = 2.97 kPa,即渗透压大小顺序为3价盐 > 2价盐 > 1价盐。细胞外无机盐阳离子的浓度越大,价态越高,则细胞内外渗透压差越大,导致细胞内部水分等流失程度越大。因此,盐溶液引起的细胞内外渗透压差,极可能是导致细胞壁塌陷或瘪缩扭曲的另一个原因。
(3) 絮凝作用
由图 11进一步可见,1价盐作用后,菌体表面未出现絮体;多价盐作用后,明显可见菌体被较多泡沫状或较大颗粒状絮体粘附、包裹,由此不难推测这是缘于阳离子多价盐的络合反应带来的絮凝作用结果。多价无机盐如AlCl3、MgCl2,本身即可用作絮凝剂[25],当加入大肠杆菌悬液后,必然会与菌体表面的磷酸基等阴离子发生电中和、络合及交联等反应。当反应足够强烈时,还可使菌体表面物质受损脱落,细胞壁受损,并依据离子的浓度、价态不同,所发生反应的产物结构有所差异,最后产生絮体的形貌也有了明显差异。特别是高浓度、高价态的AlCl3,可与阴离子交联形成立体网状结构,因此其作用后的絮体大而密实就不难理解了。
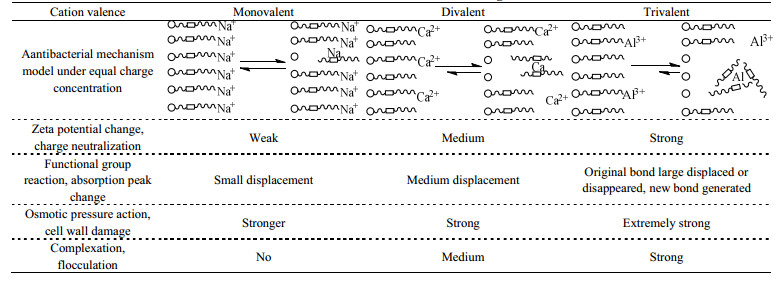
3.2.4 作用机理模型根据以上无机盐作用于菌细胞的机理研究和理论分析,综合Zeta电位测定、红外光谱分析和扫描电镜观察的实验结果,从无机盐阳离子与菌体表面物质的电中和作用、官能团反应、盐离子的渗透压作用和多价离子络合反应产生的絮凝作用等方面,较为系统地解释了盐离子浓度、价态与其抗菌效能的关系。由此,尝试建立了无机盐阳离子抗菌作用机理模型(仅考虑过量无机盐加入后,磷酸(酯/盐)基参与的作用),如表 4所示(等电荷浓度条件下)。
|
|
表 4 无机盐阳离子抗菌作用机理模型及其作用结果分析 Table 4 Antibacterial mechanism and results of inorganic salt cations |
基于这一模型,给出无机盐抗菌作用过程的精细描述:首先,无机盐阳离子吸附到菌体带负电荷的表面发生电中和作用,同步引起细胞内外渗透压差,其中多价阳离子与表面官能团可发生络合反应,产生絮凝作用,剥除脂多糖等细胞壁外膜物质,使细胞壁受损;然后,细胞内外的渗透压失去平衡,胞质外泄,细胞壁结构塌陷;最终,细胞代谢功能受损,导致菌细胞死亡。
4 结论(1) 对于5种不同价态阳离子的无机盐,作用浓度、电荷浓度越大,离子半径越小,其抗菌效果越好,抗菌性强弱顺序为:AlCl3 > MgCl2 > CaCl2 > LiCl > NaCl。对菌含量为105个·mL-1的中污染水,作用浓度为2.4 mol·L-1时,24 h最大抗菌率分别为:95.92%、85.12%、67.35%、57.14%、48.92%。对于多个电荷集中于一点的3价盐,其强烈的电中和作用、较大的渗透压差和强烈的络合与交联反应等3方面共同作用,导致3价阳离子盐突出的抗菌效果。
(2) 随着无机盐作用浓度增大、离子价态升高、离子半径减小,大肠杆菌表面Zeta电位增大,表明无机盐阳离子与菌体表面官能团发生的电中和作用增强;菌体红外光谱中的─O─H、─P=O和─C=O等官能团的吸收峰分别发生了不同程度的红移或裂分,表明无机盐阳离子与菌体表面物质如LPS中的官能团发生的络合或交联反应增强;扫描电镜显示的菌体塌陷和外膜脱落形成的絮体,表明无机盐阳离子的渗透压作用和多价盐的絮凝作用。
(3) 在建立了抗菌作用机理模型基础上,给出了无机盐抗菌作用过程的精细描述:首先,无机盐阳离子吸附到菌体带负电荷的表面发生电中和作用,同步引起细胞内外渗透压差,其中多价阳离子与表面官能团可发生络合反应,产生絮凝作用,剥除脂多糖等细胞壁外膜物质,使细胞壁受损;然后,细胞内外的渗透压失去平衡,胞质外泄,细胞壁结构塌陷;最终,细胞代谢功能受损,导致菌细胞死亡。
| [1] |
蔡萍, 刘淑俊. 中心静脉留置套管处采血对电解质结果的影响[J]. 护士进修杂志, 2006, 21(9): 851-853. CAI P, LIU S J. Effect of blood collection on central electrolyte in indwelling cannula[J]. Journal of Nurses Training, 2006, 21(9): 851-853. DOI:10.3969/j.issn.1002-6975.2006.09.041 |
| [2] |
CATTELAN M G, NISHIYAMA Y P D, GONCALVES T M V, et al. Combined effects of oregano essential oil and salt on the growth of Escherichia coli in salad dressing[J]. Food Microbiology, 2018, 73: 305-310. DOI:10.1016/j.fm.2018.01.026 |
| [3] |
PAN X, WANG Y, CHEN Z, et al. Investigation of antibacterial activity and related mechanism of a series of nano-Mg(OH)2[J]. ACS Applied Materials & Interfaces, 2013, 5(3): 1137-1142. |
| [4] |
ROBINSON D A, GRIFFITH R W, SHECHTMAN D, et al. In vitro antibacterial properties of magnesium metal against Escherichia coli, Pseudomonas aeruginosa and Staphylococcus aureus[J]. Acta. Biomaterialia, 2010, 6(5): 1869-1877. DOI:10.1016/j.actbio.2009.10.007 |
| [5] |
刘曙刚. 埃及人怎样保存木乃伊[J]. 世界文化, 1994(3): 6-6. LIU S G. How the Egyptians preserved the mummy[J]. World Culture, 1994(3): 6-6. |
| [6] |
KANE J, FISCHER J B. The effect of sodium chloride on the growth and morphology of dermatophytes and some other keratolytic fungi[J]. Canadian Journal of Microbiology, 1975, 21(6): 742-749. DOI:10.1139/m75-110 |
| [7] |
李玲玲, 李文倩, 江红波. 无机盐对生物硝化功能的影响[J]. 工业水处理, 2014, 34(11): 69-72. LI L L, LI W Q, JIANG H B. Effect of inorganic salts on biological nitrification process[J]. Industrial Water Treatment, 2014, 34(11): 69-72. DOI:10.11894/1005-829x.2014.34(11).069 |
| [8] |
许晓芳, 林海, 董颖博, 等. 阳离子对嗜酸氧化亚铁硫杆菌氧化活性的影响[J]. 稀有金属, 2016, 40(5): 478-484. XU X F, LIN H, DONG Y B, et al. Oxidation activity of Acidthiobacillus ferrooxidans with cation additives[J]. Rare Metals, 2016, 40(5): 478-484. |
| [9] |
许晓芳, 林海, 董颖博, 等. Mg2+对At. f菌氧化活性的影响[J]. 华南理工大学学报(自然科学版), 2016, 44(6): 41-46. XU X F, LIN H, DONG Y B, et al. Effect of magnesium ion on oxidation activity of Acidthiobacillus ferrooxidans[J]. Journal of South China University of Technology (Natural Science Edition), 2016, 44(6): 41-46. DOI:10.3969/j.issn.1000-565X.2016.06.007 |
| [10] |
MELCROVA A, POKOMA S, PULLANCHERY S, et al. The complex nature of calcium cation interactions with phospholipid bilayers[J]. Scientific Reports, 2016, 6: 38035-38046. DOI:10.1038/srep38035 |
| [11] |
ALI DOOSTI B, PEZESHKIAN W, BRUHN D S, et al. Membrane tubulation in lipid vesicles triggered by the local application of calcium ions[J]. Langmuir, 2017, 33(41): 11010-11017. DOI:10.1021/acs.langmuir.7b01461 |
| [12] |
赵晓蕾. PDMDAAC杀生性能及其在含菌藻原水强化混凝处理中的应用[D].南京: 南京理工大学, 2011. ZHAO X L. Biocidal performance of PDMDAAC and application in enhanced coagulation treatment of bacteria- and algae-containing raw water[D]. Nanjing: Nanjing University of Science & Technology, 2011. |
| [13] |
刘辉.抑制耐冷菌的乳酸菌抗菌肽筛选及其结构和抗菌机理研究[D].哈尔滨: 哈尔滨工业大学, 2016. LIU H. Screening, structure and mode of action of antimicrobial peptides inhibited psychrotrophs from lactic acid bacteria[D]. Harbin: Harbin Institute of Technology, 2016. |
| [14] |
杨丽君, 王静, 李兆杰, 等. 傅里叶变换红外光谱技术用于细菌检测的影响因素[J]. 食品科学, 2013, 34(8): 190-194. YANG L J, WANG J, LI Z J, et al. Several factors for the detection of bacteria by FT-IR spectroscopy[J]. Food Science, 2013, 34(8): 190-194. |
| [15] |
ZHAO X L, ZHANG Y J. Bacteria-removing and bactericidal efficiencies of PDADMAC composite coagulants in enhanced coagulation treatment[J]. CLEAN-Soil, Air, Water, 2013, 41(1): 37-42. DOI:10.1002/clen.201100324 |
| [16] |
WANG Q, YANG Z Y, QI G F, et al. Synthesis, crystal structure, antioxidant activities and DNA-binding studies of the Ln (III) complexes with 7-methoxychromone-3-carbaldehyde-(4′-hydroxy) benzoyl hydrazine[J]. European Journal of Medicinal Chemistry, 2009, 44(6): 2425-2433. DOI:10.1016/j.ejmech.2008.10.023 |
| [17] |
谢朝阳, 魏凌云. 抗重金属细菌与针铁矿体系吸附Cu2+和Cd2+的红外光谱研究[J]. 武汉生物工程学院学报, 2006, 2(3): 153-157. XIE C Y, WEI L Y. Effect of heavy metal resistant bacteria strain on absorptions of Cu2+ and Cd2+ by goethite with infrared spectrum[J]. Journal of Wuhan Bioengineering Institute, 2006, 2(3): 153-157. |
| [18] |
SNYDER D S, MCINTOSH T J. The lipopolysaccharide barrier: Correlation of antibiotic susceptibility with antibiotic permeability and fluorescent probe binding kinetics[J]. Biochemistry, 2000, 39(38): 11777-11787. DOI:10.1021/bi000810n |
| [19] |
WANG B D, YANG Z Y, CREWDSON P, et al. Synthesis, crystal structure and DNA-binding studies of the Ln(III) complex with 6-hydroxychromone-3-carbaldehyde benzoyl hydrazone[J]. Journal of Inorganic Biochemistry, 2007, 101(10): 1492-1504. DOI:10.1016/j.jinorgbio.2007.04.007 |
| [20] |
孙玥.中国林蛙抗菌肽chensinin-1b对革兰氏阴性菌的杀菌机制及抑制LPS诱导炎症反应的研究[D].大连: 辽宁师范大学, 2016. SUN Y. The mechanism against gram-negative bacteria and the effect on lipopolysaccharide-induced inflammatory responses of chensinin-1b, an antimicrobial peptide analogue from Chinese brown frog, Rana chensinensis [D]. Dalian: Liaoning Normal University, 2016. |
| [21] |
CLIFTON L A, SKODA M W A, LE BRUN A P, et al. Effect of divalent cation removal on the structure of gram-negative bacterial outer membrane models[J]. Langmuir, 2015, 31(1): 404-412. DOI:10.1021/la504407v |
| [22] |
AMRO N A, KOTRA L P, WADU-MESTHRIGE K, et al. High-resolution atomic force microscopy studies of the Escherichia coli outer membrane: Structural basis for permeability[J]. Langmuir, 2000, 16(6): 2789-2796. DOI:10.1021/la991013x |
| [23] |
林炜, 张京生, 张世湘, 等. 干酪乳杆菌05-21在酸、胆盐和渗透压胁迫条件下的同源抗性和交叉抗性反应研究[J]. 中国乳品工业, 2008, 36(11): 4-6. LIN W, ZHANG J S, ZHANG S X, et al. Study on the homologous resistance and cross-resistance of Lactobacillus casei 05-21 under three stress conditions[J]. China Dairy Industrial, 2008, 36(11): 4-6. DOI:10.3969/j.issn.1001-2230.2008.11.001 |
| [24] |
傅献彩, 沈文霞, 姚天扬, 等. 物理化学上册[M]. 第5版.北京: 高等教育出版社, 2005. FU X C, SHEN W X, YAO T Y, et al. Physical chemistry (Volume One)[M]. 5th ed. Beijing: Higher Education Press, 2005. |
| [25] |
王润楠, 张浩, 连丽丽, 等. 聚硅酸铝镁-羧甲基纤维素钠复合絮凝剂的制备及应用[J]. 精细化工, 2017, 34(9): 1044-1050. WANG R N, ZHANG H, LIAN L L, et al. Preparation and application of polyaluminum silicate-carboxymethyl cellulose sodium composite flocculant[J]. Fine Chemicals, 2017, 34(9): 1044-1050. |