2. 浙江大学 化学工程与生物工程学院,浙江 杭州 310027;
3. 浙江工业大学 生物工程学院,浙江 杭州 310014
2. College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China;
3. College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China
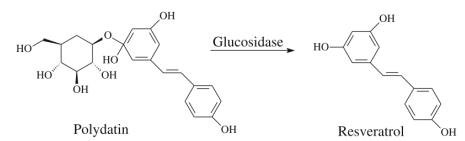
白藜芦醇(resveratrol,RSV)作为植物自身合成的一种抗逆性物质,是一类非黄酮类多酚化合物,化学名为芪三酚(3-5-4'-trihydroxy-trans-stilbene),我国主要从虎杖中提取白藜芦醇[1]。RSV在抗真菌、抗氧化、抗肿瘤、抗癌、抗衰老等方面具有显著的功效[2, 3]。植物内RSV易与葡萄糖结合形成糖苷型衍生物白藜芦醇苷(Piceid,图 1),其天然含量是RSV的3~7倍[4, 5],但在人类肠道内的利用率和生物活性远远低于RSV[2, 6]。通常以提取率和对Piceid的转化率来评价RSV的提取效果。
|
图 1 白藜芦醇苷和白藜芦醇结构 Fig.1 Structure of piceid and resveratrol |
传统的溶剂法易破坏RSV的结构,存在高成本和环境污染等问题[7]。而酶解法条件温和、对环境友好、副产物少,提取白藜芦醇的得率更高,已成为研究热点[8~10]。其中,β-葡萄糖苷酶(β-1, 4-D-glucosidase, BG,EC3.2.1.21)作为一种常用的工业用酶,常用于RSV等易糖苷化活性成分的去糖苷转化[11]。然而BG酶制剂价格较高,且单一酶对植物纤维素水解能力不足,不利于工业化提取[12]。微生物产纤维素酶已逐渐实现工业化,纤维素酶是一种含多种纤维素水解酶的复合酶(内切-β-1, 4葡聚糖酶(EC 3.2.1.4)、外切-1, 4-β-葡聚糖酶(EC 3.2.1.91)和BG酶),这些酶之间通过协同作用可以快速水解植物纤维和细胞壁,提高有效成分的溶出率[13]。常以滤纸酶活(filter paper enzyme activity,FPA)来评价协同水解能力。然而利用产纤维素酶的微生物进行虎杖的自然发酵转化易残留菌体及其代谢产物,且发酵温度远低于纤维素酶活最适反应温度,不利于纤维素酶酶活功能的最大化利用[14]。如能利用发酵得到的纤维素酶粗酶液简单浓缩后直接处理虎杖,不但可以提高对植物细胞壁的水解效率,还可以在提取过程中利用其中的BG酶同步实现去糖苷化,合并RSV的提取和转化工艺,降低经济成本。
工业上常用的纤维素酶高产菌株是里氏木霉(Trichoderma reesei,T.reesei)[15],但T.reesei自身分泌的BG酶活力极低,极大地限制了RSV的转化率。而黑曲霉FPA酶活虽然较低,但所产的BG酶具有高比活力,能够高效转化不同的中药糖苷类底物[11, 16, 17]。本实验室保存有一株FPA活力较高的里氏木霉ZU-02,拟通过基因工程技术合并两者优势:前期已提取黑曲霉高比活力BG酶基因cel7A导入整合到了T.reesei中。本文拟从619个转化子中定向筛选出高表达BG酶、且仍保持高FPA酶活的T.reesei重组菌株,初步探索和验证利用重组菌株的发酵粗酶液直接处理虎杖提取策略的可行性。
2 材料与方法 2.1 重组菌株含有黑曲霉BG酶基因cel7A的T.reesei重组菌株。重组质粒构建、根瘤农杆菌介导的转化技术、重组转化子的基因组DNA提取等方法均参照实验室前期研究建立的方法[18]。
2.2 材料和设备 2.2.1 试剂和材料中药虎杖,购于杭州天天好大药房,产地浙江。RSV和Piceid标品购于上海金穗生物有限公司,HPLC ≥ 98 %。其他所有的试剂除非有特殊说明,均为分析纯的纯度。
2.2.2 仪器与设备ME204E/02型电子分析天平(梅特勒-托利多仪器(上海)有限公司);TG21KR高速冷冻离心机(上海安亭科学仪器厂);SHZ-88A型水浴恒温振荡器(太仓市实验设备厂);HH-S精密恒温水浴锅(江苏省金坛市医疗仪器厂);UV-2800型分光光度计(尤尼柯(上海)仪器有限公司);waters 1525高效液相色谱仪(日本岛津仪器有限公司)。
2.2.3 培养基以纤维二糖为唯一碳源的CM培养基、种子培养基和产酶培养基均参照实验室建立的配方标准。
2.3 重组里氏木霉的筛选 2.3.1 初筛用切割器将选择性平板上的转化子菌落切成直径为0.3 cm的菌块,每个转化子取5块,分别转移到CM培养平板上,30℃培养3~4 d。定时记录每个菌落的生长直径,选出生长明显较快的转化子。
2.3.2 复筛采用30 mm×150 mm的大试管进行转化子的复筛。用无菌的生理盐水洗下新鲜的里氏木霉斜面,配制成浓度为107个·mL-1的新鲜孢子悬液,取1 mL接种至12 mL产酶培养基,旋转式摇床30℃,200 r·min-1培养48 h。离心取上清液,检测BG酶活力。挑取其中BG酶活力较高的转化子进行产酶实验。
2.4 发酵粗酶液的获取用无菌的生理盐水洗下新鲜的里氏木霉斜面,配制成浓度为107个·mL-1的新鲜孢子悬液,取1 mL接种至种子培养基,30℃,180 r·min-1培养48 h后转接至产酶培养基。产酶条件:装液量50 mL / 250 mL摇瓶,接种量10%,28℃,180 r·min-1振荡培养48 h后即为发酵粗酶液。检测上清液的BG酶活和FPA酶活。
2.5 发酵粗酶液提取白藜芦醇将过80目筛的虎杖粉烘干,取0.8 g溶于总体系为25 mL 50 mmol·L-1柠檬酸缓冲溶液中,加入一定量经浓缩的发酵产酶液,在45℃水浴摇床以50 r·min-1转速进行反应,5 h时加入等体积无水乙醇终止反应,2000 r·min-1离心4 min,取上清液进行HPLC测定RSV和Piceid含量。将溶解0.8 g虎杖粉的柠檬酸缓冲液与等体积无水乙醇混合提取,作为初始RSV和Piceid的含量对照(control)。
2.6 白藜芦醇的测定和含量计算 2.6.1 HPLC检测条件和标准曲线测定色谱条件:色谱柱为Hypersil ODS2柱(5 μm,4.6 mm×250 mm,柱号E2618718,批号13774),流动相:甲醇-水(40:60,V/V);梯度流速洗脱:0~10 min为0.4 mL·min-1,10~25 min为1.0 mL·min-1,常温,检测波长305 nm,进样体积10 μL。
精密称取并以甲醇稀释RSV标品为20,30,40,50,60,70,80,90,100 μg·mL-1的不同梯度溶液,HPLC出峰时间在22 min左右,以浓度C(RSV,μg·mL-1)对峰面积A进行线性回归,得方程为C(RSV)=1×10-5A,R2=0.9990。峰面积A范围为(1499580,7361354)。
精密称取并以甲醇稀释Piceid标品为2,4,6,8,10,12,14,16,18,20,30,40 μg·mL-1的不同梯度溶液,HPLC出峰时间在13 min左右,以浓度C(Piceid,μg·mL-1)对峰面积A进行线性回归,得方程为C(Piceid)=2×10-5A+0.0482,R2=0.9998。峰面积A范围为(71428,1642359)。
2.6.2 白藜芦醇提取率和转化率的计算白藜芦醇提取率(extraction rate,E)定义为:经纤维素酶解后,总的白藜芦醇质量与虎杖质量的比值。
计算公式:
白藜芦醇转化率(transformation rate,T)定义为:经纤维素酶解后,增加的白藜芦醇的物质的量与最初(醇提法)测得的白藜芦醇苷物质的量的比值。
计算公式:
根据2.3.1节方法在CM培养平板上对得到的619个潮霉素抗性转化子进行初筛,培养72 h后测定菌落直径,初筛出24个生长速率明显加快的转化子,其菌落直径可达到3.5~5.0 cm左右;而原始菌株的菌落直径仅为1.5 cm左右。
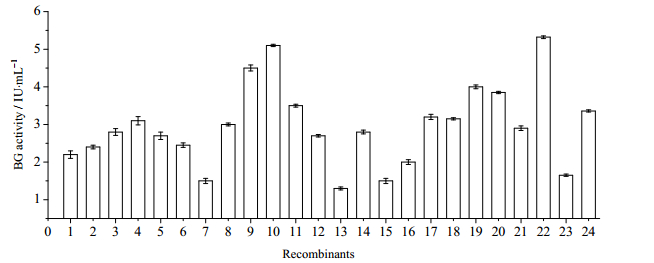
3.2 重组菌株的试管产酶复筛根据2.3.2节方法对初筛到的24个转化子进行试管产酶复筛,其BG酶活如图 2所示,24个转化子的BG酶活分布在10~5.35 IU·mL-1;大部分酶活分布在2.5~3.5 IU·mL-1,少数在1.4~2.0 IU·mL-1或5.0 IU·mL-1以上。而出发菌株仅为0.037 IU·mL-1。分别随机挑选BG酶活为1.4 IU·mL-1左右,3.0 IU·mL-1左右和5.0 IU·mL-1以上的重组菌株各2株:即7号和16号,8号和18号,10号和22号,按序分别命名为BG-1-BG-6,进行转化子传代和产酶实验。
|
图 2 重组里氏木霉基于β-葡萄糖苷酶酶活的筛选 Fig.2 BG activity of Trichoderma reesei recombinants for enzyme screening |
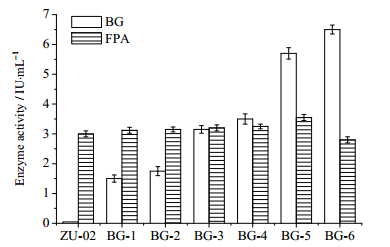
对复筛得到的6株重组菌株在PDA培养基上传代10次后进行cel7A的PCR扩增,验证所有重组子均可稳定遗传。根据2.4节方法分别进行摇瓶产酶试验,48 h后取上清测定BG酶活和FPA酶活(图 3)。产酶48 h时,出发菌株的BG酶活仅为0.048 IU·mL-1,而重组菌株产酶液中BG酶活达到1.50~1.75 IU·mL-1(BG-1和BG-2),3.15~3.50 IU·mL-1 (BG-3和BG-4),5.70~6.51 IU·mL-1 (BG-5和BG-6),约为出发菌株的30倍到144倍。证实异源的BG酶基因已经在里氏木霉中实现了高效分泌表达。
|
图 3 重组里氏木霉的β-葡萄糖苷酶和滤纸酶活力 Fig.3 BG & FPA activity of T.reesei recombinants |
出发菌株的FPA酶活为3.10 IU·mL-1,重组菌株的FPA酶活大多集中在3.10~3.21 IU·mL-1,或与BG酶活对FPA酶活贡献率不高有关;且当异源BG酶过量表达时,或将抑制内源纤维素酶其他组分的表达,导致重组菌株的FPA酶活力上升幅度有限。其中,BG-5的FPA酶活达到3.55 IU·mL-1,而BG-6的BG酶活虽然提高幅度最大,但FPA酶活仅为2.80 IU·mL-1,猜测与cel7A的整合位点有关,待深入研究验证。
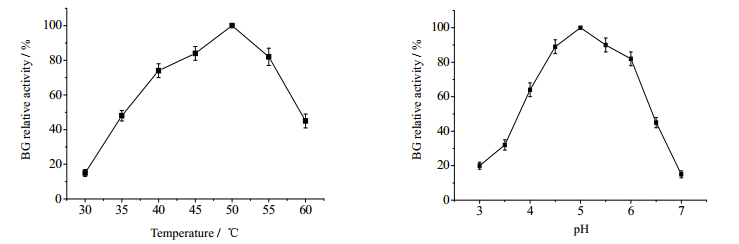
初步测定各重组菌株粗酶液的BG酶活的最适反应条件(图 4)发现,最适反应pH值和最适反应温度分别为pH 5.0和50℃。当pH在4.5~6.0;温度在45~55℃时,BG相对酶活可保持在80 %以上。
|
图 4 温度(A)和pH(B)对重组菌β-葡萄糖苷酶相对活力的影响 Fig.4 Effects of temperature (A) & pH (B) on BG relative activity of recombinants |
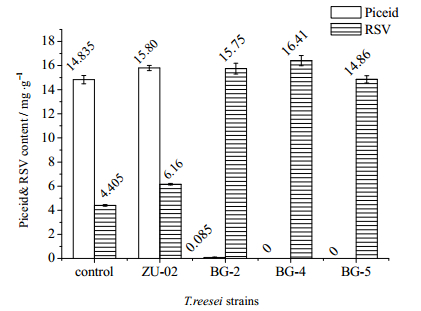
为保证RSV的提取率,选择FPA酶活未降低的重组菌株BG-2、BG-4、BG-5,将三者的粗酶液与出发菌株ZU-02的粗酶液按照2.5节方法提取RSV(图 5),并以表 1计算总结各粗酶液中的BG、FPA酶活、RSV的提取率和转化率:
|
图 5 同里氏木霉菌株的粗酶液对虎杖中白藜芦醇的提取结果 Fig.5 Extraction of resveratrol from Polygonumcuspidatum by crude enzymes from different T.reesei strains |
| 表 1 不同里氏木霉菌株粗酶液对虎杖中白藜芦醇的提取效果 Table 1 Extraction of resveratrol from Polygonumcuspidatum by crude enzyme from different T.reesei strains |
用出发菌株ZU-02粗酶液处理后的反应液中,苷元型和糖苷型含量均有所上升。很可能是因为经过纤维素酶提取后,植物细胞壁的部分纤维素被水解,从而有利于两种成分的溶出;这是溶剂法提取所没有的优势。但是得到的白藜芦醇以糖苷型为主,这与ZU-02极低的BG酶活(0.018 IU·mL-1)有关。当采用三株重组菌的产酶液处理后,反应液中几乎无糖苷型成分残留,苷元型成分大幅度提升,证实提高纤维素酶系中的BG酶活能显著提高白藜芦醇的提取效率:随着BG酶活上升至0.55 IU·mL-1 (BG-2,30.56倍)和1.10 IU·mL-1(BG-4,68.75倍)时,苷元型提取率迅速提高到15.75 mg·g-1(即1.575%,2.56倍)和16.41 mg·g-1 (即1.641%,2.66倍)。在其他纤维素酶法的同类研究中,RSV的提取率一般在0.8%~0.95%[13, 19],其中周炳贤等通过优化纤维素酶提取工艺,将提取率提高至1.389%[20]。
经重组菌株粗酶液处理后的RSV转化率均高于100%,分别为130.8%、138.4%和120.5%(表 1),计算得溶出活性成分总的物质的量均高于初始醇提对照的总的物质的量,再次验证了反应中有更多活性成分溶出。此前大部分酶法提取的转化率低于100%,应与采用单一BG酶(无法有效分解植物纤维素结构)或低BG酶活的复合酶(如本研究中的ZU-02)有关。事实上,以醇提的Piceid作为初始含量基准并不能准确描述有多少糖苷型转化为苷元型。但由于本研究采用的纤维素酶粗酶液合并了提取和转化工艺,即便是未经改造的ZU-02菌株的粗酶液也在提取时实现了同步转化,导致难以界定最终酶解反应液中测得的RSV究竟是新溶出(直接提取到)还是转化得来。因此,本研究仍然沿用了常用的转化率概念——即以醇提得到的Piceid作为初始基准,使该结果与出发菌株及其他同类研究具有可比性。此外,当BG酶活更高(1.95 IU·mL-1,BG-5)时,相比BG-2和BG-4的提取液,其苷元型含量不升反降,或与不同纤维素酶系之间的底物竞争性抑制有关。
后续研究将集中于以下四点:一是通过响应面法优化料液比、摇床转速等工艺条件,进一步提高虎杖中白藜芦醇的提取效率;二是深入研究白藜芦醇及其糖苷型在植物细胞内的存在形式;三是从分子机制探索不同酶系之间的协同作用;四是尝试将提取技术推广应用于其他苷元型中草药有效成分的提取。
4 结论本研究在定向筛选出BG酶活显著提高的里氏木霉重组菌株的基础上,以摇瓶条件下发酵的粗酶液直接处理虎杖粗提物,白藜芦醇提取率最高可达1.641%。研究选用的出发菌株FPA酶活较高,有利于白藜芦醇苷和白藜芦醇的溶出和释放,更为重要的是,通过基因定向育种技术获得的高BG、高FPA酶活的重组菌株,实现了白藜芦醇酶法提取过程中的同步高效转化。研究结果不仅从根本上显著提高了虎杖中苷元型白藜芦醇的纤维素酶法的提取效率,还可应用于植物中其他易于糖苷化的中草药活性成分的提取工艺,对于我国中医药研究的现代化进程具有重要意义。
符号说明:
| [1] | Rabassa M, Zamora-Ros R, Urpi-Sarda M, et al. Resveratrol metabolite profiling in clinical nutrition research-from diet to uncovering disease risk biomarkers:epidemiological evidence[J]. Annals of the New York Academy of Sciences , 2015, 1348(1): 107-115. DOI:10.1111/nyas.12851. |
| [2] | Park E J, Pezzuto J M. The pharmacology of resveratrol in animals and humans[J]. Biochimica Et Biophysica Acta , 2015, 1852(6): 1071-1113. DOI:10.1016/j.bbadis.2015.01.014. |
| [3] | Bhullar K S, Hubbard B P. Lifespan and healthspan extension by resveratrol[J]. Biochimica Et Biophysica Acta , 2015, 1852(6): 1209-1218. DOI:10.1016/j.bbadis.2015.01.012. |
| [4] | Kuo C H, Chen B Y, Liu Y C, et al. Optimized ultrasound-assisted extraction of phenolic compounds from Polygonum cuspidatum[J]. Molecules , 2013, 19(1): 67-77. DOI:10.3390/molecules19010067. |
| [5] | Wang L, Xu M, Liu C, et al. Resveratrols in grape berry skins and leaves in vitis germplasm[J]. PLoS One , 2013, 8(4): 1-8. |
| [6] | Henry C, Vitrac X, Decendit A, et al. Cellular uptake and efflux of trans-piceid and its aglycone trans-resveratrol on the apical membrane of human intestinal Caco-2 cells[J]. Journal of Agricultural and Food Chemistry , 2005, 53(3): 798-803. DOI:10.1021/jf048909e. |
| [7] | Wang H, Liu L, Guo Y X, et al. Biotransformation of piceid in Polygonum cuspidatum to resveratrol by Aspergillus oryzae[J]. Applied Microbiology and Biotechnology , 2007, 75(4): 763-768. DOI:10.1007/s00253-007-0874-3. |
| [8] | Mei Y Z, Liu R X, Wang D P, et al. Biocatalysis and biotransformation of resveratrol in microorganisms[J]. Biotechnology Letters , 2015, 37(1): 9-18. DOI:10.1007/s10529-014-1651-x. |
| [9] | WANG Feng-wu(王凤舞), LI Peng(李鹏), PIAO Mei-zi(朴美子). Study on enzymatic extraction of the resveratrol from peanut red skin(纤维素酶法提取花生红衣中的白藜芦醇)[J]. Journal of Chinese Institute of Food Science and Technology(中国食品学报) , 2009, 9(5): 76-80. |
| [10] | CHEN Shuai(陈帅), WANG Hui-zhu(王慧竹), WANG Wan-chao(王万超), et al. Optimization of enzyme-linked semi-bionic extraction technology of resveratrol from Polygonurn cuspidatum(酶联半仿生法提取虎杖中白藜芦醇工艺研究)[J]. Journal of Jilin Institute of Chemical Technology(吉林化工学院学报) , 2015, 32(11): 20-24. |
| [11] | Chen M, Li D, Gao Z Q, et al. Enzymatic transformation of polydatin to resveratrol by piceid-beta-d-glucosidase from Aspergillus oryzae[J]. Bioprocess and Biosystems Engineering , 2014, 37(7): 1411-1416. DOI:10.1007/s00449-013-1113-1. |
| [12] | Matsakas L, Christakopoulos P. Ethanol production from enzymatically treated dried food waste using enzymes produced on-site[J]. Sustainability , 2015, 7(2): 1446-1458. DOI:10.3390/su7021446. |
| [13] | Hamid S B A, Islam M M, Das R. Cellulase biocatalysis:key influencing factors and mode of action[J]. Cellulose , 2015, 22(4): 2157-2182. DOI:10.1007/s10570-015-0672-5. |
| [14] | Kuo C H, Chen B Y, Liu Y C, et al. Production of resveratrol by piceid deglycosylation using cellulase[J]. Catalysts , 2016, 6(3): 1-10. |
| [15] | Shida Y, Furukawa T, Ogasawara W. Deciphering the molecular mechanisms behind cellulase production in Trichoderma reesei, thehyper-cellulolytic filamentous fungus[J]. Bioscience Biotechnology and Biochemistry , 2016, 80(9): 1712-1729. DOI:10.1080/09168451.2016.1171701. |
| [16] | Zhou L F, Li S H, Zhang T, et al. Properties of a novel polydatin-beta-D-glucosidase from Aspergillus niger SK34.002 and its application in enzymatic preparation of resveratrol[J]. Journal of the Science of Food and Agriculture , 20196, 96(7): 2588-2595. |
| [17] | LU Wei(鲁玮), YUE Dong-dong(岳冬冬), LIU Xin-yu(刘新育), et al. Purification of β-Glucosidase from Aspergillus niger and enzymatic conversion of glycosides in Chinese traditional medicine(黑曲霉产β-葡萄糖苷酶的纯化及对中药糖苷类成分的转化)[J]. Chinese Journal of Pharmaceuticals(中国医药工业杂志) , 2014, 45(3): 220-223. |
| [18] | JIN Xin(金欣), XIA Li-ming(夏黎明). Recombination and expression of an anaerobic fungus endo-β-Glucanase gene in Trichoderma Reesei cells(厌氧真菌内切-β-葡聚糖酶基因在里氏木霉中的重组与表达)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2011, 25(4): 637-642. |
| [19] | SUN Yong-min(孙勇民), YUE Kun(岳鹍), WANG Peng(王芃). Study on the extraction of the resveratrol in Polygonum cuspidatum by the Composite Enzymatic(复合酶法提取虎杖中白藜芦醇的工艺研究)[J]. Food Research and Developent(食品研究与开发) , 2013, 34(17): 34-37. DOI:10.3969/j.issn.1005-6521.2013.17.010. |
| [20] | ZHOU Bing-xian (周炳贤). Research the process of extracting the resveratrol by enzymatic hydrolysisfrom Rhizoma Polygoni Cuspidate (从虎杖中酶法提取白藜芦醇的工艺研究) [D]. Chongqing (重庆): Chongqing University (重庆大学), 2014. http://cdmd.cnki.com.cn/Article/CDMD-10611-1015016971.htm |




