骨缺损通常是由外伤、感染、手术及疾病 (骨质疏松症和关节炎等) 引起的,需要骨组织替代物来重建功能[1]。自体移植物由于缺乏足够的移植材料、供区并发症以及移植骨的再吸收等问题临床应用受限[2]。同种异体移植物可避免此限制,但异体移植具有疾病传播和远期并发症的风险[3]。骨修复是一个长期的过程,组织工程和再生医学可作为骨修复的方法[4, 5]。理想的骨支架应该具备与天然骨相似的组分、结构、生物力学特性,作为骨质沉积的基底并提供机械支撑,调控细胞的粘附、增殖和分化,尤其是提供细胞向成骨分化的微环境[6~8]。
骨组织工程支架材料分为合成高分子材料和天然高分子材料两大类。合成高分子材料主要有聚乳酸、聚己内酯、聚乙烯醇等[9~11],其显著特点是具有良好的力学和加工性能,能满足许多组织工程要求,显示出良好的成骨效应;缺点是难降解,残余溶剂对机体产生不利影响。天然高分子材料制备的多孔复合支架有几个优点,如生物相容性、生物降解性、组织相似性及其具有宏观和细胞水平微环境。由于其多功能性,许多生物大分子,如壳聚糖、海藻酸盐、琼脂糖、透明质酸、胶原蛋白和明胶等被用于骨组织工程的构建[12~17]。理想的骨支架应提供满足细胞迁移、生长和增殖的多孔结构,能够支持和促进成骨诱导,骨整合和再生骨组织的血管化[18, 19],能够可控降解[20]。因此,选择合适的支架组分至关重要。
透明质酸 (HA) 属蛋白多糖,广泛存在于组织基质中,是骨组织的重要有机成分。HA是免疫中性的,吸水性强,可通过与成骨细胞表面特异性受体α整合素亚单位紧密结合,促进细胞迁移、粘附、增殖和分化来诱导新骨形成,也可诱导间充质细胞分化从而加速形成新骨。HA也可提高胶原蛋白沉积和血管生成,因其特有的机械完整性[21, 22]。明胶 (G) 是胶原蛋白部分水解的产物,无毒、免疫原性低,具备良好的细胞粘附能力、生物降解性和生物相容性。采用G制备的骨支架具有优良的特性,如提高抗压强度和细胞粘附能力,可促进细胞的增殖、分化等行为[23]。羟基磷灰石 (HAP) 是人骨骼中的无机成分之一,人工合成的HAP具有较好的生物相容性,其生物力学强度比天然HAP好,但HAP易碎,弹性不好,临床使用受限。纳米羟基磷灰石 (nHAP) 是直径为1~100 nm的纳米颗粒,研究发现其具备良好的分散能力、较大的比表面积及更强的附着能力,显示出比普通HAP更好的生物活性,但以nHAP作为单一成分的人工骨支架仍然不能满足临床的要求。因此需与其他材料结合,形成骨组织工程复合支架[24]。
本文尝试合成一种新型生物相容的,可降解HA-G-nHAP多孔仿生骨复合支架,并对支架的表观形貌、理化性能进行表征,进而探讨MC3T3-E1细胞在复合支架中的生物学特性以及成骨分化的能力,以期探索该支架材料应用于骨组织工程的可行性。
2 材料和方法 2.1 实验材料透明质酸 (陕西帕尼尔生物科技有限公司);明胶、抗坏血酸、甘油磷酸钠 (美国Sigma公司);纳米羟基磷灰石 (南京埃普瑞纳米材料有限公司);碳化二亚胺、N-羟基琥珀酰亚胺 (上海阿拉丁生化科技股份有限公司);DMEM高糖培养基、胰蛋白酶、胎牛血清 (美国Gibco公司);ALP试剂盒 (碧云天生物技术有限公司);溶菌酶 (北京索莱宝科技有限公司);多聚甲醛 (天津市大茂化学试剂厂);数显智能控温磁力搅拌器 (巩义市予华仪器有限责任公司);低速离心机 (德国Eppendorf公司);超声机 (上海科声超声波技术有限公司);冷冻干燥机 (宁波新芝生物科技股份有限公司);小型离子溅射仪 (北京中科科仪技术发展有限责任公司);傅里叶变换红外光谱仪 (美国Perkin Elmer公司);真空干燥箱 (上海一恒科学仪器有限公司);扫描电子显微镜 (日本Hitachi公司);倒置激光诱导荧光显微镜 (日本Olympus公司)。
2.2 复合支架的制备HA溶于三蒸水 (60℃水浴) 制得1% (W/V) 的原液;G溶于三蒸水 (60℃水浴) 制得3% (W/V) 的原液;将上述HA、G溶液低速离心,去除气泡后混合,配置成体积比为1:2、1:1、2:1的HA-G溶液;将上述溶液混匀、除泡后注入24孔板,−20℃预冻6 h,−80℃冷冻3 h,冷冻干燥48 h即得到不同比例HA-G支架。
将nHAP超声分散处理后,按不同质量比分别加入到体积比为1:2、1:1、2:1的HA-G溶液,形成含有1% (W/V) nHAP和2% (W/V) nHAP的HA-G悬浮液;将上述混合液静置除泡,注入24孔板,−20℃预冻6 h,−80℃冷冻3 h,冷冻干燥48 h,即得到不同比例的HA-G-nHAP的复合支架。根据HA和G的体积比,将支架编号为1:2(A)、1:1(B)、2:1(C);根据支架所含nHAP质量浓度,对上述支架编号,如HA-G (1:2) 复合支架记为A-0、HA-G (1:2)-1% nHAP复合支架记为A-1、HA-G (1:2)-2% nHAP复合支架记为A-2,以此类推。
将上述冻干的支架转移至新的容器,浸泡于碳化二亚胺 (EDC)、N-羟基琥珀酰亚胺 (NHS) 的乙醇溶液,交联48 h;然后用80%乙醇清洗4次,30 min·次-1,PBS冲洗至中性,再次冷冻干燥,室温密封保存。
2.3 复合支架的物理表征 2.3.1 复合支架的成分分析取干燥的HA、G、nHAP粉末和HA-G、HA-G-nHAP支架材料,通过溴化钾压片处理,用ATR-FTIR对官能团结构进行分析。
2.3.2 复合支架的孔径、孔隙率、吸水率、黏附率检测复合支架经乙醇梯度脱水后真空干燥,表面喷金处理后置于SEM观察并拍摄照片,采用Image-Pro Plus (IPP) 图像处理软件测量材料孔径,每组取10个不同视野,取平均值。
取装有乙醇的带刻度容器,支架初始浸入乙醇溶液体积为V1;支架完全浸入乙醇体积为V2;取出支架后乙醇体积记为V3;每个样本测试3次,取平均值。孔隙率 (P) 计算公式如式 (1):
| $ P(\% ) = \frac{{{V_1}-{V_3}}}{{{V_2}-{V_3}}} \times 100\% $ | (1) |
用电子天平称量支架的干态重量 (W1),干燥的支架浸泡于PBS溶液24 h,取出后除去表面多余水分,称重记为W2,吸水率 (W) 计算公式如式 (2):
| $ W(\% ) = \frac{{{W_2}-{W_1}}}{{{W_1}}} \times 100\% $ | (2) |
支架灭菌后提前浸入培养基12 h,吸去培养基后,将初始浓度 (C1) 为5×106 cells·mL-1,体积 (V) 为50 μL的MC3T3-E1细胞悬滴接种于HA-G-nHAP复合支架上,置于培养箱内孵育20 min后补加培养基,继续孵育4 h,待细胞彻底粘附,取出细胞支架复合物,原孔板中未黏附的细胞总数为A1,黏附率 (A) 计算公式如式 (3):
| $ A(\% ) = \frac{{{C_1} \times V-{A_1}}}{{{C_1} \times V}} \times 100\% $ | (3) |
配置0.1% (W/V) 的溶菌酶溶液,复合支架干态初始重量为W1,将不同比例复合支架分别浸入降解溶液,37℃孵育5周,每周分别取出不同支架 (3个支架/每组),用蒸馏水冲洗,冻干后称重记为W2。降解率 (D) 计算公式如式 (4):
| $ D(\% ) = \frac{{{W_1}-{W_2}}}{{{W_1}}} \times 100\% $ | (4) |
小鼠MC3T3-E1细胞由大连医科大学赠送。在DMEM高糖培养基 (含10%胎牛血清,100 U·mL-1青、链霉素) 中常规培养,传代备用。将复合支架剪成长0.5 cm、宽0.5 cm、高0.1 cm的长方体,放置在96孔板中,紫外照射12 h彻底灭菌后,将支架浸润在DMEM培养基中。将5×106 cells·mL-1的MC3T3-E1细胞单细胞悬液接种于支架上,100 μL·seatfold-1,随后置于培养箱孵育4 h,每孔补加1 mL培养基继续培养。支架分为无诱导培养基组 (-) 和诱导培养基组 (+),其中,诱导培养基为含有0.3 mmol·L-1抗坏血酸和10 mmol·L-1 β-甘油磷酸钠的基础培养基;每天换液1次,培养至7 d。
2.4.2 细胞-支架复合物的ALP显色检测MC3T3-E1细胞与支架共培养7 d后,取出用PBS (pH = 7.2) 洗3次;用多聚甲醛固定细胞30 min,PBS清洗3次;加入ALP染色工作液,避光孵育,至蓝紫色出现,去除工作液,蒸馏水终止反应,显微镜观察。
2.4.3 细胞-支架复合物的扫描电镜观察取培养7 d的细胞-支架复合物,PBS清洗3次;多聚甲醛固定20 min,PBS清洗3次;将上述细胞-支架复合物用乙醇梯度脱水处理后,冻干样品,用离子喷射仪喷金处理,扫描电镜成像。
2.5 统计分析每个实验均重复3次 (n = 3),所得结果以“平均值±标准误差”(mean ± S.E.M.) 表示。显著性分析采用Student’s t-检验,用origin8.2软件进行数据处理,以P < 0.05认为有显著性差异。
3 结果与讨论本文采用冷冻干燥法和化学交联法相结合,制备出一种新型HA-G-nHAP复合多孔支架。将nHAP均匀分散于HA、G混合液,经二次冷冻干燥以及EDC和NHS化学交联处理,形成一种天然合成复合物,HA和G形成多孔支架骨架结构,nHAP具备持续促进成骨再生的能力。本文将MC3T3-E1细胞接种于复合支架,探讨复合支架对MC3T3-E1细胞的成骨诱导作用 (图 1)。
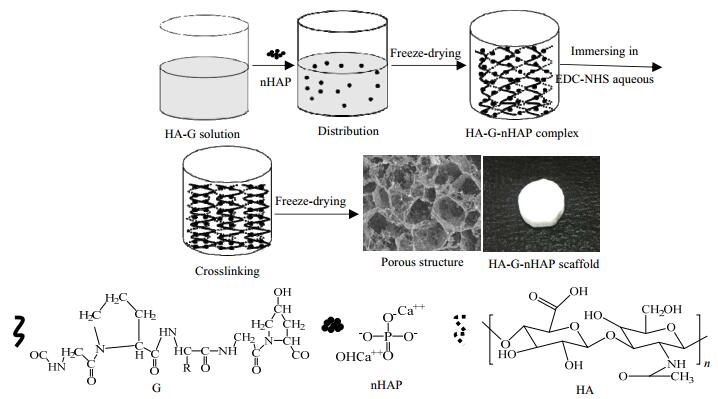
|
图 1 HA-G-nHAP复合支架的制备过程 Fig.1 Fabrication process of the HA-G-nHAP composite scaffolds |
复合支架的ATR-FTIR分析用来表征HA、G、nHAP三者在复合支架上的存在形式和构象特征。HA含有羧基和羟基;G含有氨基、羧基和酰胺基;nHAP含有羟基和磷酸基;复合支架通过化学交联处理,官能团之间相互结合。因此,酯键、酰胺键、酸酐键等特征峰存在于HA-G支架中;酯键、酰胺键、酸酐、磷酸基等特征峰存在于HA-G-nHAP支架中。
HA-G支架的1642、3283 cm−1左右出现与HA-G-nHAP支架相似的酰胺基特征峰,其中,1642 cm-1为C=O伸缩振动和N-H弯曲振动吸收峰,3283 cm-1为N-H伸缩振动吸收峰,说明HA、G交联成功;HA-G-nHAP支架的562、1025 cm−1左右出现磷酸基的特征峰,说明nHAP存在于支架中,ATR-FTIR图谱显示HA-G、HA-G-nHAP支架均交联成功 (图 2)。
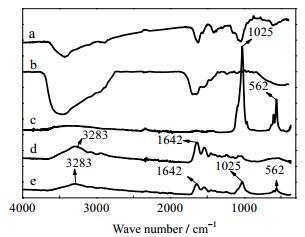
|
图 2 复合支架的衰减全反射-傅里叶红外图谱 Fig.2 ATR-FTIR spectra of the composite scaffolds a. HA b. G c. nHAP d. HA-G e. HA-G-nHAP |
扫描电镜图片显示冷冻干燥后复合支架表面凹凸不平,粗糙,弹性、柔韧性较好。所有支架都是多孔的,孔隙贯穿,有利于营养物质的传输 (图 3)。通过IPP软件分析扫描电镜图片,进而测量复合支架孔径,得到复合支架平均孔径为93.28~236.62 μm;支架壁厚为2.25~3.71 μm,为细胞提供黏附空间。

|
图 3 复合支架的扫描电镜图片 Fig.3 SEM micrographs of the composite scaffolds, bar = 100 μm |
复合支架由HA、G、nHAP三个组分组成,每组支架中三种物质的含量均不同,因此支架的物理特性不尽相同 (表 1)。支架的孔径、孔隙率、吸水率、黏附率、降解率等均与材料的天然特性、组分含量、冷冻干燥条件、交联度等因素有关。复合支架的孔径为93.28~236.62 μm,孔隙率均大于86.36%,吸水率为38.37%~47.93%,黏附率为82.05%~92.02%。当支架中HA含量增加,G含量减少时,孔径和孔隙率协同增大;同时,复合支架的比表面积增大,支架的吸水面积和细胞接触面积增加,因此,吸水率和黏附率也随之增加。纳米羟基磷灰石的加入,对孔径、孔隙率、吸水率和黏附率的影响均不大,因其属固体颗粒,对支架形貌和物理特性不起决定性作用。
| 表 1 复合支架的孔径、孔隙率、吸水率、黏附率 Table 1 Pore diameter, porosity, water absorbing ratio and adhering ratio of the composite scaffolds |
支架材料的降解速率应与体内基质的生长速率协调一致。由于溶菌酶是体液中广泛存在的一种酶,因此本文采用溶菌酶进行降解能力检测。由图 4可知,随着复合支架在溶菌酶溶液中浸泡时间的增加,复合支架的形貌及透明度逐渐发生变化,说明复合支架开始降解。前三周,复合支架的降解速度较快,呈线性增加。第二周,降解率增加至第一周的一倍,3~5周降解率呈平稳缓慢上升;第五周,降解率最高达到50.74%。随着HA含量的增加,复合支架的降解率逐渐增加,nHAP对降解率的影响不大。在整个降解过程中,复合支架均能保持其海绵状多孔结构,其中,溶菌酶溶液pH值基本不变,第5周pH值为6.8,仅下降0.2单位,基本保持生理pH值,说明整个降解过程不会产生有害物质。
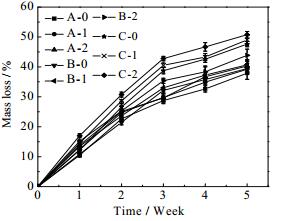
|
图 4 复合支架的降解率 Fig.4 Degradation ratio of the composite scaffolds |
理想的骨支架材料应该具备与天然基质相似的组成成分、结构特性和细胞生长微环境。B-0、B-1、B-2复合支架的孔径为156.93~168.57 μm,孔隙率为90.53%~92.57%,吸水率为40.28%~43.15%,降解速率在39.42%~43.87%,细胞黏附率为82.05%~92.02%,具备良好的机械强度,适合作为骨组织工程支架。因此,本文选用上述三种复合支架进行后续实验。
扫描电镜观察 (图 5) 复合支架表面粗糙,内部多孔,孔隙贯穿;细胞贯穿整个支架表面及内部,呈团簇状生长,大多数细胞铺展于支架表面并伸出许多伪足使细胞间、细胞与支架间紧密连接形成网络结构。其中,部分细胞伸展能力较强,横跨整个孔径生长。随着nHAP含量的增加,细胞的黏附能力更强,B-2支架表面有大量细胞生长,状态良好 (图 5G~I)。

|
图 5 MC3T3-E1细胞在HA-G-HAP复合支架上的生长形貌 Fig.5 Growth morphology of MC3T3-E1 cells in the composite scaffolds |
ALP是骨形成早期的标志物之一,在骨组织中充分表达。本实验在细胞培养7天后,通过BCIP/NBT显色试剂盒检测ALP活性。MC3T3-E1细胞在平面培养第7天,大多数细胞表达ALP,说明细胞具备向成骨分化的能力 (图 6O)。MC3T3-E1细胞在复合支架培养7天内,B-0(+) 支架组仅在第7天少量表达ALP (图 6Q),含nHAP的支架组均表达ALP,并且随着nHAP含量增加和培养时间的延长,ALP表达增加;说明nHAP对MC3T3-E1细胞成骨分化的促进作用。相对于B (-) 组,B (+) 组在细胞培养4天时均表达ALP,细胞培养7天时ALP活性达到最高,其中,B-2(+) 组的ALP活性最大;分析原因可能是,HA-G-nHAP复合支架为细胞提供良好的胞外基质及仿生微环境;nHAP作为骨骼的基质组分,具有良好的骨生成引导作用;因此,HA-G-nHAP复合支架和诱导培养基协同作用,明显提高了MC3T3-E1细胞的成骨分化能力。

|
图 6 MC3T3-E1细胞在HA-G-nHAP复合支架上的ALP染色图片 Fig.6 ALP dyeing pictures of MC3T3-E1 cells in the HA-G-nHAP composite scaffolds, bar = 100μm |
本文以HA和G为骨架基质材料,制备了一种新型HA-G-nHAP多孔复合支架,并进行体外生物相容性及成骨诱导的实验研究。ATR-FTIR谱图表明HA、G、nHAP三者发生官能团反应,化学聚合成为功能性的复合材料。HA-G-nHAP多孔复合支架为细胞提供良好的3D微环境,复合支架的贯穿孔隙结构为MC3T3-E1细胞的黏附、铺展、生长、迁移和分化提供了良好的结构支撑。nHAP的加入,对复合支架的物理性能无明显影响,但却显著的提高了MC3T3-E1细胞的成骨分化能力,提示HA-G-nHAP多孔复合支架具有良好的生物相容性及早期骨发生能力,其可作为骨组织工程支架材料,为治疗骨缺损等疾病搭建了体外技术平台,也为进一步的临床移植和再生医学奠定了基础。
| [1] | Tang D, Tare R S, Yang L Y, et al. Biofabrication of bone tissue:approaches, challenges and translation for bone regeneration[J]. Biomaterials , 2016, 83(3): 363-382. |
| [2] | Xing W, Mu D, Wang Q, et al. Improvement of fat graft survival with autologous bone marrow aspirate and bone marrow concentrate:A one-step method[J]. Plastic and Reconstructive Surgery , 2016, 137(4): 676-686. DOI:10.1097/PRS.0000000000001993. |
| [3] | Dhakal B, Vesole D H, Hari P N. Allogeneic stem cell transplantation for multiple myeloma:is there a future[J]. Bone Marrow Transplantation , 2016, 51(4): 492-500. DOI:10.1038/bmt.2015.325. |
| [4] | Ricardo T, Eduardo A, Gorka O. Toward the biomimetic implant surface:biopolymers on titanium-based implants for bone regeneration[J]. Progress in Polymer Science , 2014, 39(7): 1406-1447. DOI:10.1016/j.progpolymsci.2014.01.001. |
| [5] | Jha A K, Xu X, Duncan R L, et al. Controlling the adhesion and differentiation of mesenchymal stem cells using hyaluronic acid-based, doubly crosslinked networks[J]. Biomaterials , 2011, 32(10): 2466-2478. DOI:10.1016/j.biomaterials.2010.12.024. |
| [6] | Arundhati B, Tapas M, Arumugam G, et al. Development of biomimetic nanocomposites as bone extracellular matrix for human osteoblastic cells[J]. Carbohydrate Polymers , 2016, 141(5): 82-91. |
| [7] | Autchara P, Somsak S, Nattika S, et al. Hydroxyapatite-hybridized chitosan/chitin whisker bionanocomposite fibers for bone tissue engineering applications[J]. Carbohydrate Polymers , 2016, 144(6): 419-427. |
| [8] | Chahal S, Hussain F S J, Kumar A, et al. Fabrication, characterization and in vitro biocompatibility of electrospun hydroxyethyl cellulose/poly (vinyl) alcohol nanofibrous composite biomaterial for bone tissue engineering[J]. Chemical Engineering Science , 2016, 144(4): 17-29. |
| [9] | Sabrina M, Simona S, Jani H, et al. Osteogenic and osteoclastogenic differentiation of co-cultured cells in polylactic acid-nanohydroxyapatite fiber scaffolds[J]. Journal of Biotechnology , 2015, 204(6): 53-62. |
| [10] | Boontharika C, Thanaphum O, Nunthawan N, et al. The efficacy of polycaprolactone/hydroxyapatite scaffold in combination with mesenchymal stem cells for bone tissue engineering[J]. Journal of Biomedical Materials Research A , 2016, 104(1): 264-271. DOI:10.1002/jbm.a.35558. |
| [11] | Tang C M, Tian Y H, Shan H H. Poly (vinyl alcohol) nanocomposites reinforced with bamboo charcoal nanoparticles:mineralization behavior and characterization[J]. Materials , 2015, 8(7): 4895-4911. |
| [12] | Ruan J, Wang X S, Zhang Y, et al. Enhanced physiochemical and mechanical performance of chitosan-grafted graphene oxide for superior osteoinductivity[J]. Advanced Functional Materials , 2016, 26(11): 1085-1097. |
| [13] | Wang P, Song Y, Weir M D, et al. A self-setting iPSMSC-alginate-calcium phosphate paste for bone tissue engineering[J]. Dental Materials , 2016, 32(2): 252-263. DOI:10.1016/j.dental.2015.11.019. |
| [14] | Hu J X, Zhu Y J, Tong H, et al. A detailed study of homogeneous agarose/hydroxyapatite nanocomposites for load-bearing bone tissue[J]. International Journal of Biological Macromolecules , 2016, 82(1): 134-143. |
| [15] | Chiang E R, Ma H L, Wang J P, et al. Allogeneic mesenchymal stem cells in combination with hyaluronic acid for the treatment of osteoarthritis in rabbits[J]. Plos One , 2016, 11(2): 1-15. |
| [16] | Levingstone T J, Thompson E, Matsiko A, et al. Multi-layered collagen-based scaffolds for osteochondral defect repair in Rabbits[J]. Acta Biomaterialia , 2016, 32(3): 149-160. |
| [17] | Du M C, Chen B, Meng Q Y, et al. 3D bioprinting of BMSC-laden methacrylamide gelatin scaffolds with CBD-BMP2-collagen microfibers[J]. Biofabrication , 2015, 7(4): 1-10. |
| [18] | Deepti S, Anuj T, Zo S M, et al. Synthesis of composite gelatin-hyaluronic acid-alginate porous scaffold and evaluation for in vitro stem cell growth and in vivo tissue integration[J]. Colloids and Surfaces B:Biointerfaces , 2014, 116(4): 502-509. |
| [19] | LIANG Meng(梁猛), CHEN Hao(陈浩), WEI Kun(魏坤), et al. Effects of β-TCP amounts on compressive strength, porosity and cytocompatibility of PLGA scaffolds(不同量β-TCP对PLGA微球支架的抗压强度、孔隙率和细胞相容性的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(4): 871-877. |
| [20] | Cui N, Qian J M, Liu T, et al. Hyaluronic acid hydrogel scaffolds with a triple degradation behavior for bone tissue engineering[J]. Carbohydrate Polymers , 2015, 126(8): 192-198. |
| [21] | Zhao W, Li X W, Liu X Y, et al. Effects of substrate stiffness on adipogenic and osteogenic differentiation of human mesenchymal stem cells[J]. Materials Science and Engineering C , 2014, 40(7): 316-323. |
| [22] | Liu Y C, Shu X Z, GLENN D. Osteochondral defect repair with autologous bone marrow-derived mesenchymal stem cells in an injectable, in situ, cross-linked synthetic extracellular matrix[J]. Tissue Engineering , 2006, 12(12): 3405-3416. DOI:10.1089/ten.2006.12.3405. |
| [23] | Lin W H, Yu J S, Chen G P, et al. Fabrication of multi-biofunctional gelatin-based electrospun fibrous scaffolds for enhancement of osteogenesis of mesenchymal stem cells[J]. Colloids and Surfaces B:Biointerfaces , 2016, 138(2): 26-31. |
| [24] | Mohammad A, Abbas T, Ghasem M. Preparation, characterization and biocompatible properties of b-chitin/silk fibroin/nanohydroxyapatite composite scaffolds prepared using a freeze-drying method[J]. RSC Advances , 2016, 6(3): 7048-7060. |




