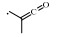
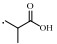
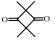
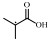
2. 浙江大学衢州研究院, 浙江 衢州 324000;
3. 浙江恒逸石化研究院有限公司, 浙江 杭州 311200
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China;
3. Zhejiang Hengyi Petrochemical Research Institute Co. Ltd., Hangzhou 311200, China
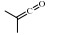
为了减少对化石燃料的依赖和保护环境,从生物质出发生产燃料是近年来的研究热点之一。其中羧酸的气相热解反应在生物质转化、生物燃料燃烧的过程中占据重要地位[1-3]。此外,在羧酸的热解过程中,脱水生成的烯酮是制备高性能聚酯的重要中间体[4-6]。因此有必要开发详细的羧酸气相热解动力学模型来描述反应过程及各种相关中间体的形成过程。目前,在实验研究方面,只有异丁酸(isobutyric acid,IBA,IC3H7COOH)的同系物乙酸(acetic acid,AA)[7-9]、丙酸[10-12]的热解实验报道,为羧酸热解反应动力学模型的发展提供了实验数据;而关于IBA热解反应的研究报道却很少。在理论计算方面,Clark等[13]使用量子化学方法计算了包括IBA在内的部分羧酸的单分子分解能垒和500~2000 K温度范围内的高压极限速率常数。Cavallotti等[14]计算了AA单分子裂解过程中与H、OH、OOH、O2和CH3等自由基发生氢提取反应的势能面,结果表明,所得到的动力学模型可以合理预测AA直接分解的产物。Mendes等[15]对一系列含氧化合物(包括甲酸、丙酸、丁酸和IBA)的氢提取反应进行了系统理论计算。Namysl等[16]对丁酸和戊酸的氧化过程进行了实验研究,并且基于AA的氧化理论研究和烷烃的速率规则得到了详细的反应机理。尽管前人对部分羧酸热解过程进行了探究,但关于IBA的热解动力学仍缺乏实验和理论研究。本研究针对IBA在管式反应器这一流动反应器中的气相热解反应,给出不同IBA分压、温度、停留时间下的实验数据;结合理论研究,提出1种新的、详细的IBA热解动力学模型,并由实验数据进行校验。针对该模型的预测效果,进行生成速率与敏感性分析,从反应动力学的角度加深对IBA热解过程的理解。
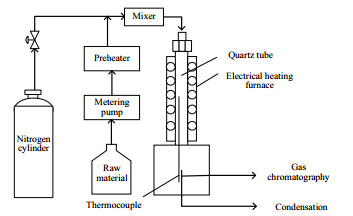
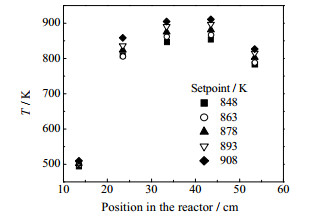
2 实验方法实验在管式反应器这一连续流动反应器中进行,裂解气在出口处用气相色谱进行分析,实验装置流程如图 1所示。管式反应器采用内径为10 mm、长为54 cm的竖直石英管,由配有温度控制器的电热炉加热。在操作条件下,贝克来(Péclet)数Pe大于100,因此,该管式反应器可视为平推流反应器[17]。在每个设定的反应温度下,可用沿管式反应器中心轴移动的热电偶测量反应器内的温度分布。无反应情况下的管式反应器内的温度分布如图 2所示,图中T为热力学温度。
|
图 1 实验装置流程图 Fig.1 Schematic of experimental setup |
|
图 2 管式反应器内的温度分布 Fig.2 Temperature profile in the tubular reactor |
开始反应时,首先将反应物IBA(质量分数为99.8%,麦克林生化科技有限公司)通过计量泵打入预热区中,气化的IBA与氮气(稀释气,质量分数大于99.999%)混合,升温至493 K后,进入反应管。反应管入口压力控制在105 kPa左右,具体实验条件列于表 1。为避免产品冷凝,反应器出口处的气体经温度为463 K左右的加热管线输送至气相色谱仪(岛津GC-2030)进行在线分析。气相色谱仪采用6根色谱柱(GS-GasPro,Rtx-5,3根MS-13X 80/100 mesh,3根P-Q 80/100 mesh),检测器包含1个热导检测器(TCD)和2个火焰离子检测器(FID)。利用气质联用对产物进行鉴定,使用标准气体混合物对非冷凝物质进行校正。
|
|
表 1 反应条件 Table 1 Reaction conditions in the study |
近年来,Konnov课题组研究了短链酸裂解及燃烧过程动力学机理,并成功模拟甲酸[18]、AA[19]和丙酸[20]的燃烧过程。本研究在Konnov等提出的丙酸机理基础上,添加了IBA特有的反应路径及相应的动力学参数,如表 2所示,反应速率常数k以A⋅Tn⋅exp(−Ea⋅R−1⋅T−1)形式给出。其中,k,s−1或cm3⋅mol−1⋅s−1;A为指前因子,s−1或cm3⋅mol−1⋅s−1;n为温度指数因子;Ea为反应活化能,J⋅mol−1;R为气体常数,J⋅mol−1⋅K−1。IBA热解机理中重要组分的分子结构和命名如表 3所示。为了更好地与相应热解条件下的组分浓度相匹配,需对得到的k进行矫正[21]。对于本研究计算得到的k,分配1个统一的不确定因子(uncertainty factors,UF)为3。对于近似获得的k,UF为5~6;而对于估算的k,UF可达到10[22]。
|
|
表 2 IBA热解反应中添加的机理 Table 2 The added reactions in IBA pyrolysis |
|
|
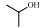
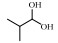
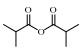
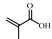
表 3 IBA热解机理中部分组分的命名与结构 Table 3 Nomenclature and structure of some species in IBA pyrolysis |
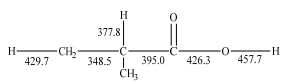
为了说明表 2中某些反应的机理,并估计相应的动力学参数,计算了IBA的键离解能(bond dissociation energies,BDEs)。根据计算出的生成焓,IBA的BDEs如图 3所示,Cα─H键(377.8 kJ⋅mol−1)与Cα─Cβ键(348.5 kJ⋅mol−1)的BDEs值相对较小,因而对IBA消耗的贡献率更高。BDEs不仅反映了羧基与邻位键的相互影响,而且为不同反应类型中键的解离提供依据。基于类比规则,可将图 3中含有羧基部分(CHCOOH)的反应类比AA、丙酸的反应,将烷烃部分(甲基)的反应类比异丁烷的反应,由此推导出IBA热解所需的部分k[16, 23]。对于没有可用数据的反应,使用量化方法计算k。本研究中的热力学和动力学参数的计算方法如下:在Gaussian 16[24]中,在B3LYP/CBSB7理论基础上进行系统构象搜索;在CBS-QB3[25]理论基础上进行单点能量和频率计算;在B3LYP/CBSB7理论基础上进行IRC计算,以验证是否得到正确的过渡态结构,并确认反应是否为基元反应。随后在Tortherm程序[26]中得到热力学参数,并在Chemkin软件中拟合并存储为多项式。在Kisthelp软件[27]中采用过渡态理论(TST)与Eckart隧穿校正模型,在振动频率比例为0.99、压力为100 kPa、温度为700~1 100 K下计算不同反应路径的动力学常数。
|
图 3 IBA的键解离能(kJ⋅mol−1) Fig.3 Bond dissociation energies of IBA (kJ⋅mol−1) |
图 4为IBA裂解为相应产物的势能面,E为反应能垒。由图可见,IBA脱水反应生成二甲基乙烯酮(IC3H6CO,dimethylketene,用DMK代表)与H2O过程可通过四元环过渡态直接脱水进行,也可通过生成1, 1-二元醇中间体(CH3C(CH3)C(OH)2)间接脱水进行,能垒分别为322.9、313.3 kJ⋅mol−1。IBA脱羧反应生成丙烷(C3H8)和CO2,其能垒为298.7 kJ⋅mol−1,与IBA脱水反应的能垒数值相近,并且在高温下,IBA存在单分子引发的自由基机理(341~371 kJ⋅mol−1)。将计算得到的AA、IBA脱羧和直接脱水的k值与文献值对比,结果如图 5所示。
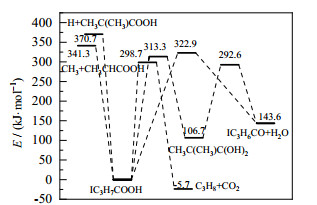
|
图 4 IBA裂解为产物的势能面 Fig.4 Potential energy surface for IBA decomposition |
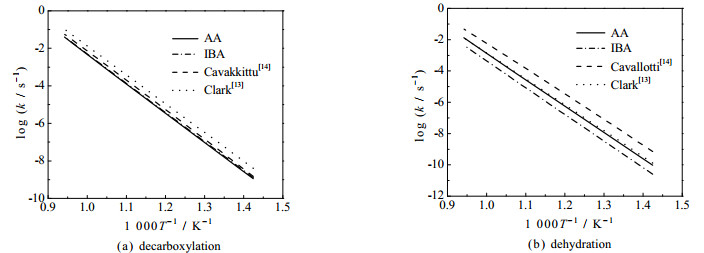
|
图 5 AA和IBA脱羧和脱水反应的k[13-14] Fig.5 k of decarboxylation and dehydration reactions of AA and IBA[13-14] |
图 5表明,本研究计算出的AA的k与Cavallotti等[14]和Clark等[13]的计算结果基本吻合。如图 5(a)所示,IBA的脱羧反应包含CCOOH─Cα与O─H键的断裂,其键解离能数值与AA的相近,因此其k值也与AA的相近。如图 5(b)所示,对于IBA的脱水反应而言,因涉及α-H转移,故IBA的k值更小,且IBA的脱水和脱羧2条反应路径之间存在激烈的竞争机制。通过上文分析及计算结果,表 2中共添加了以下5种类型反应来说明反应物的消耗。
a、IBA单分子热解反应:包括IBA的脱羧、脱水反应和涉及自由基机理的单分子引发反应,其中Cα─H键与Cα─Cβ键解离的k结合Sun等[22]计算的丙酸的k与BDEs进行推导。
b、异构化反应:CH2CH(CH3)COOH自由基与CH3C(CH3)COOH自由基之间通过氢转移的异构化反应。
c、氢提取反应:氢(H)、甲基(CH3)、羟基(OH)、异丙基(IC3H7)、正烯丙基(TC3H5)、羧基(HOCO)、2-丙羧基(CH3CHCOOH)、乙基(C2H5)、乙烯基(C2H3)等自由基对IBA的氢提取反应。其中H、CH3、OH的k采用Mendes等[15]的理论计算结果,UF约为2.5。
d、β-裂解反应:氢提取反应中生成的自由基可以通过β-裂解反应生成不饱和羧酸,也可以异构化为另一种自由基。这些自由基酸性部分的分解反应及其与H原子相互作用的k参考AA[14]、丙酸[22, 28-29]、丁酸[16]的热解过程。
e、DMK反应:包括单分子引发反应、甲基与氢自由基的氢提取与加成反应、DMK与水、酸的加成反应。其中DMK部分反应的k是基于对乙烯酮反应[29, 30]、甲基乙烯酮反应[17]的类比。
此外该反应机理模型还包括甲酸[19]、AA[14]、丙酸[22]的反应子机理,共包含271种组分、3122步反应。使用Chemkin 17.0软件[31]和新开发的化学反应动力学机理模型对IBA的热解进行模拟。
4 结果与讨论在IBA的分压pIBA为10~20 kPa、温度为848~908 K、停留时间为2~3.5 s下,IBA热解的部分产物摩尔分数的实验值和模型预测值随温度变化情况如图 6所示。结果表明,本研究的模型能够很好地预测IBA热解、后续产物的生成与消耗。
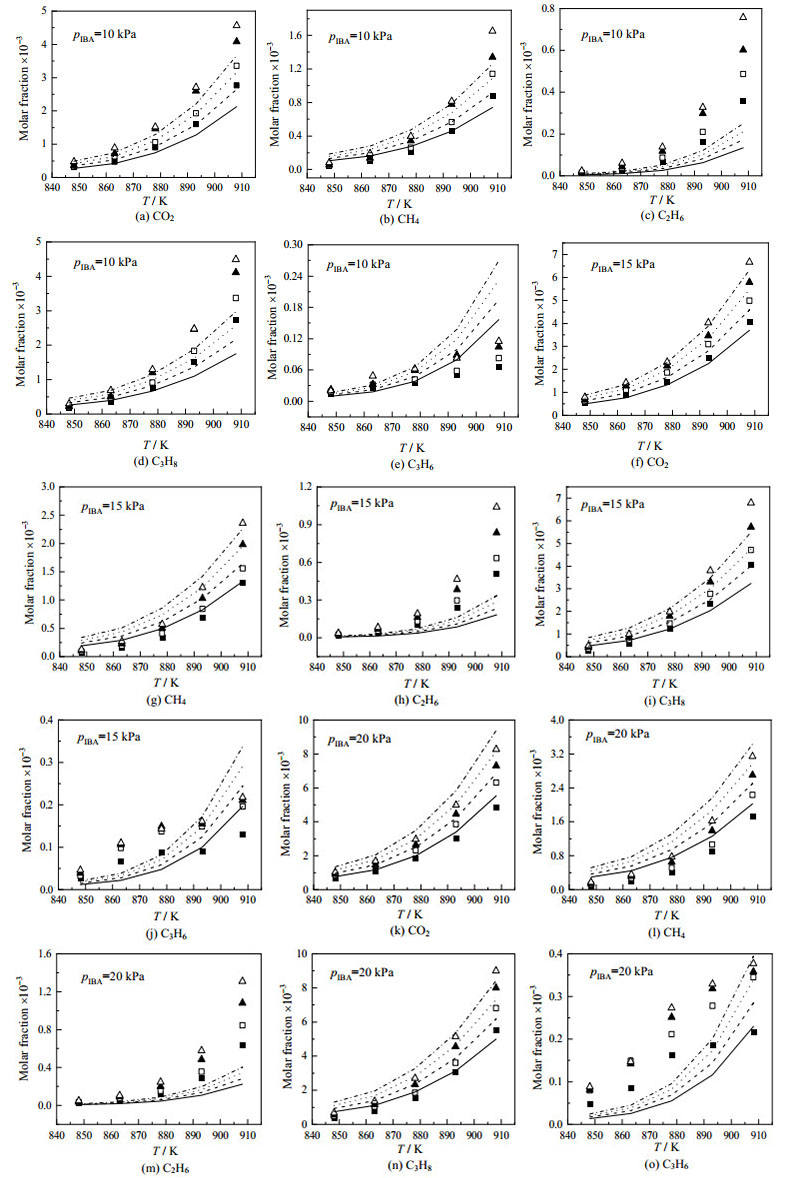
|
图 6 IBA热解的部分产物的摩尔分数实验值(符号)和预测值(线条)对比
Fig.6 Comparison of experimental (symbols) and predicted (lines) mole fractions of various species in IBA pyrolysis
■ 2 s □ 2.5 s ▲ 3 s △ 3.5 s ——2 s ----2.5 s ····3 s -·-·-·3.5 s |
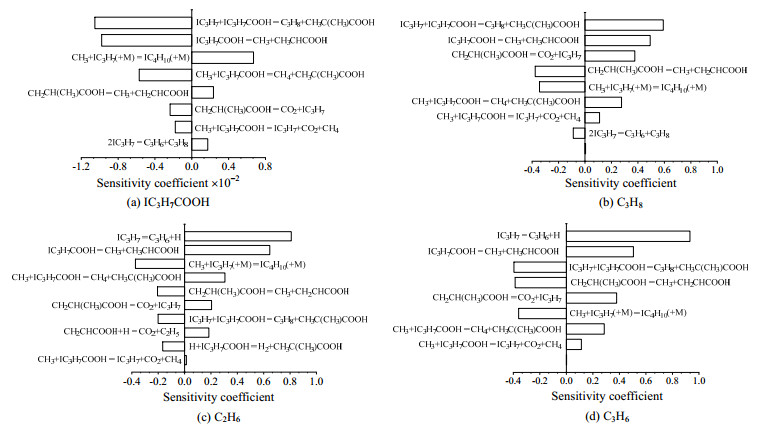
为了深入了解IBA热解的主要途径以及热解产物和中间体的形成过程,在pIBA=15 kPa、温度为893 K、停留时间为3 s条件下,在反应管的16.2 cm处,对IBA热解过程进行生成速率(rate of production, ROP)与敏感性分析,如图 7、8所示。
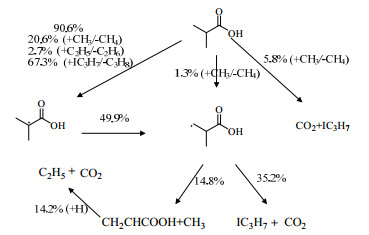
|
图 7 IBA在N2中的生成速率分析图 Fig.7 Rate of production analysis of IBA pyrolysis in N2 |
|
图 8 热解过程中各组分的敏感性分析 Fig.8 Sensitivity analysis of various species during pyrolysis |
图 7的ROP分析表明,IBA(摩尔分数为90.6%)几乎全部由氢提取反应消耗。其中主要的氢提取自由基是IC3H7(摩尔分数为67.3%)、CH3(摩尔分数为20.6%)以及C2H5(摩尔分数为2.7%),主要抽取的是IBA的α-H,生成CH3C(CH3)COOH自由基,并且该自由基通过氢转移可生成CH2CH(CH3)COOH(摩尔分数为49.9%)。CH2CH(CH3)COOH自由基可进一步发生脱羧反应生成IC3H7和CO2(摩尔分数为35.2%)。直链自由基机理的特征是第1步消耗1个自由基、最后一步再生该自由基的反应序列,这是有机化合物在气相热解反应过程中反应活性高的原因[32]。CH2CH(CH3)COOH的自由基也可以脱去CH3生成丙烯酸(摩尔分数为14.8%),由此生成的丙烯酸可与氢自由基作用并脱羧生成C2H5与CO2(摩尔分数为14.2%)。然而CH3对IBA羧基上的氢提取反应(摩尔分数为5.8%)以及对β-H的氢提取反应(摩尔分数为1.3%)都较难发生。
图 8(a)、(b)为IBA与丙烷的敏感性分析,由图可见,IC3H7的氢提取反应的敏感性最高,IBA的消耗与丙烷的生成均会受其限制,这与ROP分析结果一致。因此,CH3与IC3H7结合生成IC4H10、2个IC3H7反应生成C3H6和C3H8都会抑制IBA的热解。虽然IBA的单分子裂解反应生成CH3和IC3H7对IBA的消耗程度较少,但它是最敏感的促进反应之一,这与Gornay等[33]对辛酸的单分子裂解反应分析结果一致。关于CH2CH(CH3)COOH自由基的裂解反应,生成CH3与丙烯酸的反应会抑制IBA的反应,生成IC3H7和CO2的反应则会促进IBA的消耗与丙烷的生成。
图 6表明,乙烷摩尔分数的预测值低于实验值,且偏差最大;而对于丙烯,在pIBA=10 kPa、较低温度下,模型的预测较为准确,但温度为893~908 K时,预测值高于实验值,且随着IBA分压上升,其预测值与实验值的关系出现变化。结合图 8(c)、(d)所示的乙烷和丙烯的敏感性分析,可知二者的形成主要受IC3H7 = C3H6+H反应影响。在本机理中,该反应的k采用Miller等[34]通过理论计算得到。此外,对于乙烷的生成,还需考虑CH2CHCOOH+H = CO2+C2H5反应的影响,对于该反应,本研究采用Zhang等[28]计算得到的k。由于电子结构计算方法与过渡态理论方法中引入假设,因此通过计算得到的动力学参数与实验测定存在误差,分别将上述两个反应的指前因子A乘以0.1、10,以适应实验值。Namysl等[16]建立的丁酸氧化动力学模型与Gornay等[33]建立的辛酸热解动力学模型中,乙烷的预测值同样低于实验值,需要进一步理论研究。
5 结论本研究在管式反应器这一流动反应器中开展了IBA热解实验,在IBA分压为10~20 kPa、温度为848~908 K、停留时间为2~3.5 s下测量了部分产物的摩尔分数,探究了热解产物随反应条件的变化规律。基于实验结果和理论计算,在已报道的丙酸氧化动力学模型基础上,建立了1个包含271个组分和3 122个反应的IBA热解动力学模型,该模型的预测值与实验值吻合较好,丰富了羧酸分子的热解动力学。生成速率和敏感性分析结果表明,在本研究条件下,IC3H7与CH3对IBA α-H的提取反应是IBA的主要消耗路径,由此生成的自由基继续断键生成小分子。因此,自由基机理在IBA热解过程中起着重要作用,且消耗IC3H7的反应会抑制热解体系中IBA的消耗。
| [1] |
骆仲泱, 张晓东, 周劲松, 等. 生物质热解焦油的热裂解与催化裂解[J]. 高校化学工程学报, 2004, 18(2): 162-167. LUO Z Y, ZHANG X D, ZHOU J S, et al. Experimental study on catalytic and thermal cracking of tar from biomass pyrolysis[J]. Journal of Chemical Engineering of Chinese Universities, 2004, 18(2): 162-167. |
| [2] |
BERTERO M, DE LA PUENTE G, SEDRAN U. Fuels from bio-oils: Bio-oil production from different residual sources, characterization and thermal conditioning[J]. Fuel, 2012, 95(1): 263-271. |
| [3] |
ONARHEIM K, SOLANTAUSTA Y, LEHTO J. Process simulation development of fast pyrolysis of wood using aspen plus[J]. Energy & Fuels, 2014, 29(1): 205-217. |
| [4] |
WANG H B, DESILLES N, FOLLAIN N, et al. Dimethylketene-based aliphatic polyketones: Copolymers and star-shaped polymers potentially useful in food packaging[J]. European Polymer Journal, 2016, 85: 411-420. DOI:10.1016/j.eurpolymj.2016.10.044 |
| [5] |
NELSON A M, LONG T E. A perspective on emerging polymer technologies for bisphenol-A replacement[J]. Polymer International, 2012, 61(10): 1485-1491. DOI:10.1002/pi.4323 |
| [6] |
ZHANG M, MOORE R B, LONG T E. Melt transesterification and characterization of segmented block copolyesters containing 2, 2, 4, 4-tetramethyl-1, 3-cyclobutanediol[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2012, 50(18): 3710-3718. DOI:10.1002/pola.26176 |
| [7] |
BAMFORD C H, DEWAR M J S. The thermal decomposition of acetic acid[J]. Journal of the Chemical Society, 1949, 2877-2882. DOI:10.1039/jr9490002877 |
| [8] |
BLAKE P G, HOLE K J. The thermal decomposition of propionic acid[J]. Journal of the Chemical Society. B, 1966, 577-579. DOI:10.1039/j29660000577 |
| [9] |
BLAKE P G, JACKSON G E. The thermal decomposition of acetic acid[J]. Journal of the Chemical Society. B, 1968, 1153-1155. DOI:10.1039/j29680001153 |
| [10] |
MACKIE J C, DOOLAN K R. High-temperature kinetics of thermal decomposition of acetic acid and its products[J]. International Journal of Chemical Kinetics, 1984, 16(5): 525-541. DOI:10.1002/kin.550160504 |
| [11] |
DOOLAN K R, MACKIE J C, REID C R. High temperature kinetics of the thermal decomposition of the lower alkanoic acids[J]. International Journal of Chemical Kinetics, 1986, 18(5): 575-596. DOI:10.1002/kin.550180508 |
| [12] |
ELWARDANY A, NASIR E F, ES-SEBBAR E, et al. Unimolecular decomposition of formic and acetic acids: A shock tube/laser absorption study[J]. Proceedings of the Combustion Institute, 2015, 35(1): 429-436. DOI:10.1016/j.proci.2014.06.141 |
| [13] |
CLARK J M, NIMLOS M R, ROBICHAUD D J. Comparison of unimolecular decomposition pathways for carboxylic acids of relevance to biofuels[J]. Journal of Physical Chemistry A, 2014, 118(1): 260-74. DOI:10.1021/jp4095485 |
| [14] |
CAVALLOTTI C, PELUCCHI M, FRASSOLDATI A. Analysis of acetic acid gas phase reactivity: Rate constant estimation and kinetic simulations[J]. Proceedings of the Combustion Institute, 2019, 37(1): 539-546. DOI:10.1016/j.proci.2018.06.137 |
| [15] |
MENDES J, ZHOU C W, CURRAN H J. Theoretical chemical kinetic study of the H-atom abstraction reactions from aldehydes and acids by H atoms and OH, HO2, and CH3 radicals[J]. Journal of Physical Chemistry A, 2014, 118(51): 12089-12104. DOI:10.1021/jp5072814 |
| [16] |
NAMYSL S, PELUCCHI M, HERBINET O, et al. A first evaluation of butanoic and pentanoic acid oxidation kinetics[J]. Chemical Engineering Journal, 2019, 373: 973-984. DOI:10.1016/j.cej.2019.05.090 |
| [17] |
VIN N, BATTIN-LECLERC F, HERBINET O. A study of thermal decomposition of bromoethane[J]. Journal of Analytical and Applied Pyrolysis, 2018, 136: 199-207. DOI:10.1016/j.jaap.2018.10.005 |
| [18] |
LAVADERA M L, KONNOV A A. Laminar burning velocities of methane+formic acid+air flames: Experimental and modeling study[J]. Combustion and Flame, 2021, 225: 65-73. DOI:10.1016/j.combustflame.2020.10.050 |
| [19] |
SAVCHENKOVA A S, SEMENIKHIN A S, CHECHET I V, et al. Revisiting diacetyl and acetic acid flames: The role of the ketene+ OH reaction[J]. Combustion and Flame, 2020, 218: 28-41. DOI:10.1016/j.combustflame.2020.04.021 |
| [20] |
LAVADERA M L, KONNOV A A. Laminar burning velocities of propionic acid+air flames: Experimental, modeling and data consistency study[J]. Combustion and Flame, 2021, 230: 111431. DOI:10.1016/j.combustflame.2021.111431 |
| [21] |
REN W, SPEARRIN R M, DAVIDSON D F, et al. Experimental and modeling study of the thermal decomposition of C3-C5 ethyl esters behind reflected shock waves[J]. Journal of Physical Chemistry A, 2014, 118(10): 1785-1798. DOI:10.1021/jp411766b |
| [22] |
SUN W, TAO T, ZHANG R, et al. Experimental and modeling efforts towards a better understanding of the high-temperature combustion kinetics of C3-C5 ethyl esters[J]. Combustion and Flame, 2017, 185: 173-187. DOI:10.1016/j.combustflame.2017.07.013 |
| [23] |
PELUCCHI M, CAVALLOTTI C, RANZI E, et al. Relative reactivity of oxygenated fuels: Alcohols, aldehydes, ketones, and methyl esters[J]. Energy & Fuels, 2016, 30(10): 8665-8679. |
| [24] |
COPELAND C, MENON O, MAJUMDAR D, et al. Understanding the influence of low-frequency vibrations on the hydrogen bonds of acetic acid and acetamide dimers[J]. Physical Chemistry Chemical Physics, 2017, 19(36): 24866-24878. DOI:10.1039/C7CP04224H |
| [25] |
MONTGOMERY J A, FRISCH M J, OCHTERSKI J W, et al. A complete basis set model chemistry. Ⅵ. Use of density functional geometries and frequencies[J]. The Journal of Chemical Physics, 1999, 110(6): 2822-2827. DOI:10.1063/1.477924 |
| [26] |
LIU Y, JIANG S Y, SHI Q, et al. Kinetic investigation of the pyrolysis of isobutyric anhydride and isobutyric acid[J]. Industrial & Engineering Chemistry Research, 2020, 59(33): 14747-14757. |
| [27] |
CANNEAUX S, BOHR F, HENON E. KiSThelP: A program to predict thermodynamic properties and rate constants from quantum chemistry results[J]. Journal of Computational Chemistry, 2014, 35(1): 82-93. DOI:10.1002/jcc.23470 |
| [28] |
ZHANG X, MEI B, MA S, et al. Characterizing the fuel-specific combustion chemistry of acetic acid and propanoic acid: Laminar flame propagation and kinetic modeling studies[J]. Proceedings of the Combustion Institute, 2021, 38(1): 449-457. DOI:10.1016/j.proci.2020.06.220 |
| [29] |
SEMENIKHIN A S, SHUBINA E G, SAVCHENKOVA A S, et al. Mechanism and rate constants of the CH3+CH2CO reaction: A theoretical study[J]. International Journal of Chemical Kinetics, 2018, 50(4): 273-284. DOI:10.1002/kin.21156 |
| [30] |
CHRISTENSEN M, KONNOV A A. Laminar burning velocity of acetic acid+air flames[J]. Combustion and Flame, 2016, 170: 12-29. DOI:10.1016/j.combustflame.2016.05.007 |
| [31] |
CHRISTENSEN M, KONNOV A A. Laminar burning velocity of diacetyl+air flames. Further assessment of combustion chemistry of ketene[J]. Combustion and Flame, 2017, 178: 97-110. DOI:10.1016/j.combustflame.2016.12.026 |
| [32] |
WEI L, GUOQING W, YUYANG L, et al. Experimental and kinetic modeling investigation on pyrolysis and combustion of n-butane and i-butane at various pressures[J]. Combustion and Flame, 2018, 191: 126-141. DOI:10.1016/j.combustflame.2018.01.002 |
| [33] |
GORNAY J, GLAUDE P A, BILLAUD F, et al. Experiments and modeling of octanoic acid pyrolysis in a plug flow reactor[J]. Journal of Analytical and Applied Pyrolysis, 2020, 146: 104767. DOI:10.1016/j.jaap.2019.104767 |
| [34] |
MILLER J A, KLIPPENSTEIN S J. Dissociation of propyl radicals and other reactions on a C3H7 potential[J]. Journal of Physical Chemistry A, 2013, 117(13): 2718-2727. DOI:10.1021/jp312712p |