2. 海正生物制药有限公司, 浙江 杭州 311404
2. Hisun Biopharmaceutical Co. Ltd., Hangzhou 311404, China
细胞培养是单克隆抗体(简称单抗)生产中的重要环节。为提高单抗产量和保证产品质量,必须监控培养过程参数及细胞生长状态。目前,可在细胞培养过程中实现在线检测的参数主要为温度、pH、溶氧(dissolved oxygen,DO)、搅拌速度等[1],其他反映培养状态(如营养物、代谢物、细胞密度、活度)和产物相关(表达量、质量,如糖基化)的指标仍需取样分析。然而,取样增加了向生物反应器内引入外来污染的风险;离线检测通常耗时、花费较多,无法提供及时的反馈,增加了批次失败的风险。因此,细胞培养过程多指标实时在线监测或快速检测方法开发,有助于增加过程了解,提高过程控制水平,保证产品质量。
与传统的离线检测方法相比较,光谱技术通常具有快速、无损的特点,更适用于过程监测[1]。已有较多研究使用拉曼光谱技术检测细胞培养过程中营养物、代谢物、细胞密度、抗体表达量等指标[2-4],本课题组[5]前期也探究了拉曼光谱用于同时快速分析中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞培养液中葡萄糖质量浓度、乳酸质量浓度、谷氨酸浓度、谷氨酰胺浓度、活细胞密度、总细胞密度、细胞活度和单克隆抗体表达量等8个指标的可行性。紫外-可见(ultraviolet-visible,UV-Vis)光谱技术是一种快速、无损的检测技术[6],与近红外光谱、拉曼光谱等过程分析技术工具相比较,UV-Vis光谱技术更灵敏、光谱系统的建设成本更低[7]。然而,UV-Vis光谱在哺乳细胞培养[8]等生物制药过程[9]监测中应用较少。Leme等[8]和Takahashi等[9]以培养基含有酚红的BHK-21细胞培养过程为研究对象,以离线UV-Vis光谱数据建立多元定量校正模型,预测谷氨酰胺、谷氨酸、葡萄糖、乳酸浓度和活细胞密度。
本研究以CHO细胞培养液上清为研究对象,将细胞培养液上清与一定质量浓度的酚红溶液等体积混合,基于混合液UV-Vis光谱建立葡萄糖(glucose,Gluc)质量浓度、乳酸(lactate,Lac)质量浓度、谷氨酸(glutamate,Glu)浓度、谷氨酰胺(glutamine,Gln)浓度、活细胞密度(viable cell density,VCD)、总细胞密度(total cell density,TCD)、细胞活度(Viability)和单抗表达量(Titer)的多元校正模型,为细胞培养过程多指标快速检测提供了一种具有可行性的新方法,以期该方法可用于细胞培养过程监测。
2 材料与方法 2.1 仪器与设备FerMac 360生物反应器(规格2 L,英国Electrolab公司),Nova BioProfile 400多参数生化分析仪(美国Nova Biomedical公司),Countstar IC 1000细胞计数仪(美国Inno-Alliance Biotech公司)。
Agilent Cary 60紫外-可见光谱仪(美国Agilent Technologies公司),配有Cary WinUV Scan Application软件(Version 5.0.0.999);远紫外石英微量比色皿(光程1 mm,宜兴晶科光学仪器有限公司)。
2.2 试剂酚红(又称苯酚红,Phenol Red,阿拉丁,Lot#C1519065),超纯水(美国Millipore公司Milli-Q超纯水系统制备)。
2.3 细胞培养以2 L生物反应器培养CHO-DG44细胞,该细胞可生产单克隆抗体(HS006)。为优化细胞培养工艺,提高建模样本代表性,采用3因子2水平(23)析因实验设计改变培养条件(pH、温度、DO),重复部分实验点,共开展细胞培养12个批次,如表 1所示。每批次持续12~13 d,分别在培养第3、6、9、12和13 d取样,得到样本51个。
|
|
表 1 细胞培养条件 Table 1 Cell culture conditions |
生化指标以Nova BioProfile 400多参数生化分析仪检测,包括Gluc、Lac质量浓度以及Glu、Gln浓度。以Countstar IC 1000全自动细胞计数分析仪和台盼蓝染色法测得TCD、VCD和Viability。经Protein A亲和色谱(填料MabSelect SuRe,美国GE Healthcare公司)分离后测得Titer。
2.5 酚红溶液配制称取酚红10.04 mg于样品瓶,加入适量超纯水转移至1 000 mL量瓶,超声使酚红溶解、定容,配成质量浓度为10 mg·L-1的酚红溶液。
2.6 UV-Vis光谱分析取细胞培养液离心后所得上清,与2.5节中酚红溶液按体积比1:1混合,得供试品溶液。每个样品平行制备3份,用于UV-Vis光谱分析。UV-Vis光谱参数:扫描范围为190~800 nm,数据间隔0.50 nm,比色皿光程1 mm,以超纯水为参比基线校正。每个供试品光谱采集1次,则每份样品获得3张光谱,取平均值,共得到52张平均光谱,保留吸光度均小于2的光谱范围(235~800 nm)。
2.7 校正模型建立选择9批次样本作为校正集,以偏最小二乘(partial least squares,PLS)法分别建立UV-Vis光谱和各指标间的校正模型,以3批次样本作为验证集评估模型预测性能(见表 2)。表 2中,ρB为质量浓度的参考值,cB为浓度的参考值;出于保密需求,Titer质量浓度已除以常数C呈现。由于部分样本Lac质量浓度、Glu浓度、Gln浓度和Titer参考值缺失,建立这4个指标定量校正模型前需分别剔除参考值缺失的样本,导致表 2中这4个指标各自的总样本数小于51。对所有数据变量进行标准化(autoscaling)处理,考察不同光谱预处理方法和建模光谱范围对模型性能的影响,以校正集交叉验证均方根误差(root mean square error of cross-validation,RMSECV)和验证集预测均方根误差(root mean square error of prediction,RMSEP)评价模型性能[10]。数据分析使用SIMCA软件(Version 14.1,瑞典MKS Umetrics AB公司)。
|
|
表 2 校正集与验证集样本概况 Table 2 Overview of samples in calibration and validation sets |
此外,除使用上述传统的统计学参数评价模型性能,还可比较模型预测值和参考值间的平均百分误差(average percentage error,APE)与参考分析方法的误差(以相对标准偏差relative standard deviation,RSD)[11-12]。Nova BioProfile 400分析仪的检测误差RSD和细胞计数的误差根据已有研究[11, 12]获得。APE按下式进行计算:
| ${\rm{APE}} = \frac{{\sum\nolimits_{i = 1}^n {\left| {{{\hat y}_i} - {y_i}} \right|} }}{{n \cdot \bar y}}$ |
式中,
根据已有研究[8-9],以含有酚红成分的培养基细胞培养,可将培养液上清稀释,以稀释液UV-Vis光谱定量预测Gluc和Lac质量浓度等指标。其原理在于,Gln和Gluc经代谢产生降低培养液pH的化合物(Lac和铵),pH的改变引起酚红光谱特征峰强变化,因此酚红光谱的改变与Gln、Gluc代谢关联,进而可能与活细胞密度关联[13]。本研究中,细胞培养使用的培养基不含酚红,向细胞培养液上清添加酚红后采集UV-Vis光谱,目的是考察能否通过这种“添加酚红”的方式,使酚红光谱将相关指标“信号”放大,从而定量预测培养液的多项指标。考虑到酚红在细胞培养中的可添加质量浓度范围,将酚红溶液的质量浓度设置为10 mg·L-1。因此,实验中采集细胞培养液上清与酚红溶液体积比为1:1混合溶液的光谱,相当于采集培养基中添加质量浓度为10 mg·L-1酚红的细胞培养液上清与超纯水体积比为1:1混合样品的光谱(见图 1)。
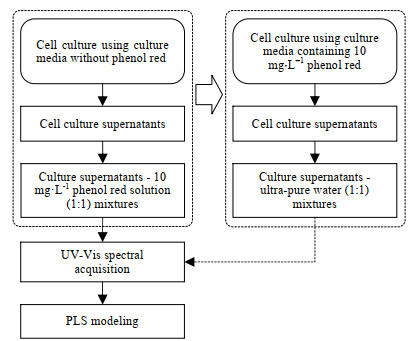
|
图 1 紫外-可见光谱分析流程示意图 Fig.1 Process flow chart for UV-Vis spectral analysis |
供试品溶液的全部平均光谱见图 2。图 2中,横坐标Wavelength为波长,纵坐标Abs为吸光度。由图 2可知,CHO细胞培养液上清与酚红的混合溶液UV-Vis光谱中,主要含3个最大吸收峰,波长分别在约270、430和560 nm处。其中,波长约430和560 nm处吸收峰由酚红产生,为酚红特征峰,与已有研究[14]报道酚红特征峰波长相符。推测上述3个吸收峰峰强变化来源见表 3。
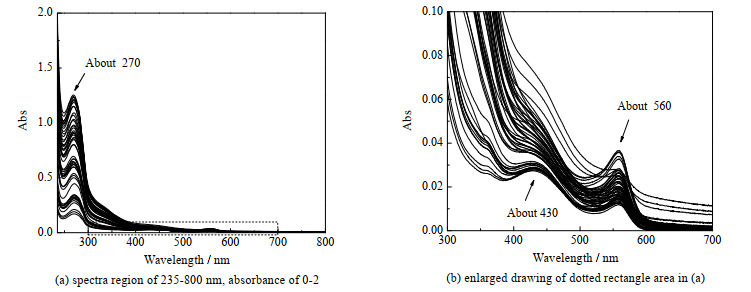
|
图 2 供试品的UV-Vis光谱图 Fig.2 UV-Vis spectra of test samples |
|
|
表 3 紫外-可见光谱吸收峰峰强变化来源推测 Table 3 Possible sources of UV-Vis spectra peak intensity variation |
本研究期望结合酚红特征峰含有的信息与培养液上清固有光谱含有的信息,利用化学计量学方法建立细胞培养液多指标定量校正模型。考察的光谱预处理方法包括无光谱预处理、Savitsky Golay(SG)平滑、标准正则变换(standard normal variate,SNV)、一阶导数(first derivatives,1stD)、二阶导数(second derivatives,2ndD)、一阶导数和标准正则变换(1stD+SNV)、二阶导数和标准正则变换(2ndD+SNV)。考察的建模光谱范围包括235~800、235~630、235~350、350~630 nm(酚红特征峰变化区域)、350~480 nm(酚红特征峰变化区域)和480~630 nm(酚红特征峰变化区域)。上述预处理方法和光谱范围依次组合,选择RMSECV最小的模型作为优选模型。SNV被认为可用于减少批次间差异[15-16],因此当某候选模型使用的预处理方法包括SNV且RMSECV接近所有模型RMSECV最小值时,选择该候选模型,以提高模型的预测性能。最终建立的各指标定量校正模型各项性能参数见表 4,如图 3所示为预测值与参考值的相关图。图 3中,ρ′B为质量浓度的预测值,c′B为浓度的预测值。出于保密需求,表 4中Titer指标RMSECV和RMSEP值、图 3中ρTiter和ρ′Titer均已除以常数C。
|
|
表 4 各指标模型的性能参数 Table 4 Performance parameters of each calibration models |
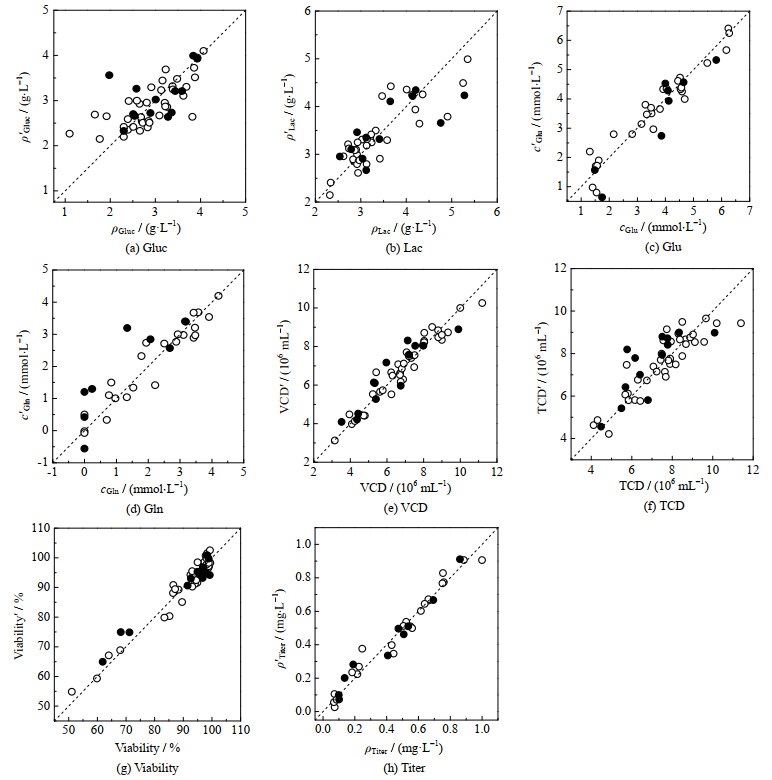
|
图 3 预测值与参考值的相关图 Fig.3 Plots of predicted values against reference values ○ calibration ● validation |
结合主成分数、RMSECV、RMSEP、RMSEP/RMSECV和APE等参数,评价各指标模型性能优劣。由表 4可知,各指标模型均具有合理的主成分数(2~8),表明模型均未过拟合。Gluc质量浓度模型RMSECV与RMSEP较小且接近,但APE达12.26%,约为参考方法RSD的3倍,说明模型预测误差过大,模型性能差。Gln浓度模型RMSECV较小,RMSEP较大,二者相差较多,APE达65.05%,约为参考方法RSD的3倍,说明模型对新样本的预测能力较差,尤其是对低浓度样本(图 3)。Lac质量浓度、Glu浓度、VCD和TCD模型RMSECV与RMSEP较小且接近,且APE分别为11.63%、12.66%、9.46% 和12.88%,接近或略小于对应参考方法RSD(分别为10%、17%、10% 和10%),说明模型预测性能较好。Viability和Titer模型RMSECV与RMSEP较小且接近,并结合比较模型RMSEP与样本范围及图 3,说明模型预测性能较好。综上,Lac质量浓度、Glu浓度、VCD、TCD、Viability和Titer模型预测性能较好,Gluc质量浓度和Gln浓度模型预测性能差;Glu浓度、VCD模型预测性能优于传统分析方法(Nova BioProfile 400分析仪和细胞计数)。模型性能的进一步提高可依赖于校正集样本数量的增加、样本代表性的提高及参考方法误差的降低等。
本研究进一步考察添加酚红是否起到提高模型性能的作用,期望通过酚红特征峰的变化,间接获取细胞培养液中某些指标的定量信息,补充细胞培养液上清固有UV-Vis光谱未反映的待测指标信息。因此,理论上,使用含酚红特征峰的光谱区域建模可提高某些指标模型性能。结果表明,不同指标PLS模型所选最优光谱范围有较大差别,对于Lac质量浓度、Gln浓度、VCD和Viability模型,包含(235~630 nm、235~800 nm)或部分包含(350~480 nm)酚红特征峰范围可提高模型性能,证实了酚红添加的作用。
对于Gluc质量浓度、Glu浓度、TCD和Titer模型,其最优光谱范围选择235~350 nm(即不包含酚红特征峰范围),推测不添加酚红也可建立这些指标的UV-Vis光谱定量校正模型,或本研究中酚红浓度较低未将相关指标信息充分反映。已有研究表明,芳香族氨基酸色氨酸、酪氨酸和苯丙氨酸残基在250~300 nm的吸收,可用以测定蛋白质的芳烃含量[17],因此可能用来估计细胞培养液上清样品中的总蛋白含量[8]。本实验中,Titer模型的最优建模光谱范围235~350 nm(包含250~300 nm区域)也说明了使用UV-Vis光谱特定区域对蛋白质定量检测的可行性。
尽管本研究所用样本为细胞培养液上清,即细胞培养液经过离心处理,样品中不含活细胞和死细胞,但对于VCD、TCD和Viability指标,模型仍有较好的预测性能,原因可能为这3个指标可能与其他指标存在相关性[18],通过对其他指标的定量分析,间接获得这3个指标的定量信息,如在某些情况下VCD可与Gluc、Gln、Lac和铵浓度线性相关[13];或细胞产生可反映生理状态的化学物质,采集的UV-Vis光谱包含了这些物质的信息,经模型校正,与这3个指标关联。
无论是已有研究[8-9]中以培养基中含有酚红的细胞培养液上清为研究对象,还是本研究中以人为添加酚红至无酚红成分的培养液上清所得样本为研究对象,都表明利用UV-Vis光谱技术和酚红结合化学计量学方法建立多元定量校正模型快速分析培养过程样本的可行性。然而,所建立的定量校正模型为隐式模型[11, 19],是系统特异的,通常不可用于其他过程样本。因此,在该方法实际应用前,应保证校正集样本具有足够的代表性,模型经准确性、重复性、稳健性和传递性等性能验证,并建立模型适用性判据[10]后,才能真正应用于细胞培养过程样本的快速分析。
此外,可进一步探究,能否找到某种(或某些)不影响细胞培养过程的化学物质(如酚红),用于直接或间接反映待分析物“信号”,从而实现更多关注指标的在线检测。目前未见学者将该思路应用于哺乳动物细胞培养过程的在线监测,思路的可行性有待后续深入研究。
4 结论通过向无酚红成分的细胞培养液上清添加酚红,基于UV-Vis光谱技术,建立Gluc质量浓度、Lac质量浓度、Glu浓度、Gln浓度、VCD、TCD、Viability和Titer的多元校正模型。结果表明,Lac质量浓度、Glu浓度、VCD、TCD、Viability和Titer模型预测性能较好,Gluc质量浓度和Gln浓度模型预测性能差,方法具有一定的可行性。后续研究中,可考察酚红添加浓度对模型性能的影响,调整酚红添加浓度并继续提高校正集样本代表性,从而提高模型预测性能,以期为细胞培养过程多指标在线监测或离线快速分析提供可行方法。
| [1] |
MEHDIZADEH H, LAURI D, KARRY K M, et al. Generic Raman-based calibration models enabling real-time monitoring of cell culture bioreactors[J]. Biotechnology Progress, 2015, 31(4): 1004-1013. DOI:10.1002/btpr.2079 |
| [2] |
BHATIA H, MEHDIZADEH H, DRAPEAU D, et al. In-line monitoring of amino acids in mammalian cell cultures using Raman spectroscopy and multivariate chemometrics models[J]. Engineering in Life Sciences, 2018, 18(1): 55-61. DOI:10.1002/elsc.201700084 |
| [3] |
LI M, EBEL B, PARIS C, et al. Real-time monitoring of antibody glycosylation site occupancy by in situ Raman spectroscopy during bioreactor CHO cell cultures[J]. Biotechnology Progress, 2018, 34(2): 486-493. DOI:10.1002/btpr.2604 |
| [4] |
TULSYAN A, WANG T, SCHORNER G, et al. Automatic real-time calibration, assessment, and maintenance of generic Raman models for online monitoring of cell culture processes[J]. Biotechnology and Bioengineering, 2019, 117(2): 406-416. |
| [5] |
阎续, 沈丽娟, 胥文彦, 等. 拉曼光谱用于CHO细胞培养液多指标快速分析[J]. 高校化学工程学报, 2019, 33(4): 872-877. YAN X, SHEN L J, XU W Y, et al. Rapid analysis of multiple parameters of CHO cell culture media using Raman spectroscopy[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(4): 872-877. DOI:10.3969/j.issn.1003-9015.2019.04.013 |
| [6] |
严斌俊, 刘爽悦, 郭正泰, 等. 基于紫外光谱的丹红提取液质量快速分析技术[J]. 中国中药杂志, 2013(11): 1676-1678. YAN B J, LIU S Y, GUO Z T, et al. Application of ultraviolet spectroscopy for rapid analysis in extraction process of Danhong injection[J]. China Journal of Chinese Materia Medica, 2013(11): 1676-1678. |
| [7] |
ZHENG X, GONG X, LI Q, et al. Application of multivariate curve resolution method in the quantitative monitoring transformation of salvianolic acid a using online UV spectroscopy and mass spectroscopy[J]. Industrial and Engineering Chemistry Research, 2012, 51(8): 3238-3245. DOI:10.1021/ie201536y |
| [8] |
LEME J, FERNANDEZ NUNEZ E G, PARIZOTTO L D A, et al. A multivariate calibration procedure for UV/VIS spectrometric monitoring of BHK-21 cell metabolism and growth[J]. Biotechnology Progress, 2014, 30(1): 241-248. DOI:10.1002/btpr.1847 |
| [9] |
TAKAHASHI M B, LEME J, CARICATI C P, et al. Artificial neural network associated to UV/Vis spectroscopy for monitoring bioreactions in biopharmaceutical processes[J]. Bioprocess and Biosystems Engineering, 2015, 38(6): 1045-1054. DOI:10.1007/s00449-014-1346-7 |
| [10] |
褚小立. 近红外光谱分析技术实用手册[M]. 北京: 机械工业出版社, 2016. CHU X L. Practical manual for near infrared spectroscopy analytical technology[M]. Beijing: China Machine Press, 2016. |
| [11] |
WHELAN J, CRAVEN S, GLENNON B. In situ Raman spectroscopy for simultaneous monitoring of multiple process parameters in mammalian cell culture bioreactors[J]. Biotechnology Progress, 2012, 28(5): 1355-1362. DOI:10.1002/btpr.1590 |
| [12] |
ABU-ABSI N R, KENTY B M, CUELLAR M E, et al. Real time monitoring of multiple parameters in mammalian cell culture bioreactors using an in-line Raman spectroscopy probe[J]. Biotechnology and Bioengineering, 2011, 108(5): 1215-1221. DOI:10.1002/bit.23023 |
| [13] |
CRAVEN S, SHIRSAT N, WHELAN J, et al. Process model comparison and transferability across bioreactor scales and modes of operation for a mammalian cell bioprocess[J]. Biotechnology Progress, 2013, 29(1): 186-196. DOI:10.1002/btpr.1664 |
| [14] |
XU X, SMITH S, URBAN J, et al. An in line non-invasive optical system to monitor pH in cell and tissue culture[J]. Medical Engineering and Physics, 2006, 28(5): 468-474. DOI:10.1016/j.medengphy.2005.07.016 |
| [15] |
ANDRÉ S, CRISTAU L S, GAILLARD S, et al. In-line and real-time prediction of recombinant antibody titer by in situ Raman spectroscopy[J]. Analytica Chimica Acta, 2015, 892: 148-152. DOI:10.1016/j.aca.2015.08.050 |
| [16] |
ANDRÉ S, LAGRESLE S, DA SLIVA A, et al. Developing global regression models for metabolite concentration prediction regardless of cell line[J]. Biotechnology and Bioengineering, 2017, 114(11): 2550-2559. DOI:10.1002/bit.26368 |
| [17] |
KAMERZELL T J, ESFANDIARY R, JOSHI S B, et al. Protein-excipient interactions: Mechanisms and biophysical characterization applied to protein formulation development[J]. Advanced Drug Delivery Reviews, 2011, 63(13): 1118-1159. DOI:10.1016/j.addr.2011.07.006 |
| [18] |
PASQUINI C. Near infrared spectroscopy: A mature analytical technique with new perspectives-A review[J]. Analytica Chimica Acta, 2018, 1026: 8-36. DOI:10.1016/j.aca.2018.04.004 |
| [19] |
BUCKLEY K, RYDER A G. Applications of Raman spectroscopy in biopharmaceutical manufacturing: A short review[J]. Applied Spectroscopy, 2017, 71(6): 1085-1116. DOI:10.1177/0003702817703270 |




