2. 江西九环检测有限公司, 江西 九江 332005;
3. 江西省生态化工工程技术中心, 江西 九江 332005;
4. 九江市流域管理与生态保护重点实验室, 江西 九江 332005
2. Jiu-Huan Detection Co. Ltd., Jiujiang 332005, China;
3. Jiangxi Province Engineering Research Center of Ecological Chemical Industry, Jiujiang 332005, China;
4. Jiujiang Key Laboratory of Basin Management and Ecological Protection, Jiujiang 332005, China
印染废水成分复杂,可生化性差,吸附和高级氧化法常用于印染废水处理[1-3]。二氧化锰是一种普遍存在、环境友好的氧化物。隐钾锰矿型二氧化锰(KMn8O16,OMS-2)具有2×2隧道结构,混价锰(Mn3+和Mn4+)特性,以及晶格氧的流动性。OMS-2广泛应用于挥发性有机废气催化氧化[4-5]、CO选择性氧化[6]、锂离子电池阴极材料等[7]。在废水处理上,OMS-2不仅可以选择性地吸附废水中的重金属离子和放射性元素[8-9],还可以活化过硫酸盐、臭氧等强氧化剂去除水中的持久性有机污染物[10-15]。通常,二氧化锰的制备方法有水热法、微乳液法、液相氧化还原法、共沉淀法等,不同的制备方法对OMS-2中混价锰比例、比表面积、多孔性、疏水性有较大影响[10, 16-17]。其中,水热法制备的OMS-2具有良好的结晶度[18]、较小的晶粒尺寸和较高的活性氧种[19]。然而,基于水热合成法,研究不同锰源制备的OMS-2对印染废水的吸附脱色性能尚未见文献报道。因此,本研究分别采用硫酸锰、氯化锰和乙酸锰为还原剂(Mn2+源),高锰酸钾为氧化剂(Mn7+源),通过水热法制备了一系列OMS-2,以亚甲基蓝(methylene blue,MB)模拟废水为研究对象,考察不同锰源制备的OMS-2对MB的吸附性能,进而为印染废水的处理提供参考和借鉴。
2 实验(材料和方法) 2.1 实验材料高锰酸钾(KMnO4)、氯化锰(MnCl2)、乙酸锰(Mn(CH3COO)2)均购自天津大茂化学试剂厂,硫酸锰(MnSO4·2H2O)购自上海试剂二厂,亚甲基蓝(C16H18ClN3S)购自国药集团化学试剂有限公司,以上试剂均为分析纯,使用前未进行进一步的分离纯化。
2.2 OMS-2的制备OMS-2采用水热法制备。以乙酸锰和高锰酸钾制备OMS-2为例:按照反应物料中Mn2+与Mn7+的量比为5:3,称取适量乙酸锰和高锰酸钾分别溶于适量的去离子水中,将上述2种溶液转移到200 mL水热釜,混匀密封,置于120 ℃烘箱水热反应24 h后,取出抽滤,滤渣用去离子水洗涤3~4次,置于105 ℃烘箱干燥,所得黑色固体研磨装袋,置于干燥器中保存备用,标记为Cry-Acet。分别以硫酸锰和氯化锰替代乙酸锰,按照上述相同的方法制备OMS-2,标记为Cry-Sulf和Cry-Chlor。
2.3 表征扫描电子显微镜(SEM)在TESCAN VEGA Ⅱ LSU上进行,加速电压为20 kV。取少量粉末样品粘附在铜箔固定的碳纤维胶带上,喷金后采集图像。粉末X射线衍射(XRD)花样在BRUKER D8 ADVANCE衍射仪上采集。测试条件:Cu靶,入射波长λKa1=1.540 6 nm,加速电压为35 kV,加速电流为35 mA,扫描步长为0.02(°)·s-1,在2θ=10°~80°进行信号采集,样品的衍射花样用Jade 6.0分析。N2吸附/脱附和比表面积分析在Tristar Ⅱ 3020上进行。样品预先在300 ℃脱气2 h后进行测量。傅里叶红外光谱(FT-IR)在VERTEX 70上进行,扫描范围为4 000~400 cm-1,分辨率为2 cm-1。
2.4 MB模拟废水吸附试验用电子天平称取MB 8.0 mg溶于适量去离子水,定容到1 000 mL。取MB模拟废水100 mL于锥形瓶中,用盐酸或氢氧化钠溶液调节pH,加入适量待测样品,置于台式恒温振荡器中,在温度为298 K,转速为200 r·min-1下震荡吸附一定时间后,取2.0 mL上清液,用0.45 μm滤膜过滤,在664 nm下测定样品的吸光度,计算脱色率为
| $\eta {\rm{ = }}\frac{{{A_0} - A}}{{{A_0}}} \times 100\% $ |
式中:A0为原水的吸光度,A为吸附后水样的吸光度。
3 结果与讨论 3.1 SEM表征如图 1所示为3种不同锰源制备的OMS-2 SEM形貌。从图 1中可以看出,不同锰源制备的OMS-2外形均为棒状,呈无规则密堆积状态。由乙酸锰制备的OMS-2晶体比其他2种样品的晶体更加纤长。

|
图 1 不同锰源制备的OMS-2SEM图 Fig.1 SEM micrographs of OMS-2 prepared with different manganese compounds |
如图 2所示为不同锰源制备的OMS-2的衍射花样。由图 2可知,样品在2θ为17.9°、28.7°、37.5°、49.9°和60.1°处有明显的衍射峰,归属于隐钾锰矿结构(KMn8O16,JCPDS#29-1020)。但衍射峰强度不一样,以氯化锰为原料制备的Cry-Chlor衍射峰最强,以乙酸锰为原料制备的Cry-Acet衍射峰最弱,表明以乙酸锰制备的OMS-2的晶粒粒径较小。
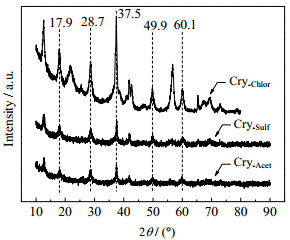
|
图 2 不同锰源制备的OMS-2 XRD Fig.2 XRD patterns of OMS-2 prepared with different manganese compounds |
通过N2-物理吸附脱附实验,测试了不同样品的比表面积SBET,结果如表 1所示。不同锰源制备的OMS-2的比表面积由大到小依次为:Cry-Acet > Cry-Chlor > Cry-Sulf。以乙酸锰为原料制备的OMS-2比表面积最大,这与XRD表征结果基本一致。
|
|
表 1 不同锰源制备的OMS-2的比表面积 Table 1 Specific surface areas of OMS-2 prepared with different manganese compounds |
如图 3所示为不同锰源制备的OMS-2红外谱图。从图 3中可以看出,3种样品在低波数466、530、710 cm-1均有强吸收峰,归属于隐钾锰矿中锰氧八面体骨架的振动峰[20],进一步证实所制备的产物为隐钾锰矿型,1 642 cm-1处的吸收峰归于隐钾锰矿孔道中的水分子的振动峰。3 432 cm-1附近的宽峰归属于隐钾锰矿表面羟基的伸缩振动吸收峰[21]。
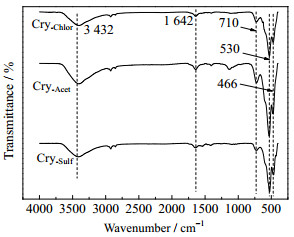
|
图 3 不同锰源制备的OMS-2 FT-IR Fig.3 FT-IR spectra of OMS-2 prepared with different manganese compounds |
如图 4所示为不同锰源制备的OMS-2对MB模拟废水的吸附性能。由图 4可知,当MB废水初始质量浓度为8 mg·L-1,初始pH=3.0,温度为298 K,吸附剂投加量为0.01%,转速为200 r·min-1时,在60 min的吸附时间内,3种OMS-2对MB模拟废水的脱色性能。测试样品对MB废水的脱色率由大到小依次为Cry-Acet > Cry-Chlor > Cry-Sulf。由乙酸锰制备的样品对MB模拟废水的脱色性能最好,60 min内水样的脱色率可达85.7%,而由硫酸锰制备的OMS-2对MB脱色性较差,在相同的测试条件下,对MB废水的脱色率仅为22.9%。MB为阳离子型化合物,在酸性溶液中,MB大多以分子形态存在[22],OMS-2表面─OH中的H原子与MB中电负性强的N原子配合,进而吸附MB到OMS-2表面[2]。结合BET表征结果,发现3种OMS-2对MB的脱色率与其比表面大小顺序是一致的。Cry-Acet比表面积最大,对MB有较强的吸附脱色能力。
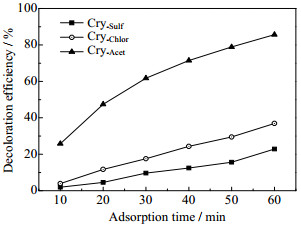
|
图 4 不同锰源制备的OMS-2对亚甲基蓝的吸附脱色性能 Fig.4 Decoloration efficiency of methylene blue wastewater by OMS-2 prepared with different manganese compounds |
如图 5所示为pH变化时,Cry-Acet对MB模拟废水的吸附脱色性能的影响。从图 5中可以看出,当MB废水初始浓度为8.0 mg·L-1,温度为298 K,Cry-Acet投加量为0.01%,转速为200 r·min-1时,在测试的pH范围内,随着pH的增加,Cry-Acet对MB模拟废水的脱色率逐渐降低。Cry-Acet在酸性条件下对MB的脱色率显著高于碱性条件,且模拟废水的酸性越强,Cry-Acet对MB脱色性能更为显著。通常,MnO2表面同时存在不同性质的酸性和碱性─OH官能团[23],且随着溶液pH下降,Cry-Acet表面质子化倾向增强[24],MB中的二甲氨基也会发生质子化[1],有利于Cry-Acet表面羟基中的H原子与MB中的电负性强的N原子结合,在Cry-Acet表面形成化学吸附。因此,当溶液pH较低时,Cry-Acet对MB的脱色率较高。但过低pH(pH < 3.0)可能会造成OMS-2中Mn的溶出[2]。当溶液的pH增大至碱性时,MB中的二甲氨基去质子化后荷正电,与Cry-Acet表面荷负电的氧原子静电吸附加强,对MB的吸附量重新增加,因此,当溶液pH=9时,Cry-Acet对模拟废水的脱色率反而略有增加。
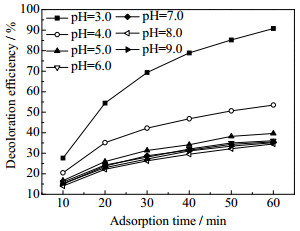
|
图 5 不同pH时Cry-Acet对MB模拟废水的脱色性能 Fig.5 Decoloration efficiency of MB wastewater by Cry-Acet under different pH |
如图 6所示为温度变化时,Cry-Acet对MB吸附效率的影响。由图 6可知,当MB废水初始浓度为8.0 mg·L-1,初始pH=3.0,Cry-Acet投加量为0.01%,转速为200 r·min-1,反应温度从298上升到318 K时,Cry-Acet对MB脱色率随着吸附温度的上升而增加,表明MB在Cry-Acet上的吸附具有化学吸附的特征,这与前面的分析结果是一致的。
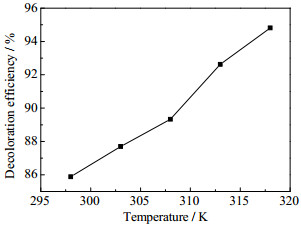
|
图 6 温度对Cry-Acet吸附MB的影响 Fig.6 Effects of temperature on MB adsorption by Cry-Acet |
配制质量浓度为4.8、6.4、8.0、9.6、11.2 mg·L-1系列MB模拟废水,分别投加0.01% 的Cry-Acet,在pH=3.0,298 K,200 r·min-1下振荡吸附60 min后,取样,样品用0.45 μm滤膜过滤后测定其吸光度,通过MB工作曲线计算Cry-Acet上的平衡吸附量qe,分别采用Langmuir(qm为吸附剂最大吸附量,mg·g-1;KL为吸附常数,L·g-1;Ce为吸附平衡时水中吸附质浓度,R2为相关系数)、Freundlich(KF为吸附容量参数,n为经验常数)、Temkin(R为摩尔气体常数,R=8.314 J·(mol·K)-1;T为热力学温度;B为与吸附热有关的常数;A为最大结合能时平衡结合常数)、Dubinin-Radushkevich(b为吸附平均自由能常数,ɛ为Polanyi吸附势,E为平均吸附自由能)吸附等温线进行拟合,结果如表 2所示。
|
|
表 2 MB在Cry-Acet上的吸附等温线参数 Table 2 Isotherm parameters of MB adsorption by Cry-Acet |
由表 2可知,MB在Cry-Acet上的吸附过程与Langmuir吸附等温式吻合较好,R2为0.98,最大吸附量qm可达289.6 mg·g-1。优于其他方法制备的锰氧化物吸附剂对MB的吸附性能(见表 3)。MB的分子尺寸为1.43 nm×0.61 nm×0.4 nm[25-26],而OMS-2的八面体双链组成的隧道尺寸为0.46 nm×0.46 nm[15],故MB不能进入OMS-2的孔道内部,表明MB在Cry-Acet上的吸附并不是孔道填充过程,OMS-2孔道内部的─OH基团不起作用,只能与外表面活性─OH基团形成化学吸附而去除[24],这与前面分析结果是一致的。
|
|
表 3 不同方法制备的氧化锰吸附剂对MB吸附性能比较 Table 3 Comparison of MB adsorption by manganese oxide adsorbents prepared with different methods |
如图 7所示为Cry-Acet投加量对MB吸附的影响。由图 7可知,当MB废水初始质量浓度为8.0 mg·L-1,初始pH=3.0,温度为298 K,转速为200 r·min-1时,随着Cry-Acet投加量从0.01% 增加到0.07%,Cry-Acet对MB模拟废水的脱色率从86.6% 增加到99.7%。当Cry-Acet投加量达到0.02%时,在60 min吸附时间内,Cry-Acet对MB的脱色率可达97.9%,进一步增加吸附剂用量对MB的脱色率提升不明显,因此,在测试条件下,0.02% Cry-Acet投加量比较经济合理。
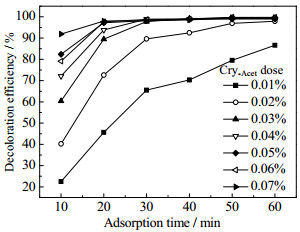
|
图 7 Cry-Acet投加量对MB吸附的影响 Fig.7 Effects of Cry-Acet dosage on MB adsorption |
以不同锰源为原料,制备了3种OMS-2,并对MB模拟废水进行吸附脱色实验,主要结论如下:
(1) 以不同锰源制备的OMS-2为隐钾锰矿型,棒状形貌,但比表面积不同,以乙酸锰为原料制备的OMS-2(Cry-Acet)比表面积最大;
(2) 不同锰源制备的OMS-2对MB模拟废水吸附脱色性能显著不同,Cry-Acet对模拟废水脱色性能最好,在测试条件下,脱色率可达85.7%;
(3) 酸性条件有利于Cry-Acet对MB模拟废水的脱色,MB在Cry-Acet上的吸附过程符合Langmuir等温式,在温度为298 K下,pH=3.0,吸附剂投加量为0.01% 时,对MB的最大吸附量可达289.6 mg·g-1。
| [1] |
生森森, 刘佳祥, 李卓. 金属有机框架材料UiO-66-(COOH)2吸附去除染料废水中的亚甲基蓝和罗丹明B[J]. 西安交通大学学报, 2020, 54(9): 180-188. SHENG S S, LIU J X, LI Z. Adsorption and removal of methylene blue and rhodamine B from dye wastewater by metal-organic framework UiO-66-(COOH)2[J]. Journal of Xi'an Jiaotong University, 2020, 54(9): 180-188. |
| [2] |
张程蕾, 韩恩山, 滕厚开, 等. MnO2/Gh的制备及对亚甲基蓝的降解研究[J]. 工业水处理, 2020, 40(5): 44-48. ZHANG C L, HAN E S, TENG H K, et al. Study on preparation of MnO2/Gh and its degradation of methylene blue[J]. Industrial Water Treatment, 2020, 40(5): 44-48. |
| [3] |
龚新怀, 李明春, 杨坤, 等. 纳米Fe3O4@茶渣/海藻酸钙磁性复合材料制备及其对亚甲基蓝的吸附性能与吸附机制[J]. 复合材料学报, 2021, 38(2): 424-438. GONG X H, LI M C, YANG K, et al. Preparation of nano-Fe3O4@tea waste/calcium alginate magnetic composited bead and it's adsorption characteristics and mechanisms for methylene blue from aqueous solution[J]. Acta Materiae Compositae Sinica, 2021, 38(2): 424-438. |
| [4] |
NI C L, HOU J T, LI L, et al. The remarkable effect of alkali earth metal ion on the catalytic activity of OMS-2 for benzene oxidation[J]. Chemosphere, 2020, 250: 126211. DOI:10.1016/j.chemosphere.2020.126211 |
| [5] |
SANTOS D F M, SOARES O S G P, FIGUEIREDO J L, et al. Preparation of ceramic and metallic monoliths coated with cryptomelane as catalysts for VOC abatement[J]. Chemical Engineering Journal, 2020, 382: 122923. DOI:10.1016/j.cej.2019.122923 |
| [6] |
DAVO-QUINONERO A, SUCH-BASANEZ I, JUAN-JUAN J, et al. New insights into the role of active copper species in CuO/cryptomelane catalysts for the CO-PROX reaction[J]. Applied Catalysis B: Environmental, 2020, 267: 118372. DOI:10.1016/j.apcatb.2019.118372 |
| [7] |
YANG S Z, TALLMAN K R, LIU P, et al. The effects of vanadium substitution on one-dimensional tunnel structures of cryptomelane: Combined TEM and DFT study[J]. Nano Energy, 2020, 71: 104571. DOI:10.1016/j.nanoen.2020.104571 |
| [8] |
YIN L, HU B W, ZHUANG L, et al. Synthesis of flexible cross-linked cryptomelane-type manganese oxide nanowire membranes and their application for U(Ⅵ) and Eu(Ⅲ) elimination from solutions[J]. Chemical Engineering Journal, 2020, 381: 122744. DOI:10.1016/j.cej.2019.122744 |
| [9] |
LIU L H, PENG Q C, QIU G C, et al. Cd2+ adsorption performance of tunnel-structured manganese oxides driven by electrochemically controlled redox[J]. Environmental Pollution, 2019, 244: 783-791. DOI:10.1016/j.envpol.2018.10.062 |
| [10] |
LI X X, ZOU Q C, WEI Y, et al. Graphite assisted room-temperature synthesis of structurally defected OMS-2 nanorods for peroxymonosulfate activation[J]. Applied Surface Science, 2019, 497: 143770. DOI:10.1016/j.apsusc.2019.143770 |
| [11] |
LIU J, KE L J, LIU J, et al. Enhanced catalytic ozonation towards oxalic acid degradation over novel copper doped manganese oxide octahedral molecular sieves nanorods[J]. Journal Hazardous Materials, 2019, 371: 42-52. DOI:10.1016/j.jhazmat.2019.02.094 |
| [12] |
WEI J, LI X M, YANG Q, et al. Sulfate radical-mediated degradation of phenol and methylene blue by manganese oxide octahedral molecular sieve (OMS-2) activation of peroxymonosulfate[J]. Environmental Science and Pollution Research, 2019, 26(13): 12963-12974. DOI:10.1007/s11356-019-04749-3 |
| [13] |
YE P, WANG M Y, WEI Y, et al. Mechanochemical formation of highly active manganese species from OMS-2 and peroxymonosulfate for degradation of dyes in aqueous solution[J]. Research Chemical Intermediates, 2019, 45(3): 935-946. DOI:10.1007/s11164-018-3653-0 |
| [14] |
WANG M Y, WEI Y, ZOU Q C, et al. Tuning manganese (Ⅲ) species in manganese oxide octahedral molecular sieve by interaction with carbon nanofibers for enhanced pollutant degradation in the presence of peroxymonosulfate[J]. Journal of Colloid and Interface Science, 2019, 536: 271-280. DOI:10.1016/j.jcis.2018.10.055 |
| [15] |
YE P, ZOU Q C, AN L Y, et al. Room-temperature synthesis of OMS-2 hybrids as highly efficient catalysts for pollutant degradation via peroxymonosulfate activation[J]. Journal of Colloid and Interface Science, 2019, 535: 481-490. DOI:10.1016/j.jcis.2018.10.019 |
| [16] |
WANG C X, MA J Z, LIU F D, et al. The effects of Mn2+ precursors on the structure and ozone decomposition activity of cryptomelane-type manganese oxide (OMS-2) catalysts[J]. The Journal of Physical Chemistry C, 2015, 119(40): 23119-23126. DOI:10.1021/acs.jpcc.5b08095 |
| [17] |
GHALY M, EL-SHERIEF E A, METWALLY S S, et al. Utilization of nano-cryptomelane for the removal of cobalt, cesium and lead ions from multicomponent system: Kinetic and equilibrium studies[J]. Journal Hazardous Materials, 2018, 352: 1-16. DOI:10.1016/j.jhazmat.2018.03.020 |
| [18] |
ZHANG Q L, LIU Q X, NING P, et al. Performance and kinetic study on Pd/OMS-2 catalyst for CO catalytic oxidation: Effect of preparation method[J]. Research Chemical Intermediates, 2017, 43(4): 2017-2032. DOI:10.1007/s11164-016-2743-0 |
| [19] |
DENG Y Q, ZHANG T, AU C T, et al. Oxidation of p-chlorotoluene to p-chlorobenzaldehyde over manganese-based octahedral molecular sieves of different morphologies[J]. Catalysis Communications, 2014, 43: 126-130. DOI:10.1016/j.catcom.2013.09.026 |
| [20] |
LI Y Z, FAN Z Y, SHI J W, et al. Modified manganese oxide octahedral molecular sieves M'-OMS-2 (M'=Co, Ce, Cu) as catalysts in post plasma-catalysis for acetaldehyde degradation[J]. Catalysis Today, 2015, 256(Part 1): 178-185. |
| [21] |
TIAN H, HE J H, ZHANG X D, et al. Facile synthesis of porous manganese oxide K-OMS-2 materials and their catalytic activity for formaldehyde oxidation[J]. Microporous Mesoporous Materials, 2011, 138(1/2/3): 118-122. |
| [22] |
姜侠, 王冠, 刘振华, 等. 改性活性炭对亚甲基蓝的吸附性能及机理[J]. 水处理技术, 2020, 46(6): 76-82. JIANG X, WANG G, LIU Z H, et al. Adsorption performance and mechanism of methylene blue by the modified activated carbon[J]. Technology of Water Treatment, 2020, 46(6): 76-82. |
| [23] |
MALLOY A P, BROWNING G J, DONNE S W. Surface characterization of heat-treated electrolytic manganese dioxide[J]. Journal of Colloid and Interface Science, 2005, 285(2): 653-664. DOI:10.1016/j.jcis.2004.12.030 |
| [24] |
赵颖, 王仁国, 曾武, 等. 纳米二氧化锰的制备及其对亚甲基蓝的吸附研究[J]. 水处理技术, 2012, 38(1): 55-58. ZHAO Y, WANG R G, ZENG W, et al. Preparation of nano-MnO2 and adsorption of methylene blue[J]. Technology of Water Treatment, 2012, 38(1): 55-58. DOI:10.3969/j.issn.1000-3770.2012.01.012 |
| [25] |
LIU Q S, ZHENG T, LI N, et al. Modification of bamboo-based activated carbon using microwave radiation and its effects on the adsorption of methylene blue[J]. Applied Surface Science, 2010, 256(10): 3309-3315. DOI:10.1016/j.apsusc.2009.12.025 |
| [26] |
PELEKANI C, SNOEYINK V L. Competitive adsorption between atrazine and methylene blue on activated carbon: The importance of pore size distribution[J]. Carbon, 2000, 38(10): 1423-1436. DOI:10.1016/S0008-6223(99)00261-4 |
| [27] |
HE Y, JIANG D B, CHEN J, et al. Synthesis of MnO2 nanosheets on montmorillonite for oxidative degradation and adsorption of methylene blue[J]. Journal of Colloid and Interface Science, 2018, 510: 207-220. DOI:10.1016/j.jcis.2017.09.066 |
| [28] |
ASFARAM A, GHAEDI M, HAJATI S, et al. Ternary dye adsorption onto MnO2 nanoparticle-loaded activated carbon: Derivative spectrophotometry and modeling[J]. RSC Advances, 2015, 5(88): 72300-72320. DOI:10.1039/C5RA10815B |
| [29] |
ZHAI R, WAN Y Z, LIU L, et al. Hierarchical MnO2 nanostructures: Synthesis and their application in water treatment[J]. Water Science and Technology, 2012, 65(6): 1054-1059. DOI:10.2166/wst.2012.925 |
| [30] |
WU R, QU J, CHEN Y. Magnetic powder MnO-Fe2O3 composite-a novel material for the removal of azo-dye from water[J]. Water Research, 2005, 39(4): 630-638. DOI:10.1016/j.watres.2004.11.005 |




