2. 四川泛宇锂能新材料科技有限公司, 四川 成都 610000
2. Fanyulineng New Material Technology Co. Ltd., Chengdu 610000, China
锂作为重要的稀有金属资源,在医药、新能源、航空航天材料等领域应用广泛[1-2]。近年来,随着锂电池在便携式电子设备、电动交通工具和电网储电方面的大量使用,锂产品的需求量急剧上升[3-4]。矿石提锂工艺流程复杂、成本高、污染大,已不能满足我国对锂的需求量,盐湖锂占全球总锂资源的79%,因此从盐湖提锂已成为目前锂行业研究的热点[5-7]。
然而,传统的沉淀法、溶剂萃取法和浸渍法等不适用于从低锂浓度的盐湖卤水中提取锂[8]。锂离子筛(LIS)作为一种有效的从盐湖卤水中提取锂离子的吸附剂,由于其吸附量大、经济效益好、污染小等显著优势而受到研究者的广泛关注[9]。目前研究的锂离子筛型吸附剂材料主要有锰锂氧化物(LiMn2O4、Li1.1Mn1.9O4、Li1.33Mn1.67O4、Li1.6Mn1.6O4、Li4Mn5O12)[10-13]和钛锂氧化物(Li2TiO3、Li4Ti5O12)等[14-19]。锰系吸附剂具有吸附容量大、吸附效率高等优点,但该类吸附材料耐酸碱性能较差、溶损率较高,不适宜用于碱性卤水提锂。钛系吸附剂具有吸附容量大、耐酸碱性能好、对锂吸附选择性高等优点,尤其适用于碱性卤水提锂[20-22]。
目前,偏钛酸锂离子筛存在的问题是其内部结构致密,传质孔道狭窄,扩散阻力大,不利于Li+从中嵌入和脱吸,极大地影响了其应用[22-24]。在钛锂氧化物电极材料研究领域,一些阳离子被掺入(包括Co2+、Ni2+、Cr3+、Mg2+、Al3+)[25-28]用于提高电化学性能,而偏钛酸锂离子筛的相关研究很少。本研究将Ce掺入偏钛酸锂离子筛中,研究了其对吸附性能的影响,结果表明掺铈偏钛酸型锂离子筛的吸附效率比未掺铈的显著提高。进一步地,对偏钛酸型锂离子筛的吸附机理进行了较深入的研究,探讨了偏钛酸锂型锂离子筛实际吸附容量远低于理论吸附容量的原因,同时,为偏钛酸型离子筛掺杂Ce元素可提高锂吸附效率的现象提供了微观解释。
2 实验部分 2.1 主要试剂和仪器试剂:二氧化钛(锐钛型),分析纯(AR),99.0%;硝酸铈,AR,99.0%;碳酸锂,AR,99.0%,硫酸,AR,95.0%~98.0%,均为质量分数。
仪器:D/MAX-IIICX射线衍射仪,日本理学公司;ZEISS sigma 500场发射扫描电镜,德国蔡司公司;Mastersizer 200激光粒度仪,英国马尔文公司;Thermo Fisher K-Alpha X射线光电子能谱仪,美国赛默飞公司;iCAP PRO XP ICP-OES电感耦合等离子发射光谱仪,美国赛默飞公司;AA-6800原子吸收分光光度计,日本岛津公司。
2.2 制备掺铈锂离子筛将碳酸锂、二氧化钛和氧化铈按物质的量比2.1:(1−x): x (x=0.05,0.06,0.07,0.08)配料,加入适量乙醇溶液,搅拌混合1 h,90 ℃下烘干,干燥物经粉碎机粉碎后,置于马弗炉,在空气氛下按10 ℃⋅min−1升温至750 ℃煅烧,冷却,研磨,得到掺杂偏钛酸锂前驱体Li2Ti1-xCexO3,命名为LTO-Ce。对比样Li2TiO3(命名为LTO)的制备条件同上。将适量制得的前驱体LTO-Ce和LTO,分别置于浓度为0.2 mol⋅L−1硫酸溶液中搅拌24 h,浸出其中的锂离子,得到了H2Ti0.94Ce0.06O3(HTO-Ce)和H2TiO3(HTO)离子筛。
2.3 锂离子筛吸附性能研究 2.3.1 饱和吸附容量配制Li+质量浓度为300 mg⋅L−1的氯化锂溶液,用氯化铵缓冲溶液调节溶液pH=10,加入5.0 g锂离子筛,在25 ℃振荡吸附,直到溶液中的锂浓度保持不变,饱和吸附容量由式(1)计算:
| $ {Q_{\rm{e}}} = \frac{{\left( {{\rho _{{\rm{0, Li}}}} - {\rho _{{\rm{e, Li}}}}} \right) \times V}}{m} $ | (1) |
式中:Qe (mg⋅g−1)为每克锂离子筛的饱和吸附容量,
将HTO-Ce和HTO离子筛应用于真实卤水提锂。所用原料卤水取自中国西藏扎仓茶卡盐湖Ⅱ湖晶间卤水(冬季取样),pH为7.5,主要成分见表 1。
|
|
表 1 扎仓查卡盐湖卤水组成(冬季取样) Table 1 Composition of brine from Zhacang Chaka Salt Lake (sampled in winter) |
配制含多种阳离子(Li+、Na+、K+、Mg2+和Ca2+)的溶液1 L,每种阳离子的浓度为0.055 mol⋅L−1,将10 g锂离子筛加入溶液,振荡24 h,静置后取样,分析各阳离子含量。离子分配系数Kd和分离因数β的计算式分别为如式(2)、(3)。
| $ {K_{\rm{d}}} = \frac{{\left( {{\rho _{{\rm{0, b}}}} - {\rho _{{\rm{e, b}}}}} \right) \times V}}{{m \times {\rho _{{\rm{e, b}}}}}} $ | (2) |
| $ \beta _N^{{\rm{Li}}} = \frac{{{K_{\rm{d}}}\left( {{\rm{Li}}} \right)}}{{{K_{\rm{d}}}\left( N \right)}}$ | (3) |
式中:
取适量的离子筛与卤水(离子筛质量与卤水体积的关系为16 g: 1 L),采用质量分数为3% 的NaOH调节pH在8左右,振荡吸附4 h后用去离子水冲洗滤饼,收集滤液和洗水测定锂浓度。加入300 mL浓度为0.2 mol⋅L−1的硫酸进行解吸,解吸时间3 h,解吸结束后用去离子水清洗滤饼,收集滤液和洗水测定锂浓度。按上述步骤循环20次。
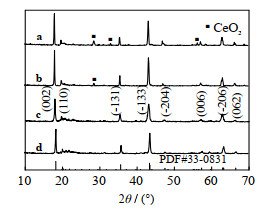
3 结果与讨论 3.1 掺铈钛系锂离子筛的表征如图 1所示为不同掺铈比例(化学计量数) Li2TiO3的XRD图谱。图中,在煅烧时间为16 h,温度750 ℃的条件下,当Ce的化学计量数为0.05、0.06时,样品的峰型较好,说明铈充分融合到偏钛酸锂晶格。当Ce的化学计量数为0.07、0.08时,谱图上不同程度地出现了CeO2的特征峰,说明过多的铈元素不能融入偏钛酸锂晶格。另外,不同掺杂比例下的样品的XRD特征峰都整体向低角度不同程度地偏移了一定距离,表明掺杂使晶胞体积扩大。
|
图 1 不同掺铈比例Li2TiO3的XRD图谱 Fig.1 XRD patterns of Li2TiO3 under different doping ratios of Ce a. 0.08 b. 0.07 c. 0.06 d. 0.05 |
采用Jade软件对不同铈的化学计量数下合成样品的晶格参数进行理论计算,结果见表 2。从表中看到,当Ce的化学计量数从0.05提高到0.07,样品的结晶度和晶胞体积都增加;但当Ce的化学计量数大于0.07后,结晶度和晶胞体积增量不明显。另外,随Ce的化学计量数提高,样品的吸附容量也在增大,但当Ce的化学计量数从0.07增加到0.08时,吸附容量变化不大。综合考虑,选择Ce的化学计量数为0.06较合适。
|
|
表 2 不同掺铈比例样品的晶格参数及吸附容量Qe Table 2 Lattice parameters and Qe of Ce-doped Li2TiO3 synthesized under different doping ratios |
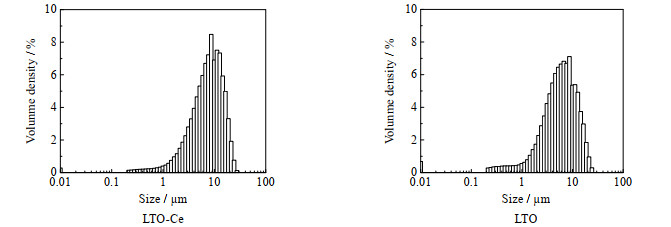
LTO-Ce和LTO的粒度分布见图 2。从图中看到LTO-Ce和LTO的粒度范围接近,主要在1~20 μm,粒度分布曲线的峰型也相似,都属于正态分布曲线。对粒度分布曲线进行分析,得到相关参数见表 3。从表中看到,LTO-Ce的中值粒径D50为8.273 μm,约比LTO的中值粒度大2 μm,表明Ce掺杂后LTO的粒径稍微长大,这和XRD结果一致。
|
图 2 偏钛酸锂样品粒度分布 Fig.2 Particle size distribution of lithium metatitanate samples |
|
|
表 3 偏钛酸锂样品的粒度分布参数 Table 3 Particle size distribution parameters of lithium metatitanate samples |
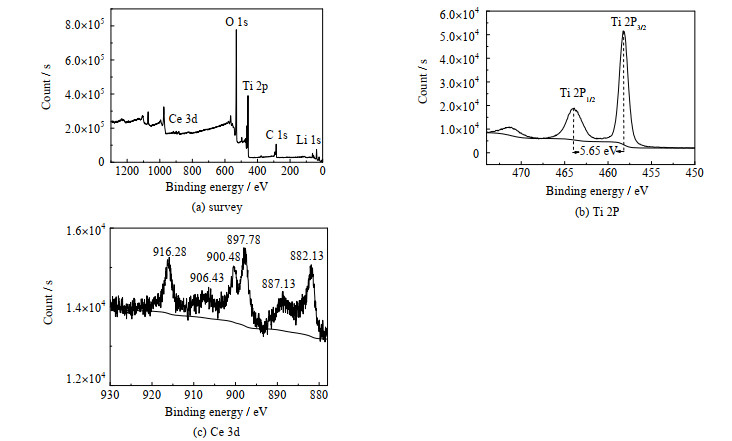
采用XPS仪器对Li2Ti0.94Ce0.06O3样品表面上元素价态进行分析,XPS谱图见图 3。从图 3(a)看到,样品表面的主要元素有Li、Ti、O和Ce,其中Ti 2p峰由Ti 2p1/2和Ti 2p3/2两个峰组成(图 3(b)),峰间距5.65 eV,表明Ti4+为Ti元素的主导价态。Ce 3d峰(图 3(c))主要由6个小峰组成,因此Ce4+为Ce元素的主导价态。这说明原料硝酸铈中的Ce3+经过合成反应已经转化为Ce4+。
|
图 3 Li2Ti0.94Ce0.06O3的XPS谱图 Fig.3 XPS spectra of Li2Ti0.94Ce0.06O |
将所制备的Li2Ti0.94Ce0.06O3样品溶解后,用原子吸收分光光度计进行元素分析,结果见表 4,表中wB为质量分数。从表 4可以看到样品中Li、Ti、Ce的质量分数分别为12.52%、37.86% 和6.92%,接近理论值12.04%、39.03%、7.29%。结合XRD,粒度测试等分析,表明所制备的样品为目标产物。
|
|
表 4 偏钛酸锂样品的元素含量 Table 4 Elemental contents of lithium metatitanate samples |
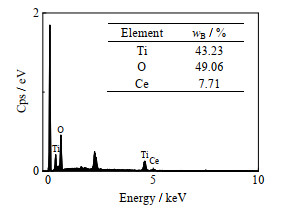
图 4为所制备的HTO-Ce的SEM图像以及O、Ti、Ce的EDS元素映射。从映射图像可以看出,各元素在HTO-Ce中分布均匀。图 5为HTO-Ce的EDS元素含量分析结果,由图 5可见,HTO-Ce中的Ce的质量分数(7.71 %)与理论计算结果(8.13%)相差不大。

|
图 4 HTO-Ce的SEM图像和O、Ti、Ce的元素映射 Fig.4 SEM microraph and O, Ti and Ce elemental mapping results of HTO-Ce |
|
图 5 HTO-Ce的EDS结果 Fig.5 EDX result of HTO-Ce |
由表 5可见,HTO和HTO-Ce的吸附容量均随时间延长而增加,最后趋于稳定。HTO-Ce的吸附容量在3 h就达到21 mg⋅g−1,而HTO的吸附容量需经过8 h才达到21 mg⋅g−1,说明HTO-Ce的吸附速率明显快于HTO。HTO的饱和吸附容量为29.74 mg⋅g−1,HTO-Ce的饱和吸附容量为32.53 mg⋅g−1 (比HTO的饱和吸附容量提高9.4%)。因此,HTO-Ce吸附速率和吸附容量均好于传统HTO吸附剂,说明掺铈后偏钛酸型离子筛的孔道结构明显改善,Li+的传质效率提高。
|
|
表 5 HTO和HTO-Ce的吸附容量与时间关系 Table 5 Relationship between adsorption capacity of HTO and HTO-Ce at different times |
图 6为溶液pH与吸附容量的关系图。从图中可以看到,吸附平衡时溶液pH对吸附容量有较大影响,随着pH的升高,HTO和HTO-Ce的吸附容量都提高。HTO对pH的变化更敏感,然而,HTO-Ce对pH的依赖性降低,在pH=8时,吸附容量已达到30.3 mg⋅g−1,比相同条件下HTO的吸附容量提高18.8%,继续升高pH到10,吸附容量增至32.5 mg⋅g−1,之后吸附容量变化不明显。从以上实验数据可以看到,偏钛酸型离子筛经过Ce掺杂改性后,因其晶体孔道扩大,锂离子的传质阻力更小,因此对溶液pH的依赖性减弱,在pH=8~10即可达到较高的吸附容量。这对镁含量较高的卤水提锂有益。
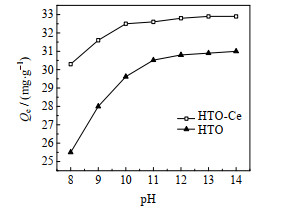
|
图 6 溶液pH与吸附容量关系图 Fig.6 Relationship between solution pH and adsorption capacity |
HTO-Ce离子筛对各阳离子的选择性吸附实验结果,见表 6。从表中看到,HTO-Ce对Li+具有优异选择性,其选择性次序为Li+ > > Mg2+ > Na+ > K+ > Ca2+,能将Li+从多种阳离子混合液中高选择性地分离出来,产生这种现象的原因有两个,一是Na+(0.102 nm)、K+(0.138 nm)、Ca2+(0.100 nm)的半径均大于Li+(0.074 nm)的半径,使得这些阳离子很难克服空间位阻效应进入晶格位点;二是虽然Mg2+半径(0.072 nm)与Li+的半径接近,但是Mg2+的水合自由能(ΔG0h = −1 980 kJ⋅mol−1)远大于Li+水合自由能(ΔG0h = −475 kJ⋅mol−1),致使Mg2+脱水进入吸附剂内部需要更多的能量,从而降低了离子筛对Mg2+的选择性。HTO-Ce离子筛对Li+的饱和吸附容量达到30.7 mg⋅g−1,该值比使用纯锂溶液的饱和吸附容量32.53 mg⋅g−1低,考虑是杂质阳离子的干扰作用。
|
|
表 6 HTO-Ce对阳离子的吸附容量和分离效果 Table 6 Cation adsorption capacity and separation effects of HTO-Ce |
以西藏扎仓茶卡盐湖原卤水为原料(主要组成见表 1),进行20次寿命实验。实验结果见表 7。从表 7看到,经过20次循环,HTO-Ce对原料卤水中Li+的平均吸附率为83.4%,平均吸附容量稳定在23.45 mg⋅g−1;平均解吸率为99.5%,表明吸附剂上负载的Li+被充分解吸;解吸液锂浓度为747.29 mg⋅L−1,是卤水原料锂浓度的1.66倍,表明卤水中的Li+被有效地分离和回收。
|
|
表 7 吸附-解吸循环实验数据 Table 7 Experimental data of adsorption-desorption cycles |
研究发现即使在最佳操作条件,H2TiO3的实验吸附容量比理论吸附容量低很多。Hosogi等[29]用300 ℃熔融态的AgNO3处理Li2TiO3,发现Ag+只能和Li层的Li+交换,不能在LiT2层与Li+交换,表明在Li层的Li+的活性要高于在LiTi2层Li+的活性。因此,在酸浸过程中,H+首先和Li层的Li+发生置换,形成H[Li1/3Ti2/3]O2,接下来H+才和LiTi2层中的Li+进行置换,最终形成H[H1/3Ti2/3]O2。此时最大吸附容量远小于理论吸附容量(126 mg⋅g−1)。Zhang等[23]认为Li+偏离子键,H+偏共价键,Li+和H+的置换过程非原位替换,导致实际锂吸附容量低于理论吸附容。然而,造成吸附剂吸附容量低的具体原因还没有较统一的解释。由于HTO结构致密,传质孔道狭窄,导致锂离子吸附解吸速度比较慢,极大地影响了其应用。经过掺杂Ce元素的LTO-Ce的晶格扩大,达到提高H/Li传质效率的目的,HTO-Ce饱和吸附容量达到理论值(120.4 mg⋅g−1)的27.1%,比HTO的饱和吸附容量提高9.4%。
4.1 吸附热力学研究参考毕参参[30]的实验方法,绘制吸附等温线如图 7所示,图中xs(Li+)、xL(Li+)分别为固相、液相中Li+的摩尔分数。从图 7中看到,不同温度下,HTO-Ce的等温线均位于对角线之上,表明HTO-Ce对锂离子选择系数大于1。等温线偏离对角线的程度越大,吸附剂对锂离子的选择性越好。从图中看到,随温度升高,等温线偏离对角线的程度增大,说明升温有利于离子交换反应进行。
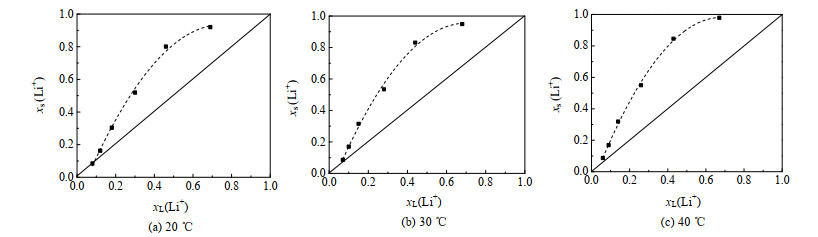
|
图 7 HTO-Ce的吸附等温线 Fig.7 Adsorption isotherm of HTO-Ce |
本实验首先考察吸附容量随时间变化的规律。将HTO和HTO-Ce分别加入氯化锂溶液(pH=10),在25 ℃水浴中振荡吸附,设定不同时间间隔取样分析锂含量,计算吸附容量,绘制的吸附容量-时间曲线见图 8。从图中看到,随吸附时间延长,HTO和HTO-Ce的吸附容量都增加,前4 h曲线较陡,表明吸附容量增速较快,4 h后曲线变平缓,吸附速率降低。在相同吸附时间,HTO-Ce的吸附容量均比HTO高,说明HTO-Ce对Li+的吸附性能好于传统HTO吸附剂。
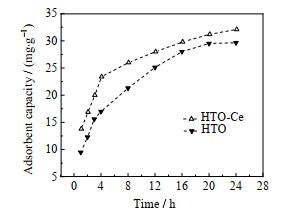
|
图 8 HTO和HTO-Ce的吸附动力学曲线 Fig.8 Adsorption kinetic curves of HTO and HTO-Ce |
本实验采用缩核模型中液膜扩散控制(FDC)和颗粒扩散控制(PDC)对吸附剂的动力学行为进行研究 [31]。结合图 8数据进行作图,见图 9。图中,F为转化率,F=Qt/Qe(Qt为某时刻吸附剂的吸附容量,mg⋅g−1)。由图 9可得到相应控制步骤下的拟合速率方程,见表 8。

|
图 9 HTO和HTO-Ce的动力学拟合曲线 Fig.9 Kinetic fitting curves of HTO and HTO-Ce |
|
|
表 8 HTO和HTO-Ce的动力学曲线拟合方程 Table 8 Fitting equations of kinetic curves for HTO and HTO-Ce |
从图 9和表 8可知,HTO和HTO-Ce的吸附动力学模型与PDC模型吻合度最高,R2 > 0.98,表明HTO和HTO-Ce的吸附过程主要受颗粒内扩散控制。由此可见,在相同吸附条件下,HTO-Ce的颗粒扩散系数要比HTO的颗粒扩散系数大,表明掺杂有利于提高离子交换速率。其原因是掺杂元素将晶格孔道扩大,有利于Li+/H+离子交换反应的进行,从而提高传质速率,在更短的时间达到较高的吸附容量。
5 结论(1) 以高温固相法合成了掺铈型偏钛酸锂离子筛前驱体,并对其进行SEM、XRD、XPS等表征,结果表明掺铈有利于扩大晶格参数,提高结晶度和晶胞体积,达到改善结晶传质孔道的目的。
(2) 所制备的HTO-Ce具有较高的饱和吸附容量为32.53 mg⋅g−1,在pH=8~10即可达到良好的吸附效果,对Li+的选择性远大于Na+、K+、Mg2+和Ca2+。经过20次的循环实验,HTO-Ce对Li+的吸附率保持在80% 以上,其晶体结构和新鲜离子筛保持一致,具有极高的稳定性。
(3) 热力学分析表明,HTO-Ce的吸附过程中升高温度有利于反应的自发进行。动力学实验结果显示,HTO和HTO-Ce的吸附动力学模型与PDC模型吻合,属于颗粒扩散控制。在相同吸附条件下,HTO-Ce的颗粒扩散系数要比HTO的颗粒扩散系数大,表明掺杂铈有利于提高离子交换速率。
| [1] |
流颖, 曾德文, 陈驰, 等. 卤水提锂吸附剂应用研究进展[J]. 无机盐工业, 2019, 51(3): 16-19. LIU Y, ZENG D W, CHEN C, et al. Research progress in application of absorbent of lithium extraction from brine[J]. Inorganic Chemicals Industry, 2019, 51(3): 16-19. |
| [2] |
周园园. 中国锂资源供需形势及对外依存度分析[J]. 资源与产业, 2019, 21(3): 46-50. ZHOU Y Y. Supply-demand situation and external dependence of China's lithium resource[J]. Resources & Industries, 2019, 21(3): 46-50. |
| [3] |
赵旭, 张琦, 武海虹, 等. 盐湖卤水提锂[J]. 化学进展, 2017, 29(7): 796-808. ZHAO X, ZHANG Q, WU H H, et al. Extraction of lithium from salt lake brine[J]. Progress in Chemistry, 2017, 29(7): 796-808. |
| [4] |
张欣, 王亮, 马来波, 等. 钛掺杂锂锰氧化物离子筛的制备及性能研究[J]. 盐科学与化工, 2019, 48(8): 31-34. ZHANG X, WANG L, MA L B, et al. Preparation and properties of lithium manganese oxide ion-sieve containing titanium[J]. Journal of Salt Science and Chemical Industry, 2019, 48(8): 31-34. |
| [5] |
刘东帆, 孙淑英, 于建国. 盐湖卤水提锂技术研究与发展[J]. 化工学报, 2018, 69(1): 141-155. LIU D F, SUN S Y, YU J G, et al. Research and development on technique of lithium recovery from salt lake brine[J]. CIESC Journal, 2018, 69(1): 141-155. |
| [6] |
葛涛, 徐亮, 孟金伟, 等. 盐湖卤水提锂工艺技术研究进展[J]. 有色金属工程, 2021, 11(2): 55-62. GE T, XY L, MENG W J, et al. Research progress of lithium extraction technology from salt lake brine[J]. Nonferrous Metals Engineering, 2021, 11(2): 55-62. |
| [7] |
GU D L, SUN W J, HAN G F, et al. Lithium ion sieve synthesized via an improved solid state method and adsorption performance for West Taijinar Salt Lake brine[J]. Chemical Engineering Journal, 2018, 350: 474-483. DOI:10.1016/j.cej.2018.05.191 |
| [8] |
VAN G S, TANG Y, Rittmann B E. Impact of precipitation on the treatment of real ion-exchange brine using the H2-based membrane biofilm reactor[J]. Water Science and Technology, 2011, 63(7): 1453-1458. DOI:10.2166/wst.2011.330 |
| [9] |
WANG S, ZHANG M, ZHANG Y, et al. High adsorption performance of the Mo-doped titanium oxide sieve for lithium ions[J]. Hydrometallurgy, 2019, 187: 30-37. DOI:10.1016/j.hydromet.2019.05.004 |
| [10] |
许惠, 卓琳. 锂吸附剂前驱体LiMn2O4的制备及吸附剂性能研究[J]. 化工新型材料, 2013, 41(8): 123-125. XU H, ZHUO L. Synthesis and lithium adsorption properties of LiMn2O4 precursor[J]. New Chemical Materials, 2013, 41(8): 123-125. |
| [11] |
XIN X, YONG M C, PING Y W, et al. Extraction of lithium with functionalized lithium ion-sieves[J]. Progress in Materials Science, 2016, 84: 276-313. |
| [12] |
CHITRAKAR R, KANOH H, MIYAI Y, et al. A new type of manganese oxide (MnO·0.5H2O) derived from Li1.6Mn1.6O4 and its lithium ion-sieve properties[J]. Chemistry of Materials, 2020, 12(10): 3151-3157. |
| [13] |
纪志永, 彭靖龄, 袁俊生, 等. 基于Li4Mn5O12的铝改性锰基锂离子筛前体的制备[J]. 无机盐工业, 2015, 47(12): 22-24, 66. JI Z Y, PENG J L, YUAN J S, et al. Synthesis of Al-doped lithium ion-sieve precursor based on Li4Mn5O12[J]. Inorganic Chemicals Industry, 2015, 47(12): 22-24, 66. |
| [14] |
SHI K, LUO M, YING J, et al. Extraction of lithium from single-crystalline lithium manganese oxide nanotubes using ammonium peroxodisulfate[J]. iScience, 2020, 23(11): 101768. DOI:10.1016/j.isci.2020.101768 |
| [15] |
杨喜云, 王豪, 曹改芳, 等. 一种锆酸锂包覆锰系锂离子筛及其制备和应用. CN, 109999750B [P], 2020-11-03. YANG X Y, WANG H, CAO G F, et al. The invention relates to a lithium zirconate coated manganese series lithium ion sieve and its preparation and application. CN, 109999750B [P]. 2020-11-03. |
| [16] |
陈自正. H2TiO3锂吸附剂的制备及其吸附性能探究[D]. 上海: 华东理工大学, 2017. CHEN Z Z. Synthesis and adsorption properties of H2TiO3 adsorbent [D]. Shanghai: East China University of Science and Technology, 2017. |
| [17] |
曾天标. Li4Ti5O12在锂离子和锂硫电池中的应用[D]. 重庆: 重庆理工大学, 2017. ZENG T B. Application of Li4Ti5O12 in Lithium ion and lithium sulfur batteries [D]. Chongqing: Chongqing University of Technology, 2017。 |
| [18] |
ZHANG L, ZHOU D, YAO Q, et al. Preparation of H2TiO3-lithium adsorbent by the sol–gel process and its adsorption performance[J]. Applied Surface Science, 2016, 368: 82-87. DOI:10.1016/j.apsusc.2016.01.203 |
| [19] |
YUAN T, TAN Z, MA C, et al. Challenges of Spinel Li4Ti5O12for Lithium-ion battery industrial applications[J]. Advanced Energy Materials, 2017, 7(12): 1601625. |
| [20] |
王永顺. 掺杂型锂离子筛的制备及性能研究[D]. 青岛: 青岛科技大学, 2017. WANG Y S. Preparation and properties of doped lithium ion sieve [D]. Qingdao: Qingdao University of Science & Technology, 2017. |
| [21] |
LI N, GAN K, LU D, et al. Preparation of three-dimensional microporous-mesoporous lithium ion sieve with high Li+ adsorption capacity[J]. Research on Chemical Intermediates, 2018, 44(2): 1105-1117. DOI:10.1007/s11164-017-3154-6 |
| [22] |
TANG D H, ZHOU D L, ZHOU J B, et al. Preparation of H2TiO3–lithium adsorbent using low-grade titanium slag[J]. Hydrometallurgy, 2015, 157: 90-96. DOI:10.1016/j.hydromet.2015.07.009 |
| [23] |
ZHANG L, LIU Y, HUANG L, et al. A novel study on preparation of H2TiO3-lithium adsorbent with titanyl sulfate as titanium source by inorganic precipitation-peptization method[J]. RSC Advance, 2018, 8(3): 1385-1391. |
| [24] |
郭佳明, 刘明言, 吴强, 等. 硝酸锂改性钛系离子筛的制备及其吸附性能[J]. 化工学报, 2020, 71(2): 879-888. GUO J M, LIU M Y, WU Q, et al. Preparation and adsorption performance of titanium based lithium ion sieve improved by LiNO3[J]. CIESC Journal, 2020, 71(2): 879-888. |
| [25] |
CHEN Z J, ZHENG R J, GRAS M, et al. Tuning electronic property and surface reconstruction of amorphous iron borides via W-P co-doping for highly efficient oxygen evolution[J]. Applied Catalysis B: Environmental, 2021, 288: 120037. |
| [26] |
陈德鑫, 李智敏, 李高锋, 等. Mg2+掺杂对Li1.2Mn0.6Ni0.2O2正极材料性能的影响[J]. 材料工程, 2020, 48(10): 157-162. CHENG D X, LI Z M, LI G F, et al. Influence of Mg2+ doping on properties of Li1.2Mn0.6Ni0.2O2 cathode materials[J]. Journal of Materials Engineering, 2020, 48(10): 157-162. |
| [27] |
梁卫春, 郭欢, 吴理觉, 等. 锂离子电池正极材料LiNi0.4Co0.2Mn0.4O2的制备与性能研究[J]. 有色金属(冶炼部分), 2018(11): 51-55. LIANG W C, GUO H, WU L J, et al. Synthesis and performance study of LiNi0.4Co0.2Mn0.4O2 cathode material for lithium-ion batteries[J]. Nonferrous Metals (Extractive Metallurgy), 2018(11): 51-55. |
| [28] |
李嘉雯. Cr3+、Co3+、Al3+离子掺杂对LiNi0. . 5Mn1.5O4晶体结构和电化学性能的影响研究[D]. 银川: 宁夏大学, 2019. LI J W. Investigation on Crystal structure and electrochemical performance of Cr3+, Co3+, Al3+ doped LiNi0. . 5Mn1.5O4 [D]. Yinchuan: Ningxia University, 2019. |
| [29] |
HOSOGI Y, KATO H, KUDO A. Visible light response of AgLi1/3M2/3O2 (M=Ti and Sn) synthesized from layered Li2MO3 using molten AgNO3[J]. Journal of Materials chemistry, 2008, 18(6): 647-653. |
| [30] |
毕参参. 锂钛系和锂锰系锂离子筛的合成及其离子交换性能研究[D]. 青岛: 青岛科技大学, 2012. BI C C. Synthesis of titanium oxide and manganese oxide Lithium ion sieve and study on its exchange property [D]. Qingdao: Qingdao University of Science & Technology, 2012. |
| [31] |
姜志新, 谌竟清, 宋正孝, 等. 离子交换分离工程[M]. 天津: 天津大学出版社, 1992. JIANG Z X, CHEN J Q, SONG Z X, et al. Ion exchange and separation engineering[M]. Tianjin: Tianjin University Press, 1992. |




