1 前言
中国磷肥工业每年产生5000多万吨固废磷石膏(PG)[1],其主要成分是二水硫酸钙(CaSO4·2H2O)。以其作为工业烟气CO2矿化剂,“以废治废”并转化为具有高附加值的化学品,具有重要意义[2, 3]。一个有代表性的反应体系是在NH3助剂作用下的复分解反应:
|
$
{\rm{CaS}}{{\rm{O}}_{\rm{4}}} \cdot {\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O(s) + C}}{{\rm{O}}_{\rm{2}}}{\rm{(g) + 2N}}{{\rm{H}}_{\rm{3}}}{\rm{(aq)}} \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}}{\rm{(s) + (N}}{{\rm{H}}_{\rm{4}}}{{\rm{)}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{(aq) + }}{{\rm{H}}_{\rm{2}}}{\rm{O(l)}}
$
|
(1) |
该反应发生在CaSO4·2H2O-NH3-CO2-H2O多相复杂体系中同,包括溶解-反应-结晶等过程[4],其中二水硫酸钙的溶解是反应控速步骤[5]。产物碳酸钙有三种可能的晶型,分别为方解石、文石、球霰石,稳定性依次降低[6]。若对产物晶型及形貌不加调控,获得的产品为方解石、球霰石等混合晶型,仅可用作水泥原料等初级产品,附加值不高,对改善烟气CO2矿化过程经济性贡献不大。近年来,碳酸钙产品逐渐向专用化、精细化、功能化发展,这为磷石膏矿化烟气CO2技术带来了新的生命力。纳米CaCO3分解温度比普通CaCO3低200℃,可用于高温CO2的吸附剂原料进行吸附-再生循环[7, 8],Lu等通过三相体系CO2-NH3·H2O-PG在30~40℃,CO2流量251~138 mL·min-1时可制备粒径为86~104 nm的纳米碳酸钙[9],Ping等证明笼状纳米CaCO3空心球能增强CO2吸附能力以及吸附率[10]。单一形貌碳酸钙晶体球霰石因其独特的介孔结构且比表面积大,在药物、催化剂载体方面具有应用价值[11],同时,因其生物相容性和可降解性可用于修复骨缺损。张腾龙等[12]以聚苯乙烯磺酸钠(PSS)为表面活性剂,通过Na2CO3和Ca(NO3)2反应制备多孔碳酸钙微球,其机理为PSS所带的磺酸基团与Ca2+络合诱导形成球霰石,但并未对其络合作用进行验证。
诱导期(induction period)是指能观察到固体颗粒的时期[13]。李艳红等[14]发现羟基乙叉二膦酸(HEDP)与磁场的协同作用可提高对Ca2+的螯合作用,在HEDP浓度为0.5 mg·L-1时,协同阻垢作用对碳酸钙的静态阻垢率比HEDP单独作用时提高28%,即延长CaCO3结晶诱导期。Song等[15]通过添加剂聚丙烯酸(PAA)延长脱硫石膏矿化制备方解石的诱导期从而抑制CaCO3晶体的形成,认为Ca2+与PAA的络合作用延长了诱导期,但对络合作用延长诱导期的机理分析尚待进一步研究。碱性添加剂不仅能有效促进CO2的吸收,而且对控制CaCO3晶体形貌有重要意义[16]。
本文以CaSO4·2H2O-NH3-CO2-H2O反应结晶为基础,提出一种快速合成单一形貌的CaCO3晶体球霰石的制备方法。采用添加碱性添加剂乙二胺(EDA),通过Ca2+与乙二胺络合生成配合物,降低溶液中Ca2+的浓度,延长诱导期,并运用质量守恒定律和配位解离平衡验证EDA以钙络合剂的形式参与碳酸钙结晶过程并延长诱导期。通过延长诱导期,将CaSO4·2H2O-NH3-CO2-H2O反应结晶过程中的溶解与结晶过程分离,为直接制备纯净的球霰石提供理论和可行性方面的指导。
2 实验部分
2.1 实验试剂与仪器
试剂:二水硫酸钙;氨水;二氧化碳;乙二胺;盐酸;乙醇。以上样品为分析纯。实验用水为去离子水。
仪器:电热恒温水浴锅(SINO TECH,XOSC-15D);电热恒温干燥箱(BOXUN,GZX-9146MBE);pH计(Ion Meter PXS-450);电子天平(SHANGPING,FA1004N);悬臂式搅拌机(IKA® EUROSTAR 20 digital);原子吸收光谱仪(VARIAN,SpectrAA 220FS);离子色谱(DIONEX,ICS-90);X射线衍射仪(HAOYUAN,DX-2700);扫描电子显微镜(JEOL,JSM-7500F);真空泵(vacuubrand,PC 201)。
2.2 制备与测定方法
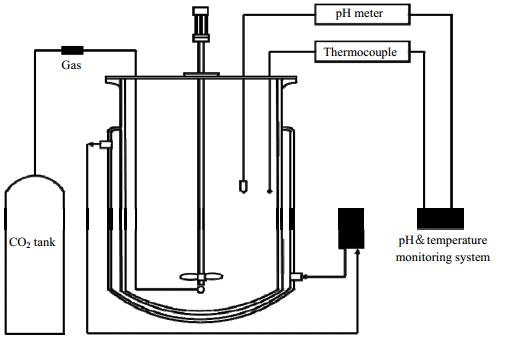
实验装置如图 1所示,称取40 g二水硫酸钙与一定量氨水、乙二胺于2 L反应器中,得到二水硫酸钙-氨水-乙二胺悬浊液,其中氨水浓度为2%,乙二胺在相同操作下的浓度分别为0、0.23、0.57 mol·L-1,搅拌转速600 r·min-1,搅拌5 min后通入1 L·min-1CO2,电热恒温水浴锅控制实验反应温度为室温20℃,反应至pH值不变时停止实验。反应过程中每次取样15 mL进行快速抽滤,并用无水乙醇洗涤数次,将所得的白色粉末状固体置于70℃的恒温干燥箱中烘干2 h后,于干燥器中保存。将滤液用盐酸酸化后分别通过原子吸收光谱仪测定滤液中钙元素浓度和离子色谱测定硫酸根浓度,利用X射线衍射仪对所得样品进行表征。
3 实验结果与讨论
3.1 液相浓度分析
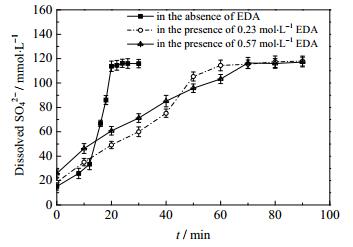
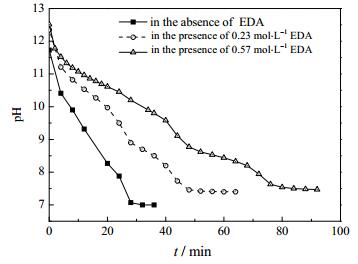
硫酸根浓度与碳酸钙沉淀无关,仅与二水硫酸钙的溶解有关,因此有必要用离子色谱对硫酸根的浓度进行表征。由图 2可知:在无添加剂乙二胺的情况下,SO42-浓度迅速增加至溶解完全共用时30 min;当EDA浓度为0.23 mol·L-1时,SO42-浓度于40~50 min增长速率明显加快,溶解完全共用时60 min;当EDA浓度为0.57 mol·L-1时,SO42-浓度于60~70 min增长速率明显加快,溶解完全共用时90 min。反应时间由无添加剂EDA的30 min延长至有0.57 mol·L-1 EDA的90 min,随添加剂乙二胺浓度的升高而延长,且出现SO42-浓度迅速增长的时间点随EDA浓度的增大而延迟。当添加EDA时反应前40 min内EDA浓度越大,体系中SO42-浓度也越大。
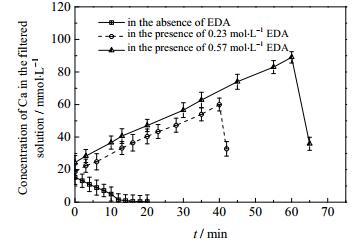
本文钙浓度指滤液中的钙元素浓度,包括钙离子与EDA形成的配合物及游离的钙离子的浓度。由图 3可知当添加EDA后,反应体系中钙浓度随时间呈先上升后下降的趋势,有别于体系中无添加剂EDA时钙浓度一直呈现的下降趋势。滤液中上升阶段的钙浓度大于20℃时二水硫酸钙的溶解度15 mmol·L-1,且当添加EDA时反应体系中的钙浓度随EDA浓度的增加有上升趋势,因此,在有添加剂EDA时反应体系中钙不仅以游离的形式存在,还以配合物的形式存在。
3.2 图谱分析
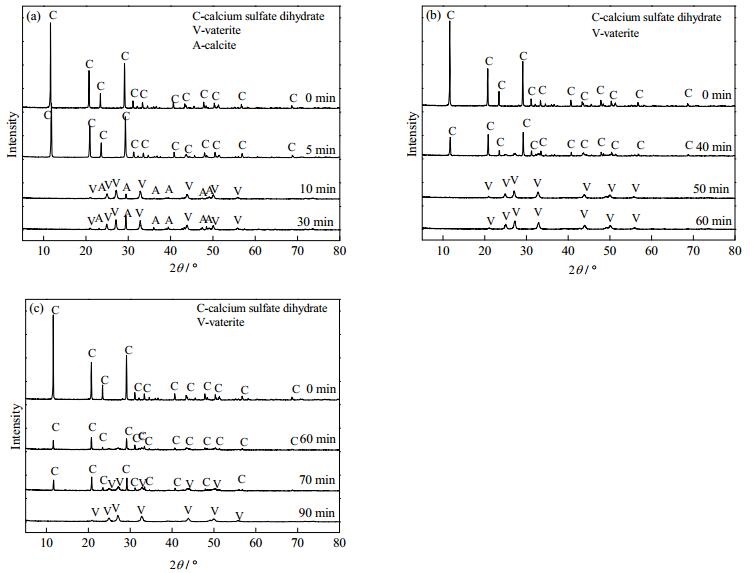
一般来说,碳酸钙晶型转变只发生在水溶液或者较高温度的煅烧下(400℃)[17]。反应结束后迅速抽滤、洗涤样品,并置于70℃烘箱内干燥,此过程没有发生晶型转变。图 4是迅速抽滤后所得样品的XRD谱图。对照二水硫酸钙(C标记)、球霰石(V标记)和方解石(A标记)XRD标准谱图(JCPDS NO.21-0816、JCPDS NO.33-0268和JCPDS NO.05-0585)可知:当无添加剂乙二胺时,得到的产物是球霰石和方解石两种碳酸钙形貌晶体(图 4(a));当添加剂乙二胺的浓度分别为0.23和0.57 mol·L-1时,得到的产物为单一形貌的球霰石(图 4(b)和(c))。晶体中球霰石的质量分数通过Rao方程根据XRD数据可以计算得到[18],计算公式如下:
|
$
{X_{\rm{A}}}{\rm{ = }}\frac{{{I_{{\rm{104(A)}}}}}}{{{I_{{\rm{104(A)}}}}{\rm{ + }}{I_{{\rm{110(V)}}}}{\rm{ + }}{I_{{\rm{112(V)}}}}{\rm{ + }}{I_{{\rm{114(V)}}}}}}
$
|
(2) |
|
$
{X_{\rm{V}}}{\rm{ = 1}} - {X_{\rm{A}}}
$
|
(3) |
式中A代表方解石,V代表球霰石;I为方解石或球霰石对应的最强特征峰的积分强度值,Xv、XA分别为方解石和球霰石的质量分数。由式(2)和(3)可计算出当无添加剂EDA时,产物中球霰石含量为71.43%。由此可见,添加剂乙二胺改变了碳酸钙晶体的晶型。
由图 4(a)可知在无EDA时,CaCO3在0~10 min期间开始结晶,此时Ca2+浓度迅速下降,强烈促进二水硫酸钙的溶解,SO42-浓度增长速率加快直至全部溶解;由图 4(b)可知当EDA浓度为0.23 mol·L-1时,CaCO3在40~50 min期间开始结晶,此时SO42-浓度增长速率加快直至全部溶解;由图 4(c)可知当EDA浓度为0.57 mol·L-1时,CaCO3在60~70 min期间开始结晶,此时SO42-浓度增长速率加快直至全部溶解。结果与图 2中SO42-浓度变化一致。碳酸钙结晶的诱导期随添加剂乙二胺浓度的增大而延长。
图 5是在20℃碳化温度下,添加剂乙二胺浓度分别为0、0.23、0.57 mol·L-1时制备的碳酸钙SEM图。通过Image J软件对图 5(a)~(c)进行粒径分析,得到它们的平均粒径分别为:5.61、4.50和3.45 µm。碳酸钙晶体粒径随添加剂浓度的升高而降低。
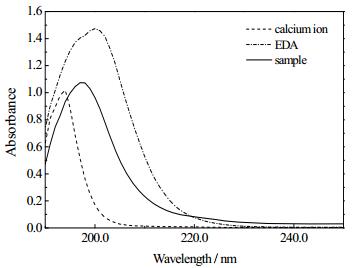
当乙二胺浓度为0.57 mol·L-1、反应时间为40 min时抽滤取样,用紫外分光光度计对滤液进行测试,由图 6可知,此时样品的特征吸收峰为197 nm,处于纯钙离子特征吸收峰194 nm和纯乙二胺特征吸收峰200 nm之间,相对于纯钙离子的特征吸收峰该特征峰往长波方向移动,即发生红移现象。在紫外光谱结构表征中,通过特征吸收峰的红移或蓝移现象及强度大小变化,表明配基在于钙离子螯合过程中,发色团和助色团的偏光性发生了变化[23]。由图 6可直接证明乙二胺对钙离子络合作用的存在。
3.3 机理分析
二水硫酸钙与氨水的悬浊液中通入二氧化碳,以乙二胺为添加剂制备单相球霰石,是一个极其复杂的气液固三相反应,包括以下过程:(1)二水硫酸钙的溶解,(2)乙二胺与钙离子形成配合物,降低溶液中Ca2+的浓度,(3)氨水吸收CO2,(4)碳酸钙晶体的形成。当pH > 10时,CO2在含胺溶液中可认为全部吸收[19],因此通过质量守恒定律和配位解离平衡模拟pH > 10、添加剂乙二胺的浓度是0.57 mol·L-1时乙二胺的钙络合作用。假设所有二水硫酸钙颗粒均为大小相同的球形颗粒,以马尔文激光粒度仪测量的平均粒径72 µm为所有二水硫酸钙颗粒初始粒径,并且在二水硫酸钙的溶解过程中其颗粒数目不变。由于Ca2+在反应体系中不仅以Ca2+单独存在,当添加乙二胺时还会以钙与乙二胺的配合物的形式存在,因此选用硫酸根浓度直接表示二水硫酸钙的溶解情况。由图 7可知,当pH > 10时反应时间约为40 min,再据图 4(c)可知此时溶液中无碳酸钙晶体生成,仅存在二水硫酸钙的溶解过程,钙以游离的钙离子、钙离子和乙二胺形成的配合物存在于溶液中,所以可将硫酸根浓度的模拟值与硫酸根、钙浓度的实验值作比较。有关反应如下:
|
$
{\rm{CaS}}{{\rm{O}}_{\rm{4}}} \cdot {\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + SO}}_{\rm{4}}^{{\rm{2 - }}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}
$
|
(4) |
|
$
{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + 2N}}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{N}}{{\rm{H}}_{\rm{2}}}\xrightarrow{{\beta _{\rm{2}}^{\rm{ \mathsf{ θ} }}}}{\rm{Ca(N}}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{N}}{{\rm{H}}_{\rm{2}}}{\rm{)}}_{\rm{2}}^{{\rm{2 + }}}
$
|
(5) |
|
$
{\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2N}}{{\rm{H}}_{\rm{3}}}\xrightarrow{{k{\rm{ = 3}}{\rm{.68}} \times {\rm{1}}{{\rm{0}}^{\rm{3}}}}}{\rm{N}}{{\rm{H}}_{\rm{2}}}{\rm{CO}}{{\rm{O}}^{\rm{ - }}}{\rm{ + NH}}_{\rm{4}}^{\rm{ + }}
$
|
(6) |
|
$
{\rm{N}}{{\rm{H}}_{\rm{2}}}{\rm{CO}}{{\rm{O}}^{\rm{ - }}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\overset {{k_{\rm{1}}}{\rm{ = 0}}{\rm{.277}}} \longleftrightarrow {\rm{HCO}}_{\rm{3}}^{\rm{ - }}{\rm{ + N}}{{\rm{H}}_{\rm{3}}}
$
|
(7) |
|
$
{\rm{HCO}}_{\rm{3}}^{\rm{ - }}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}\overset {{k_{\rm{2}}}{\rm{ = 5}}{\rm{.6}} \times {\rm{1}}{{\rm{0}}^{\rm{3}}}} \longleftrightarrow {\rm{CO}}_{\rm{3}}^{{\rm{2 - }}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}
$
|
(8) |
|
$
{\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\overset {{k_{\rm{3}}}{\rm{ = 1}}{\rm{.86}} \times {\rm{1}}{{\rm{0}}^{ - 5}}} \longleftrightarrow {\rm{NH}}_{\rm{4}}^{\rm{ - }}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}
$
|
(9) |
|
$
{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + CO}}_{\rm{3}}^{{\rm{2 - }}} \leftrightarrow {\rm{CaC}}{{\rm{O}}_{\rm{3}}}
$
|
(10) |
氨水吸收CO2的过程中,反应(6)快速形成大量氨基甲酸根(NH2COO-),反应(7)生成HCO3-较慢,且一旦有HCO3-生成,由反应(8)可知HCO3-会迅速转变为CO32-[20],溶液中二氧化碳主要以NH2COO-的形式存在。批平衡实验法可对配合物的标准积累稳定常数进行测量[21]。经测量,式(5)中钙离子与乙二胺生成配合物的积累稳定常数$ \beta _{\rm{2}}^{\rm{ \mathsf{ θ} }}$为2100。搅拌转速大于150 r·min-1后扩散阻力基本消失,即溶解反应只受表面反应控制[5]。式(11)为溶解动力学方程,其中r为溶解速率,k为溶解速率常数(mol·cm-2·s-1),n为溶解反应级数取1.27[22],20℃时二水硫酸钙的饱和度CCa2+(eq)为15 mmol·L-1。式(12)为二水硫酸钙溶解反应速率常数k与温度T的关系式[5]。
|
$
r{\rm{ = }}k\left( {{\rm{1}} - \frac{{{C_{{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}}}}}{{{C_{{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{(eq)}}}}}}} \right){\rm{ = }}k{{\rm{(1}} - C{\rm{)}}^n}
$
|
(11) |
|
$
k = 4.38 \times {10^{ - 5}}\exp \left( { - \frac{{{\rm{19070}}}}{{RT}}} \right)
$
|
(12) |
|
$
{T_{{\rm{Ca}}}}{\rm{ = }}b{\rm{ + }}a{\rm{ = [Ca(en)}}_{\rm{2}}^{{\rm{2 + }}}{\rm{] + }}{C_{{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}}}
$
|
(13) |
|
$
{\rm{[Ca(en)}}_{\rm{2}}^{{\rm{2 + }}}{\rm{] = }}b{\rm{ + }}a - {C_{{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}}}
$
|
(14) |
|
$
{\rm{[en] = }}E - {\rm{2[Ca(en)}}_{\rm{2}}^{{\rm{2 + }}}{\rm{]}}
$
|
(15) |
|
$
\beta _{\rm{2}}^{\rm{ \mathsf{ θ} }}{\rm{ = }}\frac{{{\rm{[Ca(en)}}_{\rm{2}}^{{\rm{2 + }}}{\rm{]/}}{C^{\rm{ \mathsf{ θ} }}}}}{{{\rm{(}}\frac{{{C_{{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}}}}}{{{C^{\rm{ \mathsf{ θ} }}}}}{\rm{)(}}\frac{{{\rm{[en]}}}}{{{C^{\rm{ \mathsf{ θ} }}}}}{{\rm{)}}^{\rm{2}}}}}
$
|
(16) |
|
$
C{\rm{ = }}{C_{{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}}}{\rm{ + }}a{\rm{/2}}
$
|
(17) |
因为pH > 10时反应体系中仅存在二水硫酸钙的溶解过程,所以溶液中钙浓度应与SO42-浓度守恒。将二水硫酸钙的溶解速率r (mol·cm-2·s-1)转换为单位时间内溶解的钙浓度a (mol·L-1·s-1)。b (mol·L-1)为初始状态溶液的SO42-浓度,TCa (mol·L-1)为溶液的钙浓度,CCa2+(mol·L-1)为游离钙离子的浓度,[Ca(en)22+](mol·L-1)为钙离子与乙二胺的配合物,[en](mol·L-1)为未络合的乙二胺浓度,E (mol·L-1)为溶液中乙二胺的总浓度,Cθ是标准浓度1 mol·L-1,C是溶液中的SO42-浓度。由钙守恒可计算络合物的浓度,配位解离平衡计算未络合的乙二胺浓度,进而可推算出游离的钙离子浓度以及单位时间内溶解的钙浓度,最终得到溶液中的SO42-浓度。
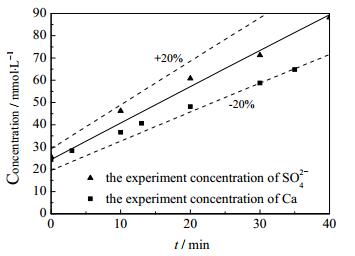
据图 8的模拟数据可知,溶液中硫酸根浓度的模拟值与实验所得滤液中钙浓度、SO42-浓度偏差 < 20%,吻合度较好,可证明乙二胺与钙形成配合物,延长了二水硫酸钙矿化的诱导期。
4 结论
通过向二水硫酸钙、乙二胺和氨水的悬浊液中通入CO2反应结晶,控制添加剂乙二胺浓度,分别为0、0.23、0.57 mol·L-1,得到结论如下:
(1) 当未添加乙二胺时体系反应完全后得到方解石和球霰石混合晶型;当添加剂乙二胺浓度分别为0.23、0.57 mol·L-1时,反应完全后皆可制备单一形貌的碳酸钙晶体球霰石。
(2) 实验过程中钙离子浓度变化和样品的紫外可见光谱证实了乙二胺对钙离子的络合作用。当未添加乙二胺时,反应体系中游离的钙浓度呈下降趋势;当添加乙二胺时,钙浓度呈先上升后下降趋势,诱导期内体系中钙浓度随添加剂乙二胺浓度的升高而增加。上升阶段钙浓度大于20℃时CaSO4·2H2O的溶解度15 mmol·L-1,证明钙离子与EDA形成的配合物存在于溶液中且通过样品的紫外可见光谱证实了该配合物的存在。
(3) 通过质量守恒定律和配位解离平衡对添加剂乙二胺以钙络合剂的形式参与反应并抑制结晶进行模拟验证,溶液中SO42-浓度的模拟值与钙元素浓度的实验值、SO42-浓度的实验值误差小于20%,可证明乙二胺与Ca2+发生络合作用,抑制碳酸钙结晶从而延长二水硫酸钙矿化的诱导期。
符号说明:
| a |
—单位时间内溶解的钙浓度,mol·L-1·s-1 |
E |
—溶液中乙二胺的总浓度,mol·L-1 |
| b |
—初始状态溶液的硫酸根浓度,mol·L-1 |
k |
—溶解速率常数,mol·cm-2·s-1 |
| C |
—溶液中的SO42-浓度,mol·L-1 |
n |
—溶解反应级数 |
| Cθ |
—标准浓度,1 mol·L-1 |
r |
—溶解速率,mol·cm-2·s-1 |
| CCa2+ |
—游离的钙离子浓度,mol·L-1 |
T |
—温度,K |
| CCa2+(eq) |
—二水硫酸钙的饱和度,mmol·L-1 |
TCa |
—溶液的钙浓度,mol·L-1 |
| [Ca(en)22+] |
— Ca2+与乙二胺配合物浓度,mol·L-1 |
β2θ |
—钙离子与乙二胺形成配合物的积累平衡常数 |
| [en] |
—未络合的乙二胺浓度,mol·L-1 |
|
|