挥发性有机化合物指常温常压下沸点低于260 ℃的有机污染物[1]。其是造成臭氧和光化学烟雾的关键前体物,对环境和人类健康都造成了负面影响[2]。挥发性有机物的主要来源于炼油工业、化工、制药工业、汽车工业、纺织制造、溶剂加工、清洁产品生产、油漆、印染、绝缘材料制造等工业过程中有机溶剂的挥发。在这些挥发性有机化合物中,甲苯广泛存在于医药、农业、涂装、印染等行业有机溶剂的挥发,由于其毒性、诱变性和恶臭特性,常被作为模型污染物[3]。催化氧化技术因其成本低、去除效率高、能耗低、几乎没有有害副产物,是目前最有前景的挥发性有机污染物(VOCs)处理技术之一[4],其核心是开发具有高活性、高稳定性和低成本的催化剂。到目前为止,贵金属(例如Pt、Au、Pd和Ag)已经被证明在低温下具有优异的催化氧化甲苯的活性[5-8]。然而,其成本高、易烧结、易结焦的问题限制了工业应用。相比之下,过渡金属氧化物来源广泛、价格便宜,是研究的热点。在甲苯氧化中,由于Mn氧化物具有Mn2+、Mn3+和Mn4+的混合价态、开放的隧道结构、高迁移率的晶格氧以及丰富的表面氧物种,使其表现出良好的催化氧化性能[9-10]。
基于MvK机理,氧空位的再循环是甲苯在过渡金属氧化物催化剂上氧化的关键步骤[11],因此,在Mn基催化剂中引入丰富的氧空位被认为是提高其催化剂性能的有效策略。Dong等[12]报道,铜离子掺杂量与铜掺杂的MnO2催化剂的氧空位含量相关,从而影响氧物种活性以及低温还原性。Zhao等[13]通过氧化还原共沉淀制备了CeaMnOx催化剂,发现Ce的掺杂改变了催化剂的结构,并引入了更多的氧空位以及吸附氧物种,从而提高了催化氧化甲苯活性。可以看出,金属掺杂可以促进催化剂表面形成丰富的氧空位,进而提高甲苯的催化氧化活性[14]。同时,铁作为一种廉价无毒的过渡金属元素,其离子半径与锰离子相近,且Fe3+↔Fe2+的氧化还原过程使其氧化物具有良好的氧化还原性[15-16]。
在此,本研究通过共沉淀法制备了一系列不同Fe掺杂量的ε-MnO2催化剂,以调节表面氧空位,实现高效甲苯催化氧化。通过一系列表征技术对所得的催化剂进行分析,并在水蒸气存在的条件下测试催化剂的稳定性。此外,为了进一步探究反应的决速步以及甲苯反应路径,利用原位红外测试分析确定了甲苯在催化剂上吸附氧化过程中的关键中间产物。
2 实验部分 2.1 实验试剂催化剂合成实验使用的试剂为九水合硝酸铁(分析纯AR,国药)、四水合氯化锰(分析纯AR,国药)、碳酸铵(分析纯AR,国药)。
2.2 催化剂制备方法将x mol Fe(NO)3·9H2O和y mol MnCl2·4H2O溶解于300 mL去离子水中。在搅拌条件下,向上述混合溶液中加入(x+y) mol (NH4)2CO3,搅拌2 h后静置老化24 h,再用去离子水离心洗涤6次,并于80 ℃下干燥8 h,放入马弗炉中,在350 ℃下煅烧3 h,得到的铁锰催化剂记为Fe1Mny/x。
2.3 催化剂表征实验使用X射线衍射(XRD)对样品晶型进行分析,扫描角度为10°~80°;使用X射线光电子能谱(XPS)进行催化剂表面元素及价态分析;采用多用吸附仪(Micromeritics AutoChem Ⅱ 2920)测试催化剂的氧化还原性能,具体步骤:称取30 mg样品置于U型石英管中,以10 ℃⋅min−1从室温程序升温至300 ℃,干燥预处理,He气流(50 mL⋅min−1)吹扫1 h,冷却至50 ℃,通入H2/Ar混合气(H2的体积分数为10%,50 mL⋅min−1)处理0.5 h。待基线稳定后,样品在10% H2/Ar气流中以10 ℃⋅min−1的升温速率升至800 ℃,采用热导检测器(TCD)检测还原气体。采用原位漫反射红外傅里叶变换光谱(Bruker Tensor Ⅱ spectrometer)进行原位红外实验,具体操作步骤为:在实验之前,反应仓升温至300 ℃,样品在N2氛围中预处理60 min,以去除表面杂质。在下降到50 ℃的过程中,收集不同温度的背景。在实验过程中,通入800 mL⋅m−3甲苯+21 % O2 +79 % N2(百分数为体积分数),总体积流量为30 mL⋅min−1,程序升温在160 ℃到300 ℃之间进行,温度间隔为20 ℃。在每个温度下平衡20 min后收集光谱,以确保获得信号的稳定性[17]。
2.4 催化剂评价催化剂评价装置主要由气体管路、固定床反应器、流量控制系统和气体检测系统4部分组成,在实验过程中,使用质量流量计对各路气体进行精确控制。甲苯蒸气由0 ℃恒温鼓泡装置中产生,并由合成空气(21% O2 + 79% N2)带出,其浓度在混合室内稀释至1 000 mL⋅m−3,并保持50 mL⋅min−1的总流速。将0.1 g催化剂(粒径为0.25~0.42 mm)填充到固定床石英管(内径为6 mm,长度为460 mm)中,质量空速为30 000 mL⋅g−1⋅h−1。将热电偶插入催化剂床中心以监测实际反应温度。此外,通过将体积分数为15% 的水蒸气分别引入反应系统,研究水蒸气对本研究中性能最佳的催化剂上甲苯催化氧化的影响。试验前,催化剂在100 ℃的反应气氛中预处理2 h,避免吸附对甲苯转化率的影响。入口和出口气体由配备火焰离子检测器(FID)的气相色谱仪(GC-2018,岛津)自动监测。同时,通过另一台配备TCD的气相色谱仪(7890A,安捷伦)检测出口气体中的CO2体积分数。
甲苯去除效率Xtoluene和矿化率
| $ {X_{{\text{toluene}}}}{\text{ = }}\frac{{{\varphi _{{\text{Inlet}}}} - {\varphi _{{\text{Outlet}}}}}}{{{\varphi _{{\text{Inlet}}}}}} \times 100\% $ |
| $ {Y_{{\text{C}}{{\text{O}}_2}}}{\text{ = }}\frac{{{\varphi _{{\text{C}}{{\text{O}}_2}}}}}{{7({\varphi _{{\text{Inlet}}}} - {\varphi _{{\text{Outlet}}}})}} \times 100\% $ |
式中:
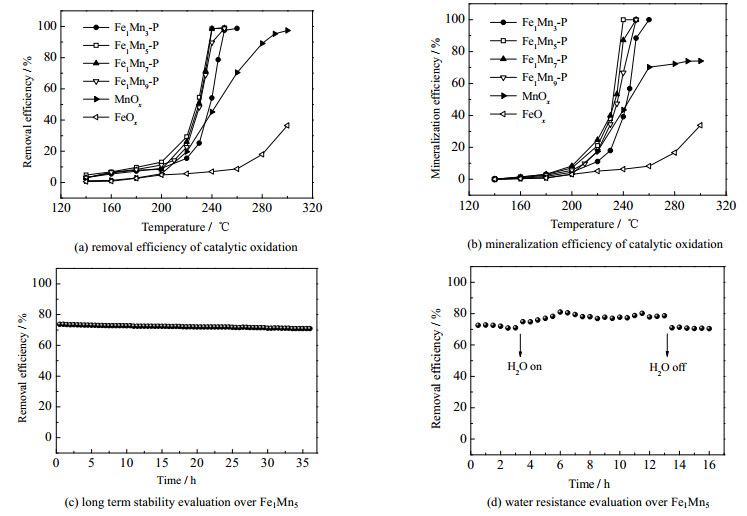
图 1(a)比较了不同Fe与Mn物质的量比n(Fe)/n(Mn)的FexMny催化剂催化氧化甲苯活性。MnOx在283 ℃时甲苯去除率达到90%(转化率为90% 时的反应温度t90=283 ℃)。然而,如图 1(b)所示,甲苯在MnOx上的矿化率在300 ℃时仍然低于75%,表明MnOx的氧化能力不足,无法将甲苯完全转化为CO2。为了进一步提高活性,选择MnOx作为基底,掺杂不同量的Fe。发现不同物质的量比的Fe1Mny催化剂的t90依次为:Fe1Mn5(237 ℃) < Fe1Mn7(238 ℃) < Fe1Mn9(240 ℃) < Fe1Mn3(248 ℃) < MnOx(283 ℃)。结果表明,在MnOx中掺杂Fe后,获得的样品Fe1Mny的t90显著降低,矿化率达到100%,表明Fe和Mn之间的协同作用促进了甲苯氧化为CO2。其中,Fe1Mn5氧化物催化剂在最低温度下表现出将甲苯完全转化为CO2和H2O的最佳活性。
|
图 1 催化剂活性评价 Fig.1 Evaluation of catalytic performance |
在实际应用中,催化剂的稳定性也值得研究。图 1(c)描述了Fe1Mn5催化剂长期催化氧化甲苯的性能测试,其结果显示,在235 ℃的条件下,甲苯在Fe1Mn5上的去除效率在36 h内几乎没有变化。另外,实际工业废气中也存在水蒸气。因此,本研究测试了体积分数为15% 的水蒸气氛围中Fe1Mn5的催化性能,结果如图 1(d)所示,通入水蒸气之后,甲苯的转化率从70%上升至80%,表明水蒸气的存在促进了甲苯的转化,可能是反应体系中引入的水蒸气可以激活催化剂上的─OH基,有利于活化O─O键,增强催化氧化过程中O2的补充,从而提高性能[17]。
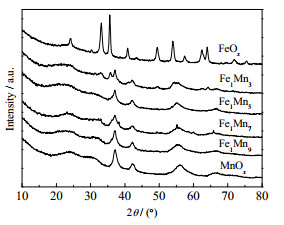
3.2 构-效关系催化剂的XRD图谱如图 2所示。MnOx在2θ为37.2°、42.7°、56.5°和67.1°处呈现4个衍射峰,对应于ε-MnO2的特征峰(JCPDS 30-0820)[18]。随着掺Fe量的加大,Fe1Mny催化剂中每个晶面对应的峰值强度显著降低,当掺Fe量的加大至n(Fe)/n(Mn)=1/3时,Fe1Mn3上检测到Fe2O3晶相,结果显示Fe物种的掺杂降低了ε-MnO2氧化物的结晶度,形成了更多的非晶相,这有助于生成丰富的氧空位,从而提高本征催化活性。同时,ε-MnO2的每个晶面对应的峰均随着Fe含量的增加而明显左移,这可能是Fe引入ε-MnO2晶体结构引起的晶胞变化[19]。
|
图 2 FexMny的X射线衍射谱图 Fig.2 XRD patterns of FexMny |
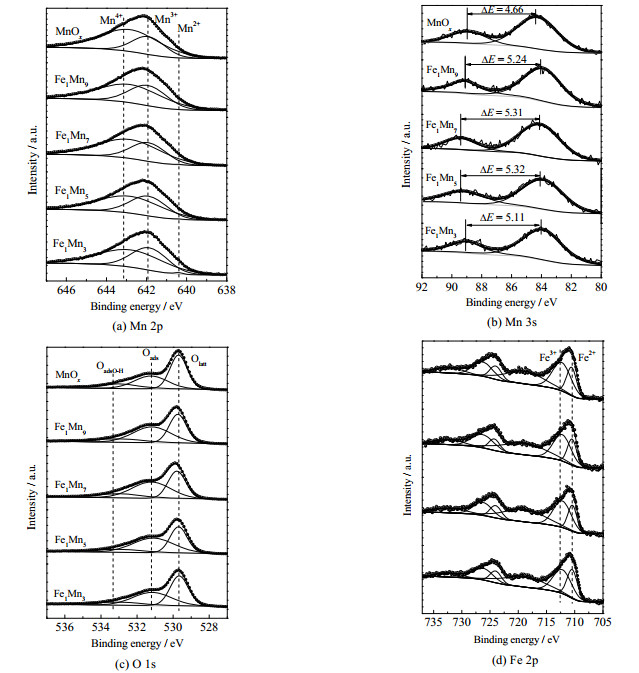
为了阐明催化剂表面Mn、O和Fe化学形态与催化活性间的构-效关系,对该系列FexMny催化剂进行了XPS表征。如图 3(a)所示,FexMny催化剂的Mn 2p光谱可分解为3个峰,对应的结合能分别为640.4、641.9和642.8 eV,分别归属于Mn2+、Mn3+和Mn4+物种,该系列催化剂表面主要存在Mn3+和Mn4+ 2种价态[20]。表 1罗列了Mn 2p的分析结果,得到3种催化剂表面的n(Mn2++Mn3+)/n(Mn4+)比值大小依次为Fe1Mn5(0.71) > Fe1Mn7(0.65) > Fe1Mn9(0.60) > Fe1Mn3(0.53) > MnOx(0.41),表明掺杂的铁物种可以促进催化剂表面低价Mn物种的增加。根据Mn 3s XPS谱(图 3(b),图中ΔE为Mn 3s轨道分峰相应的结合能的差值)计算了Mn的平均氧化态(AOS),依次为Fe1Mn5(3.17) < Fe1Mn7(3.20) < Fe1Mn9(3.30) < Fe1Mn3(3.35) < MnOx(3.72)。Mn3+─O键弱于Mn4+─O[21],因此高比例的低价Mn导致Fe1Mn5表面上的Mn─O键较长且较弱,这有利于在催化剂中形成更多的晶体缺陷和氧空位,从而促进了O2转化为活性氧物种[22]。
|
图 3 FexMny的X射线光电子能谱 Fig.3 XPS spectra of FexMny catalysts |
|
|
表 1 不同催化剂的XPS结果 Table 1 XPS data of FexMny catalysts |
如图 3(c)所示,FexMny催化剂的O 1s光谱可分解为3个峰,结合能分别为533.0、531.1和529.4 eV,分别对应于表面羟基氧(OadsO-H)、表面吸附氧(Oads)和晶格氧(Olatt)[23]。通常,表面吸附的氧物种对催化活性的贡献更大,因为它们比晶格氧具有更高的迁移率[24]。如表 1所示,n(Oads)/n(Olatt)顺序依次为Fe1Mn5 (1.31) > Fe1Mn7(1.28) > Fe1Mn9(1.17) > Fe1Mn3(0.90) > MnOx(0.72)。其中,Fe1Mn5的Oads/Olatt比率最高,这也与3.1节所示的甲苯氧化催化活性一致。
此外,图 3(d)中Fe1Mny的Fe-2p光谱可分解为710.2和711.8 eV的2个峰,分别对应于Fe2+和Fe3+物种[25]。催化剂表面n(Fe3+)/n(Fe2+)依次为Fe1Mn5 (2.00) > Fe1Mn7(1.97) > Fe1Mn9 (1.96) > Fe1Mn3 (1.47),表明在Fe1Mny表面存在更多的Fe3+离子。在所有样品中,Fe1Mn5氧化物上的3种表面物质的量比n(Oads)/ n(Olatt)、n(Mn2++Mn3+)/n(Mn4+)和n(Fe3+)/ n(Fe2+)最高,这也对应了其具有最佳的催化活性。
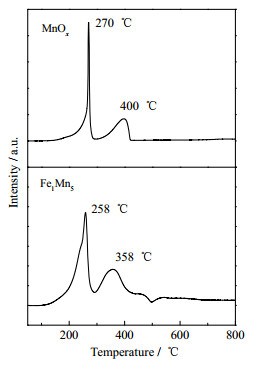
为探究催化剂的还原性能,对MnOx和Fe1Mn5进行H2-TPR测试,结果如图 4所示。在MnOx的H2-TPR谱图中观察到位于270和400 ℃处的2个还原峰,分别对应于MnO2→Mn3O4,Mn3O4→MnO的还原过程[26]。对于Fe1Mn5,这2个还原过程对应的峰分别为258和358 ℃,说明相比于MnOx,MnO2→Mn3O4→MnO的逐步还原过程更易在Fe1Mn5中发生。另外,如图 4阴影所示,位于200 ℃以下的还原峰源自吸附在氧空位上的表面氧物种的还原,相比于MnOx,Fe1Mn5催化剂的低于200 ℃曲线下面积更大,表明向MnO2中引入Fe物种,增加了表面氧空位浓度,改善了催化剂的低温还原性[19]。
|
图 4 催化剂的氢气程序升温脱附曲线 Fig.4 H2-TPR profiles of the catalysts |
为了探究在ε-MnO2和Fe1Mn5氧化物催化剂上甲苯氧化的表面吸附物种与催化反应过程之间的关系,进行了原位红外测试分析。如图 5所示,1 080、1 147、1 165、1 180 cm−1处的峰属于苯甲醇物种[10];1 244 cm−1处的峰被识别为与C─O的拉伸振动相关的苯酚物种;1 310 cm−1处的峰属于碳酸盐物种[27];1 400、1 550和1 600 cm−1处的峰属于苯甲酸盐C═O的拉伸振动[28];同时,1 030、3 060 cm−1处的峰与苯基C─H的拉伸振动相关,表明了苯环的存在[29-30];1 700 cm−1处的峰归属苯甲醛物种C═O的拉伸振动[31-32];1 835、1 915和1 980 cm−1处的峰值属于马来酸酐C═O的伸缩振动[17];2 908和2 995 cm−1处的峰与甲基CH─的拉伸振动有关;2 365 cm−1处的峰来自CO2[33],并且随着检测时间的延长,强度逐渐增强。此外,3 430、3 510、3 550和3 600 cm−1处的峰归属最终产物水的─OH[34]。
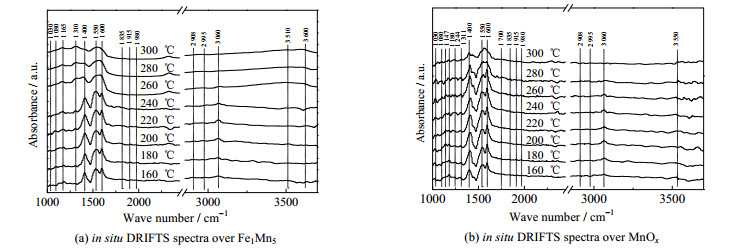
|
图 5 原位红外光谱 Fig.5 DRIFTS spectra |
如图 5(a)所示,苯甲醇物种(1 080、1 147、1 180 cm−1)和苯甲酸盐物种(1 400、1 550和1 600 cm−1)随着温度的升高逐渐消失。在整个温度范围内未检测到苯甲醛物种,这说明了由于氧空位上丰富吸附氧的存在,Fe1Mn5上发生了从苯甲醇中直接剥离2个H原子生成苯甲酸盐的快速脱氢过程[31]。当温度高于220 ℃时,苯环结构被破坏。马来酸酐(1 835、1 915和1 980 cm−1)是重要的苯环断裂中间体。如图 5(b)所示,在MnOx上观察到了苯甲醛的形成和消耗(1 700 cm−1),表明其氧化能力不足。同时,在1 244 cm−1处观察到对应于酚酸盐的峰,这意味着苯酚物种在MnOx上积累,表明苯酚C═C不能快速断裂,从而分解为马来酸酐或碳酸盐。相比之下,在几乎整个温度范围内Fe1Mn5上均未观察到酚盐,这证实了Fe物种的掺杂可以有效促进Mn基催化剂催化氧化甲苯。因此,可以推测甲苯在ε-MnO2上的反应路径为:甲苯→苯甲醇→苯甲醛→苯甲酸→马来酸酐→碳酸盐→CO2、H2O,其中苯环C=C的断裂可能是甲苯催化氧化的决速步,Fe物种的掺杂所形成的丰富氧空位提高了表面吸附氧含量,改善了ε-MnO2的低温还原性,从而促进了苯环C═C的断裂。
4 结论本研究采用共沉淀合成方法制备了一系列Fe掺杂的ε-MnO2催化剂。在Fe1Mny催化剂中,Fe1Mn5对甲苯氧化的催化活性最高,t90为237 ℃。根据表征结果分析,Fe1Mn5催化剂较高的催化性能归结于其具备较高的低价Mn和Fe3+含量、更多的氧空位以及良好的还原性。此外,原位红外分析推测,甲苯在ε-MnO2上的反应路径可能为:甲苯→苯甲醇→苯甲醛→苯甲酸→马来酸酐→碳酸盐→CO2、H2O,决速步是苯环的C═C的断裂。Fe掺杂ε-MnO2形成的丰富氧空位提升了表面吸附氧比例,加快了甲基的脱氢过程,促进了苯环的C═C断裂,从而增强了催化剂对甲苯的深度氧化能力。
| [1] |
CAO X L, SPARLING M, DABEKA R. Occurrence of 13 volatile organic compounds in foods from the canadian total diet study[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment, 2016, 33(2): 373-382. |
| [2] |
MADRONICH S. Ethanol and ozone[J]. Nature Geoscience, 2014, 7(6): 395-397. DOI:10.1038/ngeo2168 |
| [3] |
HUANG H B, XU Y, FENG Q Y, et al. Low temperature catalytic oxidation of volatile organic compounds: A review[J]. Catalysis Science & Technology, 2015, 5(5): 2649-2669. |
| [4] |
WANG Y Q, XUE Y F, ZHAO C C, et al. Catalytic combustion of toluene with La0.8Ce0.2MnO3 supported on CeO2 with different morphologies[J]. Chemical Engineering Journal, 2016, 300: 300-305. DOI:10.1016/j.cej.2016.04.007 |
| [5] |
WANG Q Y, LI Y X, SERRANO-LOTINA A, et al. Operando investigation of toluene oxidation over 1D Pt@CeO2 derived from Pt cluster-containing MOF[J]. Journal of the American Chemical Society, 2021, 143(1): 196-205. DOI:10.1021/jacs.0c08640 |
| [6] |
HE C, JIANG Z Y, MA M D, et al. Understanding the promotional effect of Mn2O3 on micro-/mesoporous hybrid silica nanocubic-supported Pt catalysts for the low-temperature destruction of methyl ethyl ketone: An experimental and theoretical study[J]. ACS Catalysis, 2018, 8(5): 4213-4229. DOI:10.1021/acscatal.7b04461 |
| [7] |
HU P Y, AMGHOUZ Z, HUANG Z W, et al. Surface-confined atomic silver centers catalyzing formaldehyde oxidation[J]. Environmental Science & Technology, 2015, 49(4): 2384-2390. |
| [8] |
VEITH G M, LUPINI A R, RASHKEEV S, et al. Thermal stability and catalytic activity of gold nanoparticles supported on silica[J]. Journal of Catalysis, 2009, 262(1): 92-101. DOI:10.1016/j.jcat.2008.12.005 |
| [9] |
LAMAITA L, PELUSO M A, SAMBETH J E, et al. A theoretical and experimental study of manganese oxides used as catalysts for VOCs emission reduction[J]. Catalysis Today, 2005, 107/108: 133-138. DOI:10.1016/j.cattod.2005.07.155 |
| [10] |
YANG X Q, YU X L, LIN M Y, et al. Enhancement effect of acid treatment on Mn2O3 catalyst for toluene oxidation[J]. Catalysis Today, 2019, 327: 254-261. DOI:10.1016/j.cattod.2018.04.041 |
| [11] |
JIANG X D, XU W C, LAI S F, et al. Integral structured Co-Mn composite oxides grown on interconnected Ni foam for catalytic toluene oxidation[J]. RSC Advances, 2019, 9(12): 6533-6541. DOI:10.1039/C8RA10102G |
| [12] |
DONG C, QU Z P, JIANG X, et al. Tuning oxygen vacancy concentration of MnO2 through metal doping for improved toluene oxidation[J]. Journal of Hazardous Materials, 2020, 391: 122181. DOI:10.1016/j.jhazmat.2020.122181 |
| [13] |
ZHAO L L, ZHANG Z P, LI Y S, et al. Synthesis of CeaMnOx hollow microsphere with hierarchical structure and its excellent catalytic performance for toluene combustion[J]. Applied Catalysis B: Environmental, 2019, 245: 502-512. DOI:10.1016/j.apcatb.2019.01.005 |
| [14] |
LI Z, YAN Q H, JIANG Q H, et al. Oxygen vacancy mediated CuyCo3-yFe1Ox mixed oxide as highly active and stable toluene oxidation catalyst by multiple phase interfaces formation and metal doping effect[J]. Applied Catalysis B: Environmental, 2020, 269: 118827. DOI:10.1016/j.apcatb.2020.118827 |
| [15] |
KHAN A, CHEN P, BOOLCHAND P, et al. Modified nano-crystalline ferrites for high-temperature WGS membrane reactor applications[J]. Journal of Catalysis, 2008, 253(1): 91-104. DOI:10.1016/j.jcat.2007.10.018 |
| [16] |
SHAKIR I, SARFRAZ M, ALI Z, et al. Magnetically separable and recyclable graphene-MgFe2O4 nanocomposites for enhanced photocatalytic applications[J]. Journal of Alloys and Compounds, 2016, 660: 450-455. DOI:10.1016/j.jallcom.2015.11.055 |
| [17] |
WANG P F, WANG J, AN X W, et al. Generation of abundant defects in Mn-Co mixed oxides by a facile agar-gel method for highly efficient catalysis of total toluene oxidation[J]. Applied Catalysis B: Environmental, 2021, 282: 119560. DOI:10.1016/j.apcatb.2020.119560 |
| [18] |
XU Y, DHAINAUT J, ROCHARD G, et al. Hierarchical porous ε-MnO2 from perovskite precursor: Application to the formaldehyde total oxidation[J]. Chemical Engineering Journal, 2020, 388: 124146. DOI:10.1016/j.cej.2020.124146 |
| [19] |
ZHENG Y F, SU Y, PANG C H, et al. Interface-enhanced oxygen vacancies of CoCuOx catalysts in situ grown on monolithic Cu foam for VOC catalytic oxidation[J]. Environmental Science & Technology, 2022, 56(3): 1905-1916. |
| [20] |
SI W Z, WANG Y, PENG Y, et al. Selective dissolution of a-site cations in ABO3 perovskites: A new path to high-performance catalysts[J]. Angewandte Chemie International Edition, 2015, 54(27): 7954-7957. DOI:10.1002/anie.201502632 |
| [21] |
ZHANG Y H. Electronegativities of elements in valence states and their applications 1. Electronegativities of elements in valence states[J]. Inorganic Chemistry, 1982, 21(11): 3886-3889. DOI:10.1021/ic00141a005 |
| [22] |
YANG W H, SU Z A, XU Z H, et al. Comparative study of α-, β-, γ- and δ-MnO2 on toluene oxidation: Oxygen vacancies and reaction intermediates[J]. Applied Catalysis B: Environmental, 2020, 260: 118150. |
| [23] |
ZHOU J, QIN L F, XIAO W, et al. Oriented growth of layered-MnO2 nanosheets over α-MnO2 nanotubes for enhanced room-temperature HCHO oxidation[J]. Applied Catalysis B: Environmental, 2017, 207: 233-243. DOI:10.1016/j.apcatb.2017.01.083 |
| [24] |
PELUSO M A, GAMBARO L A, PRONSATO E, et al. Synthesis and catalytic activity of manganese dioxide (type OMS-2) for the abatement of oxygenated VOCs[J]. Catalysis Today, 2008, 133/134/135: 487-492. |
| [25] |
TENG Y, WANG X D, LIAO J F, et al. Atomically thin defect-rich Fe-Mn-O hybrid nanosheets as high efficient electrocatalyst for water oxidation[J]. Advanced Functional Materials, 2018, 28(34): 1802463. DOI:10.1002/adfm.201802463 |
| [26] |
CARNÖ J, FERRANDON M, BJÖRNBOM E, et al. Mixed manganese oxide-platinum catalysts for total oxidation of model gas from wood boilers[J]. Applied Catalysis A: General, 1997, 155(2): 265-281. |
| [27] |
YANG W H, PENG Y, WANG Y, et al. Controllable redox-induced in-situ growth of MnO2 over Mn2O3 for toluene oxidation: Active heterostructure interfaces[J]. Applied Catalysis B: Environmental, 2020, 278: 119279. |
| [28] |
RONG S P, ZHANG P Y, LIU F, et al. Engineering crystal facet of α-MnO2 nanowire for highly efficient catalytic oxidation of carcinogenic airborne formaldehyde[J]. ACS Catalysis, 2018, 8(4): 3435-3446. |
| [29] |
WU J L, XIA Q B, WANG H H, et al. Catalytic performance of plasma catalysis system with nickel oxide catalysts on different supports for toluene removal: Effect of water vapor[J]. Applied Catalysis B: Environmental, 2014, 156/157: 265-272. |
| [30] |
AUGUGLIARO V, KISCH H, LODDO V, et al. Photocatalytic oxidation of aromatic alcohols to aldehydes in aqueous suspension of home prepared titanium dioxide: 2. Intrinsic and surface features of catalysts[J]. Applied Catalysis A: General, 2008, 349(1/2): 189-197. |
| [31] |
SUN H, LIU Z G, CHEN S, et al. The role of lattice oxygen on the activity and selectivity of the OMS-2 catalyst for the total oxidation of toluene[J]. Chemical Engineering Journal, 2015, 270: 58-65. |
| [32] |
LI K Z, CHEN J J, BAI B Y, et al. Bridging the reaction route of toluene total oxidation and the structure of ordered mesoporous Co3O4: The roles of surface sodium and adsorbed oxygen[J]. Catalysis Today, 2017, 297: 173-181. |
| [33] |
MO S P, ZHANG Q, LI J Q, et al. Highly efficient mesoporous MnO2 catalysts for the total toluene oxidation: Oxygen-Vacancy defect engineering and involved intermediates using in situ DRIFTS[J]. Applied Catalysis B: Environmental, 2020, 264: 118464. |
| [34] |
RONG S P, ZHANG P Y, YANG Y J, et al. MnO2 framework for instantaneous mineralization of carcinogenic airborne formaldehyde at room temperature[J]. ACS Catalysis, 2017, 7(2): 1057-1067. |




