乙酸异丙酯具有水果香味,是一种重要的化工原料,主要用作涂料、印刷油墨等的溶剂,也是工业上常用的脱水剂,药物生产中的萃取剂以及香料组分[1-2]。乙酸异丙酯主要通过乙酸和异丙醇酯化反应得到,酯化反应[3-4]可通过反应精馏技术高效完成。反应精馏[5-8]是一种将反应和蒸馏结合在一起的新型工艺装置。与传统的两步工艺相比,其具有反应收率高、成本低、低能耗和废物排放少等优点[9]。该技术已经广泛应用于合成酯类物质,但是由于相关的热力学数据缺乏,其工艺优化受到一定的制约。
乙酸异丙酯生产过程中由于存在着共沸体系,既抑制了反应,又增加了能耗。正确预测共沸物的数量和类型对共沸物的分离起着至关重要的作用,残留曲线不仅能准确预测体系中存在的共沸物情况,还可以分析共沸物分离的可行性[10]。对于乙酸异丙酯体系中的共沸物分离也需要精确的热力学数据。目前,体系中的二元体系汽液相平衡已经有大量的实验数据[11-12],文献中已有大量二元体系的数据;三元体系的实验数据也有一些报道,李新利等[13]探究了醋酸异丙酯-醋酸-水体系的汽液平衡,Deng等[14]研究了乙酸异丙酯-乙酸-水和异丙醇-乙酸-水2个三元体系的汽液平衡。然而,现阶段对乙酸异丙酯体系的研究,并没有全面地分析共沸物的数量和类型以及分离的可行性,也缺少部分三元体系的汽液平衡数据以及萃取精馏的模拟。
本研究使用Dvorak-Boublik平衡釜测定了乙酸+异丙醇+乙酸异丙酯、乙酸+异丙醇+水、乙酸+乙酸异丙酯+水、异丙醇+乙酸异丙酯+水4个三元体系的汽液平衡数据。用Aspen Plus计算了乙酸+异丙醇+乙酸异丙酯、乙酸+异丙醇+水、乙酸+乙酸异丙酯+水、异丙醇+乙酸异丙酯+水4个三元体系残留曲线,分析了乙酸异丙酯体系存在的共沸物及其分离的可行性,并采用Aspen Plus对异丙醇+乙酸异丙酯+水三元混合物进行萃取精馏的模拟优化。
2 实验材料和方法 2.1 材料乙酸:分析纯,99.5%;异丙醇:分析纯,99.5%;乙酸异丙酯:分析纯,99%,均购自上海麦克林生化科技有限公司。百分数均为质量分数。去离子水:实验室自制。
2.2 主要实验装置Dvorak-Boublik汽液冷凝双循环平衡釜(如图 1所示);精密温度计,0~100 ℃、0~150 ℃,衡水精创仪器仪表有限公司;玻璃仪器气流烘干器,C20,山东荣创仪器有限公司;Dvorak-Boublik平衡釜;空盒气压表,DTM3型,天津凤洋仪器仪表工贸有限公司;接触调压器,TDGC2-2,浙江正泰电器股份有限公司;气相色谱,安捷伦7820A,安捷伦科技(中国)有限公司。
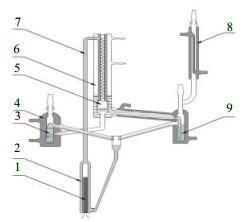
|
图 1 Dvorak-Boublik平衡釜的结构 Fig.1 Schematic diagram of the Dvorak-Boublik equilibrium still 1. heating rod 2. boiling chamber 3. liquid phase coolant storage bottle 4. water cooling jacket 5. vapor-liquid separator 6. vacuum jacket 7.lift pipe 8. condenser 9. vapor phase condensate storage bottle |
三元体系汽液平衡的测定:先按一定的比例配制其中两个组分的混合溶液,再依次向混合溶液中加入固定量的第3组分,分别测定达到平衡时的温度和汽液组成。实验具体步骤:先配制不同摩尔组分的溶液总体积为100 mL;将配制好的溶液分别倒入液相贮瓶和气相贮瓶,确保溶液充满液相贮瓶和气相贮瓶,再用橡胶塞堵住瓶口保证密封良好;将温度计放入温度计阱,再加入甘油与温度计阱阱口相平,确保温度计受热均匀;固定好加热棒,打开冷凝水,接通电源开关;每隔5 min调节电压阀增加5 V电压,记录温度计温度,直至温度计读数不再变化,即平衡温度;平衡40 min后用5 mL注射器同时从液相贮瓶和气相贮瓶取样2~3 mL,样品用5 mL的西林瓶密封处理;调节接触调压器电压至零,关闭电源,关闭冷凝水开关;用气相色谱检测从气相和液相中取得的样品,每个样品检测3次,取其平均值。
2.4 分析测定样品检测采用安捷伦GC-7820A气相色谱仪进行定量分析,色谱条件为:热导检测器(TCD)和HP-INNOWAX色谱柱(30 m×0.32 mm);载气(氢气)流量为20 mL⋅min−1;进样器温度为443 K,检测器温度为443 K;柱箱升温程序:初始温度为323 K,以升温速率10 K⋅min−1升至443 K,保持1 min;进样量为0.1 μL;分流比为60:1。每个样品至少分析3次,摩尔分数的绝对偏差为0.001,取平均值。
2.5 萃取精馏工艺乙酸和异丙醇酯化反应得到的四元混合物,其中乙酸不与另外3种组分产生共沸现象,易于从体系中分离除去,剩下的乙酸异丙酯、异丙醇和水3种组分可以形成三元共沸物较难分离。三元体系混合溶液摩尔分数为乙酸异丙酯:0.5、异丙醇:0.1、水:0.4;分离要求为乙酸异丙酯质量分数≥ 0.98、异丙醇质量分数≥ 0.99,处理量为100 kmol⋅h−1。采用Aspen Plus对体系残留曲线的分析,再进行萃取精馏工艺的模拟,利用灵敏度分析对相关的工艺参数进行优化。
3 实验结果与讨论 3.1 三元体系汽液平衡 3.1.1 汽液平衡数据在101.325 kPa下测定了乙酸(1)+异丙醇(2)+乙酸异丙酯(3)、乙酸(1)+异丙醇(2)+水(4)、乙酸(1)+乙酸异丙酯(3)+水(4)、异丙醇(2)+乙酸异丙酯(3)+水(4) 4个三元体系的汽液平衡数据。4个体系的测定过程中平衡时液相冷却液贮瓶和气相冷凝液贮瓶中的溶液均不出现液液分层现象,实验中出现液液分层现象时则停止实验,否则组成分析不准确。将测定的4个三元体系的实验数据用NRTL模型计算得到yical。实验测定的数据和模型计算值均列于表 1~4中。
|
|
表 1 在101.325 kPa下乙酸(1)+异丙醇(2)+乙酸异丙酯(3)实验值与计算值 Table 1 VLE experimental data and calculated values of acetic acid (1) + isopropanol (2) + isopropyl acetate (3) at 101.325 kPa |
|
|
表 2 在101.325 kPa下乙酸(1)+异丙醇(2)+水(4)体系实验值与计算值 Table 2 VLE experimental data and calculated values of acetic acid (1) + isopropanol (2) + water (4) at 101.325 kPa |
|
|
表 3 在101.325 kPa下乙酸(1)+乙酸异丙酯(3)+水(4)实验值与计算值 Table 3 VLE experimental data and calculated values of acetic acid (1) + isopropyl acetate (3) + water (4) at 101.325 kPa |
|
|
表 4 在101.325 kPa下异丙醇(2)+乙酸异丙酯(3) +水(4)实验值与计算值 Table 4 VLE experimental data and calculated values of isopropanol (2) + isopropyl acetate (3) + water (4) at 101.325 kPa |
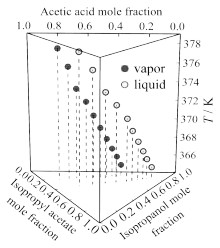
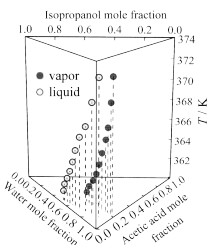
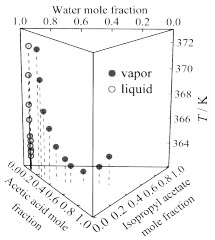
图 2将乙酸和乙酸异丙酯混合后,加入异丙醇,随着异丙醇的加入,平衡温度下降,液相和气相中乙酸和乙酸异丙酯含量(摩尔分数,后文含量均为摩尔分数)均下降。图 3将水和乙酸混合后,加入异丙醇,随着异丙醇的加入平衡温度下降;液相和气相中乙酸的含量下降幅度都比较小,水的含量下降比较明显。图 4将水和乙酸混合后,加入乙酸异丙酯,随着乙酸异丙酯的加入平衡温度先下降后上升,液相中水的含量下降幅度较大,液相中乙酸含量上升,气相中乙酸含量下降较少,水的含量略微增加;气相中乙酸含量较少,水和乙酸异丙酯溶解度很小,所以乙酸异丙酯在气相中含量较少,液相中因为乙酸的含量较多,可以溶解较多的乙酸异丙酯。图 5将异丙醇和水混合后,加入乙酸异丙酯,随着乙酸异丙酯的加入平衡温度下降;液相中异丙醇的含量略微增加,水的含量大幅度下降,气相中异丙醇的含量下降,水的含量下降幅度较小。
|
图 2 在101.325 kPa下乙酸(1)+异丙醇(2)+乙酸异丙酯(3)的T-x, y图 Fig.2 T-x, y diagram for acetic acid (1) + isopropanol (2) + isopropyl acetate (3) at 101.325 kPa |
|
图 3 在101.325 kPa下乙酸(1)+异丙醇(2)+水(4)的T-x, y图 Fig.3 T-x, y diagram for acetic acid (1) + isopropanol (2) + water (4) at 101.325 kPa |
|
图 4 在101.325 kPa下乙酸(1)+乙酸异丙酯(3)+水(4)的T-x, y图 Fig.4 T-x, y diagram for acetic acid (1) + isopropyl acetate (3) + water (4) at 101.325 kPa |
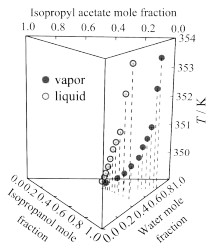
|
图 5 在101.325 kPa下异丙醇(2)+乙酸异丙酯(3)+水(4)的T-x, y图 Fig.5 T-x, y diagram for isopropanol (2) + isopropyl acetate (3) + water (4) at 101.325 kPa |
本研究测定的乙酸(1)+异丙醇(2)+乙酸异丙酯(3)和异丙醇(2)+乙酸异丙酯(3)+水(4)体系的汽液平衡报道较少,异丙醇(2)+乙酸异丙酯(3)+水(4)三元体系可以形成三元共沸物,汽液平衡数据对于其分离设计是至关重要的,本研究为共沸物的萃取精馏提供了可靠的热力学基础数据。对于乙酸(1)+异丙醇(2)+水(4)体系,Deng等[14]测定异丙醇摩尔分数在0.057 0~0.155 3,本研究测定异丙醇摩尔分数为0.024 0~0.315 5,拓展了异丙醇组分的研究范围,在异丙醇摩尔分数相同区域0.057 0~0.155 3内,本研究乙酸的摩尔分数从0.207 6变化到0.200 1,水的摩尔分数从0.714 6变化到0.656 5,文献中乙酸的摩尔分数变化从0.173 4变化到0.070 4,文献中水的摩尔分数从0.769 6变化到0.774 3;测定三元体系汽液平衡数据时,在异丙醇摩尔分数相同的区域,另外2个组分测定出的结果与文献不在相同浓度区间,所测数据可以扩展已报道体系的数据。乙酸(1)+乙酸异丙酯(3)+水(4)的体系相关报道[13, 15-16]较多,实验测定的浓度区域和文献中有重复的部分,为保证所研究体系整个数据的完整性,因而对系统中4个三元组分都进行了测定。测定的4个三元体系汽液平衡扩展了三元体系汽液平衡实验数据。
3.1.2 热力学一致性检验为了检验实验数据的可靠性[17],三元体系通过Van Ness点检验法[18]对三元体系汽液平衡数据进行热力学一致性检验[19~22],其公式如下:
| $ \Delta y{\text{ = }}\frac{1}{N}\sum\limits_{i = 1}^N {100\left| {y_i^{\exp } - y_i^{{\text{cal}}}} \right|} $ | (1) |
式中:N表示实验点的个数,yiexp和yical分别表示气相摩尔分数的实验测定值与模型计算值。若Δy < 1,则可以认为实验数据符合热力学一致性条件。乙酸(1)+异丙醇(2)+乙酸异丙酯(3)、乙酸(1)+异丙醇(2)+水(4)、乙酸(1)+乙酸异丙酯(3)+水(4)、异丙醇(2)+乙酸异丙酯(3)+水(4)4个三元体系的热力学一致性检验结果如表 5所示,4个体系均通过Van Ness法的热力学一致性检验。
|
|
表 5 Van Ness点检验法的热力学一致性检验结果 Table 5 Thermodynamic consistency test results of Van Ness point-to-point method |
将本工作中测定的实验数据用NRTL模型[23]进行关联,NRTL模型公式如下:
| $ \ln {\gamma _i} = \frac{{\sum\nolimits_j {{\tau _{ij}}{x_j}{G_{ji}}} }}{{\sum\nolimits_k {{x_k}{G_{ki}}} }} + \sum\limits_i {\frac{{{x_j}{G_{ij}}}}{{\sum\nolimits_k {{x_k}{G_{kj}}} }}} \left[ {{\tau _{ij}} - \frac{{\sum\nolimits_m {{\tau _{mj}}{x_m}{G_{mj}}} }}{{\sum\nolimits_k {{x_k}{G_{kj}}} }}} \right] $ | (2) |
| $ {G_{ij}} = {\exp _{}}\left( { - \alpha {}_{ij}{\tau _{ij}}} \right) $ | (3) |
| $ {\tau _{ij}} = \frac{{\Delta {g_{ij}}}}{{RT}} $ | (4) |
式中:γi为组分i的活度系数,
| $ OF = \sum\limits_{i{\text{ = 1}}}^N ( \gamma _i^{\exp } - \gamma _i^{{\text{cal}}}{)^2} $ | (5) |
使用NRTL模型对实验测定的数据进行关联,得到二元交互参数列于表 6中。因为体系中含有极性较强的物质,用二元汽液平衡关联得到的二元交互参数去预测三元体系数据精确性有限;2个物质的二元交互参数在不同的三元体系中也是不同的,因此以实验测定三元汽液平衡数据关联二元交互参数,考虑了三元混合溶液的非理想性,得到的参数更加适用于后续共沸物分离模型。
|
|
表 6 乙酸异丙酯酯化体系中4个三元体系的NRTL模型参数 Table 6 NRTL model parameters of the four ternary systems in the isopropyl acetate esterification system |
乙酸(1)+异丙醇(2)+乙酸异丙酯(3)、乙酸(1)+异丙醇(2)+水(4)、乙酸(1)+乙酸异丙酯(3)+水(4)、异丙醇(2)+乙酸异丙酯(3)+水(4) 4个三元体系的NRTL模型计算的yical和Tcal列于表 1~4。其最大绝对偏差与平均绝对偏差列于表 7,NRTL模型的计算值与实验测得数据的偏差都在合理的范围内。实验体系与文献[13-16]中已报道的最大绝对偏差和平均绝对偏差对比如表 7所示,本实验体系的偏差总体比文献中偏差小。
|
|
表 7 三元体系气相摩尔分数和温度的最大绝对偏差与平均绝对偏差 Table 7 Maximum absolute deviations and mean absolute deviations of vapor-phase mole fraction for ternary system |
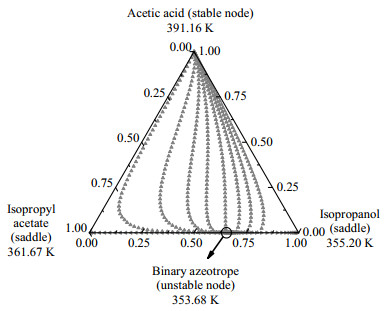
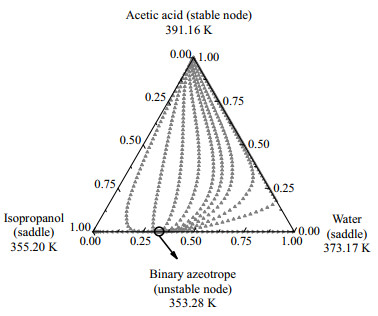
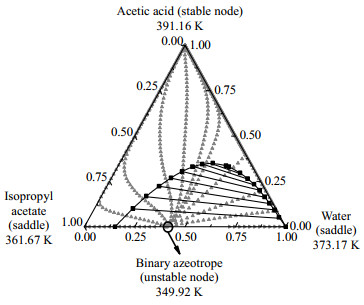
乙酸异丙酯体系存在多个共沸体系,在反应精馏生产乙酸异丙酯的过程中,如何有效分离体系中存在的共沸物是一个难题,残留曲线图用于分析共沸混合物的可行性。使用Aspen Plus计算了残留曲线图,因为体系中存在强缔合作用的乙酸,选用NRTL-HOC模型进行计算,得到4个三元体系的残留曲线图。乙酸异丙酯体系中乙酸+异丙醇+乙酸异丙酯、乙酸+异丙醇+水、乙酸+乙酸异丙酯+水、异丙醇+乙酸异丙酯+水4个三元体系的残留曲线图,如图 6~9所示。
|
图 6 在101.325 kPa下乙酸+异丙醇+乙酸异丙酯体系残留曲线 Fig.6 Residue curve map of the acetic acid + isopropanol + isopropyl acetate system at 101.325 kPa |
|
图 7 在101.325 kPa下乙酸+异丙醇+水体系残留曲线 Fig.7 Residue curve map of the acetic acid + isopropanol + water system at 101.325 kPa |
|
图 8 在101.325 kPa下乙酸+乙酸异丙酯+水体系残留曲线 Fig.8 Residue curve map of the acetic acid+ isopropyl acetate + water system at 101.325 kPa |
|
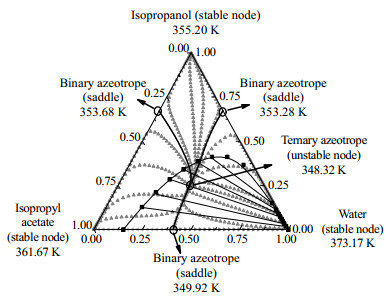
图 9 在101.325 kPa下异丙醇+乙酸异丙酯+水体系残留曲线 Fig.9 Residue curve map of the isopropanol + isopropyl acetate +water system at 101.325 kPa |
根据残留曲线的分析同时也得到了乙酸异丙酯体系的共沸物组分及沸点温度如表 8所示。
|
|
表 8 乙酸异丙酯体系共沸物组分 Table 8 Azeotrope in the isopropyl acetate system |
由图 6~9可以看出乙酸+异丙醇+乙酸异丙酯体系的中不稳定节点是异丙醇和乙酸异丙酯的二元共沸物,文献[14]中异丙醇和乙酸异丙酯的共沸物温度为353.52 K,异丙醇摩尔分数为0.657 7,乙酸异丙酯摩尔分数为0.342 3,分析残留曲线得到的共沸物的温度和组成与文献的基本吻合。乙酸+异丙醇+水体系有1个不稳定节点是异丙醇和水的二元共沸物,文献[14]中异丙醇和水的共沸物温度为353.35 K,异丙醇摩尔分数为0.632 3,乙酸异丙酯摩尔分数为0.367 7,残留曲线分析的共沸物的温度与文献温度基本一致,共沸物的摩尔分数偏差为0.038。乙酸+乙酸异丙酯+水体系中有1个不稳定节点是水和乙酸异丙酯的二元共沸物。异丙醇+乙酸异丙酯+水体系中有1个不稳定节点是异丙醇+乙酸异丙酯+水三元共沸物,3个稳定节点是纯组分,以及3个鞍点是水和异丙醇、水和乙酸异丙酯、异丙醇和乙酸异丙酯3种二元共沸物。3个鞍点与1个不稳定节点形成了两条蒸馏边界线,划分出了3个蒸馏区;所有剩余曲线都从不稳定节点开始,并在稳定节点结束。残留曲线向鞍点移动,然后远离鞍点,但决不会在鞍点处停止。图 9说明萃取精馏分离异丙醇+乙酸异丙酯+水三元共沸物是可行的。
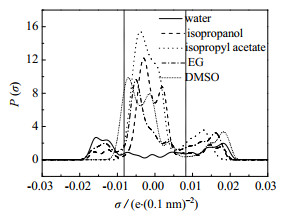
3.3 萃取精馏分离异丙醇+水+乙酸异丙酯 3.3.1 萃取剂和物性方法的选择由于异丙醇+乙酸异丙酯+水三元混合物形成共沸物,故采用萃取精馏的方法进行分离。对于酯醇水之间的共沸物的分离常用的萃取剂有乙二醇、二甲基亚砜和离子液体等,考虑到经济性,离子液体远远贵于乙二醇(EG)和二甲基亚砜(DMSO),很难用于实际分离过程。对于EG和DMSO的选择,通过COSMO-RS模型计算了水、异丙醇、乙酸异丙酯、乙二醇和二甲基亚砜的σ-profiles,结果见图 10。σ-profiles分为3个区域[29-30]:氢键供体区(σ < −0.008 2 e⋅(0.1 nm)−2),非极性区(−0.008 2 e⋅(0.1 nm)−2 < σ < 0.008 2 e⋅(0.1 nm)−2),氢键受体区(σ > 0.008 2 e⋅(0.1 nm)−2);σ-profiles的峰值距离0.008 2 e⋅(0.1nm)−2的绝对值更远,氢键供体/受体能力越强[31]。水和异丙醇都具有氢键供体和受体能力,而乙酸异丙酯只有受体能力;EG和DMSO都具有氢键受体的能力,但是EG的氢键供体能力比DMSO强,更易与水、异丙醇和乙酸异丙酯结合,所以EG作为萃取剂更优,从绿色环保的角度考虑,EG也优于DMSO,所以选择EG作为萃取剂。
|
图 10 水、异丙醇、乙酸异丙酯,乙二醇和二甲基亚砜的σ-profiles图 Fig.10 σ-profiles of water, isopropanol, isopropyl acetate, EG and DMSO |
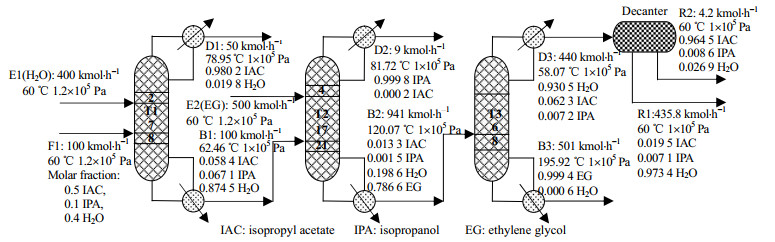
考虑到异丙醇、乙酸异丙酯和水均为极性非理性物质,且水和醇之间存在缔合作用,因此溶液模型采用RNTL-HOC模型。异丙醇+乙酸异丙酯+水三元混合物的萃取精馏采用三塔分离工艺,工艺流程如图 11所示,塔T1和塔T2为精馏塔,塔T3为萃取剂再生塔。进料前进行预热处理,进料温度:60 ℃,进料压力:1.2×105 Pa;塔T1以更经济的水为萃取剂,即可从塔顶得到符合要求的乙酸异丙酯(质量分数≥ 98%),塔釜的水和异丙醇混合物进入塔T2。塔T2选用筛选的萃取剂EG,塔顶得到异丙醇(质量分数≥ 99%),塔釜的水和EG经过萃取剂再生塔得到EG和水,水中含有少量的异丙醇和乙酸异酯,通过分相器分相处理,得到的水(质量分数≥97%)可再次作为T1塔的萃取剂循环使用,以及少量乙酸异丙酯(质量分数≥96%)。
|
图 11 三塔萃取精馏分离异丙醇+乙酸异丙酯+水工艺流程 Fig.11 Flow chart of the extractive distillation process of isopropanol + isopropyl acetate + water |
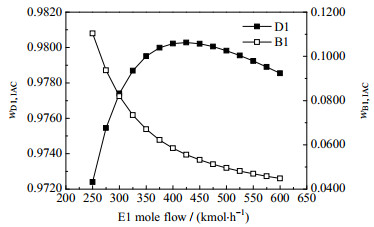
在精馏过程中,萃取剂的进料流量、理论塔板数、料液的进料位置以及回流比等工艺参数对分离效果有至关重要的影响。塔T3是萃取剂再生塔,优化较易,主要考虑塔T1和塔T2。在Aspen Plus通过灵敏度分析了塔T1和塔T2相关的工艺参数。结果如图 12~21所示:
|
图 12 萃取剂E1摩尔流量对分离效果的影响 Fig.12 Effects of molar flow rate of extractant E1 on separation |
|
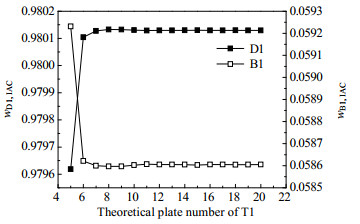
图 13 精馏塔T1的理论塔板数对分离效果的影响 Fig.13 Effects of theoretical plate number on the separation efficiency of the distillation column T1 |
|
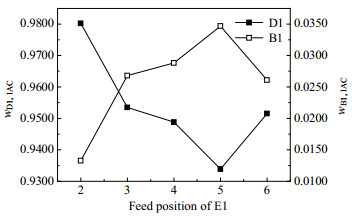
图 14 萃取剂E1的进料位置对分离效果的影响 Fig.14 Effects of feed position of extractant E1 on separation |
|
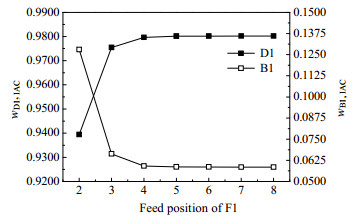
图 15 原料F1的进料位置对分离效果的影响 Fig.15 Effects of feed position of raw material F1 on separation |
|
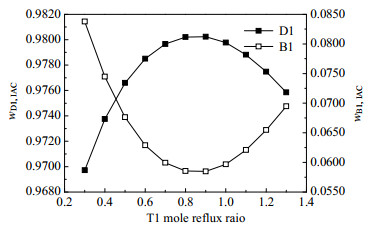
图 16 精馏塔T1的回流比对分离效果的影响 Fig.16 Effects of reflux ratio on separation efficiency of rectifying column T1 |
|
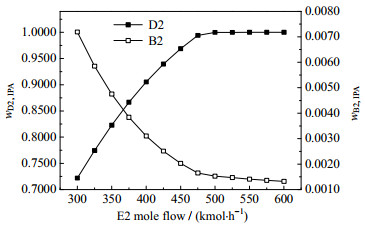
图 17 萃取剂E2摩尔流量对分离效果的影响 Fig.17 Effects of molar flow rate of extractant E2 on separation |
|
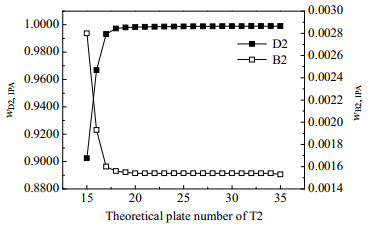
图 18 精馏塔T2的理论塔板数对分离效果的影响 Fig.18 Effects of theoretical plate number on the separation efficiency of the distillation column T2 |
|
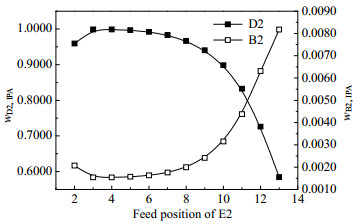
图 19 萃取剂E2的进料位置对分离效果的影响 Fig.19 Effects of feed position of extractant E2 on separation |
|
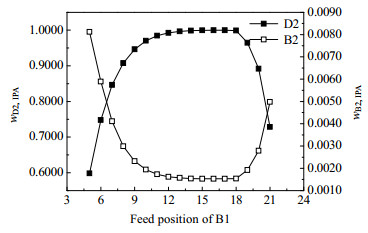
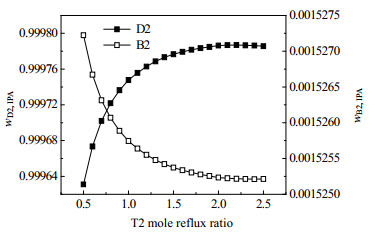
图 20 B1的进料位置对分离效果的影响 Fig.20 Effects of feed position of B1 on separation |
|
图 21 精馏塔T2的回流比对分离效果的影响 Fig.21 Effects of reflux ratio on separation efficiency of rectifying column T2 |
据灵敏度分析,三塔萃取精馏分离异丙醇+乙酸异丙酯+水工艺流程共沸物分离流程优化后的工艺参数如表 9所示:
|
|
表 9 各塔的参数优化结果 Table 9 Parameter optimization results of each tower |
对于异丙醇+乙酸异丙酯+水的三元混合物萃取分离文献也有相关报道,Shi等[32]研究了预浓缩器的双塔萃取蒸馏(各个塔的理论塔板数T1:91,T2:27,T3:20)和三塔萃取蒸馏(各个塔的理论塔板数T1:64,T2:36,T3:39)分离异丙醇+水+乙酸异丙酯,其分离结果:异丙醇、乙酸异丙酯和水的质量分数分别为99.5%、98.5% 和99.5%。本研究分离得到的乙酸异丙酯(质量分数为98.02%)和异丙醇(质量分数为99.98%)纯度与文献结果相近;水(质量分数为97.34%)的分离纯度稍差,但是本研究中水作为塔T1的萃取剂可以循环使用;理论塔板数远小于文献方案,塔的设计成本更低;本研究使用水和乙二醇作萃取剂,也比二甲基亚砜更加契合绿色环保的理念。
4 结论(1) 用Dvorak-Boublik平衡釜测定了乙酸+异丙醇+乙酸异丙酯、乙酸+异丙醇+水、乙酸+乙酸异丙酯+水、异丙醇+乙酸异丙酯+水4个三元体系的汽液平衡数据,4个体系均通过Van Ness点检验法的热力学一致性检验,扩展了三元体系的汽液平衡数据。
(2) 研究了乙酸+异丙醇酯化体系中的4个三元体系的残留曲线,得到了体系中存在的共沸物的数量和类型以及共沸物组成和沸点温度,分析了分离三元共沸物的可行性。
(3) 利用Aspen Plus软件模拟了三塔萃取精馏分离异丙醇+乙酸异丙酯+水工艺流程,优化了萃取剂的进料流量、理论塔板数、料液的进料位置和回流比等工艺参数,分离后乙酸异丙酯质量分数能达到98.02%,异丙醇的质量分数可达到99.98%。
(4) 实验测定的汽液相平衡数据以及萃取精馏的模拟对工业上乙酸+异丙醇酯化反应生产乙酸异丙酯及其产物的分离具有重要的意义。
符号说明:
B1、B2、B3
w
— 质量分数
— 精馏塔T1、T2、T3的塔釜流股
xi
— 液相摩尔分数
D1、D2、D3
yi
— 气相摩尔分数
— 精馏塔T1、T2、T3的塔顶流股
Δy1
— 气相摩尔分数平均绝对偏差
DMSO
— 二甲基亚砜
Δmaxy
— 气相摩尔分数最大绝对偏差
E1
— 萃取剂水
α12
— 相对挥发度
E2
— 萃取剂乙二醇
αij
— NRTL方程非随机参数
EG
— 乙二醇
γi
— 活度系数
F1
— 原料
σ
— 屏蔽电荷密度
Δgij
— 二元相互作用参数
上标
N
— 实验点数
cal
— 计算值
P (σ)
— 屏蔽电荷密度函数
exp
— 实验值
R1
— 分相器水相流股
下标
R2
— 分相器有机相流股
IAC
— 乙酸异丙酯
T
— 平衡温度,K
IPA
— 异丙醇
ΔT
— 温度平均绝对偏差,K
i, j, k, m, 1, 2, 3
ΔmaxT
— 温度最大绝对偏差,K
— 组分
| [1] |
LAI I K, HUNG S B, HUNG W J, et al. Design and control of reactive distillation for ethyl and isopropyl acetates production with azeotropic feeds[J]. Chemical Engineering Science, 2007, 62(3): 878-898. DOI:10.1016/j.ces.2006.10.019 |
| [2] |
FANG P, WANG J, ZENG Z X, et al. Solubility and liquid-liquid equilibria for the isopropyl acetate + isopropanol + acetic acid + water quaternary system at 313.15 K and 101.3 kPa[J]. Journal of Chemical & Engineering Data, 2019, 64(10): 4551-4556. |
| [3] |
徐浩, 李洋, 夏成康, 等. 吡啶硫酸氢盐离子液体催化甘油与乙酸酯化反应动力学[J]. 化工学报, 2020, 71(11): 5178-5187. XU H, LI Y, XIA C K, et al. Kinetics of esterification of glycerol with acetic acid catalyzed by pyridine bisulfate ionic liquid[J]. CIESC Journal, 2020, 71(11): 5178-5187. |
| [4] |
夏成康, 徐浩, 何瑞宁, 等. 离子液体催化乙酸和乙醇酯化反应动力学的分析[J]. 高校化学工程学报, 2021, 35(6): 1027-1034. XIA C K, XU H, HE R N, et al. Kinetic analysis of acetic acid and ethanol esterification catalyzed by ionic liquids[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(6): 1027-1034. DOI:10.3969/j.issn.1003-9015.2021.06.010 |
| [5] |
LI Y, ZOU Y, XU H, et al. Preparation of n-amyl acetate via esterification of acetic acid and n-amyl alcohol using [hso3-pmim][hso4]/sio2 as catalyst: catalyst preparation, characterization and reaction kinetics[J]. Chemical Engineering Journal, 2021, 410: 128282. DOI:10.1016/j.cej.2020.128282 |
| [6] |
HE R N, DONG Y B, ZOU Y, et al. Simulation and optimization of reactive distillation for the production of ethyl acetate using [bmim]hso4 as catalyst[J]. Chemical Engineering Research and Design, 2020, 161: 218-231. DOI:10.1016/j.cherd.2020.01.014 |
| [7] |
YANG J B, ZHOU L H, GUO X T, et al. Study on the esterification for ethylene glycol diacetate using supported ionic liquids as catalyst: Catalysts preparation, characterization, and reaction kinetics, process[J]. Chemical Engineering Journal, 2015, 280: 147-157. DOI:10.1016/j.cej.2015.05.096 |
| [8] |
HE R N, ZOU Y, MUHAMMAD Y, et al. Study on the intensification of reaction kinetics and reactive distillation for the esterification of n-butyl acetate using [HSO3-BMIM][HSO4] as a high-efficiency ionic liquid catalyst[J]. Industrial & Engineering Chemistry Research, 2021, 60(35): 12847-12863. |
| [9] |
TEODORESCU M, AIM K, WICHTERLE I. Isothermal vapor liquid equilibrium in the quaternary water + 2-propanol + acetic acid + isopropyl acetate system with chemical reaction[J]. Journal of Chemical & Engineering Data, 2001, 46(2): 261-266. |
| [10] |
DEVI V K P J, SAI P S T, BALAKRISHNAN A R. Experimental studies and thermodynamic analysis of isobaric vapor-liquid-liquid equilibria of 2-propanol + water system using n-propyl acetate and isopropyl acetate as entrainers[J]. Fluid Phase Equilibria, 2017, 454: 22-34. DOI:10.1016/j.fluid.2017.09.010 |
| [11] |
李嘉琪, 丁辉, 高郁杰, 等. 乙酸异丙酯-异丙醇-DMSO的等压汽液相平衡和萃取精馏模拟[J]. 化学工业与工程, 2017, 34(6): 62-69. LI J Q, DING H, GAO Y J, et al. Vapor-liquid equilibria and simulation of extractive distillation for ternary mixtures of isopropyl alcohol, isopropyl acetate and DMSO[J]. Chemical Industry and Engineering, 2017, 34(6): 62-69. |
| [12] |
XIE Q, WAN H, HAN M, et al. Investigation on isobaric vapor-liquid equilibrium for acetic acid + water + methyl ethyl ketone + isopropyl acetate[J]. Fluid Phase Equilibria, 2009, 280(1/2): 120-128. |
| [13] |
李新利, 畅伟贤, 万辉等. 醋酸异丙酯-醋酸-水体系汽液相平衡研究[J]. 高校化学工程学报, 2006, 20(1): 7-11. LI X L, CHANG W X, WAN H, et al. Vapor-liquid equilibria of isopropyl acetate-acetic acid-water system[J]. Journal of Chemical Engineering of Chinese Universities, 2006, 20(1): 7-11. |
| [14] |
DENG X M, NOOR I I, ZHANG J, et al. Isobaric vapour-liquid equilibrium for binary and ternary systems of isopropyl acetate, isopropyl alcohol, acetic acid and water at 101.3 kPa[J]. The Journal of Chemical Thermodynamics, 2022, 165: 106662. DOI:10.1016/j.jct.2021.106662 |
| [15] |
蔡锐, 张鹏. 醋酸-水-醋酸异丙酯、醋酸-水-醋酸异丁酯体系汽液平衡研究[J]. 天然气化工, 2005, 30(5): 75-77. CAI R, ZHANG P. A study on vapour-liquid equilibrium of acetic acid-water-isopropyl acetate and acetic acid-water-isobutyl acetate systems[J]. Low-Carbon Chemistry and Chemical Engineering, 2005, 30(5): 75-77. |
| [16] |
CHANG W, GUAN G, LI X, et al. Isobaric vapor-liquid equilibria for water + acetic acid + (n-pentyl acetate or isopropyl acetate)[J]. Journal of Chemical & Engineering Data, 2005, 50(4): 1129-1133. |
| [17] |
冯微, 顾正桂, 曹晓艳. 叔丁醇-异丙醇-水汽液平衡数据的测定及关联[J]. 化学工程, 2017, 45(3): 42-45. FENG W, GU Z G, CAO X Y. Measurement and correlation of vapor-liquid equilibria for tert-butanol-isopropanol-water system[J]. Chemical Engineering, 2017, 45(3): 42-45. |
| [18] |
童张法, 王坤, 孙丽霞, 等. α-蒎烯+对伞花烃和β-蒎烯+对伞花烃体系减压汽液平衡数据的测定与关联[J]. 高校化学工程学报, 2011, 25(5): 734-739. TONG Z F, WANG K, SUN L X, et al. Measurement and correlation of VLE data for α-pinene + p-cymene and β-pinene + p-cymene systems at reduced pressures[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(5): 734-739. |
| [19] |
周峰, 陈长旭, 许春建. 乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系汽液平衡[J]. 化工学报, 2017, 68(2): 560-566. ZHOU F, CHEN C X, XU C J. Isobaric vapor-liquid equilibrium for binary systems of isoamyl acetate + isoamyl alcohol and isoamyl acetate + n-hexanol at 50.00 and 101.33 kPa[J]. CIESC Journal, 2017, 68(2): 560-566. |
| [20] |
ZHONG Y, WU Y Y, ZHU J W, et al. Thermodynamics in separation for the ternary system 1, 2-ethanediol + 1, 2-propanediol + 2, 3-butanediol[J]. Industrial & Engineering Chemistry Research, 2014, 53(30): 12143-12148. |
| [21] |
谈金辉, 徐菊美, 施云海. 常压下乙醇-水-醋酸钾系统汽液平衡数据的测定与关联[J]. 化工学报, 2020, 71(8): 3444-3451. TAN J H, XU J M, SHI Y H. Measurement and correlation of vapor-liquid equilibria for ethanol-water-potassium acetate system under atmospheric pressure[J]. CIESC Journal, 2020, 71(8): 3444-3451. |
| [22] |
徐健元, 吴艳阳, 徐菊美, 等. 2 kPa下均三甲苯-偏三甲苯与均三甲苯-邻甲乙苯体系二元汽液相平衡数据研究及精馏模拟[J]. 化工学报, 2021, 72(9): 4504-4510. XU J Y, WU Y Y, XU J M, et al. Study on vapor-liquid equilibria and distillation simulation of 1, 3, 5-trimethylbenzene-1,2,4-trimethyl-benzene and 1,3,5-trimethylbenzene-2-ethyltoluene at 2 kPa[J]. CIESC Journal, 2021, 72(9): 4504-4510. |
| [23] |
RENON H, PRAUSNITZ J M. Estimation of parameters for the NRTL equation for excess Gibbs energies of strongly nonideal liquid mixtures[J]. Industrial & Engineering Chemistry Process Design and Development, 1969, 8(3): 413-419. |
| [24] |
童张法, 杨征宇, 廖丹葵, 等. α-蒎烯+柠檬烯和对伞花烃+柠檬烯体系常压汽液平衡的测定与关联[J]. 化工学报, 2009, 60(8): 1877-1882. TONG Z F, YANG Z Y, LIAO D K, et al. Measurement and correlation of VLE data for α-pinene + limonene and p-cymene + limonene systems under atmospheric pressure[J]. CIESC Journal, 2009, 60(8): 1877-1882. |
| [25] |
YANG S K, ZHANG Y P, WANG X J, et al. Isobaric VLE data for 1-methyl-3-ethylbenzene or 1-methyl-4-ethylbenzene + 1, 2, 4-trimethylbenzene at 20 kPa[J]. The Journal of Chemical Thermodynamics, 2013, 60: 52-56. |
| [26] |
YANG S K, WANG Y J, WANG X J, et al. Isobaric vapor-liquid equilibrium data for the system of 1-methyl-2-ethylbenzene + 1,2,4-trimethylbenzene at 10 kPa[J]. Journal of Chemical & Engineering Data, 2013, 58(2): 398-401. |
| [27] |
GAO D M, ZHU D C, SUN H, et al. Isobaric vapor-liquid equilibria for binary and ternary mixtures of methanol, ethanoic acid, and propanoic acid[J]. Journal of Chemical & Engineering Data, 2010, 55(9): 4002-4009. |
| [28] |
CHEN Q Y, ZHANG L D, ZHANG H, et al. Measurements and correlation of isobaric vapor-liquid equilibrium data for binary mixtures of furan, oxolane, and furan-2-carbaldehyde and application of the binary model parameters for further prediction of the ternary system[J]. Journal of Chemical & Engineering Data, 2020, 65(5): 2583-2596. |
| [29] |
YAN L Q, LI J L, YE Q, et al. Sustainable wastewater treatment via extractive distillation process with ionic liquid as entrainer for the separation of ethyl acetate/isopropanol/water[J]. Process Safety and Environmental Protection, 2022, 160: 527-540. |
| [30] |
YUE K, ZHOU G W. Isobaric vapor-liquid equilibrium for ethyl acetate + ethanol with ionic liquids [MMIM][DMP] and [OMIM][PF6] as entrainers[J]. Journal of Molecular Liquids, 2022, 348: 118404. |
| [31] |
XU Y J, LI T T, PENG C J, et al. Influence of C2-H of imidazolium-based ionic liquids on the interaction and vapor-liquid equilibrium of ethyl acetate + ethanol system: [Bmim]BF4 vs [Bmmim]BF4[J]. Industrial & Engineering Chemistry Research, 2015, 54(36): 9038-9045. |
| [32] |
SHI T, YANG A, JIN S M, et al. Comparative optimal design and control of two alternative approaches for separating heterogeneous mixtures isopropyl alcohol-isopropyl acetate water with four azeotropes[J]. Separation and Purification Technology, 2019, 225: 1-17. |




