克拉维酸钾是一种β-内酰胺酶抑制剂,它与阿莫西林或替卡西林钠复配使用,可显著降低其最小抑菌浓度[1, 2]。与其它β-内酰胺酶抑制剂相比,克拉维酸具有更强、更广的抑制作用[3],因此在临床上得到了广泛应用。近年来,随着细菌耐药性问题的日益严重,克拉维酸钾的市场销量呈上升态势。
目前克拉维酸主要由棒状链霉菌发酵生产,发酵液经过一系列的浓缩、分离和纯化过程,最后通过反应结晶将克拉维酸转化为克拉维酸金属盐,主要为克拉维酸钾。为获得高纯度的克拉维酸钾产品,工业上需要额外增加一步形成克拉维酸胺盐的中间结晶步骤,即两步结晶法:第一步结晶形成克拉维酸胺盐中间体,第二步结晶(通常选取异辛酸钾为成盐剂)得到克拉维酸钾盐。胺盐中间体主要是克拉维酸叔丁胺[4~6],也有克拉维酸叔辛胺[7, 8]或一些多聚胺[4]。两步结晶能获得较高纯度的结晶产品,但增加形成克拉维酸胺盐中间体的额外工艺步骤,降低总工艺收率,生产成本高;另外,其中间体胺盐有毒,且很难从废水中全部去除,污染环境。为解决上述问题,国内外学者纷纷开发不经过胺盐中间体的一步结晶工艺,其中Kim等[9]分别用甲基异丁基酮、正丁醇溶解异辛酸钾,克拉维酸钾结晶收率可达70%以上;也有专利研究用碳盐钾或碳酸氢钾为成盐剂[10],首先通过成盐剂与克拉维酸反应合成克拉维酸钾从而将其反萃到水相中(水溶液中的克拉维酸盐浓度要求≥ 200 g·L-1),然后加入30倍的丙酮或异丙醇溶析结晶,收率可达80%以上,但该工艺要求浓缩倍数大、能耗高,有机溶剂使用量大。现有文献报道的一步结晶工艺获得的克拉维酸钾产品纯度和收率不能兼顾,均未能在工业上实际应用。进一步分析发现,这些工艺均没有明确给出结晶产品的纯度和杂质含量,且缺乏对结晶过程的系统优化。
基于对工业生产中两步结晶法存在问题的分析,本研究省去形成克拉维酸胺盐中间体的步骤,直接将克拉维酸与成盐剂异辛酸钾一步反应结晶制备克拉维酸钾(图 1)。系统考察结晶过程中异辛酸钾用量、搅拌速率和温度等因素对产品质量(纯度、杂质含量、粒度分布和晶形)和收率的影响,确定关键的影响因素并优化工艺操作条件,以期获得高纯度和高得率的克拉维酸钾产品。
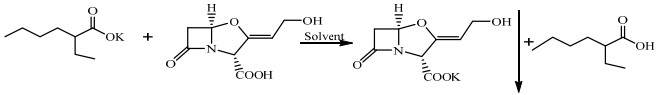
|
图 1 克拉维酸钾一步反应结晶方程式 Fig.1 Scheme of one-step reactive crystallization of potassium clavulanate |
甲醇、乙醇、异丙醇、丙酮、乙酸乙酯和异辛酸钾为分析纯,购自国药化学试剂有限公司;硫酸氢四丁基胺为色谱纯,购自美国阿拉丁工业公司;活性炭(分析纯)、克拉维酸标准品(纯度 > 99%)和克拉维酸溶液(克拉维酸含量为40 g·L-1,纯度为90.82%,其中杂质E为1.26%,杂质G为0.46%,总杂质为3.18%)均由国药集团威奇达药业有限公司提供。ODS Hypersil色谱柱(4.6 mm×100 mm,5 µm)购自Thermo Fisher Scientific公司。仪器包括:AB204-N型电子分析天平(梅特勒-托利多仪器(上海)有限公司);JJ200Y型精密电子天平(美国双杰兄弟集团有限公司);DLSB-10/40低温冷阱(郑州长城科工贸有限公司);YZ1515x蠕动泵(兰格恒流泵有限公司);D2010W电动搅拌器(上海梅颖浦仪器仪表制造有限公司);DZF-6050B真空干燥箱(昆山一恒仪器有限公司);2010A高效液相色谱仪(日本岛津仪器有限公司);卡尔费休水分分析仪(梅特勒-托利多仪器(上海)有限公司);Malvern S型粒度分析仪(英国马尔文公司);JSM-5600LV型扫描电子显微镜(日本电子光学公司)。
2.2 实验过程结晶操作采用半间歇方式,装置如图 2所示。
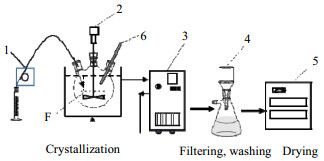
|
图 2 克拉维酸钾反应结晶装置
Fig.2 Schematic diagram of the experimental setup for reactive crystallization of potassium clavulanate
1. peristaltic pump 2. stirring controller 3. cold hydrazine 4. filter setups 5. vacuum oven 6. thermometer |
将250 mL克拉维酸溶液倒入500 mL三口烧瓶中,置于DLSB-10/40低温冷阱中,三口瓶中间口插入不锈钢两叶式螺旋桨,用D2010W电动搅拌器控制搅拌速度,两侧口一个插入温度计(或pH计),另一个插入玻璃管,与YZ1515x蠕动泵用胶管连接。启动搅拌(100~500 r·min-1),待温度恒定后(15 ℃),按一定的克拉维酸与异辛酸钾摩尔比(1:1~1:1.3)用YZ1515x蠕动泵将预先配好的异辛酸钾溶液(浓度为0.50~1.00 mol·L-1,温浴至15℃)流加到烧瓶中,流加速度为1.80~6.90 mL·min-1,加料点位置如图 2 F点,即以搅拌浆为中心形成圆的边缘处,垂直方向上为液体高度的1/2处。流加完毕后,按图 3所示的三种降温模式养晶,搅拌速度为180 r·min-1。结晶结束后,抽滤,沉淀用乙酸乙酯洗涤两次,真空干燥得到结晶产品。
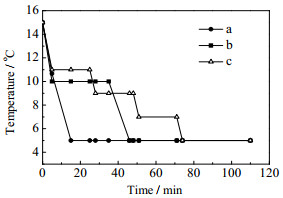
|
图 3 养晶降温模式 Fig.3 Different cooling modes for crystal growth |
用2010A高效液相色谱仪测定克拉维酸和杂质(杂质E、杂质G、总杂质)的含量,色谱柱为ODS Hypersil (4.6 mm×100 mm,5 µm),高效液相色谱方法详见作者的前期研究[11];梅特勒卡尔费休水分仪测定产品水分;JSM-5600LV型扫描电子显微镜(scanning electron microscopy,SEM)观测晶体的表面形貌和结构,操作电压15~20 kV;Malvern激光粒度分析仪分析测定产品粒度分布(CSD)。
结晶收率(Y)计算公式如下:
| $ Y/\% = m/M \times 100 $ | (1) |
式中M为克拉维酸与异辛酸钾反应生成克拉维酸钾的理论质量(g),m为实际称量的克拉维酸钾结晶产品的干重(g)。
3 结果与讨论 3.1 结晶溶剂筛选反应结晶的溶剂对晶体成核和晶体生长的影响较大。选取甲醇、乙醇、异丙醇、乙酸乙酯、丙酮5种溶剂,考察不同溶剂对结晶的影响,进而筛选出合适的反应结晶溶剂。从图 4中可以看出,使用甲醇得到结晶产品的杂质E和杂质G含量最低,即甲醇的除杂效果最好。因此后续实验均选用甲醇作为结晶溶剂。
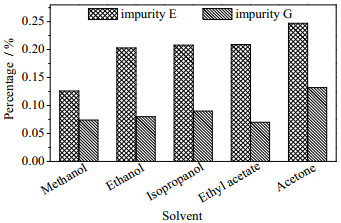
|
图 4 溶剂对结晶的影响 Fig.4 Effects of solvents on the crystallization of potassium clavulanate (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 1.00 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1, potassium isooctanoate addition rate 2.40 mL·min-1; stirring rate 330 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1 with cooling mode of "a" as shown in Fig. 3) |
异辛酸钾浓度对晶体成核的速率影响较大。从图 5中可以看出,随着异辛酸钾浓度的降低,杂质E、杂质G均减少,且杂质E降低的趋势更为明显,但收率也会降低;当异辛酸钾浓度降至0.56 mol·L-1,继续降低异辛酸钾浓度对杂质去除效果不明显,但仍显著降低产品收率。经综合考虑,确定优化的异辛酸钾浓度为0.56 mol·L-1。
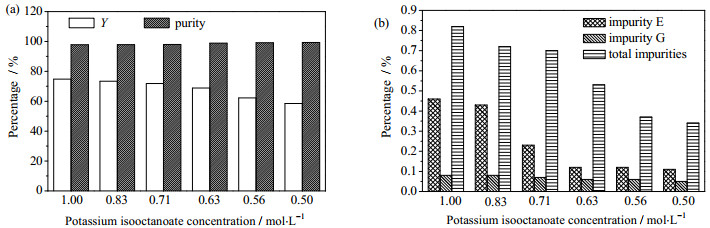
|
图 5 异辛酸钾浓度对结晶的影响 Fig.5 Effects of potassium isooctanoate concentrations on the crystallization of potassium clavulanate (conditions: clavulanic acid 40 g·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1, potassium isooctanoate addition rate 2.40 mL·min-1; stirring rate 330 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1 with cooling mode of "a" as shown in Fig. 3) |
克拉维酸与异辛酸钾摩尔比也是影响结晶收率的关键因素之一。从图 6中可以看出,随着克拉维酸与异辛酸钾摩尔比降低,产品杂质含量先降低后增加,而收率呈相反趋势。这可能跟体系pH的变化有关,随着异辛酸钾用量增加,体系pH值从5.67增大到6.87,而克拉维酸在pH为6.39时最稳定[12]。此外,pH值可以通过影响溶质溶解度、改变杂质活性和晶面的吸附等来直接或间接影响晶体的生长,进而影响产品的质量和收率[13~15]。经综合考虑,确定优化的克拉维酸与异辛酸钾摩尔比为1:1.2。
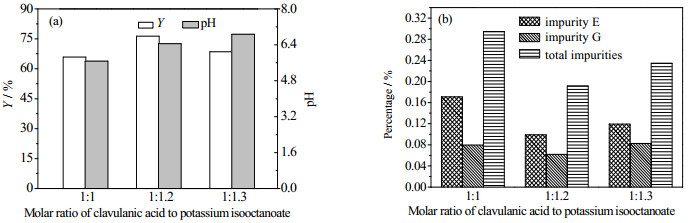
|
图 6 克拉维酸与异辛酸钾摩尔比对结晶的影响 Fig.6 Effects of molar ratios of clavulanic acid to potassium isooctanoate on the crystallization of potassium clavulanate (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, potassium isooctanoate addition rate 2.40 mL·min-1; stirring rate 330 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1 with cooling mode of "a" as shown in Fig. 3) |
晶体的生长速率和成核速率都与体系的过饱和度有关。反应物的流加速率过快,体系中过饱和度产生的速度太快,成核速率过快,产生大量细小晶核;而当流加速率过慢,由于克拉维酸易发生降解产生杂质也不利于克拉维酸钾结晶。因此本文考察不同的异辛酸钾溶液流加速率对结晶的影响。随着流加速率增大,产品杂质含量先降低后增加、收率呈相反趋势(图 7),晶体的长径比增大、细晶的数量减少、晶体聚结得到改善(图 8)。可能的原因为:当流加速率过快时,体系的过饱和度产生过快,产生晶核的速率大于晶体生长的速率,未能充分消耗溶质,使得收率降低。同时流加速率增大,杂质的析出速度也增大,使得杂质增多;而当流加速率过低时,晶体易发生聚结,包藏少量母液,从而导致杂质含量也较高。综合考虑产品收率和纯度,确定优化的异辛酸钾溶液流加速率为4 mL·min-1。
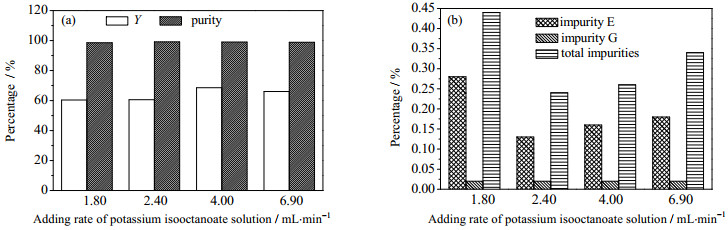
|
图 7 异辛酸钾溶液流加速率对结晶的影响 Fig.7 Effect of adding rate of potassium isooctanoate solution on the crystallization of potassium clavulanate (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1.2; stirring rate 330 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1 with cooling mode of "a" as shown in Fig. 3) |

|
图 8 不同异辛酸钾溶液流加速率下晶体扫描电镜图
Fig.8 SEM micrographs of potassium clavulanate crystal obtained with different potassium isooctanoate addition rates
(conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1.2; stirring rate 330 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1 with cooling mode of "a" as shown in Fig. 3) a:1.80 mL·min-1 b:2.40 mL·min-1 c:4.00 mL·min-1 d:6.90 mL·min-1 |
搅拌速率是工业结晶中一个重要的影响因素,成核速率和溶质扩散都会受到搅拌的影响。考察了搅拌速率对晶体粒度分布的影响,结果如图 9所示。随着搅拌速率增加,晶体平均粒度减小。这是因为搅拌速率过低时,成盐剂不能即时散开,反应在局部进行,随着成盐剂的不断流加,晶体粒度变大;同时当搅拌速率低时,由于局部过饱和度过大,晶体易发生聚结[16, 17]。而当搅拌速率过大时,晶浆内的剪切应力过大,致使晶体破碎,晶体粒度减小,同时根据Botsaris二次成核理论[18],搅拌强度增大,二次成核速率增大,晶体粒度减小。为使得克拉维酸钾晶体平均粒度为50~60 μm,确定优化的反应搅拌速率为280 r·min-1。而在养晶过程中,晶体生长只需晶浆悬浮混匀即可,因此可降低为180 r·min-1。

|
图 9 搅拌速率对晶体平均粒度的影响 Fig.9 Effects of stirring rates on mean crystal size (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1.2, potassium isooctanoate addition rate 4.00 mL·min-1; stirring rate 330 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1 with cooling mode of "a" as shown in Fig. 3) |
温度的影响包括反应温度和养晶温度两个方面。预实验结果表明,较高的反应温度有利于反应的快速进行,但反应温度过高,克拉维酸降解加快,降解产生的杂质会影响产品的纯度,因此选取反应时温度为15℃。异辛酸钾溶液流加结束后,需要进一步降温养晶。由于克拉维酸钾溶解度随着温度的降低而降低,低温更有利于晶体的析出。因此,选取养晶温度为5℃。
养晶过程对产品收率和晶体的完整性有较大的影响。一方面晶核不断生长,消耗溶质,提高产品收率,另一方面,养晶过程中小的晶体溶解,较大晶体继续生长,有利于晶体的粒度分布均匀。而养晶时的降温模式是控制晶体生长的主要操作因素。从图 10中可以看出,降温模式b得到的晶体杂质含量最低。这是因为降温模式a得到的晶体聚结最为严重,包藏少量母液,从而导致杂质含量较高;而降温模式c时处于较高温度的时间最长,克拉维酸发生降解,产生杂质较多,导致产品纯度下降。进一步地,从图 11可以看出,降温模式b得到的晶体形状最佳;降温方式a得到的晶体聚结最为严重,且晶体单元短小;降温模式c得到的晶体表面粗糙,有小的晶核粘附。另一方面,降温模式a得到的晶体收率最高,降温模式c得到的晶体收率最低(图 10),这是因为克拉维酸钾在醇类溶剂的溶解度随着温度的降低而降低[19, 20],因此降温过程中处于低温时间越长越有利于溶质析出;与此相反,降温模式c得到的晶体平均粒度最大,降温模式a得到的晶体平均粒度最小(图 12)。从上述结果可以看出,养晶时的降温模式对产品的收率、杂质含量、晶体粒度分布等的影响不尽相同,可以在后续的研究中根据不同的需求作进一步的优化。本研究中权衡收率和纯度,确定优化的降温模式为b,即以0.5℃·min-1的降温速率从15℃降到10℃后保持30 min,再以同样速率从10℃降至5℃,保持60 min。
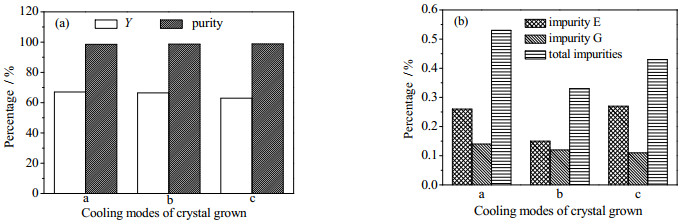
|
图 10 养晶降温模式对结晶的影响 Fig.10 Effects of cooling modes of crystal grown (a, b and c in Fig. 3) on the crystallization of potassium clavulanate (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1.2, potassium isooctanoate addition rate 4.00 mL·min-1; stirring rate 280 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1) |

|
图 11 不同养晶降温模式下得到的晶体扫描电镜图 Fig.11 SEM micrographs of potassium clavulanate crystal obtained with different cooling modes of crystal grown (a, b and c in Fig. 3) (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1.2, potassium isooctanoate addition rate 4.00 mL·min-1; stirring rate 280 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1) |

|
图 12 养晶降温模式对晶体粒度的影响 Fig.12 Effects of cooling modes of crystal growth (a, b and c in Fig. 3) on crystal size distribution (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1.2, potassium isooctanoate addition rate 4.00 mL·min-1; stirring rate 280 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1) |
在结晶过程中,杂质对晶体成核、晶体生长以及晶体聚结产生影响,进而影响产品质量和收率。优化上述条件后,考察克拉维酸溶液的杂质含量的对结晶的影响,其中将国药集团威奇达药业有限公司提供的克拉维酸溶液定义为高杂质含量组,经活性炭处理进一步除杂后的克拉维酸溶液定义为低杂质含量组。从表 1中可以看出,克拉维酸溶液中的杂质含量对克拉维酸钾结晶有着显著影响,低杂质含量组得到的克拉维酸钾产品收率和质量均比高杂质含量组高。低杂质含量组得到的产品纯度大于99%,收率大于73%,各项杂质指标符合EP 8.0和中国药典2015年版的要求。而且,从图 13中可以看出,低杂质含量组得到的克拉维酸钾晶体几乎不聚结;而高杂质含量组得到的克拉维酸钾晶体由于杂质具有黏性,促进了聚结的搭桥过程,晶体出现了聚结现象。
|
|
表 1 克拉维酸溶液杂质含量对结晶质量和收率的影响 Table 1 Effects of impurity contents of clavulanic acid solution on the crystallization of potassium clavulanatea |

|
图 13 不同杂质含量的克拉维酸溶液得到的克拉维酸钾晶体扫描电镜图
Fig.13 SEM micrographs of potassium clavulanate crystal obtained from clavulanic acid solution with different impurity contents
(a: high impurity content; b: low impurity content) (conditions: clavulanic acid 40 g·L-1, potassium isooctanoate 0.56 mol·L-1, molar ratio of clavulanic acid to potassium isooctanoate 1:1.2, potassium isooctanoate addition rate 4.00 mL·min-1; stirring rate 280 r·min-1 and temperature 15℃ (reaction process); crystal growth process: stirring rate 180 r·min-1 with cooling mode of "b" as shown in Fig. 3) |
比较了一步结晶工艺在优化操作条件下得到的产品与工业生产中采用的两步结晶工艺得到产品质量和收率,结果如表 2所示。从表 2中可以看出,一步结晶产品杂质含量和收率与两步结晶相当,且杂质含量符合中国药典2015年版要求(杂质E ≤1.00%、杂质G ≤ 1.00%、总杂质≤ 2.00%)。与两步结晶相比,一步结晶省去了形成克拉维酸胺盐中间体的步骤,简化了工艺流程,可以降低生产成本。
|
|
表 2 一步结晶与两步结晶产品比较 Table 2 Comparison of crystallization products via one or two-step crystallization |
通过系统考察克拉维酸钾一步反应结晶过程中异辛酸钾用量、异辛酸钾溶液流加速率、搅拌速率和温度等因素对产品质量和收率的影响,优化确定了克拉维酸钾结晶工艺的操作条件为:异辛酸钾浓度0.56 mol·L-1,克拉维酸与异辛酸钾摩尔比1:1.2, 异辛酸钾溶液流加速率4 mL·min-1;反应时搅拌速率280 r·min-1,温度15℃;养晶时搅拌速率180 r·min-1,降温方式以0.5℃·min-1的降温速率从15℃降到10℃,保持30 min后以同样速率降至5℃,保持60 min。同时发现杂质含量低的克拉维酸溶液得到的晶体晶形完整、为棒状晶体、不聚结、粒度分布均匀。优化条件下得到的克拉维酸钾产品纯度大于99%,收率大于73%,杂质含量符合《中国药典》2015年版要求。本研究采用单因素实验的方法对克拉维酸钾一步结晶工艺进行了初步优化,在后续的研究中将采用正交设计或响应面等方法对工艺条件作进一步优化,为工艺的放大及工业化提供更有力的支撑。
| [1] | Vons C, Barry C, Maitre S, et al. Amoxicillin plus clavulanic acid versus appendicectomy for treatment of acute uncomplicated appendicitis:an open-label, non-inferiority, randomised controlled trial[J]. The Lancet, 2011, 377(9777): 1573-1579. DOI:10.1016/S0140-6736(11)60410-8. |
| [2] | Howarth T T, Brown A G, King T J. Clavulanic acid, a novel β-lactam isolated from Streptomyces clavuligerus; X-ray crystal structure analysis[J]. Journal of the Chemical Society, Chemical Communications, 1976(7): 266b-267. DOI:10.1039/C3976000266B. |
| [3] | Payne D J, Cramp R, Winstanley D J, et al. Comparative activities of clavulanic acid, sulbactam, and tazobactam against clinically important beta-lactamases[J]. Antimicrobial Agents and Chemotherapy, 1994, 38(4): 767-772. DOI:10.1128/AAC.38.4.767. |
| [4] | Cook M A, Curzons A D, Wilkins R B. Amine salt of clavulanic acid, its preparation and use: EP 0026044B1[P]. 1983-06-08. |
| [5] | Butterly P G, Keohane G J, Kosal E F. Process for preparing potassium clavulanate: US 6414142B1[P]. 2002-07-02. |
| [6] | Capuder E. Process for the isolation of clavulanic acid and of pharmaceutically acceptable salts thereof from the fermentation broth of streptomyces sp. P6621 FERM P2804: US 6207428B1[P]. 2001-03-27. |
| [7] | LIU Bao-shu(刘宝树), WANG Jing-kang(王静康), GONG Jun-bo(龚俊波), et al. Study on the reactive crystallization of potassium clavulanate(克拉维酸钾反应结晶研究)[J]. Chinese Journal of Antibiotics(中国抗生素杂志), 2005, 30(11): 656-658, 698. DOI:10.3969/j.issn.1001-8689.2005.11.005. |
| [8] | Yang H S, Choi N H, Lee S C, et al. Process for the purification of crude clavulanic acid: EP 0594099B1[P]. 1998-06-24. |
| [9] | Kim J W, Choi N H, Choi G S, et al. Process for manufacturing clavulanic acid salt: US 5734048[P]. 1998-03-31. |
| [10] | ZHAO Zhi-quan (赵志全). A new method for the preparation of clavulanate salt (一种制备克拉维酸盐的新方法): CN 101279982A[P]. 2008-10-08. |
| [11] | HU Chun-yan(胡春燕), QIN Chao(秦超), WANG Xu-dong(王旭东), et al. Stability of clavulanic acid in ethyl acetate(克拉维酸在乙酸乙酯中的稳定性)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2017, 31(2): 270-275. |
| [12] | Haginaka J, Nakagawa T, Uno T. Stability of clavulanic acid in aqueous solutions[J]. Chemical and Pharmaceutical Bulletin, 1981, 29(11): 3334-3341. DOI:10.1248/cpb.29.3334. |
| [13] | YIN Ping(殷萍), WEI Hong-yuan(卫宏远). Effect of pH on the solubility and crystallizing metastable zone of ammonium sulfate(pH值对硫酸铵溶解度及结晶介稳区的影响)[J]. Chemical Industry and Engineering(化学工业与工程), 2009, 26(2): 137-140. DOI:10.3969/j.issn.1004-9533.2009.02.010. |
| [14] | ZHANG Rong(张荣), CHEN Jing(陈静). The influence of crystallization control to the crystal morphology(结晶控制技术对晶体形貌的影响)[J]. Guang Zhou Chemical Industry(广州化工), 2011, 39(3): 30-31. DOI:10.3969/j.issn.1001-9677.2011.03.011. |
| [15] | HOU Chong-qiang(侯崇强). Effects of temperature and pH on the crystallization yield of meleumycin(温度和pH对麦白霉素结晶收率的影响)[J]. Journal of North Pharmacy(北方药学), 2012, 9(9): 7-7. |
| [16] | Grimbergen R F P, Boek E S, Meekes H, et al. Explanation for the supersaturation dependence of the morphology of lysozyme crystals[J]. Journal of Crystal Growth, 1999, 207(1): 112-121. |
| [17] | GONG Jun-bo(龚俊波), HOU Jing-mei(侯静美), LIU Sheng(刘胜), et al. Optimization of cefadroxil monohydrate reactive crystallization process(头孢羟氨苄单水合物反应结晶工艺优化)[J]. Chinese Journal of Antibiotics(中国抗生素杂志), 2012, 37(4): 280-283. DOI:10.3969/j.issn.1001-8689.2012.04.008. |
| [18] | Botsaris G D, Qian R Y, Barrett A. New insights into nucleation through chiral crystallization[J]. AIChE Journal, 1999, 45(1): 201-203. DOI:10.1002/(ISSN)1547-5905. |
| [19] | Liu B S, Wang J K, Sun H. Solubility of potassium clavulanate in aqueous 2-propanol mixtures[J]. Journal of Chemical & Engineering Data, 2006, 51(1): 291-293. |
| [20] | Liu B S, Gong J B, Wang J K, et al. Solubility of potassium clavulanate in ethanol, 1-propanol, 1-butanol, 2-propanol, and 2-methyl-1-propanol between 273K and 305K[J]. Journal of Chemical & Engineering Data, 2005, 50(5): 1684-1686. |




