2. 洛阳理工科技学院 环境工程与化学学院,河南 洛阳 471023
2. School of Environmental Engineering and Chemistry, Luoyang Institute of Science and Technology, Luoyang 471023, China
喜树碱(分子式C20H16N2O4,CAS号:7689-03-4,简称CPT)是一种天然生物碱,结构式如图 1,1958年首次被Wall 和Wani [1, 2]从亚洲喜树中分离提取出。作为一种抗癌天然药物,CPT能够有效抑制真核拓扑异构酶I。目前市场上有伊立替康和拓扑替康一系列CPT衍生物的抗癌药物,CPT作为一种中间产物,其纯度对CPT抗癌药物有着重要的影响。

|
图 1 CPT 的结构式 Fig.1 Chemical structure of camptothecin |
原料药或合成药物的中间产物的提纯方法很多种,最常用的是结晶[3~5]。对于结晶过程固液相平衡研究中,溶解度的测定是很重要不可缺少的部分[6~11]。目前还未见有关CPT溶解度的文献报道,本文旨在研究CPT在二甲亚砜(dimethylsulfoxide,DMSO)和甲醇(或乙醇)混合溶液的溶解度的测定,并计算了相关的热力学参数,这对以后CPT的结晶提纯有着理论指导意义。
2 实验部分 2.1 原料试验中所用的原料见表 1。CPT含量为98%(wt),甲醇、乙醇和DMSO都是分析纯,实验用水为去离子水。
| 表 1 原料的来源和纯度 Table 1 Sources and purity of the materials |
实验中采用重量法测定CPT的溶解度[7~11]。重量法是特定温度下,在溶剂中加入过量的溶质搅拌溶解后,静置取上层清液并称重(即:m1+m2+m3),待溶剂蒸发完全后,对剩余固体溶质再次称重(m1,),两次称重的差值为溶剂的质量(m2+m3),混合溶剂按照一定的摩尔比配制,求算出m2和 m3,从而计算溶解度。把过量CPT和定量的溶剂置于夹层反应器中,夹层反应器用低温恒温槽控温(温度的不确定度为0.05K),磁力搅拌最少保持12 h,静置8 h后取上层清液用0.22 μm的有机滤膜过滤,虑后的样品置于玻璃培养皿中称重,在真空干燥箱中干燥,待溶剂挥发完全后再次称重即为m1。CPT在溶剂中的溶解度x1由下式计算得出:
| ${{x}_{1}}=\frac{{{m}_{1}}/{{M}_{1}}}{{{m}_{1}}/{{M}_{1}}+{{m}_{2}}/{{M}_{2}}+{{m}_{3}}/{{M}_{3}}}$ | (1) |
| ${{x}_{\text{2}}}=\frac{{{m}_{2}}/{{M}_{2}}}{{{m}_{2}}/{{M}_{2}}+{{m}_{3}}/{{M}_{3}}}$ | (2) |
式中M1,M2,M3分别是CPT,DMSO和甲醇(或乙醇)的摩尔质量(g⋅mol-1),m1,m2,m3分别是CPT,DMSO和甲醇(或乙醇)的质量(g),x2是DMSO在DMSO和甲醇(或乙醇)混合溶剂中的摩尔分数。
2.3 验证试验采用重量法测定对甲基苯甲酸的溶解度,在溶剂水中加入过量的对甲基苯甲酸,搅拌后静置取上层清液于培养皿中称重,真空干燥后对剩余固体再次称重,即可计算出对甲基苯甲酸的溶解度,如下表中,xexp为重量法测定的实验值,xlit为对甲基苯甲酸的文献值,数据和文献值[12~14]比较,溶解度的相对误差ADD在2% 以内,说明此实验方法是可靠的。
| $ADD=\frac{\left| {{x}_{lit}}-{{x}_{\exp }} \right|}{{{x}_{\exp }}}$ | (3) |
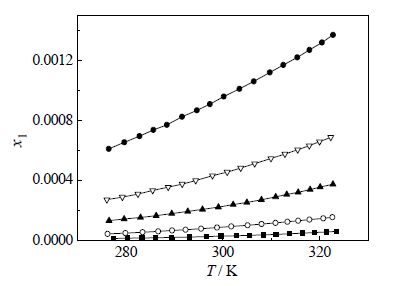
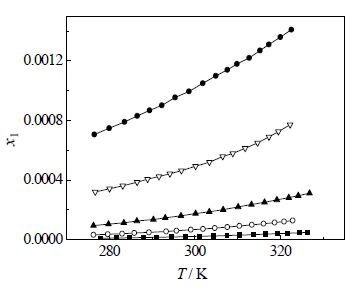
由上述方法测得CPT在DMSO+甲醇(或乙醇)混合溶剂中的溶解度见表 2、表 3和图 2、图 3。表中T为绝对温度(K)。从表 3和图 2、图 3中可看出,CPT溶解度随着DMSO在混合溶剂中的摩尔分数和温度的增大而增大。
| 表 2 压强为0.1 MPa 下对甲基苯甲酸在水中的 溶解度实验值xexp 和文献值xlit Table 2 Experimental xexp and literature xlit results of mole fraction solubility of p-toluic acid in water at 0.1 MPa |
| 表 3 压强为0.1 MPa 下CPT 在DMSO+甲醇(或乙醇)溶剂中固液相平衡数据 Table 3 Solid-liquid equilibria of camptothecine in DMSO-methanol/ethanol solvents at 0.1 MPa |
|
图 2 CPT 在DMSO+甲醇溶剂中的溶解度 Fig.2 Solubility of CPT in DMSO+ methanol mixed solutions |
|
图 3 CPT 在DMSO+乙醇溶剂中的溶解度 Fig.3 Solubility of CPT in DMSO+ ethanol mixed solutions |
采用Apelblat方程、λh方程和理想状态方程来表述固液相平衡状态的相关参数。表述固液相平衡状态经常用Apelblat方程来表示[15]:
| $\ln x=A+\frac{B}{T}+C\ln \left( T \right)$ | (4) |
式中A、B和C表示Apelblat经验方程中的三个参数; x表示溶液中CPT的摩尔分数;T表示绝对温度(K)。A、B和C的拟合值见表 4。平均偏差(AAD)和均方根偏差(RMSD)的计算公式如下:
| $AAD=\frac{\sum\limits_{i=1}^{N}{\frac{\left| {{x}_{i,cal}}-{{x}_{i,\exp }} \right|}{{{x}_{i,\exp }}}}}{N}$ | (5) |
| $RMSD={{\left[ \sum\limits_{i=1}^{N}{\frac{{{\left( {{x}_{i,cal}}-{{x}_{i,\exp }} \right)}^{2}}}{N}} \right]}^{1/2}}$ | (6) |
| 表 4 Apelblat 方程的拟合结果 Table 4 Regression results of the modified Apelblat equation |
λh 方程是一个半经验方程,最初由Buchowski提出,所以也被称为Buchowski-Ksiazczak方程,λh 方程中只用两个参数λ和h来表述固液相平衡状态。λh 方程如下式[16]:
| $\ln \left[ 1+\frac{\lambda \left( \text{1-}x \right)}{x} \right]=\lambda h\left( \frac{1}{T}-\frac{1}{{{T}_{m}}} \right)$ | (7) |
式中Tm是溶质(CPT)的熔点;λ和h是方程的两个参数;x 表示溶液中CPT的摩尔分数;T 表示绝对温度(K)。CPT的熔点由差示扫描量热法(型号是 STA409PC-luxx)测得为543.95 K。λ和h是由方程7拟合得到,见表 5。
| 表 5 λh 方程的拟合结果 Table 5 Regression result of the λh equation |
理想状态方程是基于热力学原理用来表述固液平衡状态的最常用的方程[17],理想状态模型如下式(8):
| $\ln x=\frac{a}{T}+b$ | (8) |
式中;a和b是方程的两个参数;x表示溶液中CPT的摩尔分数;T表示绝对温度(K)。a和b由方程(8)拟合得到,见表 6。
| 表 6 理想状态方程的拟合结果 Table 6 Regression results of the ideal model |
如上所示,采用Apelblat方程、λh方程和理想状态方程来拟合相平衡实验数据,单从AAD和RMSD很难判断哪个模型拟合的效果更好,在此引入Akaike信息的价值标准(AIC)来评判拟合效果。在文献[18]中,AIC提供了一个简单有效客观的方法进行数据分析,选出“最佳数据模型”。一般来说,AIC的值最小的模型可以被认为是拟合效果最好的数据模型。
AIC 的计算公式如下[19]:
| $AIC=-2\ln (L)+2\kappa $ | (9) |
式中 κ 是统计模型中参数的数量,L 是估计的似然函数的模型的最大值。
进一步假设模型的方差未知且相等,AIC 的计算公式简化如下式:
| $AIC=2\kappa +N\left[ \ln (2\pi RSS/N)+1 \right]$ | (10) |
式中N是实验数据点的数量,RSS是残差平方和,RSS的计算公式如下:
| $RSS=\sum\limits_{i=1}^{N}{{{\left( {{x}_{i,cal}}-{{x}_{i,\exp }} \right)}^{2}}}$ | (11) |
按照参考文献[18]把Nln(2π)和常数N分离出来,AIC可简化为:
| $AIC=2\kappa +N\ln (RSS/N)$ | (12) |
按照上式计算出Apelblat方程、λh方程和理想状态方程的AIC值见表 7。从表中可以看出:在DMSO + (甲醇或乙醇)混合系统中λh方程的AIC值最小,所以λh方程的拟合效果最好。在(DMSO +甲醇)混合系统,λh方程的最小相关误差最小,分别是Apelblat方程和理想状态方程的1.10×1015和3.0倍;同样在(DMSO +乙醇)混合系统,λh方程的最小相关误差分别是Apelblat方程和理想状态方程的1.59×107和32.33倍。
| 表 7 Apelblat 方程,λh 方程和理想状态方程的Akaike 信息的价值标准 Table 7 Results of the Akaike’s information criterion for the modified Apelblat equation, λh equation and ideal model |
在固液相平衡体系中,热力学参数是很重要的热力学参数,作者计算出在 DMSO + (甲醇或乙醇)混合系统中溶解焓、溶解熵和溶解吉布斯自由能。为了减小计算误差,采用修正的 van’t Hoff 方程来计算热力学参数,在此引入一个参数简谐温度Thm:
| ${{T}_{hm}}=\frac{n}{\sum\limits_{j=1}^{n}{\frac{1}{{{T}_{j}}}}}$ | (13) |
式中 n 是测得实验数据的温度的个数。
在恒定压力下,固体在溶液中的溶解度和温度存在下面的函数关系式[20~22]:
| ${{\left( \frac{\partial \ln {{x}_{1}}}{\partial (1/T-1/{{T}_{hm}})} \right)}_{p}}=-\frac{{{\Delta }_{sol}}{{H}^{o}}}{R}$ | (14) |
式中${{\Delta }_{sol}}{{H}^{o}}$是表观摩尔焓,R 是气体常数,T 是绝对温度,x 是 CPT 在混合溶剂中的溶解度。
吉布斯自由能也是在温度为 Thm计算得出的:
| ${{\Delta }_{sol}}{{G}^{o}}=-R\times {{T}_{hm}}\times Intercept$ | (15) |
Intercept 是以ln x1 和(1/T -1/Thm)作图得出的斜率,溶解熵由下式计算出[23~25]:
| ${{\Delta }_{sol}}{{S}^{o}}=\frac{{{\Delta }_{sol}}{{H}^{o}}-{{\Delta }_{sol}}{{G}^{o}}}{{{T}_{hm}}}$ | (16) |
由上式计算出的,和见表 8。由表 8可看出,和都是正值,都是负值。为正值说明溶解过程是吸热的,为正值说明是一个自发溶解的过程,为负值可能是由于计算的温度范围偏小,还有一方面可能是因为溶质的溶解度偏小。
| 表 8 溶解焓、溶解熵和吉布斯自由能的计算结果 Table 8 Standard enthalpy, entropy and Gibbs energy change of camptothecine in solvent mixtures |
(1) 采用重量法测定了CPT在DMSO + 甲醇(或乙醇)混合溶剂中的溶解度,CPT的溶解度随温度和混合溶剂中DMSO摩尔分率的增大而增大。
(2) 分别用修正Apelblat方程、λh方程和理想状态方程对CPT在DMSO+甲醇(或乙醇)混合溶剂中的溶解度进行关联,获得了相关模型参数。通过Akaike信息的价值标准得出λh方程关联的效果较好。
(3) 根据溶解度数据和修正的Apelblat方程计算出溶解焓、溶解熵和溶解吉布斯自由能。
符号说明:
| 表 Table |
| [1] | Wall M E, Wani M C, Cook C E . Plant antitumor agents. I. The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from camptotheca acuminata1,2[J]. Journal of the American Chemical Society , 1966, 88 (16) : 3888-3890 DOI:10.1021/ja00968a057 |
| [2] | Lorence A, Nessler C L . Camptothecin, over four decades of surprising findings[J]. Phytochemistry , 2004, 65 (20) : 2735-2749 DOI:10.1016/j.phytochem.2004.09.001 |
| [3] | ZHANG Hai-tao (张海涛). Research on crystallization technique of cefotaxime sodium (头孢噻肟钠结晶技术研究) [D]. Tianjin (天津): Tianjin University (天津大学), 2008. |
| [4] | LIN Bo (林波). Crystal structure studies of -conotoxins in complex with acetylcholine-binding proteins (α-芋螺毒素与乙酰胆碱结合蛋白共结晶研究)[D]. Haikou (海口): Hainan University (海南大学), 2014. |
| [5] | CHEN Kui (陈葵). Study on the erythromycin crystallization processes (红霉素结晶过程研究) [D]. Shanghai (上海):East China University of Science and Technology (华东理工大学), 2011. |
| [6] | WANG Wei(汪伟), ZHANG Yan(张彦), WANG Ya-yun(王亚运) . Measurement and correlation of the solubility of aluminium ethoxide(三乙醇铝溶解度的测定及关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29 (6) : 1293-1296 |
| [7] | Shen Y M, Liu Z F, Li T . Determination and correlation of solubility of tylosin tartrate in alcohol mixtures[J]. The Journal of Chemical Thermodynamics , 2015, 80 : 128-134 DOI:10.1016/j.jct.2014.08.026 |
| [8] | Zhang Y, Liu J J, Zhang L . Solubility of 2,5-di-tert-butylhydroquinone and process design for its purification using crystallization[J]. Journal of Chemical & Engineering Data , 2015, 60 (7) : 1968-1974 |
| [9] | Li C L, Wang Q B, Shen B W . Solubilities of 5,10,15,20-tetraphenylporphyrin and 5,10,15,20-tetra(p-chlorophenyl)porphyrin in binary N,N-dimethylformamide + water solvent mixtures[J]. Journal of Chemical & Engineering Data , 2015, 60 (10) : 2834-2842 |
| [10] | Gao X, Xue W L, Zeng Z X . Determination and correlation of solubility of N-tert-butylacrylamide in seven different solvents at temperatures between (279.15 and 353.15) K[J]. Journal of Chemical & Engineering Data , 2015, 60 (8) : 2273-2279 |
| [11] | Shen Y M, Liu Z F, Zhi J J . Solubility correlation and thermodynamic analysis of solution of tylosin tartrate in methanol + tetrahydrofuran or acetone) mixtures[J]. Journal Of Molecular Liquids , 2015, 203 : 131-136 DOI:10.1016/j.molliq.2014.12.040 |
| [12] | Sugunan S, Thomas B . Salting coefficients of 2-, 3-, and 4-methylbenzoic acids[J]. Journal of Chemical & Engineering Data , 1993, 38 (4) : 520-521 |
| [13] | Apelblat A, Manzurola E . Solubilities of o-acetylsalicylic, 4-aminosalicylic, 3,5-dinitrosalicylic, and p-toluic acid, and magnesium-DLaspartate in water from T=(278 to 348)K[J]. The Journal of Chemical Thermodynamics , 1999, 31 : 85-91 DOI:10.1006/jcht.1998.0424 |
| [14] | Kong Q R, Cheng Y W, Bao X X . Solubility and partition coefficient of p-toluic acid in p-xylene and water[J]. Fluid Phase Equilibria , 2013, 340 : 46-51 DOI:10.1016/j.fluid.2012.12.009 |
| [15] | Apelblat A, Manzurola E . Solubilities of o-acetylsalicylic, 4-aminosalic, 3,5-dinitrosalicylic and p-toluic acid and magnesiumDL-aspartate in water from 278 to 348 K[J]. The Journal of Chemical Thermodynamics , 1991, 31 : 85-91 |
| [16] | Buchowski H, Ksiazcak A, Pietrzyk S . Solvent activity along saturation line and solubility of hydrogen-bonding solids[J]. The Journal of Chemical Physics , 1980, 84 (9) : 975-979 DOI:10.1021/j100446a008 |
| [17] | HAN Shi-jun(韩世钧) . Chemical phase equilibrium(化工相平衡)[M]. Beijing(北京): China Petrochemical Press(中国石化出版社), 1991 . |
| [18] | Burnham K P, Anderson D R, Huyvaert K P . AIC model selection and multimodel inference in behavioral ecology:some background, observations, and comparisons[J]. Behavioral Ecology and Sociobiology , 2011, 65 (1) : 23-35 DOI:10.1007/s00265-010-1029-6 |
| [19] | Kai Y, Hu Y, Liu Y . The solubility of mercaptosuccinic acid in water +(methanol, ethanol, acetone) mixtures from[J]. Fluid Phase Equilibria , 2014, 361 : 282-288 DOI:10.1016/j.fluid.2013.11.001 |
| [20] | Guo Q R, Hua Y H, Yang W G . Thermodynamic models for determination of the solubility of omeprazole sulfide in (ethanol + ethyl acetate) binary solvent mixtures[J]. Fluid Phase Equilibria , 2015, 406 : 1-26 DOI:10.1016/j.fluid.2015.07.020 |
| [21] | Wu G, Hu Y H, Gu P F . Solubility and solution thermodynamics of gibberellin A4 in different organic solvents from 278.15 K to 333.15 K[J]. Journal of Chemical & Engineering Data , 2015, 60 (7) : 2104-2109 |
| [22] | Deng Y J, Xu L, Sun X B . Measurement and correlation of the solubility for 4,4'-diaminodiphenylmethane in different solvents[J]. Journal of Chemical & Engineering Data , 2015, 60 (8) : 2028-2034 |
| [23] | Zhang M D, Fang Z X, Zhai J H . Measurement and correlation of the solubility of rivaroxaban (form I) in binary mixtures of ethyl acetate with tetrahydrofuran, N,N-dimethylformamide, and N,N-dimethylacetamide from T=(278.15 to 318.15) K[J]. The Journal of Chemical Thermodynamics , 2016, 94 : 1-6 DOI:10.1016/j.jct.2015.10.016 |
| [24] | Xue J C, Wang Y L, Wang G . Thermodynamic equilibrium of 4-hydroxy-2,5-dimethyl-3(2H)-furanone in different solvent systems[J]. The Journal of Chemical Thermodynamics , 2016, 92 : 12-20 DOI:10.1016/j.jct.2015.08.035 |
| [25] | Zhu P P, Chen Y X, Fang J . Solubility and solution thermodynamics of thymol in six pure organic solvents[J]. The Journal of Chemical Thermodynamics , 2016, 92 : 198-206 DOI:10.1016/j.jct.2015.09.010 |




