丝素蛋白(silk fibroin,SF)是一种提取于天然蚕丝的蛋白质,形成的微丝具有独特的结构,兼具良好的机械性能和生物相容性。丝素蛋白最早被应用于手术缝合线中[1-2],如今越来越多的丝素蛋白衍生物如薄膜、支架、纤维和水凝胶等正广泛应用于生物医学领域和组织工程[3-5]。Zhou等[6]和Thierry等[7]分别通过鸟枪法和拉曼光谱等技术对丝素蛋白分子的氨基酸序列与结构进行分析。丝素蛋白在组成上含有18种氨基酸,其中含有大量的甘氨酸(Gly)、丙氨酸(Ala)和丝氨酸(Ser),这3种氨基酸约占总氨基酸含量的80%以上。丝素蛋白重链的分子链上有大量GAGAGS重复结构单元,这些重复单元在一定条件下能形成排列紧密、结构高度有序的氢键缔合β折叠结晶区,通过X射线衍射已确定其属于单斜晶系[8-9]。该结晶区相对较硬和较高的疏水性,使丝素蛋白形成的微丝在水环境中具有很高的机械强度,但缺乏柔韧性和延伸能力。温度、pH、溶剂和应力等的变化都能够使丝素蛋白的无规则卷曲和α螺旋向热力学更稳定的β折叠转变,形成微丝[10-14]。
双网络水凝胶(double network hydrogel)是一种经典的水凝胶强化方式,是一种刚性-柔性双网络互穿的形式强化水凝胶。当承受载荷时,刚性网络通过牺牲键的形式对机械能进行耗散,由第2网络维持水凝胶的结构完整性,双网络水凝胶能够在超过90% 含水率同时获得高弹性模量和应力。然而这种水凝胶在压缩后牺牲了其化学交联网络,回复性能及抗疲劳性能仍有待提升[15-20]。为了解决传统双网络水凝胶的化学交联不可逆破坏问题,改善水凝胶的恢复性能与抗疲劳性,基于化学交联网络和具备多点弱相互作用聚合物形成的互穿的双网络水凝胶展现出了更大的研究价值[21-24]。Chen等[25]基于双网络理论使用“一锅法”制备出聚丙烯酰胺/大分子琼脂糖(PAM/Agar)双网络水凝胶,其中第1网络采用化学交联的聚丙烯酰胺,而第2网络则使用多氢键交联的大分子琼脂糖。这种物理与化学交联结合的双网络水凝胶在未经水溶胀条件下,压缩强度达到38 MPa,拉伸强度达到1 MPa,同时其可恢复性能也大大增强。
本文选用兼具出色机械强度和生物相容性的丝素蛋白作为物理交联网络,以甲基丙烯酸羟乙酯(HEMA)或甲基丙烯酰胺(MAA)作为柔性网络,通过原位聚合制备了完全由物理交联所构建的双网络水凝胶,展示了高形变和抗疲劳能力,以及在高应变条件下的高模量和高应力响应。结合结构分析结果,提出了丝素蛋白微纤维网络强化双网络水凝胶的机理。
2 实验部分 2.1 实验材料甲基丙烯酸羟乙酯(HEMA)以及甲基丙烯酰胺(MAA)均购于阿达玛斯试剂有限公司;过硫酸铵购于国药集团化学试剂有限公司;可溶性冻干丝素蛋白购于苏州丝美特有限公司。
2.2 实验仪器电子分析天平(CPA225D,赛多斯科学仪器有限公司),即热式恒温加热磁力搅拌器(DF-101S,巩义市予华仪器有限公司),旋涡混合器(FK-X1,方科仪器有限公司),电热鼓风干燥箱(DHG-9053A,上海一恒科学仪器有限公司),微型高速离心机(Mini-14K,杭州奥盛仪器有限公司),超声波清洗机(YM-040S,深圳市方奥微电子有限公司),万能材料试验机(Zwick/Roell Z020,德国Zwick公司),场发射扫描电子显微镜((SU8010,日本Hitachi有限公司)。
2.3 制备过程HEMA/SF双网络水凝胶制备过程:分别取质量为0.2、0.3、0.4 g可溶性冻干丝素蛋白置于5 mL离心管中,加1 mL去离子水,置于旋涡混合器上充分震荡后进行超声处理5 min,重复2~3次直至离心管中无固体残留物。吸取质量为0.5 g HEMA加入溶液中,再次置于旋涡混合器上充分震荡后超声处理,重复直至无固体残留。将所得黏稠溶液分装于2 mL离心管内,以转速10 000 r·min-1离心5 min之后得到淡黄色澄清黏稠溶液,再称取HEMA摩尔分数为1% 的过硫酸铵加入溶液充分混合均匀。最后向溶液中加入100 μL乙醇,混合均匀后将所得溶液注入模具中,置于80 ℃恒温箱中过夜。在去离子水中平衡溶胀7 d后所得的不同浓度丝素蛋白的双网络水凝胶根据丝素蛋白的质量浓度(g·mL-1)不同分别记为HEMA/SF-0.1、HEMA/SF-0.15、HEMA/SF-0.2。
MAA/SF双网络水凝胶制备过程:分别取质量为0.2、0.3、0.4 g可溶性冻干丝素蛋白置于5 mL离心管中,加1 mL去离子水,置于旋涡混合器上充分震荡后进行超声处理5 min,重复2~3次直至离心管中无固体残留物。称取质量为0.6 g MAA加入溶液中,将溶液加热至75 ℃同时超声处理,使MAA充分溶解。将所得黏稠溶液分装于2 mL离心管内,以转速10 000 r·min-1离心5 min之后得到淡黄色澄清黏稠溶液,加入MAA摩尔分数为1% 的过硫酸铵充分混合,处理过程中溶液应保持至少60 ℃,否则温度过低,MAA溶解度下降会从溶液中析出。最后向溶液中加入100 μL乙醇,混合均匀后将所得溶液注入模具中置于80 ℃环境放置过夜。在去离子水中平衡溶胀7 d后所得不同浓度丝素蛋白的双网络水凝胶根据丝素蛋白的质量浓度(g·mL-1)不同分别记为MAA/SF-0.1、MAA/SF-0.15、MAA/SF-0.2。
HEMA单网络水凝胶制备过程:吸取质量为0.5 g HEMA于2 mL离心管中,加入1 mL去离子水,充分混合后,加入HEMA摩尔分数为1% 的过硫酸铵,置于80 ℃条件下2 h,所得水凝胶放入去离子水环境中进行一周平衡溶胀。
MAA单网络水凝胶制备过程:称取质量为0.6 g MAA于2 mL离心管中,加入1 mL去离子水,充分混合后将溶液加热至75 ℃同时超声处理,使MAA充分溶解,加入MAA摩尔分数为1% 的过硫酸铵后置于80 ℃条件下2 h,所得水凝胶放入去离子水环境中进行一周平衡溶胀。
2.4 平衡含水率测定制备完成后的水凝胶保存在去离子水中进行至少一周的平衡溶胀。分别取若干溶胀平衡后的水凝胶样品,用天平称其质量m0。接着将样品浸入液氮中冷冻,待样品完全固化后置于冷冻干燥机中2 d。待样品完全干燥后称取残余固体质量m1,平衡含水率为
| $ w=\left(m_{0}-m_{1}\right) / m_{0} \cdot 100 \% $ | (1) |
水凝胶被做成直径10 mm,高10 mm的圆柱形样品,使用万能材料试验机进行压缩测试,测试速度为2 mm·min-1,形变量上限为95%。压缩应变能由应力应变曲线积分得到
| ${U_1} = \int_0^{0.95} \sigma \rm d\varepsilon $ | (2) |
式中:U1为单位体积压缩应变能,MJ·m-3;σ为应力,Pa;ε为应变。
2.5.2 拉伸测试水凝胶被做成厚度为1 mm哑铃形片状试样,中间部分测试的有效长度为15 mm,宽度为4 mm。使用万能材料试验机进行拉伸测试,测试速度为6 mm·min-1。拉伸断裂能为
| ${U_2} = L\int_0^{{\varepsilon _1}} \sigma \rm d\varepsilon $ | (3) |
式中:U2为单位截面积拉伸断裂能,MJ·m-2;L为试样长度,m;ε1为断裂应变值。
2.5.3 疲劳测试水凝胶被做成直径10 mm,高10 mm的圆柱形样品,使用万能材料试验机进行压缩循环测试,测试速度为2 mm·min-1,形变量上限分别为60%和90%,循环次数为5次。
2.6 水凝胶结构分析水凝胶经溶胀平衡后置入液氮中快速冷却,后放入冷冻干燥器中,3 d后取出完全干燥的样品,打碎,取完整的断面置于扫描电子显微镜下观察其断面形貌。
3 实验结果与讨论 3.1 平衡含水率如图 1所示为HEMA/SF与MAA/SF体系的平衡含水率。经过丝素蛋白强化后,HEMA/SF和MAA/SF水凝胶的含水率相比于单网络的HEMA和MAA都有明显的下降。随着丝素蛋白质量浓度的增加,SF强化水凝胶的含水率趋于平缓,丝素蛋白网络有效抑制了水凝胶的溶胀,说明随着丝素蛋白网络的丝素含量的增加,其网络的稳定性逐渐提高。
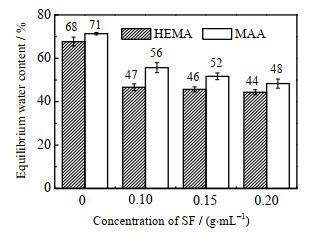
|
图 1 HEMA/SF与MAA/SF体系的平衡含水率 Fig.1 Water contents of HEMA/SF and MAA/SF systems |
HEMA/SF与MAA/SF水凝胶的压缩曲线如图 2所示。相比于单网络的HEMA水凝胶和MAA水凝胶,随着SF的引入,双网络的HEMA/SF和MAA/SF展现出更多的刚性特征。HEMA/SF双网络水凝胶在丝素蛋白质量浓度为0.15 g·mL-1时应力从8增加至42 MPa,提高了5倍以上。随着SF浓度进一步增加,HEMA/SF水凝胶在压缩应变88% 时发生破裂。对于MAA/SF水凝胶而言,在丝素蛋白质量浓度为0.20 g·mL-1时能够同时达到95% 压缩应变和最大强度58 MPa,相比于单网络MAA的5 MPa提高了11倍。
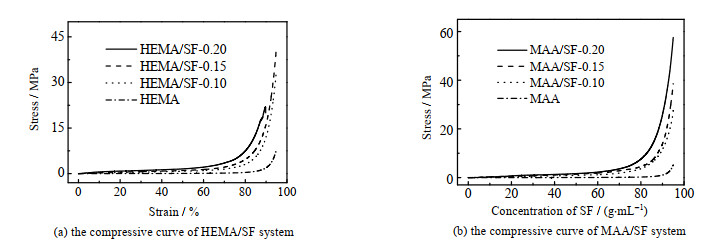
|
图 2 HEMA/SF与MAA/SF体系的压缩曲线 Fig.2 Compressive curves of HEMA/SF and MAA/SF systems |
如图 3所示,SF的引入带来的刚性特征反映在弹性模量和压缩应变能的显著提高。HEMA/SF双网络水凝胶在丝素蛋白质量浓度为0.2 g·mL-1时弹性模量达到了5.3 MPa,相比HEMA单网络水凝胶的0.06 MPa提升近100倍;MAA/SF双网络水凝胶弹性模量也实现了大幅提升,最高达到了2.17 MPa。SF强化水凝胶的应变能也获得了相应的提高。由于HEMA/SF-0.2中丝素蛋白含量过高而破裂,HEMA/SF双网络水凝胶最大应变能出现在HEMA/SF-0.15时,为3.17 MJ·m-3。而对于MAA/SF双网络水凝胶而言,随着丝素蛋白质量浓度的增加,MAA/SF-0.2最高应变能达到了4.64 MJ·m-3。
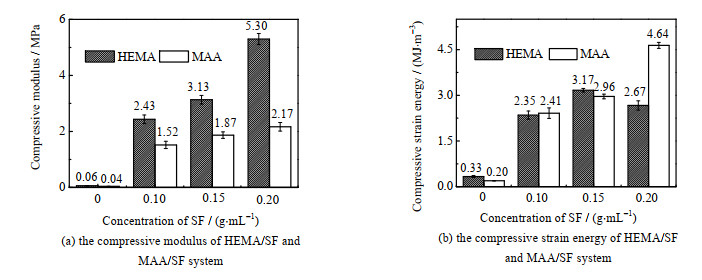
|
图 3 HEMA/SF与MAA/SF体系的压缩弹性模量与应变能 Fig.3 Compressive modulus and strain energy of HEMA/SF and MAA/SF systems |
如图 4所示,HEMA/SF和MAA/SF水凝胶的拉伸测试能够更显著地体现SF网络的强化效果。在HEMA/SF体系中,HEMA/SF水凝胶在SF质量浓度增加至0.15 g·mL-1时的拉伸强度由0.2增加至1.1 MPa,拉伸应变从650% 降低至400%,SF在为水凝胶提供强度的同时,也限制了拉伸应变。而在MAA/SF体系中,MAA/SF水凝胶在SF质量浓度增加至0.15 g·mL-1时的拉伸强度由0.16增加至0.45 MPa,拉伸应变则保持330%,当SF质量浓度增加至0.20 g·mL-1时,拉伸强度进一步增加至0.55 MPa,拉伸应变降低至200%。与压缩测试的结果相一致,在MAA/SF中,SF质量浓度的增加在显著提升应力的同时,仍然能够保持较好的应变能力。
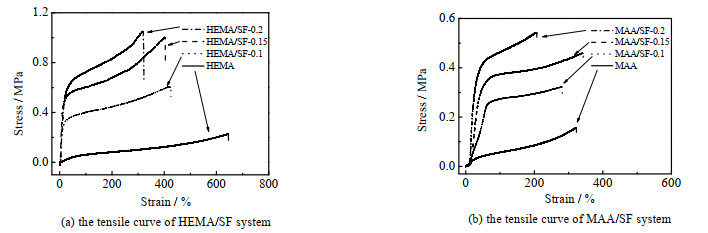
|
图 4 HEMA/SF与MAA/SF体系的拉伸曲线 Fig.4 Tensile curves of HEMA/SF and MAA/SF systems |
与压缩性能类似,经过丝素蛋白网络强化后的双网络水凝胶在拉伸弹性模量与能量吸收上有显著提升。当SF质量浓度增加至0.20 g·mL-1时,HEMA/SF的弹性模量从0.10增加至6.6 MPa,断裂能从0.07增加至0.36 MJ·m-2,MAA/SF的弹性模量从0.06增加至2.7 MPa,断裂能从0.04增加至0.17 MJ·m-2。
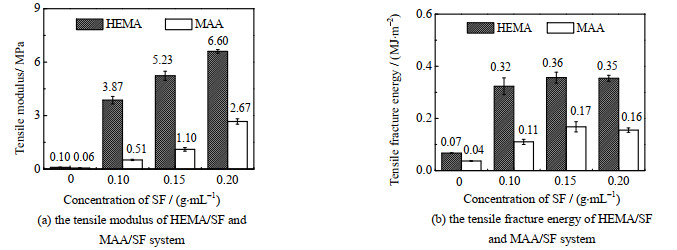
|
图 5 HEMA/SF与MAA/SF体系的拉伸弹性模量与断裂能 Fig.5 Tensile modulus and fracture energy of HEMA/SF and MAA/SF systems |
水凝胶对疲劳的抵抗通过压缩循环测试来进行评估。以60%压缩应变为上限,对HEMA/SF和MAA/SF水凝胶的压缩循环进行了5次记录(见图 6)。从图中可以看到,在第1次循环和第2次循环中,由于可能存在的应力集中区域的破坏,导致2次循环在60% 应变处的压缩应力出现较大差异。随着压缩次数的增加,HEMA和MAA单网络水凝胶在60% 压缩应变处的压缩强度逐渐下降,而当SF网络引入之后,水凝胶展现出了较好的疲劳抵抗能力。对于HEMA/SF水凝胶而言,5次循环在60% 应变条件下的压缩强度相同,且均保持在起始值附近,而对于MAA/SF水凝胶而言,随着丝素蛋白质量浓度的提高,水凝胶的抗疲劳性能逐步降低。这些结果说明,丝素微纤维网络在第1次压缩中产生了结构改变,但这种改变后的结构在后续过程中能够得以维持。
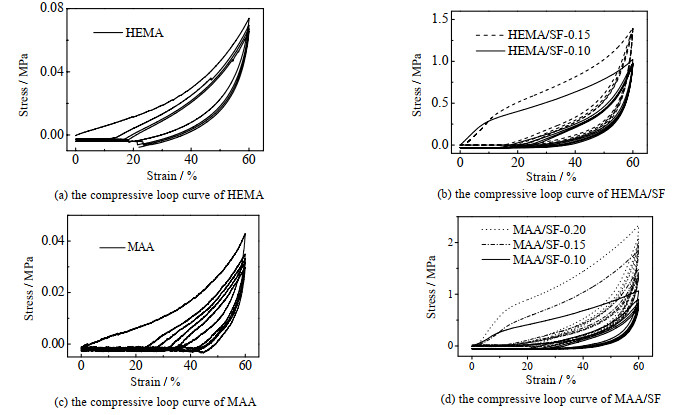
|
图 6 HEMA/SF与MAA/SF体系的压缩循环曲线 Fig.6 Compressive loop curves of HEMA/SF and MAA/SF systems |
如图 7所示为SF强化双网络水凝胶在SEM下的断面照片。水凝胶的网络展现出明显的两相组织,稀疏的网格状组织(图 7(a))与高度有序致密的结构(图 7(b)),其中排列高度有序致密的结构(图 8(b))含量较高,与该凝胶中丝素蛋白含量一致,因此可推测为SF网络,其高度统一的取向可能与SF本身具备的有序性以及聚合过程中热诱发结合时的传热方向有关。

|
图 7 HEMA/SF双网络水凝胶的SEM照片 Fig.7 SEM images of HEMA/SF double network hydrogel |
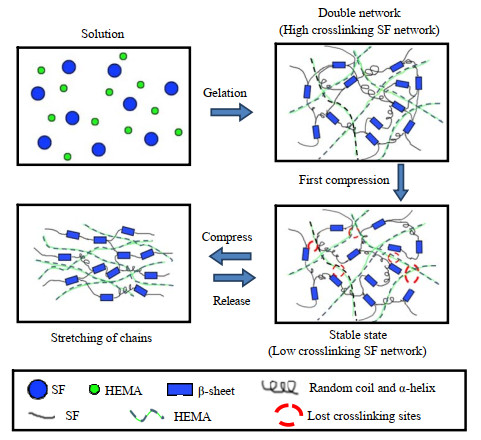
|
图 8 双网络水凝胶可能的强化机制 Fig.8 Proposed strengthening mechanism of the double network hydrogel |
从SEM的结果可以推测,丝素蛋白的加入成为了双网络水凝胶的支撑组分,显著提升了水凝胶的弹性模量和压缩强度。作为物理交联的刚性支撑网络,在第1次压缩后形成了具有一定适应性的稳定刚性丝素蛋白网络。在受到应力作用时,通过与柔性网络的相互作用,起到有效的机械能耗散作用。另一方面,柔性网络阻隔了丝素蛋白网络的相互接触,使丝素网络不会在压缩条件下形成新的结晶区,而使丝素蛋白微纤维网络失去恢复能力(见图 8)。因此,该丝素微纤维与柔性亲水性聚合物形成的双网络水凝胶不仅能够利用双网络水凝胶的强化机理提高力学性能,而且能够在适应性丝素蛋白网络形成后保持优良的抗疲劳能力。
4 结论(1) 本文采用一锅法合成了2种丝素蛋白微纤维增强的物理交联双网络水凝胶。
(2) 通过压缩拉伸测试证明了经丝素蛋白微纤维强化后的双网络水凝胶的压缩和拉伸强度实现5~10倍提升,弹性模量和能量吸收也提高了一个数量级以上。同时在压缩循环实验中发现其虽然在第1次压缩后弹性模量有较大的回落,但最高强度几乎未降,也证实了其物理交联在结构重构后具备了良好的抗疲劳能力。
(3) 通过对水凝胶在扫描电镜下的断面形貌分析,对其微观结构与强化机制做出初步的推测,即丝素蛋白纤维网络作为骨架网络保持其结构的可恢复能力,并与柔性聚合物填充网络协同,实现机械强度大幅提升。
| [1] |
OBERMEIER A, SCHNEIDER J, WEHNER S, et al. Novel high efficient coatings for anti-microbial surgical sutures using chlorhexidine in fatty acid slow-release carrier systems[J]. PLoS One, 2014, 9(7): e101426. DOI:10.1371/journal.pone.0101426 |
| [2] |
PANILAITIS B, ALTMAN G H, CHEN J S, et al. Macrophage responses to silk[J]. Biomaterials, 2003, 24(18): 3079-3085. DOI:10.1016/S0142-9612(03)00158-3 |
| [3] |
ROCKWOOD D N, PREDA R C, YÜCEL T, et al. Materials fabrication from bombyx mori silk fibroin[J]. Nature Protocols, 2011, 6(10): 1612-1631. DOI:10.1038/nprot.2011.379 |
| [4] |
FAROKHI M, MOTTAGHITALAB F, SAMANI S, et al. Silk fibroin/hydroxyapatite composites for bone tissue engineering[J]. Biotechnology Advance, 2018, 36(1): 68-91. DOI:10.1016/j.biotechadv.2017.10.001 |
| [5] |
SU D H, YAO M, LIU J, et al. Enhancing mechanical properties of silk fibroin hydrogel through restricting the growth of β Sheet domains[J]. ACS Applied Materials and Interfaces, 2017, 9(20): 17489-17498. DOI:10.1021/acsami.7b04623 |
| [6] |
ZHOU C Z, CONFALONIERI F, MEDINA N, et al. Fine organization of bombyx mori fibroin heavy chain gene[J]. Nucleic Acids Research, 2000, 28(12): 2413-2419. DOI:10.1093/nar/28.12.2413 |
| [7] |
THIERRY L, MARIE R, MICHEL P. Protein secondary structure and orientation in silk as revealed by Raman Spectromicroscopy[J]. Biophysical Journal, 2007, 92(8): 2885-2895. DOI:10.1529/biophysj.106.100339 |
| [8] |
INOUE S, TANAKA K, ARISAKA F, et al. Silk fibroin of Bombyx mori is secreted, assembling a high molecular mass elementary unit consisting of H-chain, L-chain, and P25, with a 6:6:1 molar ratio[J]. Journal of Biological Chemistry, 2000, 275(51): 40517-40528. DOI:10.1074/jbc.M006897200 |
| [9] |
MARSH R E, COREY R B, PAULING L. An investigation of the structure of silk fibroin[J]. Biochimica Et Biophysica Acta, 1955, 16(1): 1-34. |
| [10] |
LU Q, HU X, WANG X Q, et al. Water-insoluble silk films with silk I structure[J]. Acta Biomaterialia, 2010, 6(4): 1380-1387. DOI:10.1016/j.actbio.2009.10.041 |
| [11] |
YOSHIOKA T, HATA T, KOJIMA K, et al. Fabrication scheme for obtaining transparent, flexible and water-insoluble silk films from apparently dissolved silk-gland fibroin of Bombyx mori silkworm[J]. ACS Biomaterials Science & Engineering, 2017, 3(12): 3207-3214. |
| [12] |
YOSHIOKA T, KAMEDA T, TASHIRO K, et al. Transformation of coiled α helices into cross-β-sheets superstructure[J]. Biomacromolecules, 2017, 18(12): 3892-3903. DOI:10.1021/acs.biomac.7b00920 |
| [13] |
CHEN Z W, ZHANG H H, LIN Z F, et al. Programing performance of silk fibroin materials by controlled nucleation[J]. Advanced Functional. Material, 2016, 26(48): 8978-8990. DOI:10.1002/adfm.201602908 |
| [14] |
LING S J, QIN Z, LI C M, et al. Polymorphic regenerated silk fibers assembled through bioinspired spinning[J]. Nature Communications, 2017, 8: 1387. DOI:10.1038/s41467-017-00613-5 |
| [15] |
DAI W T, GUO H L, GAO B, et al. Double network shape memory hydrogels activated by near-infrared with high mechanical toughness, nontoxicity, and 3D printability[J]. Chemical Engineering Journal, 2019, 356: 934-949. DOI:10.1016/j.cej.2018.09.078 |
| [16] |
NA Y H, KUROKAWA T, KATSUYAMA Y, et al. Structural characteristics of double network gels with extremely high mechanical strength[J]. Macromolecules, 2004, 37(14): 5370-5374. DOI:10.1021/ma049506i |
| [17] |
NA Y H, TANAKA Y, KAWAUCHI Y, et al. Necking phenomenon of double-network gels[J]. Macromolecules, 2006, 39(14): 4641-4645. DOI:10.1021/ma060568d |
| [18] |
NAKAJIMA T, FURUKAWA H, TANAKA Y, et al. True chemical structure of double network hydrogels[J]. Macromolecules, 2009, 42(6): 2184-2189. DOI:10.1021/ma802148p |
| [19] |
TSUKESHIBA H, HUANG M, NA Y H, et al. Effect of polymer entanglement on the toughening of double network hydrogels[J]. The Journal of Physical Chemistry, 2005, 109(34): 16304-16309. DOI:10.1021/jp052419n |
| [20] |
GONG J P. Why are double network hydrogels so tough[J]. Soft Matter, 2010, 6: 2583-2590. DOI:10.1039/b924290b |
| [21] |
LIN P, MA S H, WANG X L, et al. Molecularly engineered dual-crosslinked hydrogel with ultrahigh mechanical strength, toughness and good self-recovery[J]. Advanced Materials, 2015, 27(12): 2054-2059. DOI:10.1002/adma.201405022 |
| [22] |
DAI X Y, ZHANG Y Y, GAO L N, et al. A mechanically strong, highly stable, thermoplastic, and self-Healable supramolecular polymer hydrogel[J]. Advanced Materials, 2015, 27(23): 3566-3571. DOI:10.1002/adma.201500534 |
| [23] |
HU X B, VATANKHAH-VARNOOSFADERANI M, ZHOU J, et al. Weak hydrogen bonding enables hard, strong, tough, and elastic hydrogels[J]. Advanced Materials, 2015, 27(43): 6899-6905. DOI:10.1002/adma.201503724 |
| [24] |
LUO K Y, YANG Y H, SHAO Z Z. Physically crosslinked biocompatible silk-fibroin-based hydrogels with high mechanical performance[J]. Advanced Functional Material, 2016, 26(6): 872-880. DOI:10.1002/adfm.201503450 |
| [25] |
CHEN Q, ZHU L, ZHAO C, et al. A robust, one-pot synthesis of highly mechanical and recoverable double network hydrogels using thermoreversible sol-gel polysaccharide[J]. Advanced Materials, 2013, 25(30): 4171-4176. DOI:10.1002/adma.201300817 |




