细胞培养是生物工程的关键技术,细胞生长状况和生化指标会直接影响产品例如疫苗或单克隆抗体的质量。目前对反映细胞生长状态/环境指标(如培养体系葡萄糖、乳酸质量浓度和细胞直径等)的检测,主要依赖离线的分析技术[1-2]。虽然技术比较成熟,但有一定的时间滞后,频繁的取样分析也极大地增加了染菌的风险[3],且耗费人力资源。因此,许多研究者将过程分析技术应用于细胞形貌和营养物质/代谢产物浓度的实时在线检测。例如Burgemeister等[4]采用CellViCAM系统(搭载原位显微镜)结合多种图像处理和监督机器学习技术对人类细胞系AGE1.HN.进行分类,准确度可达0.88。Rudolph等[5]采用原位显微镜成功测量了成纤维细胞在微载体表面的定植水平。但上述研究均只是实时采集图像,并未对图像进行实时在线处理,也就无法实时获得细胞形态、密度,特别是直径分布等信息。Whelan等[6]采用在线拉曼光谱仪实时检测中国仓鼠卵巢细胞(Chinese hamster ovary, CHO)培养体系,并通过偏最小二乘法(partial least squares,PLS)建立葡萄糖、乳酸等质量浓度校正模型,葡萄糖和乳酸质量浓度的预测均方根误差(RMSEP)分别为0.221和1.236 g·L−1。有研究报道采用Cubist建模方法,葡萄糖和乳酸质量浓度的RMSEP分别仅为0.259和0.18 g·L−1 [7]。由于细胞培养体系的复杂性,对光谱数据进行合适的预处理,剔除无关信息和波段选择是进一步提高化学计量学模型准确性的关键。针对不能实时获得细胞培养过程中的细胞直径分布和葡萄糖、乳酸质量浓度定量校正模型准确度不够的问题。本研究以CHO细胞培养为例,采用原位显微镜实时观察细胞生长状态,通过实时图像处理,得到细胞的形态、密度及直径分布。同时采用拉曼光谱仪实时在线采集体系拉曼光谱图。对光谱数据采用遗传算法(genetic algorithm, GA)进行波段选择、再采用PLS分别建立葡萄糖和乳酸质量浓度的校正模型。
2 实验 2.1 实验材料与设备CHO-K1SV-GS KO细胞株(南京科佰生物科技有限公司),CD-CHO Medium培养基(GIBCO公司),生物反应器EF-5L(规格5 L,广州齐志生物工程设备有限公司),M-100生物传感器分析仪(深圳市西尔曼科技有限公司),2D Vision Probe工艺过程成像仪(青岛晶格码智能系统有限公司),探头式拉曼光谱仪(青岛晶格码智能系统有限公司),全自动细胞计数仪(美国Bio-Rad公司)。
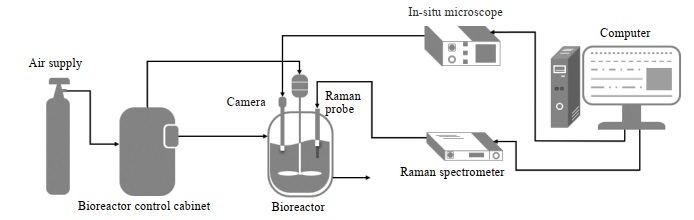
实验平台由生物反应器及控制柜系统和集成拉曼光谱仪和原位显微镜的在线监测系统组成,如图 1所示。
|
图 1 设备平台图 Fig.1 Schematic diagram of the experimental setup |
将CHO细胞接种于生物反应器中,接种密度为2.16×105 cell·mL−1。细胞培养过程中,所用溶氧(DO)设定为50%;pH设定值为7.2;液位设定为5 L;温度设定为37 ℃;搅拌速度控制在100 r·min−1;总培养时间约为11 d。
2.3 数据采集及处理在细胞培养过程中每隔4~12 h采集一次体系拉曼光谱,共获40组拉曼光谱图,每次采样重复扫描3次,取平均值作为建模数据。激光波长为785 nm,光谱位移范围为180~2 100 cm−1,积分时间为2.8 s,平滑宽度为3。在拉曼光谱采集的同时,2D Vision Probe工艺过程成像系统(集成多种图像处理方法)实时在线采集体系图像(40组),拍摄的时间间隔为0.18 s,每组拍摄100张图片。每张照片通过直方图均衡法进行预处理、小波分析法进行细胞识别[8-10],实时统计细胞直径分布,并将100张照片细胞直径分布的平均值作为最终结果。在线采集数据的同时,采用全自动细胞计数仪和生物传感器分析仪分别检测体系中细胞直径分布、葡萄糖和乳酸质量浓度。
对采集的拉曼光谱数据采用SPXY法按照4:1的比例划分校正集和验证集[1, 11]。光谱数据进行标准化处理后,再进行预处理和波段选择,建立PLS模型(采用Matlab 2020a软件,并调用PLS_Toolbox_881工具箱),以校正均方根误差(RMSEC)、校正决定系数RC2评价模型的拟合能力。分别采用留一交叉验证法(交叉验证均方根误差(RMSECV)、交叉验证决定系数RCV2)和验证集数据(RMSEP、预测决定系数RP2)对模型进行验证。并用平均百分比误差(APE)表示模型的预测能力。
| $ {\rm APE} = \sum\limits_{i = 1}^n {\frac{{\left| {Yi - yi} \right|}}{{yi}}} $ | (1) |
式中:Yi和yi分别为验证集第i个样本的预测值和实验值,n为验证集样本个数。
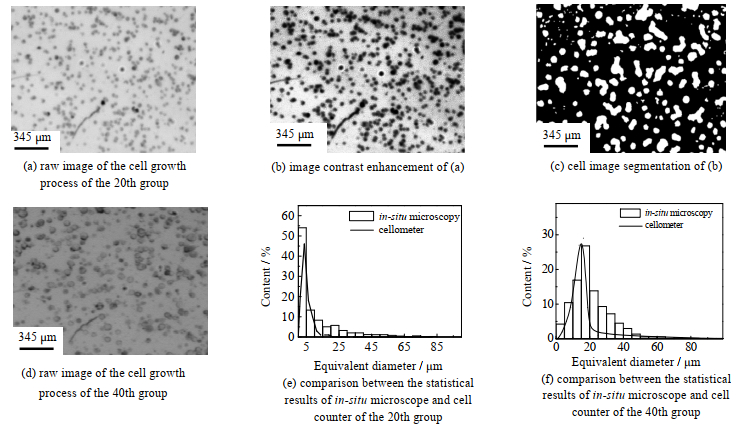
3 结果与讨论 3.1 原位在线采集图像图 2(a)和(d)分别为第20组和第40组原位显微镜采集的细胞图像,从图中可以看出CHO细胞大多呈圆形或椭圆形,随着培养时间的延长,细胞的直径缓慢增长。从图 2(b)中可以看出,经直方图均衡化预处理后的图像背景噪音明显降低,细胞轮廓明显清晰,大小和形态保持不变。
|
图 2 细胞培养原始图像及处理结果 Fig.2 Pictures of cell growth with processed results |
小波分析方法将CHO细胞从背景噪音中准确识别和分离出来,如图 2(c)(图中白色区域为所识别的细胞,黑色区域为背景)。图 2(e)和(f)分别为第20组和第40组原位显微镜和细胞计数仪获得的细胞直径分布对比图,结果表明,原位显微镜和细胞计数仪获得的细胞直径分布结果很好地吻合,因此,原位显微镜可以替代细胞计数仪实现细胞培养过程中细胞直径分布的实时在线检测。
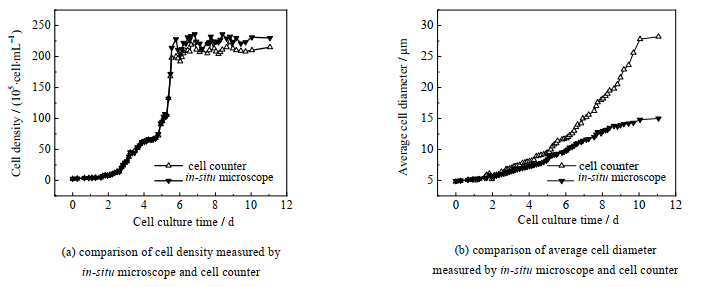
图 3对比了原位显微镜和细胞计数仪对细胞密度和细胞直径的测量结果。由图 3(a)可知在第0至6天细胞生长速度较快,第6至11天细胞生长速度降低;在较低的细胞密度(2×107 cell·mL−1),原位显微镜与生化分析仪的结果基本一致。在较高密度下,原位显微镜测量密度的结果会偏小,可能是由于图像处理过程中不能很好地分割团聚的细胞,使得统计的个数偏少,这也可由图 3(b)的结果(在高细胞密度下,原位显微镜测量的细胞直径比细胞计数仪测量结果小)得到佐证。
|
图 3 原位显微镜与细胞计数仪测量结果对比 Fig.3 Comparison of results measured by in situ microscope and cell counter |
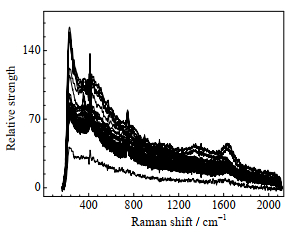
将在线采集的40组拉曼光谱数据(见图 4)和对应的葡萄糖质量浓度数据(离线生化分析采集),按4:1的比例划分训练集和验证集。
|
图 4 培养体系的拉曼光谱图 Fig.4 Raman spectra of cell culture media |
葡萄糖的拉曼光谱图在1 453、1 201~1 356、1 074~1 123、726~915、509、423 cm−1处产生特征峰。从图 4中可以看出,拉曼光谱图除包含葡萄糖分子的特征峰,还有强烈的背景噪音及基线漂移等问题。噪音的存在不仅会干扰拉曼光谱特征峰的信息识别,还会增加提取特征峰的难度,因此需要对拉曼光谱进行预处理[12]。本研究采用的预处理方法有背景趋势消除技术(Detrend)、多元散射校正(MSC)、标准正态变量变换(SNV)、一阶导数法(1D)、二阶导数法(2D)、Savitzky-Golay滤波法(S.G.)、去除基线法(Baseline)[2, 6-7, 13-15]以及上述方法的组合等。对拉曼光谱数据进行预处理,之后对光谱数据进行PLS建模,模型的评价结果见表 1。
|
|
表 1 拉曼光谱预处理及葡萄糖质量浓度PLS模型评价结果 Table 1 Preprocessing results of Raman spectra and evaluation of the PLS model for glucose concentration |
由表 1可知,光谱数据未进行预处理,模型的决定系数及误差均较大,而经过预处理之后模型的相关性显著提高,误差也显著下降,说明采集的光谱引入了仪器或环境的噪音。其中采用Detrend的预处理方法使得PLS模型获得最高的校正/验证决定系数和最低的校正/验证误差。采用MSC预处理得到的模型交叉验证决定系数最高。综合校正、交叉验证和验证的结果,将上述2种方法进行组合(MSC+Detrend)的预处理方法使建立的模型获得较高的决定系数和较低的误差,模型的潜在变量数(LVs)也较少,因此,本研究采用MSC+Detrend的预处理方法进行后续的建模。
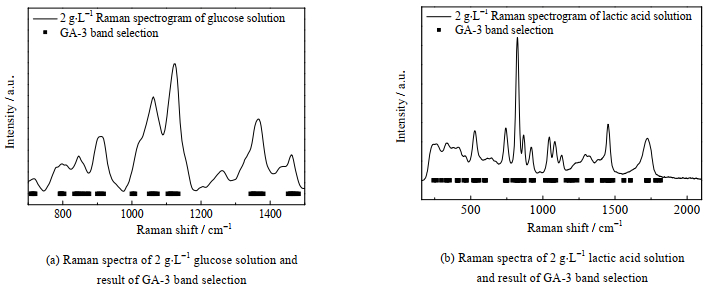
3.2.2 波段选择由于培养基中除葡萄糖、乳酸以外还有谷氨酸、谷氨酰胺等众多其他营养物/代谢产物,因此分析关键区域相关峰的光谱差异(例如葡萄糖的C-H拉曼响应在2 800~3 000 cm−1)能够显著提高模型的准确性。本研究采用窗口宽度为3和6的遗传算法(GA-3和GA-6)对拉曼光谱数据进行波段选择,并采用变量投影重要性法(VIP)[16]作为对比,波段选择的长度和PLS模型的评价结果见表 2。结果表明:经过VIP法波段选择后变量个数由1 044个变为247个。采用GA-3进行波段选择,变量个数由1 044个变为246个。若采用GA-6进行波段选择,变量个数由1 044个变为234个。这3种波段选择方法产生的变量个数差别不大,计算速度差别不明显。从PLS模型的评价结果可以看出,选择GA-3进行波段选择建立的PLS模型校正、交叉验证和验证决定系数均是最高,误差也是最小的。通过GA-3选择后的波段与葡萄糖溶液拉曼特征峰的波段范围大致相同(如图 5(a)),准确保留了谱图的关键信息。这是由于GA算法以RMSECV的倒数作为适应度函数,通过不断循环迭代实现由筛选的波段建立的模型的误差较小,低于目前文献的报道[17]。
|
|
表 2 波段选择及葡萄糖浓度PLS模型评价结果 Table 2 Band selection results and evaluation of the PLS model for glucose concentration |
|
图 5 葡萄糖及乳酸溶液拉曼光谱图及GA-3波段选择结果 Fig.5 Raman spectra of glucose and lactic acid solutions and results of GA-3 band selection |
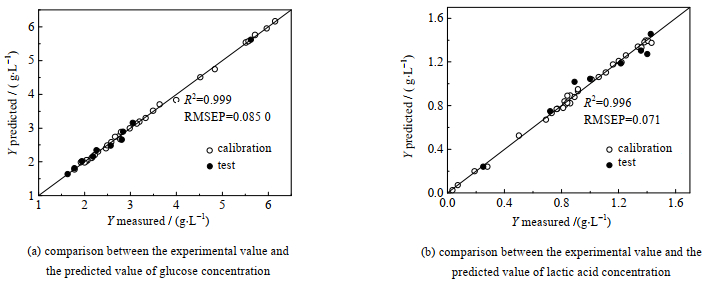
采用MSC+Detrend预处理方法、GA-3波段选择方法、PLS建立葡萄糖质量浓度定量校正模型计算值,并与实验值对比,如图 6(a)所示。从图中可以看出,模型的计算值与样品的实验值偏差较小,模型的相关性达0.999。
|
图 6 葡萄糖和乳酸质量浓度模型预测结果 Fig.6 Evaluation of glucose and lactate concentration models |
由表 2模型的评价结果可知,模型的主元个数为4个,RMSEC为0.051 g·L−1,RMSECV为0.109 g·L−1,RMSEP为0.085 g·L−1。RC2为0.999、RCV2为0.994、RP2为0.999。模型的主元数较少,且3个误差指标较小,决定系数接近于1,且APE为0.95%。说明模型拟合效果较好,对未知样品的预测能力也较强。
3.3 乳酸质量浓度校正模型的建立采用不同预处理、波段选择方法建立乳酸质量浓度PLS校正模型,模型评价结果如表 3所示。由表 3可知,MSC+Detrend的预处理方法使得建立的模型在校正、交叉验证和验证中均获得较高的决定系数和较低的误差。乳酸的拉曼光谱图在260、335、411、527、743、822、866、918、1 044、1 082、1 451、1 724 cm−1处产生特征峰。通过GA-3选择后的波段与乳酸溶液拉曼特征峰的波段范围大致相同,见图 5(b)。
|
|
表 3 光谱预处理、波段选择及乳酸浓度PLS模型评价结果 Table 3 Preprocessing results of Raman spectra, band selection and evaluation of the model for lactic acid concentration |
用MSC+Detrend预处理方法、GA-3波段选择方法、PLS建立乳酸质量浓度定量校正模型计算值,并与实验值对比,如图 6(b)所示。从图中可以看出,模型的计算值与样品的实验值偏差较小,模型的验证相关性达0.966。
由表 3模型评价结果可以看出:主元个数为5个,RMSEC为0.023 g·L−1,RMSECV为0.056 g·L−1,RMSEP为0.070 g·L−1。RC2为0.996、RCV2为0.980、RP2为0.966。模型的主元数较少,且3个误差指标较小,决定系数接近于1,且APE为0.28%。说明模型拟合效果较好,预测能力强。
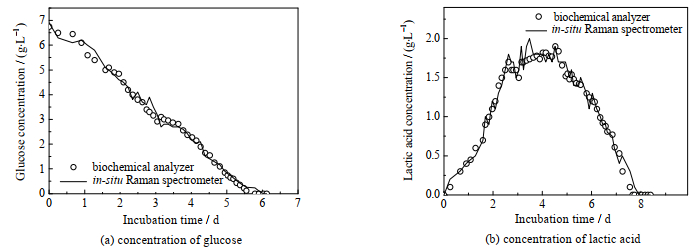
3.4 模型泛化能力的验证为了进一步验证所建立的化学计量学模型的泛化能力,在上述实验平台上进行第2次CHO细胞培养,实时在线采集培养体系拉曼光谱图,并根据上述校正模型实时预测体系葡萄糖和乳酸浓度,在线检测结果与生化分析仪离线检测结果对比如图 7所示。
|
图 7 葡萄糖和乳酸质量浓度预测结果与离线检测结果对比 Fig.7 Comparison of prediction and off-line test results of glucose and lactic acid concentrations |
从图 7中可以看出,模型的预测值与离线生化分析仪的测量值具有很好的相关性(葡萄糖质量浓度校正模型Rp2为0.990,乳酸质量浓度校正模型Rp2为0.962)。同时为了确定模型的适用范围,向培养体系中补充乳酸溶液及更换CHO细胞株,结果表明乳酸质量浓度在0~9.86 g·L−1,模型的决定系数仍高于0.96。由于不同培养基所产生拉曼散射的物质不一样,因此,本研究所建立的模型适用于培养基为CD-CHO Medium悬浮CHO细胞培养过程中葡萄糖和乳酸浓度(浓度范围为0~9.86 g·L−1)时在线检测。
葡萄糖和乳酸分别是细胞生长过程中的营养物质和代谢产物。对CHO细胞而言,一般认为葡萄糖质量浓度应在合适的范围内。在适宜的葡萄糖质量浓度下,CHO细胞利用葡萄糖供能,代谢乳酸,细胞生长速度较快,活力较强。而本实验过程未进行葡萄糖的补充,随着培养时间延长,葡萄糖质量浓度逐渐降低,当葡萄糖质量浓度过低时,细胞将利用乳酸分解供能,细胞生长速度降低,活力也较弱。因此乳酸质量浓度随着培养的进行,呈现先增加后降低的变化过程。
4 结论本研究使用原位显微镜和在线拉曼光谱仪,实时获得动物悬浮细胞(以CHO细胞为研究对象)生长过程的图像和体系的拉曼光谱图。通过图像预处理和分割,获得细胞生长过程中实时细胞形态以及细胞直径分布等信息。并通过对拉曼数据进行预处理(MSC+Detrend)、遗传算法进行波段选择、偏最小二乘法进行多元校正,分别建立准确的葡萄糖和乳酸质量浓度定量校正模型。在连续生产的细胞培养工艺过程中,该方法可以减少取样的繁琐过程,以及降低反应过程中染菌的风险。同时,该方法可为细胞培养过程的智能化控制提供研究基础。
未来对细胞生长状态的实时在线检测研究可聚焦于提高显微镜镜头分辨率,改进图像处理技术等提高细胞识别的准确性。同时在对细胞培养体系营养物/代谢产物浓度的实时在线检测中,可深化对图谱波段选择方法的改进,以进一步提高方法的准确性和普适性。
| [1] |
阎续, 沈丽娟, 胥文彦, 等. 拉曼光谱用于CHO细胞培养液多指标快速分析[J]. 高校化学工程学报, 2019, 33(4): 872-877. YAN X, SHEN L J, XU W Y, et al. Rapid analysis of multiple parameters of CHO cell culture media using Raman spectroscopy[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(4): 872-877. |
| [2] |
MEHDIZADEH H, LAURI D, KARRY K M, et al. Generic Raman-based calibration models enabling real-time monitoring of cell culture bioreactors[J]. Biotechnology Progress, 2015, 31(4): 1004-1013. DOI:10.1002/btpr.2079 |
| [3] |
王远山, 郝文辉, 吴哲明, 等. 原位显微镜在细胞生物量在线监测中的发展与应用[J]. 生物工程学报, 2019, 35(9): 1607-1618. WANG Y S, HAO W H, WU Z M, et al. Development and application of in-situ microscopy in on-line monitoring of cell biomass[J]. Chinese Journal of Biotechnology, 2019, 35(9): 1607-1618. |
| [4] |
BURGEMEISTER S, NATTKEMPER T W, NOLL T, et al. CellViCAM-Cell viability classification for animal cell cultures using dark field micrographs[J]. Journal of Biotechnology, 2010, 149(4): 310-316. DOI:10.1016/j.jbiotec.2010.07.020 |
| [5] |
RUDOLPH G, LINDNER P, GIERSE A, et al. Online monitoring of microcarrier based fibroblast cultivations with in situ microscopy[J]. Biotechnology and Bioengineering, 2007, 99(1): 136-145. |
| [6] |
WHELAN J, CRAVEN S, GLENNON B. In situ Raman spectroscopy for simultaneous monitoring of multiple process parameters in mammalian cell culture bioreactors[J]. Biotechnology Progress, 2012, 28(5): 1355-1362. DOI:10.1002/btpr.1590 |
| [7] |
RAFFERTY C, JOHNSON K, O'MAHONY J, et al. Analysis of chemometric models applied to Raman spectroscopy for monitoring key metabolites of cell culture[J]. Biotechnology Progress, 2020, 36(4): e2977. |
| [8] |
CHEN J, WANG X Z. A wavelet method for analysis of droplet and particle images for monitoring heterogeneous processes[J]. Chemical Engineering Communications, 2005, 192(4): 499-515. DOI:10.1080/00986440590477908 |
| [9] |
WAN J, MA C Y, WANG X Z. A method for analyzing on-line video images of crystallization at high-solid concentrations[J]. Particuology, 2008, 6(1): 9-15. DOI:10.1016/j.cpart.2007.11.001 |
| [10] |
TANG X H, LI Y, LIU J J, et al. Process Analytical Technology (PAT) aided identification of operational spaces leading to tailored crystal size distributions in azithromycin crystallization via coordinated cooling and solution mediated phase transition[J]. Organic Process Research & Development, 2017, 21(12): 1963-1971. |
| [11] |
门昌骞, 孟晓超, 姜高霞, 等. 一种利用SPXY采样的标签噪声主动清洗方法[J]. 小型微型计算机系统, 2021, 42(9): 1865-1870. MEN C Q, MENG X C, JIANG G X, et al. Active label cleaning method based on SPXY sampling[J]. Journal of Chinese Computer Systems, 2021, 42(9): 1865-1870. |
| [12] |
王忠. 拉曼光谱预处理及数据分析应用中的关键技术研究 [D]. 兰州: 兰州大学, 2021. WANG Z. Study on key technologies for preprocessing of Raman spectrum and data analysis application [D]. Lanzhou: Lanzhou University, 2021. |
| [13] |
ESMONDE-WHITE K A, CUELLAR M, LEWIS I R. The role of Raman spectroscopy in biopharmaceuticals from development to manufacturing[J]. Analytical and Bioanalytical Chemistry, 2022, 414(2): 969-991. DOI:10.1007/s00216-021-03727-4 |
| [14] |
BERRY B, MORETTO J, MATTHEWS T, et al. Cross-scale predictive modeling of CHO cell culture growth and metabolites using Raman spectroscopy and multivariate analysis[J]. Biotechnology Progress, 2014, 31(2): 566-577. |
| [15] |
DOMJÁN J, FRICSKA A, MADARÁSZ L, et al. Raman-based dynamic feeding strategies using real-time glucose concentration monitoring system during adalimumab producing CHO cell cultivation[J]. Biotechnology Progress, 2020, 36(6): e3052. |
| [16] |
OZEN B F, MAUER L J. Detection of hazelnut oil adulteration using FT-IR spectroscopy[J]. Journal of Agricultural Food Chemistry, 2002, 50(14): 3898-3901. |
| [17] |
ROLINGER L, RÜDT M, HUBBUCH J. A critical review of recent trends, and a future perspective of optical spectroscopy as PAT in biopharmaceutical downstream processing[J]. Analytical and Bioanalytical Chemistry, 2020, 412(9): 2047-2064. |




