2. 绍兴市生态环境局上虞分局,浙江 上虞 312300;
3. 浙江新和成特种材料有限公司,浙江 上虞 312369
2. Shangyu Branch of Shaoxing Ecology and Environment Bureau, Shangyu 312300, China;
3. Zhejiang NHU Special Materials Co., Ltd., Shangyu 312369, China
聚酰胺(Polyamide, PA)商品名尼龙,是主链上含有重复酰胺键的高分子缩聚物[1-2]。根据主链链节特征可将聚酰胺细分为脂肪族聚酰胺、全芳族聚酰胺和半芳族聚酰胺[3-4]。脂肪族聚酰胺拉伸强度和弯曲强度高,但易于吸水,导致尺寸稳定性不佳;全芳族聚酰胺熔点高、力学性能优异,但因不溶于常用溶剂且分解温度同熔点相近而难以加工成型[5-6]。半芳香聚酰胺兼具脂肪族及全芳族聚酰胺优点,吸水性较弱,可通过常用高温溶液缩聚法制得,广泛用于汽车工业、电子电气和机械加工等领域[7]。
工业常用的高温溶液法生产聚酰胺包括成盐-预聚-终聚3个工序[8-9]。通常采用溶液法成盐:以水为溶剂、二胺和二酸为原料,主要产物为尼龙盐[10-12]。关于尼龙66 (己二胺与己二酸缩聚物)盐和尼龙6T(己二胺与对苯二酸缩聚物)盐制备条件对后续缩聚影响的研究发现原料投料比、pH值和反应温度等条件均会影响聚酰胺产物性能[13-16]。纯度、溶解度和热稳定性是尼龙盐的重要性质,纯度影响聚酰胺产品分子量,溶解度决定预聚过程水含量,热稳定性决定预聚反应升温速率及起始温度[17]。
关于尼龙盐制备过程及尼龙66盐性质研究的文献报道较多,但关于其他尼龙盐性质的系统研究的文献极少[18-19]。本文合成多种短碳链尼龙盐,并进行纯度和结构表征,选择合适方法测定尼龙盐溶解度,分析尼龙盐热稳定性,为后续反应及相关理论研究提供参考。
2 实验及分析 2.1 实验材料己二酸(上海阿拉丁生化科技股份有限公司,HPLC);对苯二甲酸(上海阿拉丁生化科技股份有限公司,99%);1, 6-己二胺(国药集团化学试剂有限公司,AR);1, 4-丁二胺(上海阿拉丁生化科技股份有限公司,98%);1, 3-丙二胺(上海阿拉丁生化科技股份有限公司,98%);去离子水(杭州娃哈哈集团有限公司)。
2.2 制备方法称取0.5 mol己二酸或对苯二甲酸加到500 mL带搅拌磁子的三颈烧瓶,加入200 mL水后置于50 ℃恒温水浴搅拌30 min至形成悬浊液,以氮气吹扫三颈烧瓶去除空气。称取0.5 mol丙二胺/丁二胺/己二胺溶于100 mL去离子水后滴加到二酸悬浊液中,混合液从乳白色悬浊液逐渐变为澄清透明溶液,二胺溶液加完后继续搅拌1 h,使用精密酸度计测定pH值。若pH值保持在7附近,停止加热。
将反应液置于防爆冰箱冷却至5~8 ℃,24 h后可见大量晶体析出,抽滤后以少量去离子水洗涤结晶2~3次。将结晶物用无水乙醇溶解并进行重结晶,除去去离子水,所得结晶物用无水乙醇洗涤2~3次后在90 ℃下干燥8 h,用研钵研磨成细粉状精制尼龙盐。
2.3 分析方法(1) 红外光谱分析(FTIR):采用美国Thermo Fisher Scientific公司的Nicolet iS10傅里叶变换红外光谱仪对样品进行分析;样品处理采用溴化钾压片法。
(2) 核磁共振分析(NMR):采用德国BRUKER公司Advance III 500M核磁共振仪进行1H-NMR分析;内标为四甲基硅烷(TMS),溶剂为重水(D2O)。
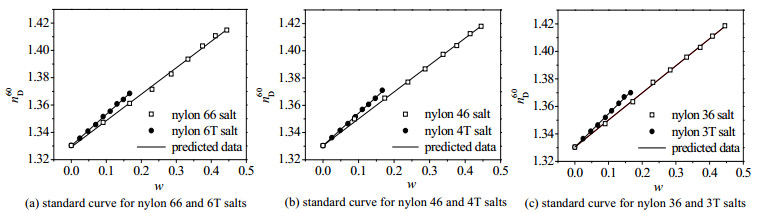
(3) 溶解度测定:取一定质量尼龙盐置于20 mL试管,加入10 mL去离子水,将试管置于超级恒温槽加热到50 ℃直至尼龙盐溶解,恒温30 min。采用阿贝折光仪在50 ℃下测量并记录折射率。改变尼龙盐质量后测定不同质量分数尼龙盐溶液的折射率,绘制拟合曲线如图 2所示。

|
图 1 尼龙盐合成化学反应式 Fig.1 Chemical reaction route of nylon salt synthesis |
|
图 2 6种尼龙盐的标准曲线 Fig.2 Standard working curves of 6 nylon salts |
尼龙盐溶液质量分数与溶液折光率存在线性关系[16],采用一次函数对溶解度曲线进行拟合,所得拟合结果如表 1所示。
|
|
表 1 种尼龙盐的校正曲线拟合结果 Table 1 Linear fitting results of six nylon salts |
取过量尼龙盐置于25 mL三颈烧瓶,加入10 mL去离子水,置于水浴加热至一定温度,恒温搅拌4 h,将阿贝折光仪升温至相同温度后用取适量上层清液测定折光率,平行测定两次,若前后2次一致则达到溶解平衡。用锥形瓶取去离子水30 mL,称重记为m1,以移液管取尼龙盐饱和溶液的上层清液5 mL加入到锥形瓶称重记为m2,振荡摇匀并测定50 ℃下的折光率,对照标准曲线得到稀释后溶液中尼龙盐的质量分数w,通过下式计算得到尼龙盐的溶解度:
| $ S=\frac{w\times \left( {{m}_{1}}+{{m}_{2}} \right)}{{{m}_{2}}-w\times \left( {{m}_{1}}+{{m}_{2}} \right)}\times 100 $ | (1) |
(4) 热重分析(TGA):氮气氛围中采用美国TA公司的TA-Q500热重分析仪分析尼龙盐的热稳定性,升温速率为10 ℃·min-1,测试温度为50~600 ℃。
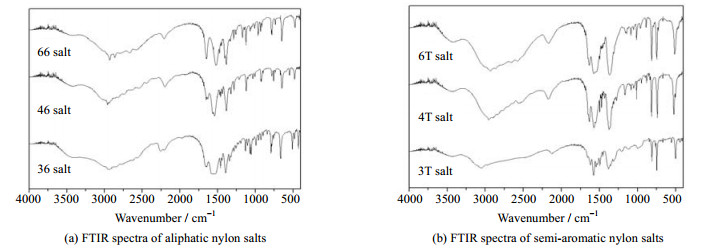
3 实验结果与讨论 3.1 尼龙盐纯度及结构分析尼龙盐红外分析结果如图 3所示。3 300~3 500 cm-1处二胺单体仲胺N─H键伸缩振动峰完全消失,说明原料二胺反应完全。3 500 cm-1附近未出现羟基伸缩振动峰,说明原料二酸反应完全。2 900 cm-1附近是亚甲基─CH2─的伸缩振动吸收峰,1 650 cm-1附近出现羧基与氨基缔合的特征吸收峰,1 570 cm-1附近是N─H键面内弯曲振动的特征吸收峰。1 375 cm-1附近出现亚甲基C─C伸缩振动吸收峰。以上分析表明二胺和二酸在上述条件下反应生成尼龙盐。
|
图 3 6种尼龙盐的红外谱图 Fig.3 FTIR spectra of six nylon salts |
对比半芳族尼龙盐和脂肪族尼龙盐的FTIR出峰特征可知,半芳族尼龙盐和脂肪族尼龙盐在高波数区的出峰基本一致。但半芳族尼龙盐在740和820 cm-1附近出现苯环C─H键面外弯曲振动的特征吸收峰,这是半芳族尼龙盐区别于脂肪族尼龙盐的特征峰。此外,脂肪族尼龙盐1 650 cm-1附近的特征吸收峰较强,可能是盐内离子间缔合能力较强所致。
对比不同碳链长度尼龙盐的特征出峰可以发现酰胺键和苯环的出峰位置基本一致,但亚甲基出峰有区别。如半芳族尼龙盐的亚甲基─CH2─的伸缩振动吸收峰在2 900 cm-1附近出现,但尼龙3T(丙二胺与对苯二酸缩聚物)盐出峰波数比尼龙4T(丁二胺与对苯二酸缩聚物)盐和尼龙6T盐更高,脂肪族尼龙盐也出现同样现象。这可能是尼龙36(丙二胺与己二酸缩聚物)盐及尼龙3T盐中较短的丙二胺链节使亚甲基更易受氨基离子等强极性基团影响而移向高波数区。
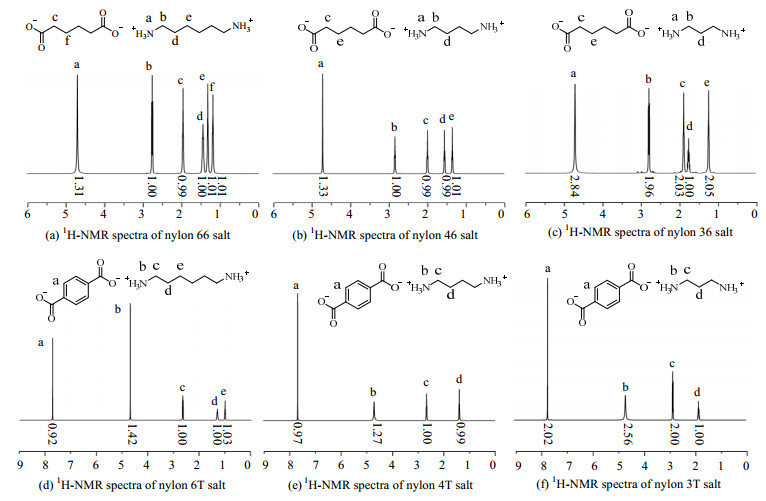
尼龙盐的1H-NMR分析结果如图 4所示。6种尼龙盐的1H-NMR谱图中均未出现明显杂峰,说明所得尼龙盐的纯度较高。图中没有发现氨基氢原子和羧基氢原子出峰,说明二酸和二胺反应完全。6种尼龙盐在δ = 4.7附近出现铵根离子峰、积分面积约为二胺α位亚甲基积分面积的1.5倍,表明尼龙盐中的二胺及二酸在成盐反应后均以离子形式存在。根据1H-NMR谱图中的出峰个数及积分面积比可以推测尼龙盐的结构式如图 4所示。
|
图 4 6种尼龙盐的1H-NMR谱图 Fig.4 1H-NMR spectra of six nylon salts |
对比半芳族尼龙盐和脂肪族尼龙盐的1H-NMR谱图可知,半芳族尼龙盐在δ=7.7附近存在对苯二酸苯环氢原子出峰,脂肪族尼龙盐在δ=1.0~2.0存在己二酸碳链亚甲基氢原子出峰。与脂肪族尼龙盐相比,半芳族尼龙盐二胺链节上的亚甲基氢原子出峰移向高场,这是半芳族尼龙盐中苯环同羰基形成共轭、导致羰基吸电子能力减弱所致。
对比不同碳链长度的尼龙盐发现,己二酸碳链、对苯二甲酸苯环和二胺碳链上α位亚甲基氢原子的出峰位置基本一致,但二胺碳链上β位亚甲基氢原子出峰位置的差别较大。与尼龙66盐和尼龙6T盐相比,尼龙36盐和尼龙3T盐β位亚甲基氢原子出峰大幅移向低场,尼龙46 (丁二胺与己二酸缩聚物)盐和尼龙4T盐β位亚甲基氢原子的出峰也移向低场,只是位移较小。碳链长度越短,β位亚甲基受周围极性离子基团影响越大,导致出峰位置变化大,β位亚甲基氢原子出峰位置可用于鉴别尼龙盐种类。
综上所述,FTIR及1H-NMR谱图表明尼龙盐制备过程中原料二胺和二酸反应完全,盐内无游离氨基或羧基,端基全部形成离子。6种尼龙盐的1H-NMR谱图中均未出现明显杂峰,出峰积分面积比例与结构式对应氢原子的数量比例相符,表明所得尼龙盐纯度较高。
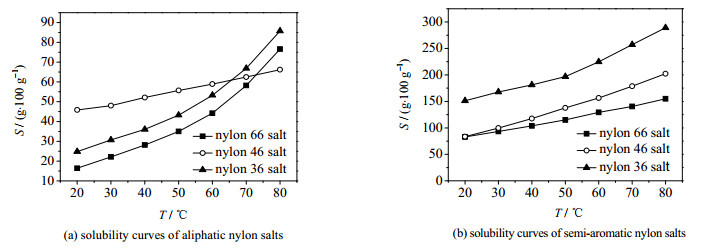
3.2 尼龙盐溶解度测定现有文献报导了多种尼龙66盐及尼龙6T盐的溶解度测定方法,主要有直接观察浑浊点、蒸发饱和溶液称重和折射率法[16-19]。折射率法直接测定溶液折射率,对照标准曲线获得溶液浓度,测得结果较为精确,广泛用于海水及各种盐溶液浓度的测定。选用折射率法测定尼龙盐溶解度,结果如图 5所示。对所得尼龙盐溶解度与温度的关系进行拟合,结果如表 2所示。
|
图 5 6种尼龙盐的溶解度曲线 Fig.5 Solubility curves of six nylon salts |
|
|
表 2 6种尼龙盐的溶解度曲线拟合结果 Table 2 Solubility fitting curves of six nylon salts |
折射率法测得尼龙66盐溶解度数据与沈国良等[16]测得的溶解度数据基本一致。以上图表结果表明相同温度下,脂肪族尼龙盐溶解度远高于半芳族尼龙盐,溶解度随尼龙盐中二胺链节碳原子数量的增加而降低。但尼龙4T盐的溶解度随温度变化不大,成盐过程中发现尼龙4T盐的结晶方式与氯化钠结晶类似,冷却结晶无法直接获得大量尼龙4T盐,需要在低温下投入晶种、延长结晶时间才可以制得大量较大颗粒的晶体。
从尼龙盐的溶解度曲线可知,半芳族尼龙盐和脂肪族尼龙盐溶解度差异较大。后续预聚过程中,溶解度更好的脂肪族单体先发生缩聚反应、生成分子量较高的脂肪族预聚物时半芳族单体才发生缩聚反应。要实现脂肪族尼龙盐和半芳族尼龙盐均匀共聚则需要较高温度和一定含水量以保证尼龙盐的溶解。同时相同温度下,分子量越大的尼龙盐溶解度越低,预聚水含量过高会导致预聚物分子量过低。尼龙36盐和尼龙3T盐等低分子量尼龙盐需要控制预聚含水量以获得较高转化率。
3.3 尼龙盐热稳定性比较聚酰胺的工业生产先通过预聚获得热稳定性较高的预聚物,再采用固相缩聚制备聚酰胺。预聚过程中升温速率较快时可能超过尼龙盐分解温度,导致尼龙盐未完全预聚便部分分解。尼龙盐分解温度的测定对于预聚工艺条件的确定具有重要意义。为分析尼龙盐的热稳定性,对6种不同尼龙盐进行TGA分析,结果如图 6所示。
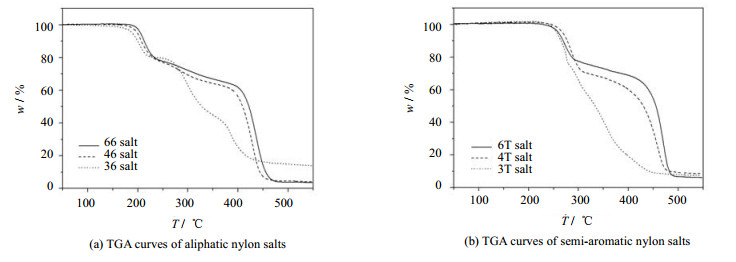
|
图 6 6种尼龙盐的热失重曲线 Fig.6 TGA curves of six nylon salts |
TGA分析结果表明半芳族尼龙盐初始分解温度约为250 ℃,脂肪族尼龙盐初始分解温度约为200 ℃,热分解过程中均经历了“快速失重-缓慢失重-快速失重”过程。
PA66/6T共聚物的工业预聚温度常为200~250 ℃,尼龙盐初始分解温度也位于这个温度范围。第1段快速失重约为尼龙盐总质量的20%,与尼龙盐缩聚反应所脱除水分的质量分数相近,可以推测第1段快速失重为尼龙盐脱水缩聚所致。
文献报道PA66和PA6T的10%热分解温度分别约为425和460 ℃[17],同第2段快速失重温度相近,故推测第2段快速失重为尼龙盐缩聚产物热分解所致。
比较脂肪族尼龙盐的TGA曲线可以发现二胺碳链长度增加,尼龙盐初始分解温度略有上升,热稳定性提高。脂肪族尼龙盐在200~300 ℃均经历“快速失重-缓慢失重”的过程,但尼龙66盐和尼龙46盐在300~400 ℃仍以前期速率缓慢失重,而尼龙36盐则以较高速率快速失重。推测原因是尼龙66盐和尼龙46盐缩合反应剩余二胺链节容易成环、形成较稳定的环状端基,而尼龙36盐缩聚产物的丙二胺链节不易成环、容易断链形成小分子后离去、热稳定性变差。
比较半芳族尼龙盐的TGA曲线发现初始热分解温度基本一致,3T尼龙盐的热失重曲线更为陡峭,未经历尼龙4T盐和尼龙6T盐在300~450 ℃的缓慢失重过程,热失重曲线同尼龙36盐相近,原因同样是丙二胺链节不易成环、尼龙3T盐缩聚产物更容易断链形成小分子离去。
综上所述,芳环的存在提高了尼龙盐缩聚所需反应温度,二胺链节长度对缩聚所需反应温度影响不大。故在高温溶液法进行尼龙盐预聚反应时,脂肪族尼龙盐的反应温度应高于200 ℃、半芳族尼龙盐初始反应温度应高于250 ℃。
4 —结论(1) FTIR分析结果表明,740和820 cm-1附近的特征出峰区可区分半芳族及脂肪族尼龙盐,1H-NMR分析结果表明,特征峰出峰数量、出峰位置和积分面积可区分不同碳链长度尼龙盐。
(2) 相同温度下半芳族尼龙盐在水中溶解度低于脂肪族尼龙盐;碳链长度增加,尼龙盐溶解度降低;温度升高,尼龙盐溶解度升高。
(3) 半芳族尼龙盐初始热分解温度高于脂肪族尼龙盐;碳链长度增加,尼龙盐初始分解温度略有上升。
符号说明:
| m1 | —去离子水质量,g | S | — 溶解度,g·100 g-1 |
| m2 | —饱和盐溶液质量,g | T | —温度,℃ |
| n | —折光率 | w | —尼龙盐质量分数 |
| [1] |
白荣光, 李鹏洲. 尼龙(聚酰胺)66聚合技术研究进展[J]. 化工进展, 2014, 33(1): 21-24. BAI R G, LI P Z. Advances in the research on Nylon (polyamide) 66 polymerization technology[J]. Chemical Industry & Engineering Progress, 2014, 33(1): 21-24. |
| [2] |
GAYMANS R J. HAM A G J V D. Nylon 4, I: An amorphous polyamide[J]. Polymer, 2017, 25(12): 1755-1758. |
| [3] |
HOWARD N G. Partially aromatic polyamides and a process for making them: US, 6355769 B1[P]. 2002-03-12.
|
| [4] |
胡君. 半芳香聚酰胺合成研究现状[J]. 化工新型材料, 2008, 36(10): 23-27. HU J. Present status of synthesis investigation on semi-aromatic polyamides[J]. New Chemical Materials, 2008, 36(10): 23-27. DOI:10.3969/j.issn.1006-3536.2008.10.008 |
| [5] |
AYALA V, MAYA E M, GARCIA J M, et al. Synthesis, characterization, and water sorption properties of new aromatic polyamides containing benzimidazole and ethylene oxide moieties[J]. Journal of Polymer Science Part A Polymer Chemistry, 2010, 43(1): 112-121. |
| [6] |
ADRIAENSENS P, POLLARIS A, CARLEER R, et al. Quantitative magnetic resonance imaging study of water uptake by polyamide 4, 6[J]. Polymer, 2001, 42(19): 7943-7952. DOI:10.1016/S0032-3861(01)00314-7 |
| [7] |
常静.含芳环聚酰胺的合成与表征[D].杭州: 浙江大学, 2009. CHANG J. Synthesis and characteristics of polyamide with aromatic rings[D]. Hangzhou: Zhejiang University, 2009. |
| [8] |
VAN L B, HELMSING M. Process for preparing a polyamide, a nylon salt to be used therein and a process for making the salt: WO, 2016062579 A3[P]. 2017-07-27.
|
| [9] |
NAKAI M, MORIMOTO M, KAWAHARA M. Method for producing nylon salt powder, and method for producing nylon: US, 20130172521A1[P]. 2013-07-04.
|
| [10] |
WELCH R J, MONSTER L, NOMIKOS P, et al. Nylon salt solution preparation processes with trim diamine: WO, 2014179062[P]. 2016-03-17.
|
| [11] |
THIERRY J F. Production of solutions of diacid/diamine salts: US, 20100168375 A1[P]. 2010-07-01.
|
| [12] |
PORFYRIS A, VOUYIOUKA S, et al. Investigating alternative routes for semi-aromatic polyamide salt preparation: The case of tetramethylenediammonium terephthalate (4T salt)[J]. Journal of Applied Polymer Science, 2016, 133(13): 1-11. |
| [13] |
顾雪萍, 田璐璐, 冯连芳, 等. 基于新UNIFAC基团的尼龙66盐溶解度的计算方法[J]. 化工学报, 2016, 67(2): 435-441. GU X P, TIAN L L, FENG L F, et al. Thermodynamic modeling with new UNIFAC groups for solubility of nylon66-salt in water system[J]. CIESC Journal, 2016, 67(2): 435-441. |
| [14] |
顾亮, 顾星, 张红星, 等. 半芳香族尼龙的制备方法[J]. 聚酯工业, 2012, 25(4): 23-26. GU L, GU X, ZHANG H X, et al. A preparation method of semi-aromatic nylon[J]. Polyester Industry, 2012, 25(4): 23-26. DOI:10.3969/j.iSSn.1008-8261.2012.04.008 |
| [15] |
张冬梅, 朱俊, 顾雪萍, 等. 尼龙66盐/尼龙6T盐的成盐过程分析[J]. 高校化学工程学报, 2017, 31(4): 911-917. ZHANG D M, ZHU J, GU X P, et al. Study on forming processes of nylon 66 salt/nylon 6T salt[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(4): 911-917. DOI:10.3969/j.issn.1003-9015.2017.04.022 |
| [16] |
沈国良, 吴宝峰. 尼龙66盐水溶液的溶解度与结晶成核诱导期的研究[J]. 合成纤维工业, 1993, 16(6): 22-25. SHEN G L, WU B F. Study on the solubility of nylon 66 salt aqueous solution and crystal nucleation induction period[J]. China Synthetic Fiber Industry, 1993, 16(6): 22-25. |
| [17] |
王佩刚.含芳环尼龙的合成与表征[D].杭州: 浙江大学, 2007. WANG P G. Synthesis and characteristics of nylons containing aromatic rings[D]. Hangzhou: Zhejiang University, 2007. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1270866 |
| [18] |
赵志.多元共聚半芳香尼龙的合成与性能研究[D].湘潭: 湘潭大学, 2015. ZHAO Z. Synthesis and properties of multiple copolymerized semi-aromatic nylon[D]. Xiangtan: Xiangtan University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10530-1015629680.htm |
| [19] |
王双.半芳香聚酰胺PA6T/66的合成工艺及性能研究[D].郑州: 郑州大学, 2014. WANG S. A study in the synthetic technology and properties of semi-aromatic polyamide PA6T/66[D]. Zhengzhou: Zhengzhou University, 2014. http://www.cnki.com.cn/Article/CJFDTotal-GFZC200206054.htm |




