2. 中国石化扬子石油化工有限公司, 江苏 南京 210048
2. Yangzi Petrochemical Co. Ltd., Sinopec, Nanjing 210048, China
对二乙酰苯是重要的有机合成中间体,广泛用于合成医药、农药和染料等[1, 2]。对二乙酰苯与苯甲醛缩合制备新型医药中间体双查耳酮[3];也可通过气相沉积用作有机发光二极管的电致发光物质[4];或氧化生产对苯二乙酸用于合成塑料的热稳定剂和聚烯烃的抗氧化剂等。目前,我国只有少量试剂级对二乙酰苯产品,尚无规模化装置,对二乙酰苯产品主要依赖进口。
对二乙酰苯的合成主要以苯乙酮为原料,氯化铝为催化剂,通过Friedel-Crafts酰化反应生产[5~8],存在催化剂用量较大、反应过程中会产生氯化氢、设备腐蚀及环境污染严重等问题。开发对二乙酰苯生产新工艺受到广泛关注。朱红军等[9]以对乙基苯乙酮为原料,氯化铝为催化剂,高锰酸钾为氧化剂,在水反应体系中研究对乙基苯乙酮氧化制备对二乙酰苯,对二乙酰苯收率为63.5%。佘远斌等[10]以对二乙苯为原料,选用单核或者双核金属卟啉为催化剂,氧气为氧化剂,对二乙苯的转化率为90.4%,对二乙酰苯的选择性为73.9%。关于过氧化氢氧化对二乙苯制备对二乙酰苯工艺研究,未见报道。
本文以乙酸钴为催化剂,冰乙酸为溶剂,过氧化氢为氧化剂,研究对二乙苯液相氧化制备对二乙酰苯工艺及条件。实验考察原料配比、催化剂用量、反应温度和反应时间等条件对对二乙苯氧化制备对二乙酰苯反应性能影响;通过正交实验优化反应工艺条件;探讨过氧化氢氧化对二乙苯制对二乙酰苯反应机理。为开发对二乙苯氧化制备对二乙酰苯工艺技术提供基础研究。
2 实 验 2.1 原料及试剂原料:对二乙苯,纯度为99.3%(wt),由南京某石油化工公司提供。试剂:冰乙酸,A.R,购自上海申博化工有限公司;过氧化氢(30%(wt))、四水合乙酸钴和溴化钾,均为A.R,购自国药集团化学试剂有限公司。
2.2 对二乙苯氧化制备对二乙酰苯实验称取一定量对二乙苯、冰乙酸(溶剂)、四水合乙酸钴(催化剂)和溴化钾(助剂),依次加入50 mL三口烧瓶中,搅拌,加热,回流;滴加过氧化氢(氧化剂);恒温反应一定时间后,取反应液试样分析其组成。
2.3 反应产物分析采用气质联用色谱仪(德国布鲁克公司Scion-MS-436GC)和气相色谱仪(鲁南SP6890)分析对二乙苯氧化反应产物组成。采用SE-30毛细气相色谱柱,FID氢火焰检测器;气相色谱检测条件为:柱室温度220℃,升温速率10℃⋅min-1,检测器、气化室温度为280℃。采用校正因子法对色谱数据进行处理,校正因子的测定参考文献[11]中的直接法。
对二乙苯(PDEB)转化率(xPDEB)、对乙基苯乙酮(EAP)选择性(SEAP)和对二乙酰苯(PDAB)选择性(SPDAB)按式(1)~(3)计算:
| $\begin{align} & {{x}_{\text{PDEB}}}=1- \\ & \frac{{{m}_{\text{PDEB}}}/{{M}_{\text{PDEB}}}}{{{m}_{\text{PDEB}}}/{{M}_{\text{PDEB}}}+{{m}_{\text{EAP}}}/{{M}_{\text{EAP}}}+{{m}_{\text{PDAB}}}/{{M}_{\text{PDAB}}}+{{m}_{\text{A1}}}/{{M}_{\text{A}1}}+{{m}_{\text{A2}}}/{{M}_{\text{A2}}}+{{m}_{\text{A3}}}/{{M}_{\text{A3}}}} \\ & \times 100\text{ }%\text{ } \\ \end{align}$ | (1) |
| $\begin{align} & {{S}_{\text{EAP}}}= \\ & \frac{{{m}_{\text{EAP}}}/{{M}_{\text{EAP}}}}{{{m}_{\text{EAP}}}/{{M}_{\text{EAP}}}+{{m}_{\text{PDAB}}}/{{M}_{\text{PDAB}}}+{{m}_{\text{A1}}}/{{M}_{\text{A1}}}+{{m}_{\text{A2}}}/{{M}_{\text{A2}}}+{{m}_{\text{A3}}}/{{M}_{\text{A3}}}}\times 100\text{ }\!\!%\!\!\text{ } \\ \end{align}$ | (2) |
| $\begin{align} & {{S}_{\text{PDAB}}}= \\ & \frac{{{m}_{\text{PDAB}}}/{{M}_{\text{PDAB}}}}{{{m}_{\text{EAP}}}/{{M}_{\text{EAP}}}+{{m}_{\text{PDAB}}}/{{M}_{\text{PDAB}}}+{{m}_{\text{A1}}}/{{M}_{\text{A1}}}+{{m}_{\text{A2}}}/{{M}_{\text{A2}}}+{{m}_{\text{A3}}}/{{M}_{\text{A3}}}}\times 100\text{ }\!\!%\!\!\text{ } \\ \end{align}$ | (3) |
在四水合乙酸钴与对二乙苯摩尔比(n(Co(Ac)2·4H2O) / n(PDEB))为0.22,溴化钾与对二乙苯摩尔比(n(Br) / n(Co))为1.67,对二乙苯和冰乙酸体积比(VPDEB / VHAc)为0.10,以及反应温度及反应时间一定条件下,实验考察对二乙苯/过氧化氢(n(PDEB) / n(H2O2))配比对对二乙苯氧化反应转化率和对二乙酰苯选择性的影响,结果列于表 1。
| 表 1 反应物配比对PDEB转化率和PDAB选择性的影响 Table 1 Effects of n(PDEB) / n(H2O2) on PDEB conversion |
由表 1可知,当 n(PDEB) / n(H2O2)为0.20时,对二乙苯转化率为98.62%,对二乙酰苯选择性为42.52%;n(PDEB) / n(H2O2)为0.10时,对二乙苯的转化率接近100%,对二乙酰苯选择性提高了36.90%;继续增加氧化剂(H2O2)用量(n(PDEB) / n(H2O2)为0.07),对二乙酰苯选择性上升不明显,仅提高了2.00%。这是由于过量的氧化剂使对二乙酰苯进一步氧化,并且引入了大量的水,相对降低了对二乙苯和催化剂在反应液中的浓度,不利于反应的进行。因此,合适的反应物配比为n(PDEB) / n(H2O2)为0.10。
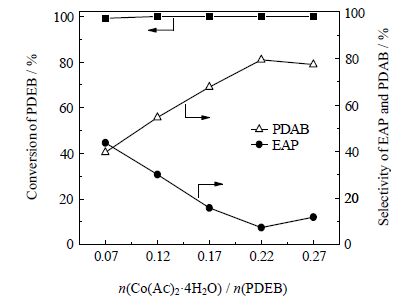
3.1.2 催化剂用量在过氧化氢、溴化钾和冰乙酸用量等一定条件下,实验考察四水合乙酸钴(Co(Ac)2·4H2O)用量对对二乙苯氧化反应转化率以及对二乙酰苯选择性的影响。结果如图 1所示。
|
图 1 四水合乙酸钴用量对PDEB转化率和PDAB选择性的影响 Fig.1 Effects of catalyst dosage on PDEB conversion and selectivity Reaction conditions: VPDEB / VHAc = 0.10, n(PDEB) / n(H2O2) = 0.10, n(Br) / n(Co) = 1.67, (80±1.0)℃, 5.88 h. |
从图 1可知,当n(Co(Ac)2·4H2O) / n(PDEB)为0.07时,对乙基苯乙酮的选择性为43.86%,n(Co(Ac)2·4H2O) / n(PDEB)为0.22时对二乙酰苯的选择性达到79.42%,继续增加催化剂用量,产物选择性增大不明显。这是由于过氧化氢氧化对二乙苯的反应需要通过催化剂进行氧传递,当催化剂加入量较少时,同一时间内参与反应的活性中心少,反应速率较慢;当催化剂用量过大,过多的活性金属离子使得过氧化氢在短时间形成大量的自由基,产生的自由基一部分来不及有效攻击未氧化的乙基便发生自终止,降低氧化剂的有效利用率,降低了对二乙酰苯的选择性。因此,适宜的催化剂用量为n(Co(Ac)2·4H2O) / n(PDEB)为0.22。
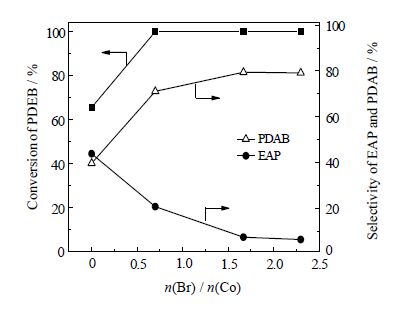
3.1.3 助剂用量在原料配比、催化剂及溶剂用量等一定条件下,实验考察助剂(n(Br) / n(Co))用量对对二乙苯氧化反应转化率以及对二乙酰苯选择性的影响。结果见图 2。
|
图 2 溴化钾用量对PDEB转化率和PDAB选择性的影响 Fig.2 Effects of KBr dosage on PDEB conversion and selectivity Reaction conditions: VPDEB / VHAc = 0.10, n(PDEB) / n(H2O2) = 0.10, n(Co(Ac)2•4H2O) / n(PDEB) = 0.22, (80±1.0)℃, 5.88 h |
由图 2可知,不加助剂时,对二乙苯的转化率和对二乙酰苯的选择性较低,随着助剂量的加大,对二乙苯的转化率逐步增加,接近100%;在n(Br) / n(Co)为1.67时,对二乙酰苯的选择性达到最大,为79.42%;继续增加助剂用量,对二乙苯的转化率和对二乙酰苯的选择性基本不变。这是因为不添加溴化钾时,反应存在很长的诱导期,反应速率较低;加入溴化钾后,溴化钾在乙酸钴的作用下生成溴自由基,能加速自由基的生成,缩短诱导期,加快了反应速率;但是溴化物过量,会加快过氧化氢的分解,降低氧化剂的利用率。因此,适宜的催化助剂用量为n(Br) / n(Co)为1.67。
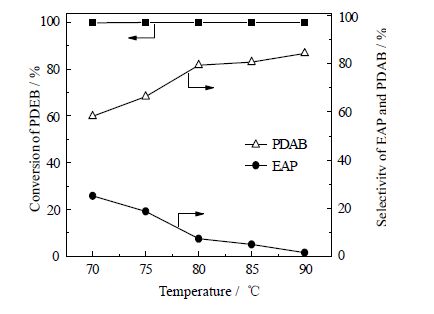
3.1.4 反应温度在原料配比、溶剂、催化剂及助剂用量等一定条件下,实验测定反应温度对对二乙苯转化率以及对二乙酰苯选择性的影响。结果如图 3所示。
|
图 3 反应温度对PDEB转化率和PDAB选择性的影响 Fig.3 Effects of temperature on PDEB conversion and selectivity Reaction conditions: VPDEB / VHAc = 0.10, n(PDEB) / n(H2O2) = 0.10, n(Co(Ac)2·4H2O) / n(PDEB) = 0.22, n(Br) / n(Co) = 1.67, 5.88 h |
由图 3可知,温度为80℃时,对二乙酰苯和对乙基苯乙酮的总选择性达到86.84%,对二乙酰苯的选择性为79.42%,相比温度为70℃ 时,对二乙酰苯的选择性增加了21.2%;这是因为温度较低时,自由基的引发时间较长,大量的对乙基苯乙酮并未能进一步氧化为对二乙酰苯;反应温度过高虽然使反应的引发时间明显缩短,提高了自由基的累积速度,但是也使副产物产生的速度加快,并且过氧化氢在高温下不稳定,分解速度加快,氧化能力降低。因此,合适的反应温度为80℃。
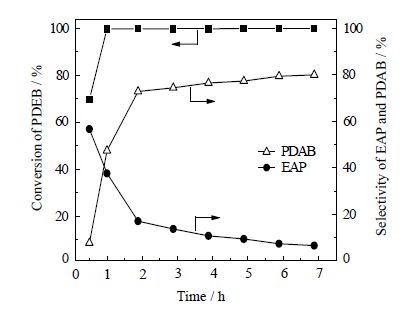
3.1.5 反应时间在反应原料、试剂配比和反应温度一定的条件下,实验考察反应时间对对二乙苯转化率以及对二乙酰苯选择性的影响。实验结果如图 4所示。
|
图 4 反应时间对PDEB 转化率和PDAB 选择性的影响 Fig.4 Effects of reaction time on PDEB conversion and selectivity Reaction conditions: VPDEB / VHAc = 0.10, n(PDEB) / n(H2O2) = 0.10, n(Co(Ac)2·4H2O) / n(PDEB) = 0.22, n(Br) / n(Co) = 1.67, (80±1.0)℃ |
由图 4可知,反应初期,对二乙苯转化率和对二乙酰苯选择性较低,当反应时间为0.50 h时,对二乙苯的转化率已达70%,对乙基苯乙酮的选择性接近60%,只有极少量的对二乙酰苯生成;采用GC-MS分析此反应产物中还含有4-乙基苯乙醇、4-乙酰基苯甲酸和对苯二甲酸。随着反应时间的延长,对乙基苯乙酮的选择性逐渐降低,对二乙苯的转化率接近100%,对二乙酰苯选择性持续上升,当反应时间为5.88 h时,对二乙酰苯的选择性达79.42%,继续延长反应时间对二乙酰苯的选择性几乎不变。因此,适宜的反应时间为5.88 h。
由此可见,相比目前已报道文献[10],本研究开发的过氧化氢液相氧化对二乙苯制对二乙酰苯工艺,具有反应温度较低、反应时间较短、转化率和对二乙酰苯选择性较高的优势。
3.2 对二乙苯氧化制对二乙酰苯反应工艺条件优化在上述实验研究基础上,本研究采用L8(27)正交试验对二乙苯液相氧化制对二乙酰苯反应工艺条件进行优化。正交试验的因素与水平选取见表 2,L8(27)正交实验设计及结果见表 3,其中,8组正交试验中对二乙苯转化率均接近100%。
| 表 2 正交试验的因素水平对照表 Table 2 Factors and levels of the orthogonal test |
按照数理统计原理对L8(27)正交试验结果进行处理,以对二乙酰苯选择性为指标,计算各因素的水平和均值(K1、K2)、极差(R)、效应因子(EF)和离差(S)列于表 3。
| 表 3 L8(27)正交设计实验及结果 Table 3 Experimental design and results of the orthogonal test L8(27) |
从表 3可知,极差(R)和离差(S)分析结果一致,各因素对指标影响大小顺序为:D>C>E>B>A;催化剂(四水合乙酸钴D)、氧化剂(过氧化氢C)和助剂(溴化钾E)用量显著影响对二乙酰苯选择性,是主要因素;反应温度(B)的影响大于反应时间(A);反应温度和反应时间之间的交互作用(A×B)对对二乙酰苯选择性有影响。实验误差(F)的影响很小,低于各个因素。
由正交试验结果分析可见,在本实验范围内,对二乙苯液相氧化制对二乙酰苯反应工艺的最佳条件为A2B2C2D2E2,即四水合乙酸钴与对二乙苯摩尔比为0.25,对二乙苯与氧化剂过氧化氢摩尔比为1:12,溴化钾与对二乙苯摩尔比为1.8,反应时间6.38 h,反应温度82℃。
因A2B2C2D2E2条件不在表 3 L8(27)正交设计实验方案中,为此,本研究对优化结果进行了验证实验。结果表明,在A2B2C2D2E2条件下,对二乙苯液相氧化制对二乙酰苯反应转化率接近100%,对二乙酰苯的选择性为80.81%,大于表 3中SPDAB (%)最高值。可见,本研究优化出的最佳条件合理。
3.3 过氧化氢氧化对二乙苯制对二乙酰苯反应机理探讨借鉴文献[12~15]报道烷基苯液相氧化反应是自氧化自由基反应,以及本研究对二乙苯氧化产物组成随着反应时间变化(图 4)的实验结果,本研究提出对二乙苯的氧化过程为两步进行,如图 5所示,首先是对二乙苯在催化剂作用下氧化生成对乙基苯乙酮;然后随着反应时间的延长,对乙基苯乙酮进一步氧化为对二乙酰苯。
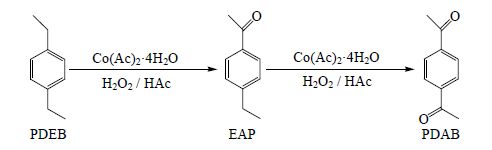
|
图 5 过氧化氢氧化对二乙苯制对二乙酰苯反应过程示意 Fig.5 Oxidation of PDEB by hydrogen peroxide to prepare PDAB |
根据自由基氧化理论和本研究GC-MS分析结果,本研究对过氧化氢氧化对二乙苯制对二乙酰苯反应历程进行了分析,认为对二乙苯氧化制对二乙酰苯反应经历如图 6所示的步骤:①二价钴在过氧化氢作用下生成钴过氧化物自由基;②钴过氧化物自由基攻击对二乙苯,使其碳氢键均裂得到烷基苯自由基;③烷基苯自由基在过氧化氢作用下生成氢过氧化物;④氢过氧化物与钴过氧化物碰撞得到对乙基苯乙酮和4-乙基苯乙醇,钴过氧化物也重新变为二价钴;⑤重复①~④氧化步骤使得对乙基苯乙酮上的乙基被进一步氧化,生成对二乙酰苯。
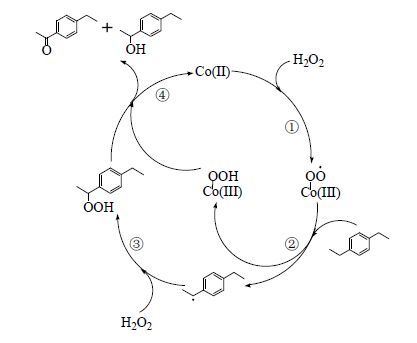
|
图 6 过氧化氢氧化对二乙苯制对二乙酰苯反应历程 Fig.6 Reaction pathway of PDEB oxidation to prepare PDAB |
(1) 本研究开发的过氧化氢液相氧化对二乙苯制对二乙酰苯工艺,具有反应温度较低、反应时间较短、转化率和对二乙酰苯选择性较高的优势。四水合乙酸钴(催化剂)、过氧化氢(氧化剂)和溴化钾(助剂)用量对二乙酰苯选择性影响显著;反应温度和反应时间的交互作用对对二乙酰苯选择性有影响。
(2) 过氧化氢液相氧化对二乙苯制对二乙酰苯反应适宜的工艺条件为:对二乙苯和冰乙酸体积比为0.10、n(Co(Ac)2·4H2O) / n(PDEB)为0.25、n(Br) / n(Co)为1.8、n(PDEB) / n(H2O2)为0.08,反应温度82 ℃,反应时间6.38 h,在此条件下,对二乙苯的转化率接近100%,对二乙酰苯的选择性为80.81%。
(3) 探讨了过氧化氢氧化对二乙苯制对二乙酰苯反应历程为:在过氧化氢作用下,二价钴离子转化为钴过氧化物自由基,作用于对二乙苯生成烷基苯自由基;烷基苯自由基与过氧化氢作用生成氢过氧化物,并与钴过氧化物作用生成对乙基苯乙酮和4-乙基苯乙醇;对乙基苯乙酮上的乙基被过氧化氢进一步氧化生成对二乙酰苯。
符号说明:
| 表 Table |
| [1] | Jana S K, Wu P, Tatsumi T . NiAl hydrotalcite as an efficient and environmentally friendly solid catalyst for solvent-free liquid-phase selective oxidation of ethylbenzene to acetophenone with 1 atm of molecular oxygen[J]. Journal of Catalysis , 2006, 240 (2) : 268-274 DOI:10.1016/j.jcat.2006.03.021 |
| [2] | Lu C, Fu Z, Liu Y . A moderate and efficient method for oxidation of ethylbenzene with hydrogen peroxide catalyzed by 8-quinolinolato manganese (III) complexes[J]. Journal of Molecular Catalysis A:Chemical , 2010, 331 (1) : 106-111 |
| [3] | Mobinikhaledi A, Kalhor M, Jamalifar H . Synthesis, characterization and antimicrobial activities of some novel bis-chalcones[J]. Medicinal Chemistry Research , 2012, 21 (8) : 1811-1816 DOI:10.1007/s00044-011-9696-z |
| [4] | Amabilino D B, Ramos E, Serrano J L . Long-range chiral induction in chemical systems with helical organization. Promesogenic monomers in the formation of poly (isocyanide) s and in the organization of liquid crystals[J]. Journal of the American Chemical Society , 1998, 120 (36) : 9126-9134 DOI:10.1021/ja980474m |
| [5] | Song C E, Shim W H, Roh E J . Scandium (III) triflate immobilised in ionic liquids:a novel and recyclable catalytic system for Friedel-Crafts alkylation of aromatic compounds with alkenes[J]. Chemical Communications , 2000 (17) : 1695-1696 DOI:10.1039/b005335j |
| [6] | TONG Tian-xia(佟天下), ZENG Ai-wu(曾爱武) . Friedel-Crafts acylation reaction of liquid thiophene catalyzed by C25(C25沸石分子筛催化液相噻吩Friedel-Crafts酰基化反应的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26 (6) : 989-993 |
| [7] | Du Y, Liu S, Ji Y . Highly efficient synthesis of Fe-containing mesoporous materials by using semi-fluorinated surfactant and their high activities in Friedel-Crafts alkylations[J]. Catalysis Today , 2008, 131 (1) : 70-75 |
| [8] | FU Ying(付颖), WANG-Min (王敏), YE-Fei (叶非) . Synthesis of N-dichloroacetyl-5-chloro-2,3-dihydro-benzoxazole(N-二氯乙酰基-5-氯-2,3-二氢苯并噁唑的合成)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26 (1) : 134-138 |
| [9] | LIU Shan(刘山), YANG Xiao-yan(杨小燕), CHEN Xiao-bo(陈晓波) . Synthesis methods for a series of acetyl aromatic compounds(乙酰基芳环化合物的合成)[J]. Speciality Petrochemicals(精细石油化工) , 2012, 28 (6) : 24-29 |
| [10] | SHE Yuan-bin (佘远斌). The preparation of bionically catalyzing and oxidizing p-Diethylbenzene is to the method for diacetyl benzene (仿生催化氧气氧化对二乙苯制备对二乙酰基苯的方法): CN, 201010103457.7[P]. 2010-01-29. |
| [11] | ZHANG Da-yang(张大洋), FAN Wen-yu(范文玉), CHEN Li-ya(陈丽娅) . Determination of correction factor without standard of determined compound(无需待测化合物标准样品便可测定校正因子)[J]. Chinese Journal of Chromatography(色谱) , 1998, 16 (2) : 134-136 |
| [12] | QIN J, FU Z, LIU Y . Aerobic oxidation of ethylbenzene Co-catalyzed by N-hydroxyphthalimide and oxobis (8-Quinolinolato) Vanadium (IV) complexes[J]. Chinese Journal of Catalysis , 2011, 32 (6) : 1342-1348 |
| [13] | LI Yan-bin(李延斌), GAO Bao-jiao(高保娇), DU Rui-kui(杜瑞奎) . Catalytic properties of immobilized imido-acetic acid-copper(II) complex in oxidation of organic compounds with molecular oxygen as oxidant(固载化亚胺乙酸-铜配合物催化剂在分子氧氧化有机物过程中的催化性能)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27 (3) : 431-437 |
| [14] | Habibi D, Faraji A R, Arshadi M . Characterization and catalytic activity of a novel Fe nano-catalyst as efficient heterogeneous catalyst for selective oxidation of ethylbenzene, cyclohexene, and benzylalcohol[J]. Journal of Molecular Catalysis A:Chemical , 2013, 372 : 90-99 DOI:10.1016/j.molcata.2013.02.014 |
| [15] | Habibi D, Faraji A R, Arshadi M . Efficient catalytic systems based on cobalt for oxidation of ethylbenzene, cyclohexene and oximes in the presence of N-hydroxyphthalimide[J]. Applied Catalysis A:General , 2013, 466 : 282-292 DOI:10.1016/j.apcata.2013.06.045 |




