2. 陕西煤业化工技术研究院有限责任公司, 陕西 西安 710070
2. Shaanxi Coal Chemical Technology Research Institute Co. Ltd., Xi'an 710070, China
碳酸二苯酯(DPC)是合成工程塑料聚碳酸酯的主要原料之一,其高效合成方法的开发是该领域的热点之一。酯交换法作为一种环境友好的制备碳酸二苯酯的方法,近年来的得到了更多关注。
目前酯交换法制备碳酸二苯酯的方法主要有碳酸二甲酯[1](DMC)和苯酚(PhOH)酯交换法以及碳酸二甲酯同乙酸苯酯(PA)酯交换法,反应方程分别是:
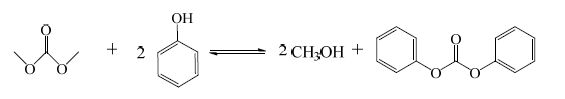
|
(1) |
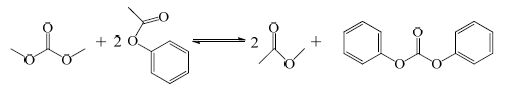
|
(2) |
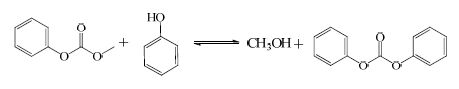
实际上上述反应均会分步发生。如DMC与PhOH的反应,反应首先生成中间产物碳酸苯甲酯(MPC),MPC继续与PhOH或MPC本身发生进一步的酯交换,最终得到DPC,其过程如下:
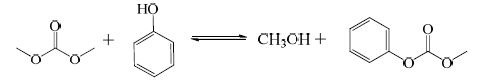
|
(3) |
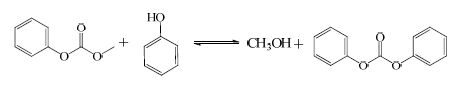
|
(4) |
|
(5) |
相似的,DMC与PA的反应由反应(5)以及以下两个反应构成:
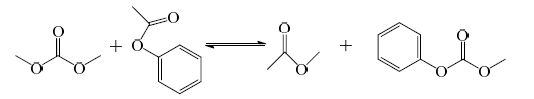
|
(6) |
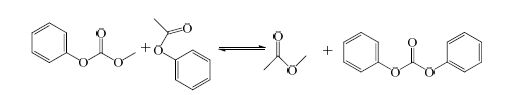
|
(7) |
已报道的DMC酯交换制备DPC工艺分为“一步法”和“两步法”两种[2],一步法将DMC与PhOH以一定比例加入同一反应器中反应,反应直接得到产物DPC,该方法操作简单、设备成本低廉;两步法则首先将DMC与PhOH以一定比例加入反应器,控制反应条件得到中间产物MPC,再由MPC在另一个反应器中,通过歧化反应(5)生成最终产物DPC,该方法的原料利用率高,反应液中PhOH浓度低,分离方便,但设备投入明显增加,操作更加繁琐。这两种方法的比较选择,需要由热力学研究来判断;此外热力学研究结果对反应器设计也具有重要的参考意义。
上述反应体系中,MPC的热力学数据未见报道;DMC、DPC仅有298 K下的生成焓,缺少熵以及热容等数据;碳酸基团在基团贡献法中亦无熵及热容的贡献值数据[3],使用基团贡献法估算生成焓值也不准确。吴元欣等[4]用Benson法对DPC和碳酸乙烯酯(EC)进行热力学计算所得的生成焓与实验值的误差分别达2.0% 和6.5%。与基团贡献法相比,量子化学方法不受基团数据缺失的限制[5]。因为化合物的焓、熵等热力学数据可通过配分函数[6]计算,而配分函数仅是温度及压力的函数,若根据能量最低原理得到化合物优化的分子结构,就可通过配分函数计算特定温度、压力下该分子结构对应的热力学数据。因此理论上量子化计算的方法可以计算任何化合物的热力学数据[3]。
本文应用量子化学计算软件Gaussian,计算各化合物理想气体的热力学数据,结合蒸发焓数据对液相酯交换法制备DPC的反应途径进行了热力学分析,探讨了温度变化对于反应的焓变、吉布斯自由能变、平衡常数的影响,考察了PhOH和PA作为反应物的优缺点,以期为DPC新制备工艺开发提供理论依据。
2 热力学性质计算的基本策略本文采用Gaussian计算软件,基于密度泛函理论(DFT)在B3LYP-D3/6-311(d)水平上,对反应中涉及的几种化合物进行构型优化,又在多个水平上对优化过的构型进行了频率计算,以得到计算值和已有实验值最接近的基组水平[7]。最终确定在B3LYP-D3/6-311(2df,p)水平计算DPC的热力学性质,使用 B3LYP-D3/6-311(2df,2p)水平计算DMC,MA,EC,PhOH、MeOH的热力学性质。由于中间产物MPC在分子构型上十分接近PA和DPC,因此这两种物质的热力学性质计算同样在B3LYP-D3/6-311(2df,p)水平上进行。
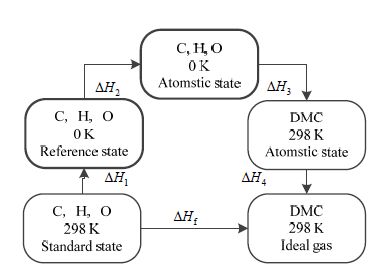
以DMC在298 K下相关计算为例,计算得到的U0 K、H298 K、G298 K见表 1、表 2,然后根据生成焓的定义,设计如图 1所示的反应过程用于计算其生产焓DHf[8]。
| 表 1 C、H、O 原子0 ~ 298 K 的参比态焓变ΔHX 及其实验生成焓ΔHY (kJ▪mol-1)[10] Table 1 Formation enthalpy correction for C,H,O under reference states at 0~298 K (ΔHX) and formation enthalpies (ΔHY) of gaseous atoms measured during experiments (kJ▪mol-1)[10] |
| 表 2 101.325 kPa、298 K 下的计算理想气体热力学性质计算值(B3LYP-D3/6-311G+(2df,2p)) Table 2 Calculated thermodynamic values under ideal gas conditions at 101.325 kPa, 298 K (B3LYP-D3/6-311G+(2df,2p)) |
|
图 1 生成焓计算流程示意图 Fig.1 Calculation of formation enthalpy |
计算所得各物质标准状态下的热力学数据,实验报道数据以及Benson基团贡献法计算结果列于表 3,其中Benson法基团贡献值取自文献[3]。
| 表 3 101.325 kPa、298 K 下的理想气体生成焓 ΔfHg,298 Kφ (kJ▪mol-1)、标准熵Sg,298 Kφ (J▪mol▪K-1)的比较 Table 3 Comparison of calculated formation enthalpies ΔfHg,298 Kφ(kJ▪mol-1) and entropies Sg,298 Kφ(J▪mol▪K-1) under ideal gas conditions at 101.325 kPa 298 K by the two methods |
从表 3中可以发现,通过本文计算方法所得的数据准确,与实验值相比,标准生成焓的最大误差小于1.2%,标准熵的最大误差小于3%。如文献[4]采用Benson基团贡献法估算了碳酸酯类物质DPC与EC的热力学参数,其估算的生成焓分别是 -317.28 kJ▪mol-1、-536.18 kJ▪mol-1;本文计算的DPC、EC生成焓分别为 -311.81 kJ▪mol-1、-504.09 kJ▪mol-1,以实验报道值 -311.00 kJ▪mol-1[10]、-508.30 kJ▪mol-1[9]作为基准来考量,本文的计算方法拥有更好的精确度。
4 计算结果与讨论 4.1 各个反应物、产物在不同温度下生成焓与生成熵的计算碳酸二甲酯与PhOH或PA的反应温度通常在413 ~473 K[12~14]范围,依据上述方法,计算所得373~473 K的各组分焓熵数据见表 4和5。
| 表 4 不同温度下的气体生成焓 fHg,T (kJ▪mol-1) Table 4 Formation enthalpies fHg,T (kJ▪mol-1) under gas phase at different temperatures |
| 表 5 不同温度下的气体标准熵 Sg,Tφ (J▪mol-1▪K-1) Table 5 Entropies Sg,Tφ (J▪mol-1▪K-1) under gas phase at different temperatures |
因实际合成反应均在液相中发生,需要各物质各温度的蒸发焓数据;根据文献报道[9, 10]以及采用Vetere法、Watson方程[3]计算的各组分在不同温度下蒸发焓数据见表 6。
| 表 6 各物质不同温度下的蒸发焓 ΔvHT (kJ▪mol-1) Table 6 Vaporization heat ΔvHT of different components at different temperatures (kJ▪mol-1) |
各个组分在不同温度下的液态生成焓、液态标准熵可以分别通过式(8)、式(9)进行计算:
| $\Delta H_{\operatorname{L},T}^{\phi }=\Delta H_{\operatorname{g},T}^{\phi }-{{\Delta }_{\text{v}}}{{H}_{T}}$ | (8) |
| $S_{\operatorname{L},T}^{\phi }=S_{\operatorname{g},T}^{\phi }-\frac{{{\Delta }_{\text{v}}}{{H}_{T}}}{T}$ | (9) |
根据已得到的气相热力学数据以及蒸发焓,可算得的各组分液态生成焓、液态标准熵见表 7及8。
| 表 7 各物质不同温度下的液态生成焓 ΔfHφL,T (kJ▪mol-1) Table 7 Calculated formation enthalpies ΔfHφL,T (kJ▪mol-1) under liquid phase at different temperatures |
| 表 8 各物质不同温度下的液态标准熵SφL,T (J▪mol-1▪K-1) Table 8 Calculated entropies SφL,T (J▪mol-1▪K-1) under liquid phase at different temperatures |
基于上文所得到的液相各个反应物、产物的热力学数据,各反应的焓变、熵变、吉布斯自由能变以及平衡常数可以分别按照式(10)~(13)进行计算。
| ${{\Delta }_{r}}{{H}^{0}}=\sum{({{n}_{j}}{{\Delta }_{\operatorname{f}}}H_{\operatorname{L}}^{\phi }}{{)}_{products}}-\sum{({{n}_{j}}{{\Delta }_{\operatorname{f}}}H_{\operatorname{L}}^{\phi }}{{)}_{reactants}}$ | (10) |
| ${{\Delta }_{\operatorname{r}}}{{S}^{0}}=\sum{({{n}_{j}}{{\Delta }_{\operatorname{f}}}S_{\operatorname{L}}^{\phi }}{{)}_{products}}-\sum{({{n}_{j}}{{\Delta }_{f}}S_{\operatorname{L}}^{\phi }}{{)}_{reactants}}$ | (11) |
| ${{\Delta }_{r}}{{G}^{0}}={{\Delta }_{r}}{{H}^{0}}-T{{\Delta }_{r}}{{S}^{0}}$ | (12) |
| ${{K}_{C}}=\exp [\frac{-{{\Delta }_{r}}{{G}^{0}}}{RT}]$ | (13) |
PhOH体系计算的焓变 ΔrH0、熵变 ΔrS0见表 9。
| 表 9 不同温度下PhOH体系反应的焓变 ΔrH0 (kJ▪mol-1)以及熵变 ΔrS0 (J▪mol-1▪K-1) Table 9 ΔrH0 (kJ▪mol-1) and DrS0 at different temperatures studied with the phenyl route |
通过上表的数据可以发现,PhOH体系中的各步反应均是吸热反应,其中反应(1)、(3)、(4)的热效应显著,反应(5)的热效应较小,各步反应的热效应随温度的变化都不明显。
PhOH体系中计算吉布斯自由能变 ΔrG0以及平衡常数KC见表 10。
| 表 10 不同温度下的PhOH体系的吉布斯自由能变 ΔrG 0 (kJ▪mol-1) 以及平衡常数KC Table 10 ΔrG0 (kJ▪mol-1) and KC at different temperatures studied with the phenyl route |
使用本文方法计算的反应(1)、(3)、(4)以及反应(5)在298 K下的 ΔrG0分别是49.28、22.36、26.92、4.559 kJ▪mol-1,与目前已有的实验报道值[15]50.7、 23.9、28.1以及4.2 kJ▪mol-1比较接近,再次证明了该方法的可靠性。
从表 10数据可以看出,反应(5)的ΔrG0明显小于反应(4),这两个反应都有可能生成DPC,反应(5)相比(4)在热力学上优势很大。另外,反应平衡常数都很小,说明PhOH体系中的各步反应在热力学上都不利。
对于PA体系,计算所得焓变 ΔrH0、熵变 ΔrS0见表 11。
| 表 11 不同温度下PA体系的焓变 ΔrH0 (kJ▪mol-1)以及熵变 ΔrS0 (J▪mol-1▪K-1) Table 11 ΔrH0 (kJ▪mol-1) and ΔrS0 (J▪mol-1▪K-1) at different temperatures studied with the phenyl acetate route |
由上表可以发现,PA体系中各步反应在各个温度下同样是吸热反应,与PhOH体系相比,对应反应所吸收的热量较少,这种热效应随温度的变化同样不大。
PA体系中计算吉布斯自由能变 ΔrG0以及平衡常数KC见表 12。
| 表 12 不同温度下PA体系的吉布斯自由能变 ΔrG0 (kJ▪mol-1) 以及平衡常数KC Table 12 ΔrG0(kJ▪mol-1)and KC at different temperatures studied with the phenyl acetate route |
从表 12数据可以看出,各个温度下反应(7)的 ΔrG0与反应(5)的 ΔrG0 都比较接近,因此从热力学角度考虑,DPC由反应(5)或者反应(7)生成无太大差别。另外,虽然各反应步骤的平衡常数明显大于PhOH反应体系中的平衡常数,但反应仍然受到热力学的制约,移除副产物有希望有效地提高原料的利用率并提高DPC收率。
综合分析以上计算结果可以发现,PhOH体系中歧化反应(反应(5))的吉布斯自由能变 ΔrG0远小于MPC与PhOH酯交换反应(反应(4))的 ΔrG0,因此从热力学角度考虑,若选择性的生成MPC,再由MPC歧化生成DPC,可以绕过热力学非常不利的反应(4),使得整个反应在热力学上更加合理。因此在PhOH同DMC的反应中应采用“两步法”。
然而PA体系与PhOH体系明显不同,MPC同PA酯交换反应(反应(7))与歧化反应(反应(5))的 ΔrG0值在计算的温度范围内相近,因此从热力学角度考虑,“两步法”并不会使反应在热力学上变得更加有利,而使用“一步法”直接反应生成DPC可以减少设备 以及操作投入,使得反应工艺得到简化,因此在PA同DMC的反应中宜使用“一步法”。
从热力学角度上分析,同样条件下DMC同PA反应的平衡常数KC远大于DMC同PhOH的反应,前者KC约是后者的105倍,因此以DMC同PA为反应原料制备DPC在热力学方面更有利;同时,DMC和PA反应中不会出现DMC同PhOH反应中出现的共沸问题[16],不需要采用萃取精馏等复杂的操作[17],设备也会更加简单。综合来看,PA相较于PhOH可能是一种更适宜的反应原料。
5 结 论(1) 两种酯交换反应均为吸热反应。反应温度的变化对反应热的影响都不大。
(2) 在101.325 kPa、373~473 K,两种酯交换反应在热力学上都不易于发生,总反应的平衡常数KC偏小。为提高DPC收率,宜采取反应分离耦合的方法从反应体系中随时移除产物,如反应精馏以打破反应平衡的限制。
(3) 采用不同原料时,应采用不同的反应工艺。
符号说明:
| 表 Table |
| [1] | DING Xiao-shu(丁晓墅), DONG Xiang-mo(董香茉), LIU Hao(刘浩) . One-pot synthesis of dimethyl carbonate from epichlorohydrin, methanol and carbon dioxide(环氧氯丙烷、甲醇和二氧化碳一步直接催化合成碳酸二甲酯的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29 (1) : 164-169 |
| [2] | YIN Xia(殷霞), MA Fei(马飞), LI Jian-guo(李建国) . Progress in reaction dynamics and process of transesterification of dimethyl carbonate and phenol(碳酸二甲酯与苯酚反应动力学及工艺研究进展)[J]. Chemical Engineering (China)(化学工程) , 2013, 12 (4) : 1-4 |
| [3] | 气液物性估算手册[M].第5版.北京:化学工业出版社, 2005. Poling B E, Prausnitz J M, O'Connell J P. The properties of gas and liquids [M]. 5th ed . Beijing :Chemical Industry Press , 2005. |
| [4] | WU Yuan-xin(吴元欣), CHEN Cheng(陈成), WEN Qing(文庆) . Thermodynamic analysis of synthesis of diphenyl carbonate by transesterification of ethylene carbonate and phenyl acetate(碳酸乙烯酯与醋酸苯酯合成碳酸二苯酯的热力学分析)[J]. Journal of Wuhan Institute of Technology(武汉工程大学学报) , 2012, 34 (8) : 1-5 |
| [5] | CHEN Li-yu(陈立宇), LEI Peng(雷鹏), SHI Bo-hui(师博辉) . Study on the thermodynamics of methane partial oxidation in oleum(甲烷在发烟硫酸体系中部分氧化反应的热力学研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26 (3) : 365-369 |
| [6] | Ochterski J W. Thermochemistry in Gaussian. http://www.gaussian.com/thermo/thermo.pdf, 2000. |
| [7] | Saeys M, Reyniers M F, Marin G B . Ab Initio calculations for hydrocarbons:enthalpy of formation, transition state geometry, and activation energy for radical reactions[J]. Journal of Physical Chemistry A , 2003, 107 (43) : 9147-9159 DOI:10.1021/jp021706d |
| [8] | Li X W, Shibata E, Nakamura T . Theoretical calculation of thermodynamic properties of polybrominated dibenzo-p-dioxins[J]. Journal of Chemical Engineering Data , 2003, 48 (3) : 727-735 DOI:10.1021/je0256582 |
| [9] | 上海:世界图书出版社, 1999. Dean J A. Langes chemistry handbook version 15th[M]. Shanghai :World Book Inc , 1999. |
| [10] | NIST Chemistry WebBook:http://webbook.nist.gov./chemistry/. |
| [11] | Steele W V, Chirico R D, Knipmeyer S E . Thermodynamic properties and ideal-gas enthalpies of formation for dicyclohexyl sulfide, diethylenetria-mine, di-n-octyl sulfide, dimethyl carbonate, piperazine, hexachloroprop-1-ene, tetrakis(dimethylamino) ethylene, N,N'-Bis-(2-hydroxyethyl) ethyleneediamine, and 1,2,4-triazolo1,5-apyrimidine[J]. Journal of Chemical Engineering Data , 1997, 42 (6) : 1037-1052 DOI:10.1021/je9700986 |
| [12] | XING Ai-hua(邢爱华), ZHANG Min-qing(张敏卿), HE Zhi-min(何志敏) . Thermodynamic analysis of synthesis of diphenyl carbonate by transesterification on dimethyl carbonate and phenol(碳酸二甲酯与苯酚酯交换合成碳酸二苯酯热力学分析)[J]. Chemical Engineering (China)(化学工程) , 2006, 34 (11) : 40-43 |
| [13] | WANG Li-hui(王立慧), MA Fei(马飞), LI Jian-guo(李建国) . Transesterification of dimethyl carbonate and phenyl acetate to diphenyl carbonate(碳酸二甲酯与乙酸苯酯酯交换合成碳酸二苯酯)[J]. Industrial Catalysis(工业催化) , 2012, 20 (1) : 7-12 |
| [14] | NIU Hong-ying(牛红英), DU Zhi-ping(杜志平), KANG Tao(康涛) . Progress in synthesis of diphenyl carbonate by transesterification of dimethyl carbonate and phenol(碳酸二甲酯和苯酚酯交换合成碳酸二苯酯的研究进展)[J]. Petrochemical Technology(石油化工) , 2006, 35 (2) : 191-196 |
| [15] | Haubrock J, Raspe M, Versteeg G F . Reaction from dimethyl carbonate to diphenyl carbonate. 1. Experimental determination of the chemical equilibria[J]. Industrial & Engineering Chemistry Research , 2008, 47 (24) : 9854-9861 |
| [16] | CHEN Bing(陈兵), LI Guang-xing(李光兴), ZHENG Yu-yin(郑宇印) . Measurement and correlation of VLE date for dimethyl carbonate and methanol binary system(碳酸二甲酯-甲醇体系汽液平衡数据的测定及交联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 1997, 11 (2) : 193-196 |
| [17] | SHI Yun-hai(施云海), ZHANG Yan(张岩), TU Jin-lin(涂晋林) . Separation of methanol and dimethyl carbonate azeotropic mixture(甲醇与碳酸二甲酯恒沸物的萃取精馏分离)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 1999, 13 (3) : 211-216 |




