近年来,随着人类工业化进程的加快,包括CO2在内的温室气体排放量逐年上升,导致温室效应日益加剧[1],在密闭环境(如太空舱、潜艇等)中CO2的累积损害人体健康。为了缓解温室效应,保障密闭环境中作业人员的健康,利用各项技术去除CO2具有非常重要的意义和研究价值。大气和密闭空间中CO2浓度属于低浓度范围,其浓度值远低于工业企业排放的烟道气,因此捕集(或去除)方法存在一定的区别。
常见的CO2捕集分离技术包括吸收分离法[2]、吸附分离法[3]、膜分离法[4]等。固体吸附剂具有吸附量大且吸附速率快,选择性高,易再生,使用周期长等优点,因此成为近年来研究的热点[5-6]。多孔材料包括分子筛、碳材料和MOFs材料均具有较好的CO2吸附性能,是较为常见的CO2固体吸附剂,利用有机胺对多孔材料进行理化性质调控,可以进一步提高材料的CO2吸附性能。
根据CO2吸附的特性,固体吸附剂常用再生方法包括变温吸附(temperature swing adsorption, TSA)、变压吸附(pressure swing adsorption, PSA)、变真空吸附(vacuum swing adsorption, VSA)、变电吸附(electric swing adsorption, ESA),还包括最近兴起的湿法再生[7]和变电容吸附技术等。为了提高解吸效率,文献报道了一种新颖的快速电解吸技术[8],即变电吸附,它是利用吸附剂具有的导电性,采用直接在吸附剂两端通电或电磁诱导产生焦耳热的方式加速CO2脱附,它实际上是变温吸附技术的改进,具有升温效率高、能耗低、能量利用率高、循环周期短、不引入其他杂质等优点[9]。
传统炭凝胶材料具有良好的导电导热性能,但本身对CO2的吸附能力较差,通过表面浸渍有机胺改性可以提高其CO2吸附容量,并在吸附剂中掺杂金属改变材料的孔结构以及进一步提高其导电性[10]。以炭凝胶材料为例,将金属元素引入碳骨架的方法主要包括:(1)将金属离子(如锆、铈)溶解于间苯二酚-甲醛混合物中[11];(2)使用离子交换后的间苯二酚衍生物,再用溶胶凝胶法聚合[12];(3)将金属前驱体沉积在湿凝胶或炭凝胶上,具体方法包括浸渍、吸附、升华和超临界沉积等[13]。
本文利用炭凝胶材料良好的导电导热能力,通过表面改性的方法提高其CO2吸附容量,并研究金属元素掺杂对电解吸性能的影响,为电解吸工艺的应用提供新思路。
2 实验材料和方法 2.1 吸附剂制备炭凝胶吸附材料合成参考PEKALA的方法[14],将间苯二酚同碳酸钠溶液混合,配制成浓度约50%的水溶液,在室温下搅拌30 min,搅拌速度为600 r·min-1,待搅拌均匀后再加入甲醛溶液,仍在室温下以600 r·min-1搅拌1 h。然后将反应液装入透明玻璃管中,用封口膜和生料带封口后在干燥箱中进行老化,老化时间包括25 ℃ 1 d,50 ℃ 1 d及80 ℃ 5 d,将老化成型的有机湿凝胶从玻璃管中取出并置于丙酮溶液中,采用超声方式将水萃取出来,每次超声10 min,超声后换取丙酮,重复3次。之后在管式炉中置于氮气氛中(100 mL·min-1)进行干燥(以0.5 ℃·min-1的速度由室温升到65 ℃,保持5 h;再升到110 ℃,保持5 h)和炭化(以5 ℃·min-1的速度升到900 ℃,保持3 h)。反应物配比如下:间苯二酚(R)和甲醛(F)摩尔比为1:2;间苯二酚(R)和碳酸钠(C)摩尔比为1 500:1,得到的炭凝胶载体记为CX1500。
按此操作方法在前驱体中分别掺杂醋酸锆、醋酸铈、醋酸铜,间苯二酚(R)与锆(Zr)、铈(Ce)、铜(Cu)的摩尔比分别为50:1和100:1,对应获得6种金属掺杂炭凝胶,分别记为Zr50,Zr100,Ce50,Ce100,Cu50和Cu100。
称取4 g四乙烯五胺(tetraethylenepentamine, TEPA),6 g乙醇于锥形瓶中,振荡至溶液透明澄清无分层,称取3 g干燥的金属/炭凝胶载体,超声30 min后取出固体材料,再经乙醇洗涤并真空干燥,得到固态胺吸附剂。
2.2 吸附剂表征比表面积、孔体积和平均孔径采用气体吸附仪(AUTOSORB-1-C,Quantachrome,America)分析计算得到;热稳定性和载体浸渍量采用热重分析仪(SDT Q600,TA Instruments,America)进行分析;表面形貌采用扫描电子显微镜(SU-70,Hitachi,Japan)观察,工作电压3.0 kV;金属元素种类及表面含量采用能谱仪(SU-70-EDS,Hitachi,Japan)配合扫描电子显微镜分析得到,总含量采用电感耦合等离子体发射光谱仪(Optima 2100DV,PerkinElmer,America)将样品消解后测得。
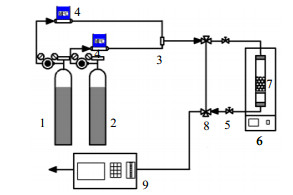
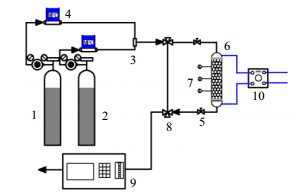
2.3 动态吸脱附CO2及电解吸实验图 1为CO2吸/热脱附实验装置图,图 2为CO2电解吸实验装置图。
|
图 1 CO2吸附/热脱附实验流程装置图 Fig.1 Schematic diagram of the CO2 adsorption/thermal desorption experimental setup 1. N2 2. 2.7% CO2 + 97.3% N2 3. gas mixer 4. mass flow controller 5. two-way valve 6. thermostat 7. tube reactor 8. three-way valve 9. infrared gas analyzer |
|
图 2 CO2电解吸实验流程装置图 Fig.2 Schematic diagram of the CO2 electrothermal desorption experimental setup 1. N2 2. 2.7% CO2 + 97.3% N2 3. gas mixer 4. mass flow controller 5. two-way valve 6. electrothermal desorption reactor 7. temperature sensor 8. three-way valve 9. infrared gas analyzer 10.DC power supply |
GXH-510型红外线气体分析仪由北京西比仪器有限公司生产;D08-2F型流量显示仪和D07-19C型质量流量控制器由北京七星华创电子股份有限公司北京生产;AT-950型恒温箱由天津奥特赛恩斯仪器有限公司生产;PD9603型直流电源由东莞纳普电子科技有限公司生产;减压阀由上海减压器厂有限公司生产;高纯氮气和CO2混合气体由杭州今工气体公司生产。
电解吸反应器为石英玻璃管,其尺寸(长×外径×壁厚)为100 mm × 30 mm × 5 mm,吸附剂两端用石墨电极,中间放入一片泡沫镍薄片使其接触良好,采用直流电源调节输出电流,热电偶测量不同位置吸附剂温度。根据恒温箱尺寸自行设计加工了不锈钢反应器作为吸附及热吹扫脱附反应器,其尺寸(长×外径×壁厚)为200 mm × 20 mm × 2 mm,反应器进出口变径为3 mm后与外气路相连,变径头与反应器连接用硅橡胶O型圈密封。
吸附试验前先将吸附柱加热至70 ℃,用高纯N2吹扫至出口CO2体积浓度低于0.01%,以除去吸附剂中残留的H2O和CO2。吹扫结束后设置吸附柱温度为20 ℃,待温度稳定后,通过质量流量计分别控制氮气和CO2混合气,配成体积浓度约为0.40%的CO2吸附气。在不锈钢反应器中装填一定量吸附剂,材料两端用多孔镍筛板固定。直至出口气中CO2浓度与进气浓度一致且浓度维持10 min不变,则判断吸附过程结束。脱附过程用高纯N2吹扫,脱附温度为60和70 ℃。
固定床吸附CO2后,取出吸附剂填入电解吸反应器中,泡沫镍薄片连接吸附剂和石墨电极,热电偶探针插入反应器的测温孔中,使探头位于吸附剂中心位置,测量脱附过程中吸附剂的中心温度变化,打开直流电源开关及电脑上的直流电源记录软件,设定电流恒定分别为0.7和0.75 A,调节初始电压为2.1和2.25 V,用高纯N2吹扫。
实验过程中,采用CO2红外气体分析仪来在线检测吸附柱出口处的CO2浓度。吸附剂一定时间(t,min)内的CO2动态吸/脱附量(q,mg·g-1)按以下公式计算:
| $ q = \int_0^t {\frac{{Q(\left| {{c_{{\rm{in}}}} - {c_{{\rm{out}}}}} \right|){\rm{M}}}}{{m \times V}}} {\rm{d}}t $ | (1) |
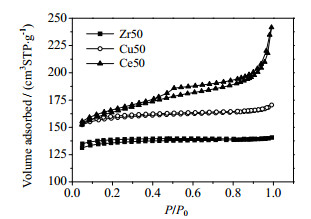
Zr50、Cu50、Ce50 3种金属/炭凝胶载体的低温N2吸/脱附等温曲线如图 3所示。
|
图 3 不同炭凝胶的低温N2吸/脱附等温曲线 Fig.3 N2 adsorption/desorption isotherms for different carbon xerogels |
根据IUPAC分类,Zr50和Cu50金属/炭凝胶的N2吸附/脱附等温线属于Ⅱ型,Ce50属于Ⅳ型,表现为H1型滞后环,说明Ce50炭凝胶具有有序的介孔孔道结构。在P/P0 = 1.0时,Cu50和Zr50的N2吸附量明显减少,说明Cu50和Zr50材料介孔数量较少,可能形成了大孔结构。表 1是按BET法计算得到的孔结构参数。
图 4(a)~(l)为电子显微镜扫描得到的Zr50、Zr100、Cu50、Cu100、Ce50、Ce100金属/炭凝胶载体及浸渍后吸附剂表面形貌图。

|
图 4 金属/炭凝胶载体及吸附剂的表面形貌 Fig.4 Scanning electron microscopy (SEM) images of supports and adsorbents |
由图 4可知,掺杂不同金属得到的金属/炭凝胶的表面形貌差异较大,金属掺杂量不同得到的炭凝胶表面差异较小。掺杂不同金属的炭凝胶表面形貌差异主要表现为骨架形状的不同,掺铜和掺铈炭凝胶的骨架是由其内部的纳米颗粒联结形成,Cu50骨架颗粒尺寸小于1 μm,Cu100小于500 nm,Ce50小于300 nm,Ce100小于150 nm,掺锆炭凝胶骨架为非颗粒状结构,其骨架尺寸进一步增大。结合表 1载体的孔结构参数和图 4载体的表面形貌来看,Zr50以大孔和微孔为主,Cu50以微孔为主,含少量的介孔,Ce50以介孔和微孔为主。影响炭凝胶表面形貌及其孔结构的因素是多方面的,制备载体时的初始溶液的酸碱性差异被认为是最主要的原因。间苯二酚和甲醛的缩合反应涉及到两个反应过程:加成和聚合。间苯二酚和甲醛的加成反应是碱催化反应,而聚合反应是酸催化反应。Zr50、Zr100、Cu50、Cu100、Ce50、Ce100制备时的初始溶液的pH值分别为3.91、4.15、4.65、4.88、5.51、5.63,溶液的酸碱度会影响炭凝胶制备过程中的聚合反应,从而影响炭凝胶的表面形貌。随着醋酸盐加入量的增多,溶液的pH值降低,得到的炭凝胶颗粒尺寸逐渐增大。
|
|
表 1 炭凝胶孔结构参数 Table 1 Pore characteristics of the carbon xerogels |
浸渍TEPA之后,炭凝胶的骨架更加光滑,但没有明显变化,TEPA负载在载体孔道表面,孔结构发生了较大的变化。
采用能谱仪,配合扫描电子显微镜对载体表面进行金属元素分析,采用电感耦合等离子体发射光谱仪(inductively coupled plasma optical emission spectrometry,ICP-OES)进行载体金属总含量分析,表 2是通过能谱和ICP-OES分析得到的金属/炭凝胶载体的金属含量表。
|
|
表 2 金属含量表 Table 2 Metal contents of the carbon xerogels |
通过金属含量分析可知,金属均掺杂到了炭凝胶载体上,锆和铈掺杂量较高而铜的掺杂量较低。前驱体金属盐掺杂含量越高,制备得的金属/炭凝胶载体金属含量就越高。
通过热重仪测定炭凝胶载体上有机胺的浸渍量,浸渍量测定条件为在高纯氮气的气氛中,以升温速率10 ℃·min-1从室温升至500 ℃,其失重量即可认为是TEPA浸渍量。表 3中列出了不同吸附剂的TEPA浸渍量。
|
|
表 3 不同吸附剂的TEPA浸渍量 Table 3 TEPA impregnation amounts of different adsorbents |
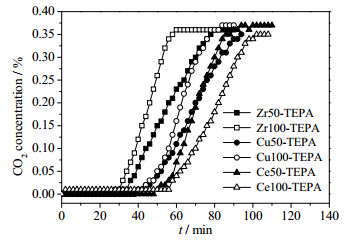
分别称取~3 g吸附剂在20 ℃下进行体积分数0.4%的CO2固定床吸附,图 5为不同吸附剂的CO2吸附穿透曲线。
|
图 5 不同吸附剂的CO2穿透曲线 Fig.5 CO2 adsorption breakthrough curves of different adsorbents |
根据式1可计算得到6种吸附剂的吸附量,图 6为不同吸附剂的CO2吸附速率曲线。
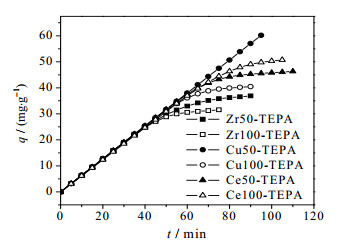
|
图 6 不同吸附剂的CO2吸附速率曲线 Fig.6 CO2 adsorption profiles of different adsorbents |
从图中可看出,Ce100-TEPA和Ce50-TEPA吸附量最大,吸附速率最快,其次是Cu50-TEPA和Cu100-TEPA,Zr50-TEPA和Zr100-TEPA吸附量最小,吸附速率最慢。根据表 3,在一定范围内,有机胺浸渍量越高,吸附量越大,吸附速率越快,对于浸渍量接近的材料来说浸渍地越均匀吸附效果越好,而掺铜吸附剂吸附量不高可能是由于浸渍不均匀导致堵塞了孔道,使得吸附时有机胺无法充分与CO2接触。有机胺浸渍情况受到吸附剂孔结构的影响,因此,不同吸附剂吸附量的不同,最终是由吸附剂孔结构不同所导致的。
3.3 脱附性能研究6种吸附剂在恒定电流下进行电脱附及固定床恒温热脱附,不同金属/炭凝胶-TEPA吸附剂得到不同的脱附穿透曲线,图 7(a)~(f)为不同吸附剂的脱附穿透曲线。

|
图 7 不同吸附剂的脱附穿透曲线 Fig.7 CO2 desorption breakthrough curves of different adsorbents |
不同吸附剂的电脱附穿透曲线是由一个峰加一个较长的拖尾组成,脱附到300 min时,吸附剂已经能实现较好的再生。随着热脱附温度的提高或电脱附电流的增大,最高脱附浓度随之增大。脱附时间随着脱附温度或电流的升高而减小,温度太低或电流太小时,脱附时间长,不利于吸附剂的再生。对于有机胺负载的吸附剂,吸脱附CO2表现为化学反应,因此温度是影响吸附剂再生的重要因素。
热脱附过程初始阶段,脱附温度较低,脱附速率小,因此只有少量的CO2脱附,随着温度逐渐升高,脱附速率增加,CO2大量脱附。在脱附过程的升温段,出口气CO2浓度逐渐变大,很快达到了最大值,这时温度不再上升,仅仅依靠N2吹扫的溶解效应使CO2脱附,脱附快达到完全时,CO2浓度推动力变小,传质过程变慢,因此导致了脱附曲线的拖尾。
电脱附过程,初始阶段吸附剂温度迅速上升,5 min后温度趋于平稳,30 min后吸附剂温度达到稳定值,通过测定电脱附过程的吸附剂的温度分布,可近似认为0.75 A恒电流电脱附时,吸附剂平均脱附温度为70 ℃,0.7 A恒电流电脱附时,吸附剂平均脱附温度为60 ℃。通过对比电脱附和固定床热脱附穿透曲线可知,脱附过程初始阶段,电脱附的脱附速率大于热脱附,电脱附较热脱附能更快达到最大脱附速率,符合电脱附快速高效的要求。对于掺锆材料,Zr50-TEPA的电脱附速率明显大于电脱附过程平均温度所对应的热脱附速率,而Zr100-TEPA在较低温度和电流下差异不大,在较高温度下热脱附速率大于电脱附速率。对于掺铜材料,Cu100-TEPA脱附速率变化率较大,脱附主要集中在前半段,Cu50-TEPA脱附速率较Cu100-TEPA平缓,平均脱附温度为70 ℃时,电脱附速率较热脱附速率小,但平均脱附温度为60 ℃时,电脱附速率较热脱附速率大,说明对于掺铜材料,电脱附在较低的电流下,脱附效果较相同温度下的热脱附要好。对于掺铈材料,相应平均脱附温度下,电脱附的脱附速率与热脱附相差较小。
为了研究金属掺杂对脱附速率是否有影响,作者对比了传统炭凝胶浸渍TEPA后的吸附剂与这6种金属掺杂改性炭凝胶制得固态胺吸附剂的脱附效果,图 8为7种吸附剂热脱附与电脱附穿透曲线。
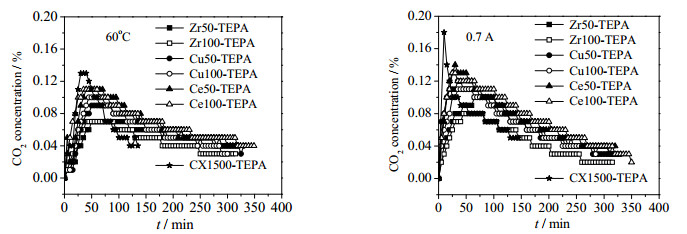
|
图 8 同一条件下不同吸附剂脱附穿透曲线 Fig.8 CO2 desorption breakthrough curves of different adsorbents at 60 ℃ and 0.7 A |
由图 8(a)可知热吹扫条件下,CX1500-TEPA在开始阶段能较快达到最大脱附速率,且最大脱附速率略高于掺杂金属的吸附剂,但脱附速率降低地也很快,大概在80 min后就低于其他6种吸附剂。由图 8(b)可知,通电情况下,CX1500-TEPA一开始很快达到最大脱附速率,但同时脱附速率也迅速降低,30 min后就低于其他几种金属改性吸附剂,可能是由于金属的掺杂在电的作用下改变了有机胺与CO2之间的活化能。因此,从整体脱附过程来说,金属掺杂改性在一定程度上提高了炭凝胶作为载体的固态胺材料的电脱附性能,而掺铈材料为其中效果最好的材料。不同金属及掺杂比例导致载体孔结构和导电导热性能的差异,从而影响在CO2脱附过程中的传质,最终影响脱附效果。
对于所有的吸附剂来说,无论是热脱附还是电脱附,CO2在脱附初始阶段内大量脱除,而脱附后期脱附量很小,能耗很大,因此为了降低能耗,可在脱附后期降低脱附温度或减小工作电流。
3.4 能耗分析由于本实验采用恒电流加热的方式,电解吸过程中,随着温度不断升高,电阻不断减小,消耗的电能可以用式(2)计算
| $ E = I\int_0^t {U{\rm{d}}t} $ | (2) |
由式(2)可看出,恒电流条件下,电能耗的大小取决于电压的大小与加热时间的长短。电压的大小与吸附剂的导电性能有关,温度升高过程中电阻逐渐变小,电压逐渐变小,放热逐渐变少,有利于吸附剂维持一定的脱附温度。通电加热的时间长短与吸附剂的导热性能有关,热导率越大,升温速率越快,通电加热时间相对就短。因此,吸附剂的导电和导热性能都将影响到电加热过程中消耗的电能。
由于脱附过程有较长拖尾现象,整个过程的能耗参考价值不大,因此本文只比较100 min内的能耗。根据式(2)计算得到100 min内6种吸附剂电脱附过程的能耗,列于表 4中:
|
|
表 4 电脱附能量消耗 Table 4 Energy consumption of electrodesorption |
由表 4可知,不同的吸附剂,脱附每千克CO2所需的能量有所差异,掺杂不同金属的吸附剂中,掺锆材料脱附每千克CO2所需的能耗较大,其次是掺铜材料,能耗最小的是掺铈材料。0.7 A电脱附时,对于掺杂相同金属的吸附剂,金属掺杂量越小,脱附每千克CO2所需的能耗越大。0.75 A电脱附时,掺铜材料和掺铈材料脱附每千克CO2所需的能耗与金属掺杂量正相关,而掺锆材料则相反。对比同种材料,除了Cu50-TEPA,0.7 A电脱附所需的能耗要大于0.75 A电脱附。
陈建宇[15]研究了蜂窝状活性炭吸附CO2及电解吸过程,发现随着CO2进料浓度的提高,捕集单位质量CO2的能耗显著下降,由于本实验去除的是低浓度CO2,吸脱附难度较烟道气更高,有机胺与CO2结合力更大,化学吸附相较于物理吸附来说逆反应即脱附过程更难进行,且反应器很小,吸附剂使用量很少,所以在脱附过程中能量损失较大。
4 结论载体孔结构不同影响了有机胺的浸渍,从而影响固态胺吸附剂吸附量。氨基吸附CO2为化学反应,随着脱附温度或电流升高,脱附速率增大。脱附过程由一个峰加一个较长的拖尾组成,为了降低能耗,可在脱附后期降低脱附温度或减小工作电流。电脱附较热脱附更快达到最大脱附速率,符合电脱附快速高效的要求。掺铈材料吸/脱附速率快,吸/脱附量大,且在电脱附过程中,脱附每千克CO2所需能耗最少,因此,掺铈吸附剂的吸脱附性能较掺铜吸附剂和掺锆吸附剂更为优异,可进行更深入的研究和探讨。
符号说明:
|
|
| [1] |
RANJAN M, HERZOG H J. Feasibility of air capture[J]. Energy Procedia, 2011, 4: 2869-2876. DOI:10.1016/j.egypro.2011.02.193 |
| [2] |
KIM S, SHI H, LEE J Y. CO2 absorption mechanism in amine solvents and enhancement of CO2 capture capability in blended amine solvent[J]. International Journal of Greenhouse Gas Control, 2016, 45: 181-188. DOI:10.1016/j.ijggc.2015.12.024 |
| [3] |
CHOI S, GRAY M L, JONES C W. Amine-Tethered solid adsorbents coupling high adsorption capacity and regenerability for CO2 capture from ambient air[J]. Chemsuschem, 2011, 4(5): 628-635. DOI:10.1002/cssc.201000355 |
| [4] |
PERATITUS M. Porous inorganic membranes for CO2 capture:Present and prospects[J]. Chemical Reviews, 2014, 114(2): 1413-1492. DOI:10.1021/cr400237k |
| [5] |
UNVEREN E E, MONKUL B O, SARIOGLAN S, et al. Solid amine sorbents for CO2 capture by chemical adsorption:A review[J]. Petroleum, 2017, 3(1): 37-50. DOI:10.1016/j.petlm.2016.11.001 |
| [6] |
LEUNG D Y, CARAMANNA G, MAROTOVALER M M, et al. An overview of current status of carbon dioxide capture and storage technologies[J]. Renewable & Sustainable Energy Reviews, 2014, 39: 426-443. |
| [7] |
HE H, LI W, ZHONG M, et al. Reversible CO2 capture with porous polymers using the humidity swing[J]. Energy and Environmental Science, 2013, 6(2): 488-493. DOI:10.1039/C2EE24139K |
| [8] |
GRANDA C A, RODRIGUES A E. Electric swing adsorption for CO2 removal from flue gases[J]. International Journal of Greenhouse Gas Control, 2007, 2(2): 194-202. |
| [9] |
HUI A, BO F. Desorption of CO2 from activated carbon fibre-phenolic resin composite by electrothermal effect[J]. International Journal of Greenhouse Gas Control, 2010, 4(1): 57-63. DOI:10.1016/j.ijggc.2009.06.003 |
| [10] |
MORENOCASTILLA C, MALDONADOHODAR F J. Carbon aerogels for catalysis applications:An overview[J]. Carbon, 2005, 43(3): 455-465. DOI:10.1016/j.carbon.2004.10.022 |
| [11] |
NAGY B, CZAKKEL O, LASZLO K. Novel synthesis route of metal doped resorcinol-formaldehyde polymer xerogels with tuned porosity[J]. Microporous and Mesoporous Materials, 2014, 185: 66-71. DOI:10.1016/j.micromeso.2013.11.004 |
| [12] |
BAUMANN T F, FOX G A, Satcher J H, Y, et al. Synthesis and characterization of copper-doped carbon aerogels[J]. Langmuir, 2002, 18(18): 7073-7076. DOI:10.1021/la0259003 |
| [13] |
SAQUING C, CHENG T, Aindow M, et al. Preparation of platinum/carbon aerogel nanocomposites using a supercritical deposition method[J]. Journal of Physical Chemistry B, 2004, 108(23): 7716-7722. DOI:10.1021/jp049535v |
| [14] |
PEKALA R W. Organic aerogels from the polycondensation of resorcinol with formaldehyde[J]. Journal of Materials Science, 1989, 24(9): 3221-3227. DOI:10.1007/BF01139044 |
| [15] |
陈建宇.蜂窝状活性炭吸附CO2及电解吸过程的研究[D].上海: 华东理工大学, 2012. CHEN J Y. CO2 adsorption on activated carbon monolith and electrothermal desorption[D]. Shanghai: East China University of Science and Technology, 2012. |




