2. 陆军勤务学院 军事设施系,重庆 401311
2. Department of Military Installation, Army Logistics University, Chongqing 401311, China
高级氧化技术[1, 2]又称做深度氧化技术,以产生具有强氧化能力的自由基[3~5]为特点,在高温高压、电、声、光辐照、催化剂等反应条件下,使大分子难降解有机物氧化成低毒或无毒的小分子物质。该技术因其具有处理效果好,成本低,不产生二次污染,反应易控等特点,被广泛应用于很多领域[6]。而微波技术[7, 8]具有可加快反应速度,降低反应活化能等特点。因此,将微波技术与高级氧化技术结合,利用微波的高效、快速的特点及高级氧化技术的氧化性强、不产生污染物等优点,达到高效、稳定、绿色的处理污水中微生物的目的。
在过去的几年中,微波高级氧化技术[9~12]已被广泛应用于许多领域,如污水处理等。作为微波高级氧化法中最常用的氧化剂,过硫酸氢钾复合盐(Oxone,2KHSO5·KHSO4·K2SO4)[13, 14]和过硫酸盐(K2S2O8)[15, 16]由于其性质稳定、便于运输、无毒无副产物及成本低廉,已广泛应用于许多行业中,如引发乳液聚合反应,有机分子合成和焦化废水的处理等[17~21]。Oxone和过硫酸钾都能在外界条件(如微波辐射和过渡金属)的激发下产生硫酸根自由基[22~24],但Oxone和K2S2O8生成硫酸根自由基的机理及杀菌效果一直未被深入研究。本文取秦皇岛口岸黄骅港码头和京塘港码头的入境船舶内的压载水,考察Oxone和过硫酸钾在微波辐射下,对压载水中微生物的杀灭效果,并探讨硫酸根自由基的产生过程和杀菌机理。同时比较微波高级氧化技术与传统氯消毒方法对压载水处理效果及水质分析,验证微波高级氧化技术的优越性。
2 实验部分 2.1 实验装置与试剂实验压载水取自秦皇岛口岸黄骅港码头和京塘港码头的装载境外压载水的入境船舶内,过硫酸钾,Oxone,甲醇等试剂均为分析纯,购于天津大茂化学试剂厂;平板计数琼脂,月桂基硫酸盐胰蛋白胨肉汤购于天津科密欧试剂有限公司。溶液的配制均采用纯净水。
生化培养箱,单人单面超洁净工作台购于上海康路仪器设备有限公司;生物显微镜购于重庆光电仪器公司;全自动立式压力蒸汽灭菌器购于上海博迅实业有限公司医疗设备厂。
微波改造后的微波设备图如图 1所示。聚四氟乙烯反应器置于微波炉谐振腔内的支撑台上,避开金属导波管,在微波炉的顶部打一个孔,插入玻璃管,在接口处用密封胶封好,防止微波泄露。与微波谐振腔内反应器相连的为缓冲瓶和洗瓶。谐振腔的尺寸为340 mm×320 mm×220 mm,聚四氟乙烯容器底部直径为145 mm,高为195 mm。微波炉顶部转动的风扇会改变微波的传播方向,使反应器中的压载水被均匀地辐射到。
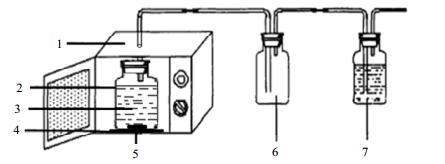
|
Fig.1 Schematic diagram of microwave setup 1. microwave radiation apparatus 2. PTFE container 3. ballast water 4. support platform 5. rotator 6. surge flask 7. gas-washing bottle |
微波能量密度:调节微波功率,使谐振腔中微波密度分别达到0、0.004、0.013、0.021、0.033、0.042 W·cm-3,辐射1 L的扩培海水,辐射时间30 s,平行取样3次,检测总菌群数,重复试验3次,计算平均杀灭率。
微波辐射时间:调节微波密度为0.042 W·cm-3,分别辐射1 L的扩培海水0~720 s,平行取样3次,检测总菌群数,重复试验3次,计算平均杀灭率。
2.2.2 氧化剂的种类及投加量对压载水中总菌群杀灭率的影响选择Oxone和K2S2O8,比较两种氧化剂在50 s时,不同的投加量及无有微波协同的条件下对总菌群的杀灭效果,实施方案如下:
1) 在1 L的水样中,加入过硫酸氢钾复合盐0、1、5、10、15、20、25、30 mg,反应50 s,平行取样3次,重复试验3次,检测总菌群数。
2) 在1 L的水样中,加入过硫酸氢钾复合盐0、1、5、10、15、20、25、30 mg,放入微波炉中,调节功率1000 W,反应50 s,平行取样3次,重复试验3次,检测总菌群数。
3) 在1 L的水样中,加入过硫酸钾0、1、5、10、15、20、25、30 mg,反应50 s,平行取样3次,重复试验3次,检测总菌群数。
4) 在1 L的水样中,加入过硫酸钾0、1、5、10、15、20、25、3 0 mg,放入微波炉中,调节功率1000 W,反应50 s,平行取样3次,重复试验3次,检测总菌群数。
(注:总菌群数的检测方法参考《GB4789.2-2010 GB 4789.2-2010食品微生物学检验菌落总数测定》中菌落总数测定方法。)
3 结果与讨论以压载水中总菌群为代表,考察并比较微波-过硫酸钾、微波-Oxone协同作用对细菌杀灭率的影响,并以微波功率、辐射时间、Oxone和过硫酸钾投加量及投加时间对细菌杀灭率的影响作对比,验证硫酸根自由基在杀菌方面的可行性。
3.1 微波参数对水中总菌群杀灭率的影响如图 2所示,随着微波密度的增加,存活的总菌群数逐渐减少,当微波密度升至0.042 W·cm-3时,总菌群数由2.82×107降至2.01×107 cfu·L-1,杀灭率为28.16%。这是因为微波可使压载水中水分子和无机盐离子极化并随着微波场方向的变化不断变化[25],通过分子、离子间摩擦生热,使水体中的局部温度瞬间达到高温,即利用微波的热效应将总菌群杀死。
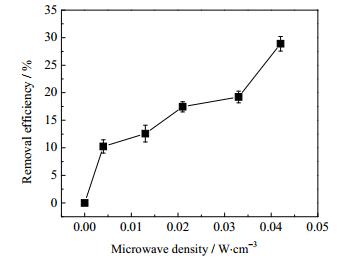
|
图 2 微波密度对压载水中总菌群的影响 Fig.2 Effects of microwave density on bacteria in ballast water |
如图 3所示,随着微波辐射时间的增加,存活的总菌群数数均逐渐减少,当微波辐射时间达到60 s时,压载水中的总菌群数由2.82×107降至1.97×107 cfu·L-1,杀灭率为30.25%,50 s后总菌群的杀灭率快速上升,同时压载水的温度也迅速升高,在540 s时,杀灭率达到100%,且无菌体复活。这是根据微波热效应的原理[26]杀灭微生物,辐射时间越长,水分子摩擦运动产生的热量就越大,死亡的总菌群越多。但该方法杀菌时间过长,温度过高(达到78.5℃),不适用于实际压载水处理。因此,从快速、节能两方面考虑,应加入氧化剂协助微波杀灭总菌群,并在以下实验中,选择50 s为微波最佳辐射时间。
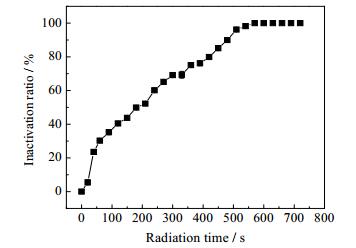
|
图 3 微波辐射时间对压载水中总菌群的影响 Fig.3 Effects of radiation time on bacteria in ballast water |
Oxone和过硫酸钾都是强氧化剂,在杀菌方面有很好的效果。考察Oxone和过硫酸钾对压载水的杀菌情况以及Oxone和过硫酸钾分别与微波协同作用下对压载水的杀菌情况,并对两种氧化剂的杀菌效果进行比较。
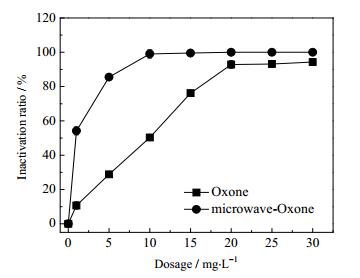
如图 4和图 5所示,有微波辐射的情况下,过硫酸钾的杀灭率提高了6.3%,Oxone的杀灭率提高了52.77%,且Oxone在投加量为15 mg·L-1的条件下,杀灭率达到了100%。这是因为过硫酸钾的氧化还原电位为2.01 V[27],比Oxone(1.85 V)的氧化还原电位高,因此,过硫酸钾利用自身的氧化性可杀灭一部分总菌群,但随着投加量增加,Oxone的杀灭率逐渐增大,当投加量超过15 mg·L-1,Oxone的杀菌效果比过硫酸钾的杀菌效果好。但过硫酸盐在微波的激发下会生成SO4·-,SO4·-具有强氧化性,氧化还原电位2.7 V,所以在有微波的存在的情况下,杀菌率会增加。
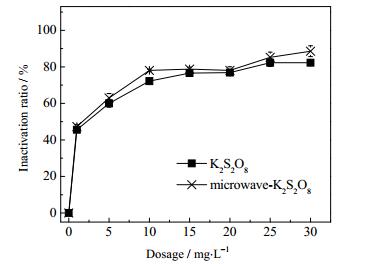
|
图 4 K2S2O8和微波-K2S2O8对压载水的杀菌率 Fig.4 Sterilization ratios of K2S2O8 and microwave-K2S2O8 in ballast water treatments |
|
图 5 Oxone和微波-Oxone对压载水的杀菌率 Fig.5 Sterilization ratios of Oxone and microwave-Oxone in ballast water treatments |
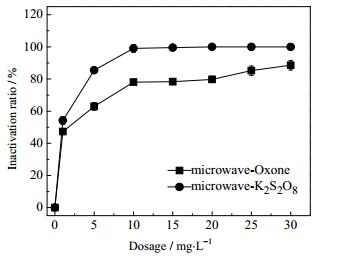
在微波作用下,Oxone和过硫酸钾对压载水杀菌率如图 6所示。Oxone的杀灭率比过硫酸钾的高,且Oxone在投加量为15 mg·L-1的条件下,杀灭率达到了100%。这是因为过硫酸钾需要130.93 kJ·mol-1左右[28]的活化能才能使得自身的双氧健断裂产生SO4·-;而Oxone是由一个SO3和K2S2O8取代HOOH得到的不对称过氧化物,固态的情况下很稳定,但在水溶液中仅需要很低的能量就能使O4S-OH键断链并生成SO4·-。当微波密度为0.042 W·cm-3且辐射60 s时无法提供较高的活化能,因此不能促使大量的K2S2O8生成SO4·-。所以微波-Oxone的杀灭率比微波-K2S2O8的高。
|
图 6 比较微波-Oxone和微波-K2S2O8的杀灭率 Fig.6 Sterilization ratio comparison of microwave-Oxone and microwave-K2S2O8 |
考察微波/Oxone是否对压载水的水质造成二次污染,因此对原水样及处理后的压载水样进行检测,结果如表 1所示。
| 表 1 微波-Oxone处理压载水前后的物理参数 Table 1 Parameters of untreated and microwave-Oxone treated ballast water |
如表 1所示,经过微波/Oxone处理后的水样与原水样基本没有差别。这是因为投入的Oxone较少,所以对盐度和电导率的影响不大。DO的浓度在处理后增加,原水样的DO含量为7.8 mg·L-1,处理后达到8.6 mg·L-1。这是因为微波能使Oxone分解产生[O],增加水中DO浓度,使水中的溶解氧处于过饱和状态。TSS、COD、TOC含量在处理后,分别由原水样的58.6、1.56和2.39 mg·L-1下降到40.4、1.48和2.28 mg·L-1。这是由于Oxone在微波辅助作用下,产生了自由基,能够快速杀灭细菌和其它一些藻类,从而使得原水样中的悬浮颗粒物减少,使TSS有了改善;硫酸自由基虽然能氧化细胞膜,使细胞膜破裂细胞质外泄至水样中,对细胞残骸氧化分解,一定程度上增加了水样中的有机物含量,但同时硫酸根自由基还可与水中的有机物进行反应,对有机物进行降解,所以最终导致检测出的TOC少于原水样的TOC,化学需氧量降低。同时,硫酸根自由基的半衰期非常短[29],为30~40 μs,且如果硫酸根自由基生成量过大,就会与其它没有反应的硫酸根自由基发生猝灭反应,生成过硫酸根,反应方程式为:2 SO4·-→S2O82-。因此不会存在生成硫化氢等污染物的现象。综上,微波/Oxone处理压载水工艺可以有效的杀灭水中的微生物,且不会对水质有很大影响。
3.4 硫酸根自由基杀菌效果的研究甲醇是一种典型的SO4·-淬灭剂,在水溶液中可快速地与SO4·-发生反应,从而对有机物的氧化反应构成竞争,并且反应后不产生自由基,相当于终止了过硫酸盐的活化反应,因此通过考察甲醇对反应的影响可间接的判断反应是否产生了硫酸根自由基,若压载水中的微生物确实是被SO4·-所氧化杀灭,那么在反应溶液中加入甲醇,对压载水中微生物的杀灭效率就会明显地受到甲醇的影响。
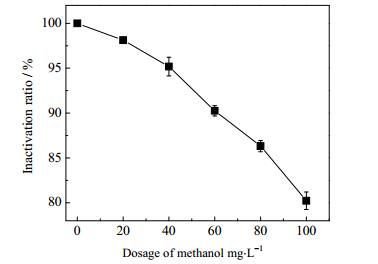
当微波密度为0.042 W·cm-3,Oxone投加量15 mg·L-1,辐射时间50 s,甲醇投加量增加至100 mL时,微波-Oxone对压载水杀灭率如图 7所示。随着甲醇投加量的增加,杀灭率也随之下降,且加入的甲醇越多,这种抑制作用就越强烈,当甲醇投加量增加到100 mL时,杀灭率从100%下降至80.23%,这是因为甲醇捕获了生成的SO4·-,阻碍了SO4·-杀菌,由此可推断出压载水中微生物的死亡的确是SO4·-对其氧化杀灭的结果。
|
图 7 甲醇对微波-Oxone杀灭率的影响 Fig.7 Effects of methanol on microwave-Oxone sterilization ratios |
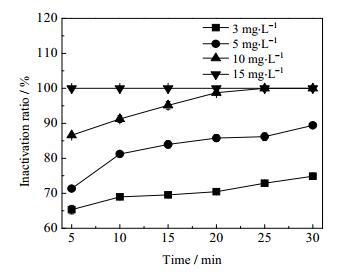
将微波高级氧化技术与我国最常用压载水处理技术——氯消毒的方法进行比较,验证微波高级氧化工艺是否比最常用的氯消毒法更加安全、高效且环保。因此,向人工压载水中投加不同剂量的NaClO溶液,反应5、10、15、20、25、30 min后加入一定量亚硫酸钠溶液去除余氯,加氯对压载水中细菌的杀灭效果如图 8所示。
|
图 8 NaClO的杀灭率随浓度和时间的变化情况 Fig.8 Sterilization ratios of NaClO as functions of concentration and time |
由图 8可以看出,加氯量越大杀菌效果越显著;而同一浓度下,随着接触时间的增加,杀菌率逐渐上升,当水样加氯量为10 mg·L-1,接触25 min时,细菌的灭活率可达到100%。对比微波-Oxone法,当Oxone的投加量为15 mg·L-1,50 s内即可杀灭所有微生物。和氯消毒法比较,微波-Oxone法虽然投药量大,但用时仅为氯消毒工艺的1/36,达到了高效的要求。
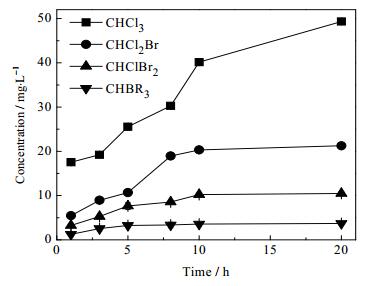
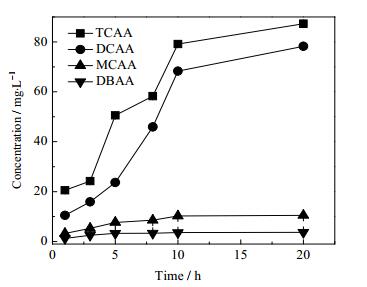
氯消毒中最常见的消毒副产物是THMs与HAAs,这两类化合物有较高的致癌风险。因此当NaClO投加量10 mg·L-1,处理30 min后压载水中消毒副产物THMs和HAAs的情况如图 9和图 10所示。
|
图 9 不同氯投加量下THMs生成势随反应时间的变化 Fig.9 THMs formation potential profiles as a function of reaction time under different chlorine dosages |
|
图 10 不同氯投加量下HAAs生成势随反应时间的变化 Fig.10 HAAs formation potential profiles as a function of reaction time under different chlorine dosages |
在氯投加后,随着时间增长,THMs和HAAs的生成量随着反应时间的增加而增加。其中三卤甲烷以三氯甲烷及一溴二氯甲烷为主要产物,卤乙酸中则以三氯乙酸和二氯乙酸为主。由于压载水中含有浓度较高的溶解性有机物,其中能与次氯酸钠反应的物质种类多样,但结构和活性存在差异,活性高的前驱物将优先发生反应,活性相对较弱的前驱物的反应程度则取决于可获得的消毒剂的量,所以随着投氯量的增加,这些前驱物的副产物生成潜能逐步表现出来,导致三卤甲烷和卤乙酸的生成量急剧上升。而本项目所采用的微波高级氧化工艺,没有任何消毒副产物的生成,而且硫酸根自由基半衰期短[29],因此,不存在二次污染及持续污染的情况。
上述研究表明,本项目所提出的微波/Oxone高级氧化技术处理压载水工艺不但能快速杀灭压载水中微生物,而且不会产生消毒副产物等有害物质,该工艺完全符合IMO提出的安全、经济、适用、高效、环境允许五大要求,并且还能在短时间内达到《船舶压载水及沉积物控制和管理国际公约》其附则第D-2条的规定。
4 结论a) 微波协同Oxone处理压载水中的微生物是一种行之有效的方法,该方法具有设备简单,操作方便,处理时间短,反应彻底无二次污染物产生等优点,为压载水中微生物的处理提供了一种新型物理化学水处理技术。
b) 微波功率越大,辐射时间越长,对压载水中总菌群的杀灭效果越好,当微波功率由0 W升至1000 W时,杀灭率由0升至28.16%,当微波辐射时间由0 s升至50 s时,杀灭率升至34.25%,随着时间增加,杀灭率逐渐增大,且在540 s时杀灭率达到100%;没有微波辐射条件下,随着投加量的增加,K2S2O8和Oxone对总菌群的杀灭率逐渐增加,二者分别从45.53%和10.69%升至82.28%和94.29%;有微波辐射的情况下,K2S2O8杀灭率仅提高6.3%,而Oxone杀灭率提高迅速,提高了52.77%,且Oxone在投加量为15 mg·L-1的条件下,杀灭率即达到了100%。
c) 与传统氯消毒工艺比较可知,本项目所提出的微波/Oxone高级氧化工艺在消毒时间和处理后水样中是否产生消毒副产物两方面较氯消毒工艺有优势,不但达到了《国际船舶压舱水及其沉积物管理和控制公约》的标准,而且符合安全、经济、适用、高效、环境允许五项要求。
| [1] | O'Shea K E, Dionysiou D D. Advanced oxidation processes for water treatment[J]. Journal of Physical Chemistry Letters , 2012, 3(15): 2112-2113. DOI:10.1021/jz300929x. |
| [2] | JING Jiang(景江), ZHOU Ming(周明), WANG Xing(汪星), et al. Engineering experiment and investigation of effect on degradation of cyanobacteria by the combination of UV-C and H2O2(H2O2与UV-C灭藻的协同效果研究及工程实验)[J]. Research of Environmental Sciences(环境科学研究) , 2006, 19(6): 59-63. |
| [3] | CHEN Zhen(陈震), CHEN Xiao(陈晓), ZHENG Xi(郑曦), et al. Influence of pH and current concentration on electrochemical-generated hydroxylradical for degradation and decolorization of dye wastewater(溶液pH及电流浓度对电化学法生成羟基自由基降解机制的影响)[J]. Research of Environmental Sciences(环境科学研究) , 2002, 15(3): 42-52. |
| [4] | CHEN Ri-yao(陈日耀), ZHENG Xi(郑曦), QU Yue-wen(曲跃文), et al. Studies of electro-generated hydroxyl radical and its using in degradation and decolorization of dyes(电生成羟基自由基及其对染料降解脱色的研究)[J]. Research of Environmental Sciences(环境科学研究) , 2002, 15(1): 16-19. |
| [5] | YANG Hai(阳海), LI Yuan(黎源), XU Miao(徐淼), et al. Chemical oxidation degradation of acetamiprid by radical ions in Fe2+/S2O82-/EDTA aqueous solution(Fe2+/S2O82-/EDTA体系中自由基离子对啶虫脒的氧化降解)[J]. Research of Environmental Sciences(环境科学研究) , 2014, 27(3): 321-327. |
| [6] | Deng Y, Zhao R. Advanced oxidation processes (AOPs) in wastewater treatment[J]. Current Pollution Reports , 2015, 10(3): 33-40. |
| [7] | Safari J, Naseh S, Zarnegar Z, et al. Applications of microwave technology to rapid synthesis of substituted imidazoles on silica-supported SbCl3 as an efficient heterogeneous catalyst[J]. Journal of Taibah University for Science , 2014, 8(4): 323-330. DOI:10.1016/j.jtusci.2014.01.007. |
| [8] | Manco I, Giordani L, Vaccari V, et al. Microwave technology for the biodiesel production:Analytical assessments[J]. Fuel , 2012, 95(1): 108-112. |
| [9] | Lo K V, Chan W W I, Yawson S K, et al. Microwave enhanced advanced oxidation process for treating dairy manure at low pH[J]. Journal of Environmental Science and Health, Part B , 2012, 47(4): 362-367. DOI:10.1080/03601234.2012.646175. |
| [10] | QIN Wei-wei(秦伟伟), XIAO Shu-hu(肖书虎), SING Yong-hui(宋永会), et al. Treatment of berberine pharmaceutical wastewater by O3/UV synergetic oxidation(O3/UV协同氧化处理黄连素制药废水)[J]. Research of Environmental Sciences(环境科学研究) , 2010, 23(7): 877-881. |
| [11] | Xiao J, Fang X, Yang S, et al. Microwave-assisted heterogeneous catalytic oxidation of high-concentration Reactive yellow 3 with CuFe2O4/PAC[J]. Journal of Chemical Technology & Biotechnology , 2015, 90(10): 1861-1868. |
| [12] | Barros F C F, Barros A L, Silva M A A, et al. Use of Microwave-assisted oxidation for removal of the pesticide chlorpyrifos from aqueous media[J]. International Journal of Civil & Environmental Engineering , 2013, 13(6): 16-27. |
| [13] | Chun-Wai T, Toby Wai-Shan C, Zhen G, et al. Nonheme iron mediated oxidation of light alkanes with oxone:characterization of reactive oxoiron(Ⅳ) ligand cation radical intermediates by spectroscopic studies and DFT calculations[J]. Angewandte Chemie International Edition , 2014, 53(3): 798-803. DOI:10.1002/anie.201305153. |
| [14] | Victoria S N, Jebaraj J, Suni I I, et al. Chemical mechanical planarization of ruthenium with Oxone as oxidizer[J]. Electrochemical and Solid-State Letters , 2012, 15(15): 55-58. |
| [15] | Chen W S, Jhou Y C, Huang C P. Mineralization of dinitrotoluenes in industrial wastewater by electro-activated persulfate oxidation[J]. Chemical Engineering Journal , 2014, 252(5): 166-172. |
| [16] | Kordkandi S A, Forouzesh M. Application of full factorial design for methylene blue dye removal using heat-activated persulfate oxidation[J]. Journal of the Taiwan Institute of Chemical Engineers , 2014, 45(5): 2597-2604. DOI:10.1016/j.jtice.2014.06.015. |
| [17] | Shih Y J, Li Y C, Huang Y H. Application of UV/persulfate oxidation process for mineralization of 2, 2, 3, 3-tetrafluoro-1-propanol[J]. Journal of the Taiwan Institute of Chemical Engineers , 2013, 44(2): 287-290. DOI:10.1016/j.jtice.2012.10.005. |
| [18] | Eor S, Hwang J, Choi M G, et al. Fluorescent signaling of oxone by desulfurization of thioamide[J]. Organic letters , 2010, 13(3): 370-373. |
| [19] | Tang X, Hashmi M Z, Zeng B, et al. Application of iron-activated persulfate oxidation for the degradation of PCBs in soil[J]. Chemical Engineering Journal , 2015, 279(5): 673-680. |
| [20] | Poláková M, L'uboš J, Kucková L, et al. Application of Oxone immobilized on montmorillonite for an efficient oxidation of mannose thioglycoside[J]. Monatshefte Fuer Chemie/chemical Monthly , 2013, 144(7): 969-973. DOI:10.1007/s00706-013-0964-0. |
| [21] | Desai L V, Malik H A, Sanford M S. Oxone as an inexpensive, safe, and environmentally benign oxidant for C-H bond oxygenation[J]. Organic Letters , 2006, 37(30): 1141-1144. |
| [22] | Mineno T, Yoshino S, Ubukata A. Oxone-mediated oxidative esterification of heterocyclic aldehydes using indium(Ⅲ) triflate[J]. Green & Sustainable Chemistry , 2014, 04(1): 20-23. |
| [23] | Chou Y C, Lo S L, Kuo J, et al. Microwave-enhanced persulfate oxidation to treat mature landfill leachate[J]. Journal of Hazardous Materials , 2015, 284(284): 83-91. |
| [24] | Asgari G, Seidmohammadi A M, Chavoshani A. Pentachlorophenol removal from aqueous solutions by microwave/persulfate and microwave/H2O2:a comparative kinetic study[J]. Journal of Environmental Health Science & Engineering , 2014, 12(12): 1-7. |
| [25] | Arancon R A D, Romero A A, Luque R. Microwaves in catalysis:methodology and applications[M].Hoboken: John Wiley & Sons, Inc., 2015: 171-192. |
| [26] | Benavente R, Salvador M D, Peñaranda-Foix F L, et al. High thermal stability of microwave sintered low-κr β-eucryptite materials[J]. Ceramics International , 2015, 41(10): 13817-13822. DOI:10.1016/j.ceramint.2015.08.066. |
| [27] | Anipsitakis G P, Dionysiou D D. Transition metal/UV-based advanced oxidation technologies for water decontamination[J]. Applied Catalysis B:Environmental , 2004, 54(3): 155-163. DOI:10.1016/j.apcatb.2004.05.025. |
| [28] | Gao Y Q, Gao N Y, Deng Y, et al. Heat-activated persulfate oxidation of sulfamethoxazole in water[J]. Desalination & Water Treatment , 2015, 56(8): 2225-2233. |
| [29] | An T, Yang H, Li G, et al. Kinetics and mechanism of advanced oxidation processes (AOPs) in degradation of ciprofloxacin in water[J]. Applied Catalysis B:Environmental , 2010, 94(3): 288-294. |




