生物柴油是一种清洁的可再生能源[1],在生物柴油生产过程中产生约占其质量十分之一的副产物甘油[2]。随着生物柴油产业的发展,甘油产量显著增加,甘油的高值化利用已成为研究热点,甘油醚化制备聚甘油是甘油高值化利用的途径之一[3-6]。二甘油是聚甘油系列中最重要品种,广泛应用于化妆品[7-8]、食品[9]以及塑料工业[10]。二甘油由两个甘油脱水缩合生成,分子中存在的羟基使二甘油深度缩合生成三聚、四聚等聚合度更高的聚甘油。不同聚合度的聚甘油极性和水溶性相近、沸点高,从聚甘油混合物中提取二甘油难度大、成本高。为了生产高纯度的二甘油产品,同时提高收率、降低成本,必须从反应步骤控制二甘油的深度聚合、提高甘油聚合生产二甘油的选择性。二甘油选择性的提高主要依赖于催化剂的性质[11]。目前甘油醚化生成二甘油的催化剂主要有酸催化剂和碱催化剂。酸催化反应速率快,但选择性极低,主要生成高聚合度的聚甘油,另外反应过程中还产生大量有毒、有害的丙烯醛气体,产物颜色也较深。碱催化[12-15]选择性高,生成聚甘油的聚合度较低,并且无丙烯醛生成,是甘油醚化常用的催化剂,但是碱催化反应速率慢,甘油转化率低,反应温度高。本文选择K2CO3为碱催化剂,活性Al2O3为Lewis酸催化剂,通过酸碱协同催化甘油醚化生产二甘油。首先以K2CO3为催化剂,通过单因素实验考察反应温度、反应时间、催化剂用量对二甘油制备的影响,并通过正交实验优化反应条件。然后加入Al2O3,考察酸碱协同催化效果,与仅以K2CO3为催化剂时进行比较。最后通过两种情况下的反应动力学,进一步探究协同催化的效果。
2 实验部分 2.1 实验材料与仪器实验材料主要有生物柴油副产物粗甘油(宁波杰森生物柴油有限公司),KAl(SO4)2·12H2O (化学纯试剂(CP),湖州湖试化学试剂有限公司),H3PO4 (分析纯试剂(AR),浙江新安化工集团股份有限公司),CH3OH、K2CO3、Al2O3、HCl、NaOH (AR,上海泰坦科技股份有限公司),二甘油(AR,梯希爱化成工业发展有限公司),HCOOH (AR,上海凌峰化学试剂有限公司),C2H3N (色谱纯试剂(HPLC),上海阿达玛斯试剂有限公司),超纯水(自制)。
实验仪器主要有pH计(Delta320,上海精密科学仪器有限公司),旋转蒸发仪(R201,上海大普仪器有限公司),岛津液相色谱仪(LC-20AT,日本岛津公司),电子分析天平(赛多利斯科学仪器有限公司),智能恒温电加热套(巩义市予华仪器有限责任公司),集热式恒温加热磁力搅拌器(DF-101S,杭州博研仪器设备有限公司),马弗炉(L5/11/P330,上海微行炉业有限公司),电热恒温鼓风干燥箱(DHG-9075A,上海索域试验设备有限公司)。
2.2 实验方法 2.2.1 甘油提纯以生物柴油副产物粗甘油为原料,经酸化破乳、絮凝沉淀提纯得到精制甘油,具体过程如下:
称取50 g粗甘油(精确到0.1 g)于500 mL烧杯中,加入50 mL的CH3OH溶解,边搅拌边缓慢滴加H3PO4,调节其pH值至4.5,此时有沉淀析出,减压抽滤,滤去残渣。将滤液转移至250 mL分液漏斗中,静置分层取下层溶液,减压旋转蒸发后得到富含甘油(甘油含量为85.3%)的黏稠状澄清液体。
称取50 g (精确到0.1 g)经上述处理后的粗甘油于500 mL烧杯中,加入2%的KAl(SO4)2·12H2O水溶液,搅拌至生成絮状物,然后边搅拌边缓慢滴加H3PO4,调节pH值至4.5,过滤脱除胶质。将滤液转移到250 mL的分液漏斗中,静置分层取下层溶液,减压旋转蒸发后得到富含甘油和絮凝剂的液体,加入一定量的CH3OH稀释使过量的絮凝剂沉淀,过滤脱除絮凝剂,滤液减压旋转蒸发得到富含甘油(甘油含量为90.5%)的液体。
2.2.2 二甘油的催化合成① 碱催化
称取100 g精制甘油,四口烧瓶中加适量K2CO3后置于加热套中,设定温度,0.1 L·min-1N2通入四口烧瓶,开搅拌反应,结束后N2保护下冷却至室温。分别称取反应后物料质量和集水瓶中水的质量,液相色谱分析物料中甘油和二甘油的含量。
② 酸碱协同催化
取活性Al2O3 (100~200目),150 ℃烘箱中干燥5 h,在干燥器中冷却至室温后备用。取一定量的活性Al2O3分别放入1.0×10-4 L·min-1的HCl和NaOH的水溶液中,于80 ℃的水浴下搅拌6 h,浸渍过夜,过滤,固体先在150 ℃的烘箱中干燥24 h,然后在500 ℃的马弗炉内焙烧4 h,冷却至室温,分别得到酸性Al2O3和碱性Al2O3。
酸碱协同催化的反应过程:在①碱催化的基础上,分别加入中性Al2O3、酸性Al2O3和碱性Al2O3。
2.2.3 聚甘油产品的高效液相色谱分析(HPLC)称取30~40 mg聚甘油,用8 mL超纯水溶解,滴加HCOOH中和溶液(高温下K2CO3溶于甘油形成稳定的均相溶液),用0.22 μm有机相微孔膜过滤后进行HPLC分析。分析条件如下:华谱XAmide色谱柱(4.6 mm × 250 mm,5 μm),流动相:乙腈:水= 85:15,流量:1 mL·min-1,进样量:20 μL,柱温30 ℃,示差折光检测器灵敏度为4,分析时间25 min。
通过外标法确定甘油和二甘油的含量,根据式(1)、(2)、(3)计算甘油的转化率和二甘油的收率及选择性。
| ${X_{\rm{G}}} = \frac{{{n_{{\rm{GC}}}}}}{{{n_{{\rm{GT}}}}}} \times 100\% $ | (1) |
| $Y = \frac{{{n_{{\rm{DA}}}}}}{{{n_{{\rm{DT}}}}}} \times 100\% $ | (2) |
| $S = \frac{{2{n_{{\rm{DA}}}}}}{{{n_{{\rm{GC}}}}}} \times 100\% $ | (3) |
反应温度分别为210、220、230、240 ℃,K2CO3用量1.8 g,反应时间为3 h,考察甘油转化率、二甘油收率及选择性随反应温度的变化(见表 1)。从表 1可知,随着反应温度的上升,甘油转化率和二甘油收率逐渐增加,二甘油的选择性逐渐减小。在反应温度为230 ℃时,二甘油的选择性降至87.66%。从甘油醚化的反应机理可知,在甘油转化为二甘油的过程中,生成的二甘油会继续反应生成三甘油或四甘油,同时温度的提高会造成丙烯醛和有色物质的生成[10]。
|
|
表 1 反应温度对甘油醚化制备二甘油的影响 Table 1 Effects of reaction temperature on the preparation of diglycerol by glycerol etherification |
K2CO3用量分别为0.9、1.8、2.7 g,反应温度为230 ℃,反应时间为3 h,考察甘油转化率、二甘油收率及选择性随K2CO3用量的变化(见表 2)。从表 2可知,随着K2CO3用量的增加,甘油转化率和二甘油收率逐渐增加,二甘油的选择性逐渐减小。在K2CO3用量为2.7 g时,二甘油的选择性降至75.58%。这是因为当K2CO3用量增加时,催化甘油或二甘油形成氧负离子的能力增加,从而使甘油转化率和二甘油收率增加,同时,多聚甘油含量也增加,二甘油选择性降低。
|
|
表 2 催化剂用量对甘油醚化制备二甘油的影响 Table 2 Effects of catalyst dosage on the preparation of diglycerol by glycerol etherification |
反应时间分别为1、2、3、4和5 h,反应温度为230 ℃,K2CO3用量为1.8 g,考察甘油转化率、二甘油收率及选择性随反应时间的变化(见图 1)。从图 1可知,随着反应时间的增加,甘油转化率和二甘油收率逐渐增加,二甘油的选择性逐渐减小。在反应5 h后,二甘油的选择性降至74%。随着反应时间的延长,二甘油收率的增长速率小于甘油转化率的增长速率。这主要是由于体系中二甘油含量增大,二甘油分子与甘油分子碰撞进一步反应为多聚甘油的几率上升造成的。
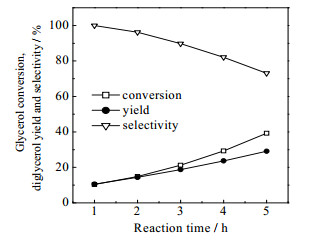
|
图 1 反应时间对甘油醚化制备二甘油的影响 Fig.1 Effects of reaction time on the preparation of diglycerol by glycerol etherification |
从单因素实验可以看出,增加催化剂用量、提高反应温度、延长反应时间均有助于甘油转化率的提高,但二甘油的选择性会急剧下降。为了进一步优化反应温度、反应时间和催化剂用量,在上述实验结果的基础上用Minitab设计3因素4水平正交实验,实验结果见表 3。从表 3可以看出,二甘油选择性与甘油的转化率及二甘油的收率不能同时兼顾,而这3项又是影响二甘油产品的重要指标,因此以这3项为监测指标进行多目标优化。根据极差R,得出影响二甘油制备的各因素主次顺序为:反应温度 > 催化剂用量 > 反应时间。根据各因素均值K,选出最优实验条件为:反应温度230 ℃,反应时间3 h,催化剂用量2.7 g。在该优化条件下,甘油转化率为30.41%,二甘油收率为22.99%,二甘油选择性为75.58%。从实验结果可以看出,单一的K2CO3催化并不能得到满意的结果,必须寻求其它催化方法,在兼顾选择性的同时,提高甘油转化率和二甘油收率。
|
|
表 3 正交实验的设计与结果 Table 3 Design and results of orthogonal experiments |
碱催化时,甘油的羟基容易脱去1个氢质子形成氧负离子,该氧负离子进攻另1个甘油分子上的碳原子,2分子的甘油脱去1分子水,醚化生成二甘油。催化剂中Lewis酸性位点的存在,有利于甘油分子上羟基的消除,加快甘油脱水醚化反应[11](如图 2所示)。RUPPERT[12]合成了CaO基的催化剂用于催化甘油醚化,他认为催化活性受催化剂表面碱度和Lewis酸性位点协同控制。活性Al2O3表面不仅存在强、弱2种碱中心,而且存在强、弱2种L酸吸附位[16],活性Al2O3已被用于催化CH3OH醚化脱水生成二甲醚[17]。CH3OH在活性Al2O3弱L酸中心的分子吸附态和强L酸中心的解离吸附态的相互作用下醚化脱水生成二甲醚[16]。基于甘油脱水醚化合成二甘油与CH3OH脱水醚化合成二甲醚具有相同的反应实质,将活性Al2O3用于催化甘油聚合反应,同时考虑到甘油分子比甲醇大,相邻碳原子上的羟基会互相影响,甘油醚化反应的难度大于甲醇醚化反应,因此将活性Al2O3与K2CO3联合使用,探究两者的协同催化能力,考察活性Al2O3的酸碱类型对甘油聚合的影响。
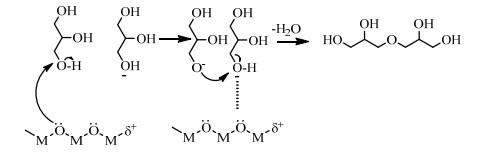
|
图 2 酸碱协同催化甘油聚合机理示意图 Fig.2 Mechanism of acid-base synergistic catalysis for glycerol polymerization |
在100 g甘油中,加入1.8 g的K2CO3,再分别加入0.2 g酸性、中性和碱性Al2O3,考察酸碱协同催化对甘油聚合的影响,结果见图 3。

|
图 3 氧化铝种类对酸碱协同催化效果的影响 Fig.3 Effects of alumina species on acid-base synergistic catalysis |
从图 3可知,加入活性Al2O3后,甘油的转化率、二甘油的收率及选择性均有不同程度的上升(除酸性Al2O3的甘油转化率外)。特别是加入0.2 g中性Al2O3后,甘油的转化率和二甘油的收率均提高了5%左右。单用K2CO3时,反应3 h,二甘油的选择性降至78.7%;加入活性Al2O3后,在反应前3 h内,二甘油的选择性维持在88%以上。尤其是加入0.2 g酸性Al2O3后,反应5 h,二甘油的选择性仍有84%。活性Al2O3经HCl和NaOH水溶液处理后,不仅其pH发生了改变,而且表面的酸碱中心的强度和类型也发生了变化,见图 4。碱性Al2O3表面上原有的强、弱2种L酸中心与NaOH分别发生分子态和解离态吸附,从而降低了L酸中心的强度。碱性Al2O3的加入提高了催化剂体系的总碱度,甘油的转化率比单用K2CO3高,但比加入中性Al2O3低,说明中性Al2O3内部的酸性位点有利于甘油的聚合。酸性Al2O3表面的酸强度增强,但原有的L酸中心转变成了B酸中心。催化体系中加入酸性Al2O3,甘油的转化率反而略有下降,说明在酸碱协同催化甘油聚合过程中,起作用的是L酸而不是B酸。
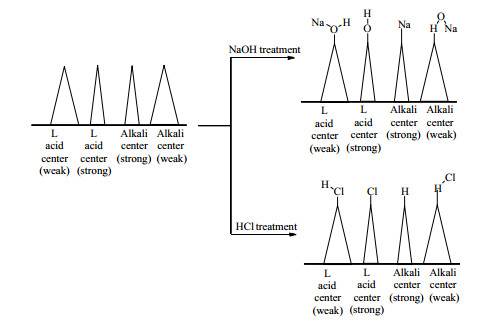
|
图 4 活性氧化铝经酸碱处理后表面化学性质的变化 Fig.4 Variation of surface chemical properties of activated alumina after acid-base treatment |
在多目标优化后的工艺条件下,分别加入0.3和1.2 g中性Al2O3,进一步考察酸碱协同催化效果,实验结果见表 4。
|
|
表 4 单一碱催化和酸碱协同催化比较 Table 4 Comparison of results of single base catalysis and acid-base synergistic catalysis |
表 4显示,在催化体系中加入中性Al2O3,在兼顾二甘油选择性情况下,甘油的转化率和二甘油的收率都有所提高,即通过酸碱协同催化,可以得到比单一碱催化最优条件下更好的反应结果。
3.3 甘油聚合反应动力学为进一步探究酸碱协同催化的机理及对甘油聚合的影响程度,论文测定了单一K2CO3催化和K2CO3+中性Al2O3协同催化时的反应动力学,通过MATLAB拟合得到两种情况下的反应级数和反应活化能。
式(4)为甘油醚化制备二甘油的反应方程式,式(5)、(6)为二甘油聚合生成其它聚合甘油的反应方程式。
| $ 2\text{G}\xrightarrow{{{k}_{1}}}\text{D}+{{\text{H}}_{\text{2}}}\text{O} $ | (4) |
| $\text{G+D}\xrightarrow{{{k}_{2}}}\text{T}+{{\text{H}}_{\text{2}}}\text{O}$ | (5) |
| $\underset{\text{G:}\ \text{glycerol;}\ \text{D: diglycerol;}\ \text{T: triglycerol;}\ \text{Tetra:}\ \text{tetraglycerol}}{\mathop{2\text{D}\xrightarrow{{}}\text{Tetra}+{{\text{H}}_{\text{2}}}\text{O}}}\, $ | (6) |
在上述优化的条件下,分析产物主要为甘油、二甘油以及三甘油。假设实验过程发生的副反应主要由式(5)表示,主要研究甘油聚合生成二甘油和三甘油的反应动力学。
在该反应中,甘油转化速率和二甘油的生成速率分别用式(7)、(8)表示。
| $\frac{{\operatorname{d} \left[ \operatorname{G} \right]}}{{\operatorname{d} t}} = - {k_1}\left[ \operatorname{G} \right]$ | (7) |
| $ \frac{\operatorname{d}\left[ D \right]}{\operatorname{d}t}={{k}_{1}}{{\left[ \operatorname{G} \right]}^{n}}-{{k}_{2}}{{\left[ \text{G} \right]}^{a}}{{\left[ \operatorname{D} \right]}^{b}} $ | (8) |
测定不同温度下反应过程中甘油和二甘油浓度与反应时间的关系,用MATLAB拟合得到反应速率常数k1、k2和反应级数n、a、b (见表 5)。根据Arrhenius方程,计算K2CO3催化甘油聚合生成二甘油的活化能为137.71 kJ·mol-1,生成三甘油的活化能为128.56 kJ·mol-1;K2CO3+中性Al2O3催化甘油聚合生成二甘油的活化能为123.35 kJ·mol-1l,生成三甘油的活化能为121.16 kJ·mol-1。相比于单一碱催化,酸碱协同催化降低了主反应与副反应的活化能,但主反应的活化能降低幅度更大。K2CO3+中性Al2O3协同催化为非均相反应,表观反应速率既与本征反应速率有关又受扩散影响,实验测得的反应速率常数为表观速率常数,计算得到的活化能为表观活化能。考虑到传质的影响,酸碱协同催化的本征反应活化能应该比测定值更低。
|
|
表 5 MATLAB拟合不同温度下的反应速率常数以及反应级数 Table 5 Reaction rate constants and reaction orders at different temperatures calculated by MATLAB simulation |
从反应级数看,活性Al2O3的加入,使甘油聚合生成二甘油的反应级数从0.49增加到了1.21,说明酸碱协同催化过程中,反应速率对反应物浓度变化的敏感性增大。
4 结论(1) 以K2CO3为催化剂,研究了反应温度、催化剂用量和反应时间对甘油聚合生成二甘油的影响,增加反应时间,提高反应温度,加大催化剂用量都使甘油的转化率增加,二甘油的收率增大,但是二甘油的选择性降低。通过正交实验,以甘油转化率、二甘油收率及选择性为监测指标进行多目标优化,得出最优实验条件为:反应温度230 ℃,反应时间3 h,催化剂用量2.7 g。在该优化条件下,甘油转化率为30.41%,二甘油收率为22.99%,二甘油选择性为75.58%。
(2) 在K2CO3中加入酸碱性不同的活性Al2O3,探究酸碱协同催化机理。在兼顾二甘油选择性情况下,酸碱协同催化能有效地提高甘油转化率和二甘油收率,并且起协同催化作用的是L酸。
(3) 借助MATLAB拟合并结合Arrhenius方程,得到K2CO3催化甘油醚化生成二甘油的活化能为137.71 kJ·mol-1,生成三甘油的活化能为128.56 kJ·mol-1,K2CO3+中性Al2O3催化甘油醚化生成二甘油的活化能为123.35 kJ·mol-1,生成三甘油的活化能为121.16 kJ·mol-1。
符号说明:
|
|
| [1] |
李丹, 周明辉, 刘莹峰, 等. 气相色谱法测定粗甘油中的游离甘油含量[J]. 分析测试学报, 2011, 30(9): 1055-1058. LI D, ZHOU M H, LIU Y F, et al. Determination of free glycerol in crude glycerine by gas chromatography[J]. Journal of Instrumental Analysis, 2011, 30(9): 1055-1058. DOI:10.3969/j.issn.1004-4957.2011.09.019 |
| [2] |
KONGJAO S, DAMRONGLERD S, HUNSOM M. Purification of crude glycerol derived from waste used-oil methyl ester plant[J]. Korean Journal of Chemical Engineering, 2010, 27(3): 944-949. DOI:10.1007/s11814-010-0148-0 |
| [3] |
BARRAULT J, CLACENS J M, POUILLOUX Y. Selective oligomerization of glycerol over mesoporous catalysts[J]. Topics in Catalysis, 2004, 27(1-4): 137-142. DOI:10.1023/B:TOCA.0000013548.16699.1c |
| [4] |
刘学民, 冯耀平, 董月珍. 聚甘油醚表面活性剂的合成及性能[J]. 大豆科学, 2009, 28(5): 894-897. LIU X M, FENG Y P, DONG Y Z. Synthesis and properties of polyglyceryl surfactants[J]. Soybean Science, 2009, 28(5): 894-897. |
| [5] |
周燕霞, 崔正刚, 陈莉. 聚甘油脂肪酸酯合成及应用[J]. 粮食与油脂, 2008(7): 6-10. ZHOU Y X, CUI Z G, CHEN L. Synthesis and application of polyglycerol fatty acid ester[J]. Cereals and Oils, 2008(7): 6-10. DOI:10.3969/j.issn.1008-9578.2008.07.003 |
| [6] |
徐怀义, 马银官, 闵菊平, 等.一种聚甘油脂肪酸酯的生产工艺: CN 106 084 209 A[P]. 2016-11-09. XU H Y, MA Y G, QI J P, et al. Production process of polyglycerol fatty acid ester: CN 106 084 209 A[P]. 2016-11-09. |
| [7] |
ARZAMENDI G, ARGUIÑARENA E, CAMPO I, et al. Alkaline and alkaline-earth metals compounds as catalysts for the methanolysis of sunflower oil[J]. Catalysis Today, 2008, 133(1): 305-313. |
| [8] |
SUNDER A, HANSELMANN R, HOLGER FREY A, et al. Controlled synthesis of hyperbranched polyglycerols by ring-opening multibranching polymerization[J]. Macromolecules, 1999, 32(13): 4240-4246. DOI:10.1021/ma990090w |
| [9] |
JAKOBSON G. Diglycerin und höhere oligomere des glycerins als synthesebausteine[J]. Fette Seifen Anstrichmittel, 1986, 88: 101-106. DOI:10.1002/lipi.v88:3 |
| [10] |
MARTIN A, RICHTER M. Oligomerization of glycerol – A critical review[J]. European Journal of Lipid Science and Technology, 2011, 113(1): 100-117. DOI:10.1002/ejlt.v113.1 |
| [11] |
SIVAIAH M V, ROBLES-MANUEL S, VALANGE S, et al. ChemInform abstract: Recent developments in acid- and base- catalyzed etherification of glycerol to polyglycerols[J]. Catalysis Today, 2012, 198(1): 305-313. |
| [12] |
RUPPERT A M, MEELDIJK J D, KUIPERS B W, et al. Glycerol etherification over highly active CaO-based materials: new mechanistic aspects and related colloidal particle formation[J]. Chemistry-A European Journal, 2010, 14(7): 2016-2024. |
| [13] |
GARCíA-SANCHO C, MORENO-TOST R, MéRIDA-ROBLES J M, et al. Etherification of glycerol to polyglycerols over MgAl mixed oxides[J]. Catalysis Today, 2011, 167(1): 84-90. |
| [14] |
BARRAULT J, CLACENS J M, POUILLOUX Y. Selective oligomerization of glycerol over mesoporous catalysts[J]. Topics in Catalysis, 2004, 27(1-4): 137-142. DOI:10.1023/B:TOCA.0000013548.16699.1c |
| [15] |
AYOUB M, KHAYOON M S, ABDULLAH A Z. Synthesis of oxygenated fuel additives via the solventless etherification of glycerol[J]. Bioresource Technology, 2012, 112(3): 308-312. |
| [16] |
解峰, 黎汉生, 赵学良, 等. 甲醇在活性Al2O3催化剂表面的吸附与脱水反应[J]. 催化学报, 2004, 25(5): 403-408. XIE F, LI H S, ZHAO X L, et al. Adsorption and dehydration of methanol on Al2O3 catalyst[J]. Chinese Journal of Catalysis, 2004, 25(5): 403-408. DOI:10.3321/j.issn:0253-9837.2004.05.015 |
| [17] |
郑晓斌, 黄大富, 张涛, 等. 新型能源二甲醚合成催化剂和工艺发展综述[J]. 化工进展, 2010, 29(s2): 149-156. ZHENG X B, HUANG D F, ZHANG T, et al. Recent development of dimethyl ether synthesis: Catalyst and production process[J]. Chemical Industry and Engineering Progress, 2010, 29(s2): 149-156. |




