2. 马鞍山德鸿生物技术有限公司, 安徽 马鞍山 243000
2. Maanshan Dehong Biotechnology Co., Ltd., Maanshan 243000, China
芳香族氰基化合物(芳香腈)是生产农药、香料、医药、燃料添加剂等的重要原料,它能通过水解、加氢、聚合等反应获得酰胺、羧酸、有机胺、功能材料等精细化学品[1, 2]。3-氰基吡啶、苯甲腈、邻苯二甲腈、间苯二甲腈、对苯二甲腈和邻氯苯甲腈等芳香腈已有规模生产[3~7]。上述芳香腈的合成方法有:氰基取代法、腙氧化法及氨氧化法。利用氰基取代法制备芳香腈的原料主要是卤代物,Sundermeier等人[8, 9]提出了以Pd为主催化剂、以四甲基乙二胺为助催化剂,以三氟甲基氯苯与氰化钾为原料,催化反应得到对三氟甲基苯腈,该反应收率可以达到91.0%,但此方法反应原子经济差,且催化剂难回收。Fujiwara等人[10]报道了苯胺先在低温条件下进行重氮化反应,然后重氮盐再与氰化亚铜进行Sandmeyer反应,不过反应过程中会使用到剧毒的氰化物,且该反应收率并不高,废水较多。利用腙氧化法制备芳香腈具有较高的收率,但是该方法的原料腙不易获得,且氧化体系MTO/ H2O2[11]反应温度为-50℃,反应条件比较苛刻,另外氧化剂二甲基过氧化酮易爆,所以腙氧化法也不利于工业化生产。氨氧化法是将含甲基芳烃、氨气、空气通过催化剂床层连续转化为腈类化合物,反应主要副产物为水,具有绿色环保[12]、原子经济性高等优点。
3-氰基吡啶是典型的利用氨氧化法生产的芳香腈。喻鹏课题组[13]和Helmut课题组[14]都对3-甲基吡啶催化氨氧化反应工艺进行了研究,所得到目标产物3-氰基吡啶具有较高的收率(分别为85.2%和90.0%)。
与氨氧化法生产3-氰基吡啶不同,2-氰基吡啶的生产收率一般较低,一般只能达到60%左右[15]。这是因为其分子结构中的羧基更靠近吸电子效应明显的N原子,导致在反应条件下发生脱羧基副反应而生成吡啶,降低了目标产物的收率。因此,对于2-氰基吡啶生产而言,催化剂的使用不能简单套用其他氨氧化催化剂。故本文开展了氨氧化法生产2-氰基吡啶的催化剂研究和生产工艺条件的优化,反应方程式如下所示:
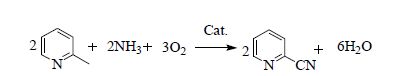
|
氨氧化反应催化剂的种类主要可以分成:钒系、钼系[16, 17]和分子筛类。Jiong-bin Pan等[12]人报道了目前的钒钛催化剂对于催化2-甲基吡啶的氨氧化反应效果较好;而钼系催化剂和分子筛都处于探索阶段。正如Chary等[18]人报道,在钒铌催化剂(V2O5/Nb2O5)中添加三氧化钼(MoO3)会降低催化剂晶格氧的活性,说明在催化剂中添加其它金属成分往往会改变催化剂的活性。由此,本文基于Pan等人[12]的实验基础,联想到在钒钛催化剂中添加第三组分三氧化钼(MoO3)来适度降低钒钛催化剂的整体活性,减少脱羧副反应,提高对2-甲基吡啶氨氧化反应的选择性,并基于改进后的催化剂对氨氧化反应工艺条件进行优化。
2 实验部分 2.1 主要试剂主要试剂有偏钒酸铵(AR,国药)、二氧化钛(AR,国药)、三氧化钼(AR,国药)、蒸馏水(自制)、2-甲基吡啶(AR,南通市天泽化工有限公司)、液氨(99.9%,浙江江山化工股份有限公司)。
2.2 仪器和方法本文氮气物理吸附(BET)测定所用仪器是Micromeritics公司的ASAP 2020型物理吸附仪,吸附操作是在液氮温度(-196℃)下进行。X射线衍射(XRD)测试仪器是日本Rigaku公司的D/max-rA型转靶多晶体X射线衍射仪,采用Cu靶和Kα射线,扫描范围是从4°至135°,电压40 kV,管流80 mA。测角精确度0.01°,分辨率0.16°。同时,采用安捷伦1790A气相色谱仪(氢气和载气氮气的柱前压为0.1 MPa,空气柱前压为0.03 MPa,进样器和检测器的温度为260℃,柱箱起始温度为100℃,初始时间为2 min,升温速率为20℃⋅min-1),挤条机(ZH-50L,如皋市盛腾捏合机械有限公司),马弗炉(SX2-25-10,上海沪铄电子科技有限公司),固定床反应器(自制,装置如图 1,固定床反应器反应管长400 mm,内部有效直径30 mm,上下两端都会装填一小段惰性的瓷环)。
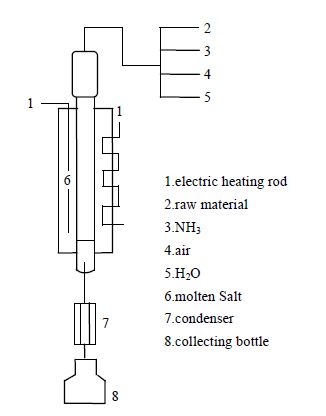
|
图 1 固定床催化氨氧化反应装置简图 Fig.1 Schematic diagram of the fixed-bed reactor |
混合法制备催化剂的流程如图 2所示:
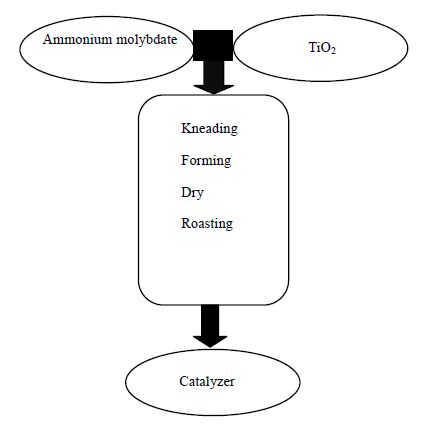
|
图 2 催化剂制备流程图 Fig.2 Flow chart for catalyst preparation |
具体制备过程:称量160 g偏钒酸铵(NH4VO3),1200 g二氧化钛(TiO2)和一定量的三氧化钼(MoO3),然后加入750 mL蒸馏水,搅拌均匀后将物料置于60℃干燥4 h,之后再加入约50 mL蒸馏水进行捏合。捏合完后放入挤条机中挤出条状,将挤出的条状剪成长度约6~8 mm小段,成型的催化剂直径约4 mm。将成型的催化剂放入真空干燥箱中,60℃干燥1 h后取出,置于马弗炉中,设置温度250℃,焙烧2 h。升温至500℃,继续焙烧5 h,然后自然降温得到催化剂。
2.3.2 2-氰基吡啶的合成过程向固定床中装填上述钒钛催化剂,开启加热,熔化夹套中的熔盐,开启预热室加热,打开空气阀门。当床层和预热室温度均达380℃且稳定后,向固定床中通入按一定比例混合的2-甲基吡啶、氨和水的混合物,调节混合物流量及空气流量。反应进行中,保持出料口控制阀一定程度打开,使固定床中无积液。收集出料口流出的反应液,用甲苯萃取,萃取液精馏回收甲苯(107~110℃)、吡啶(114~118℃)以及2-甲基吡啶(137~141℃),然后进行减压精馏(真空度10 mmHg)获得产物2-氰基吡啶(88~90℃),得到的产物用气相色谱仪进行纯度分析。
3 结果与讨论 3.1 助催化剂含量对催化效果的影响根据文献报道2-氰基吡嗪的反应机理[19],推测2-甲基吡啶的氨氧化过程可能为两条:① 2-甲基吡啶先被氧化成2-甲醛吡啶,2-甲醛吡啶和氨气反应生成一种亚胺,该亚胺被空气氧化后生成2-氰基吡啶;②2-甲基吡啶先被进一步氧化成2-羧基吡啶,2-羧基吡啶与氨气反应生成酰胺,该酰胺脱水后生成2-氰基吡啶。
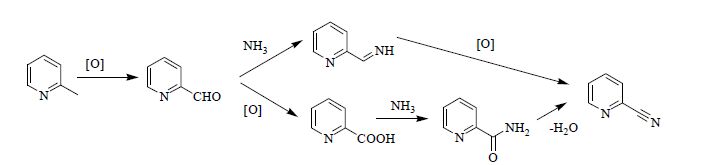
|
图 3 2-甲基吡啶氨氧化推测机理 Fig.3 Mechanism of 2- methyl pyridine ammonia oxidation |
路径②中,2-羧基吡啶很容易在高温条件下脱羧生成吡啶,而实验结果也得到了吡啶副产物(如图 4),因此可以推测2-甲基吡啶在V-Ti-O-a催化条件下的氨氧化过程很大可能是以路径②进行。若要减少副产物吡啶的生成,则需要降低催化剂表面晶格[O]的活性,防止2-甲醛吡啶被过度氧化。Chary等人[18]曾研究了助催化剂三氧化钼(MoO3)对钒铌催化剂(V2O5/Nb2O5)催化2-甲基吡啶反应的影响,研究结果表明三氧化钼(MoO3)可以降低主催化剂晶格氧的活性,因此尝试在V-Ti-O催化剂的制备过程中加入助催化剂三氧化钼(MoO3)来减少副产物吡啶的生成,从而提高2-氰基吡啶的收率。
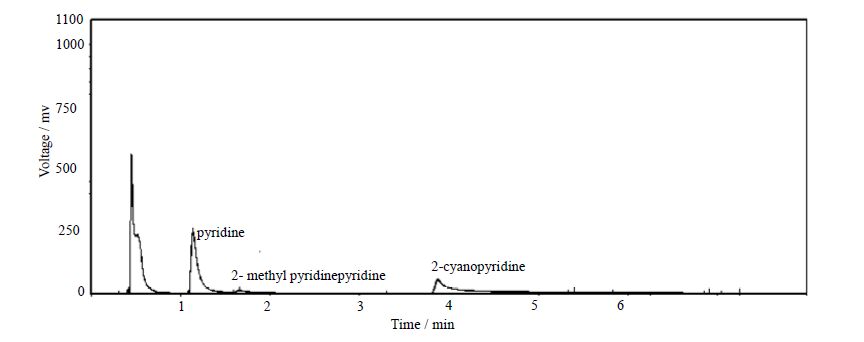
|
图 4 2-甲基吡啶氨氧化反应色谱图 Fig.4 GC spectra of the reaction chemicals |
为了探讨助催化剂三氧化钼(MoO3)加入的效果,本文尝试了三种不同钼(Mo)含量的添加量,分别为1.5%(wt)、3.5%(wt)和5%(wt),并依次记为催化剂V-Mo-Ti-O-a、V-Mo-Ti-O-b和V-Mo-Ti-O-c。反应结果和未添加三氧化钼(MoO3)时比较,如图 5所示。
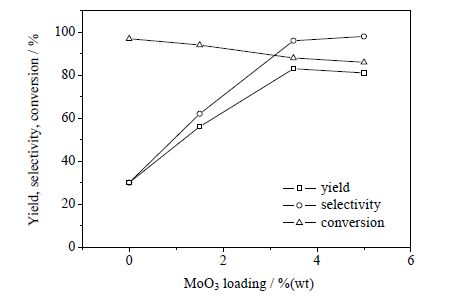
|
图 5 助催化剂三氧化钼(MoO3)对反应结果的影响 Fig.5 Effects of molybdenum trioxide (MoO3) on the reaction |
从实验结果可以看出,不含助催化剂三氧化钼(MoO3)的催化剂V-Ti-O对2-甲基吡啶氨氧化反应的选择性效果很差,产生了很多副产物吡啶,2-氰基吡啶收率在26.2%~35.6%。随着钼(Mo)含量的增加,2-甲基吡啶的转化率略有下降,当钼(Mo)含量由3.5%(wt)增加到5.0%(wt)时,2-氰基吡啶的选择性基本上不再增加,而2-甲基吡啶的转化率仍然有下降,因此当钼(Mo)含量为3.5%(wt)时,2-氰基吡啶的收率最高,记该催化剂为V-Ti-O-Mo。故适宜的催化剂组成为8.91%(wt)V2O5、85.84%(wt)TiO2和5.25%(wt)MoO3。对该V-Ti-O-Mo催化剂进行XRD和BET表征,XRD表征结果如图 6所示。
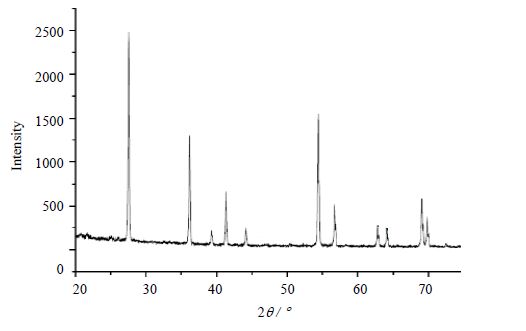
|
图 6 催化剂V-Ti-O-Mo XRD 谱图 Fig.6 XRD spectra of V-Ti-O-Mo |
通过XRD结果计算得到催化剂晶粒尺寸为53 nm,根据BET结果得到催化剂比表面积为0.8659 m2⋅g-1,孔径为14.598 nm。在XRD图中,只能观察到二氧化钛(TiO2)的特征衍射峰,并没有观察到五氧化二钒(V2O5)和三氧化钼(MoO3)的特征衍射峰,说明五氧化二钒(V2O5)和三氧化钼(MoO3)在二氧化钛(TiO2)中是高度分散的。
3.2 温度的影响为了探索温度对V-Ti-O-Mo催化2-甲基吡啶氨氧化反应结果的影响,在2-甲基吡啶体积空速0.15 h-1,2-甲基吡啶/氨气/水/空气(摩尔比)=1:6:3.3:22,在340~400℃进行了多组实验,实验结果如表 1所示。
| 表 1 催化剂V-Ti-O-Mo 催化下温度对反应的影响 Table 1 Effects of temperature on reaction catalyzed with V-Ti-O-Mo |
从表 1 可以看出,在催化剂V-Ti-O-Mo催化,2-氰基吡啶的选择性在380℃以上时开始明显下降,这可能是因为温度过高后导致了2-甲醛吡啶过度氧化成2-羧基吡啶,大量脱羧生成副产物吡啶导致,从而导致收率随着温度的升高先增加后减少。由表结果可以看出,催化剂V-Ti-O-Mo的最佳催化温度范围是370~380℃。
3.3 氨气用量的影响本文采用单因素法,在催化剂V-Ti-O-Mo催化下,研究了氨气量对反应的影响,其他反应条件如下:反应温度380℃,2-甲基吡啶液体体积空速0.15 h-1,2-甲基吡啶/水/空气(摩尔比)=1:3.3:22。
图 7中,横坐标为氨气用量和2-甲基吡啶用量的摩尔比值,从图中结果可以发现,2-甲基吡啶的转化率及2-氰基吡啶的选择性和收率都随氨气量的增加而上升,当氨气(NH3)量上升为2-甲基吡啶用量的5倍时,2-氰基吡啶收率趋于平缓,所以可以确定反应中氨气用量为2-甲基吡啶用量的5~6倍。
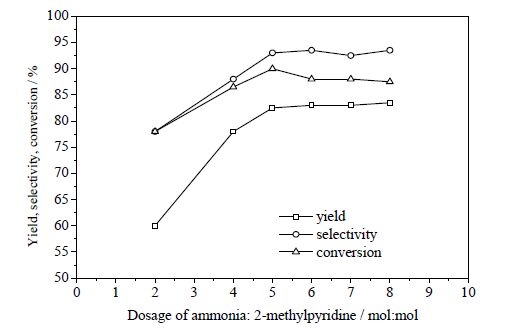
|
图 7 催化剂V-Ti-O-Mo 催化下氨气用量对反应的影响 Fig.7 Effects of ammonia gas amount on reaction catalyzed with V-Ti-O-Mo |
水作为溶剂在反应中可以避免固定床内局部反应温度过高,但是水的存在也会导致2-氰基吡啶在高温下水解生成副产物2-吡啶甲酰胺。本文采用单因素法在催化剂V-Ti-O-Mo最优配比催化下研究水用量对反应的影响,反应其他条件控制如下:反应温度380℃,2-甲基吡啶液体体积空速0.15 h-1,2-甲基吡啶/氨气/空气(摩尔比)=1:5:22。反应结果如表 2所示。
| 表 2 在催化剂V-Ti-O-Mo 催化下水用量对反应的影响 Table 2 Effects of water content on reaction catalyzed with V-Ti-O-Mo |
实验结果显示,随着水用量的增加,产物中副产物2-吡啶甲酰胺的量增多,相应的2-氰基吡啶收率降低。虽然结果显示用水量少有利于提高2-氰基吡啶的收率,但是从安全角度考虑,应该尽可能使水量增加从而避免“飞温”现象,因此选定最佳的用水量为2-甲基吡啶的3~4倍。
3.5 空速空速的大小决定了反应原料在催化剂床层中的停留时间长短,空速越大,反应停留时间越短,反应程度越浅;空速越小,反应停留时间越长,反应程度越深。为了探索空速大小对该反应的影响,采用单因素法研究了2-甲基吡啶在V-Ti-O-Mo最优配比催化下的反应。其他反应条件控制如下:反应温度380℃,2-甲基吡啶/氨气/水/空气(摩尔比)=1:5:3.3:22。反应结果如图 8所示。
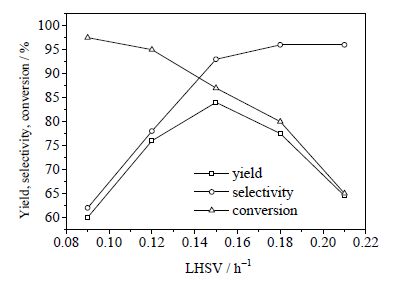
|
图 8 在催化剂V-Ti-O-Mo催化下空速对反应的影响 Fig.8 Effects of space velocity on reaction catalyzed with V-Ti-O-Mo |
从实验结果可以看出,随着空速的增加,2-甲基吡啶转化率逐渐减小,这是由于停留时间短,反应不完全造成的。随着空速的增加,2-氰基吡啶的选择性逐渐增加,这是因为空速很小的时候,停留时间太长导致了副反应的进行。因此根据结果本文确定空速的最佳范围在0.15 h-1。
3.6 催化剂稳定性研究催化剂的使用寿命对于催化剂的工业应用十分重要,为此考察了V-Ti-O-Mo最优配比催化剂的使用寿命,反应温度380℃,2-甲基吡啶液体体积空速0.15 h-1,2-甲基吡啶/氨气/水/空气(摩尔比)=1:5:3.3:22。在五次重演性实验的基础上,得到反应结果如图 9所示。
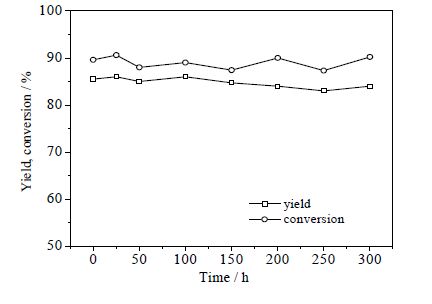
|
图 9 催化剂V-Ti-O-Mo稳定性实验图 Fig.9 Experimental results of V-Ti-O-Mo stability |
横坐标所示的反应时间为连续反应所消耗的时间,纵坐标为五次重演性实验所得产率转化率的加权平均值。实验结果显示催化剂V-Ti-O-Mo的催化效果在300h内该催化剂稳定性良好。
4 结 论利用混合法制备了一种含有钼(Mo)成分的钒钛催化剂,对2-甲基吡啶氨氧化生成2-氰基吡啶的反应显示出较高的选择性和收率。在380℃反应温度、1:5:3.3:22(2-甲基吡啶/氨气/水/空气)物料摩尔配比、空速0.15 h-1,2-氰基吡啶收率可以达到85.6%。相比于其他文献报道,本文开发的催化剂对2-甲基吡啶的氨氧化反应有很高的催化选择性,且该催化剂的制备过程简单,稳定性好,对其它芳香环上甲基的氨氧化研究有一定的指导意义。
| [1] | WANG Cun-de(王存德), YAO Zheng(姚铮) . Study on synthesis and application of nitrile compounds(腈类化合物的合成和应用研究)[J]. Chemical Industry Times(化工时刊) , 1992 (4) : 13-18 |
| [2] | JIANG Zhen-hai(江镇海) . Application of cyanopyridines in chemical pesticides(氰基吡啶在农药化工中的应用前景)[J]. Pesticides and Intermediates(农药与中间体) , 2008 (5) : 17 |
| [3] | CHEN Jin-hua(陈金华) . Application of aromatic hydrocarbon ammonia oxidation technology in fine chemical synthesis(芳香烃氨氧化技术在精细化工合成中的应用)[J]. Fine Chemical Industry(精细化工) , 1999, 16 (5) : 6-8 |
| [4] | LU Han-feng(卢晗锋), ZHOU Ying(周瑛), LIU Hua-yan(刘华彦) . Study on the reaction conditions for the synthesis of benzyl cyanide by toluene ammonia oxidation(甲苯氨氧化合成苯甲腈反应条件的探索)[J]. Journal of Zhejiang University of Technology(浙江工业大学学报) , 2005, 33 (2) : 137-140 |
| [5] | MA Yu-long(马玉龙), ZHOU Xin-hua(周新花), YANG Zhi-kuan(杨智宽) . Synthesis of 1,2-dicyanobenzene by ammonia oxidation process(氨氧化法合成邻苯二甲腈)[J]. Fine and Special Chemicals(精细与专用化学品) , 2002 (11) : 17-19 |
| [6] | LI Guo-zhen(李国珍), AI Qiu-hong(艾秋红), XIAO Xiu-yun(肖修云) . Experimental study on industrial production of isophthalonitrile with high purity(高纯间苯二甲腈工业化生产实验研究)[J]. Fine Chemical Intermediate(精细化工中间体) , 2001, 31 (6) : 36-37 |
| [7] | XUE Xu-ming(薛叙明), LÜ Chun-xu(吕春绪), ZHANG Hong-jun(张红军) . Progress in synthesis of 2-chlorobenzonitrile(邻氯苯甲腈的合成技术进展)[J]. Chemical Industry Times(化工时刊) , 2008, 22 (12) : 49-52 |
| [8] | Sundermeier M, Zapf A, Mutyala S . Progress in the palladium-catalyzed cyanation of aryl chlorides[J]. Chemistry-A European Journal , 2003, 9 (8) : 1828-1836 DOI:10.1002/chem.200390210 |
| [9] | Sundermeier M, Zapf A, Beller M . A new palladium catalyst system for the cyanation of aryl chlorides[J]. Tetrahedron Letters , 2001, 42 (38) : 6707-6710 DOI:10.1016/S0040-4039(01)01390-9 |
| [10] | Fujiwara H, Takagi T, Yamazaki Y . Association between polar molecules[J]. Journal of the Chemical Society , 1982, 78 : 347-356 |
| [11] | Rudler H, Denise B, Masi S . Methyltrioxorhenium catalyzed oxidation of aldehyde and ketone N,N-dimethyl hydrazones with H2O2:formation of nitriles from aldehydes and regeneration of the ketones[J]. Comptes Rendus de l Académie des Sciences-Series IIC-Chemistry , 2000, 3 (10) : 793-801 DOI:10.1016/S1387-1609(00)01185-3 |
| [12] | Pan J, Huang J . Ammoxidation of 2-picoline catalyzed by modified V2O5/TiO2[J]. Monatshefte für Chemie-Chemical Monthly , 2014, 145 (8) : 1365-1369 DOI:10.1007/s00706-014-1196-7 |
| [13] | YU Peng(喻鹏), HUANG Chi(黄驰), LI Xiao-yun(李晓芸) . Study on the preparation of heterocyclic aromatic compounds by ammonia oxidation of heterocyclic compounds(杂环化合物氨氧化法制备杂环芳腈研究I.3-甲基吡啶氨氧化法制备烟腈)[J]. Journal of Wuhan University(武汉大学学报) , 2003, 49 (2) : 179-182 |
| [14] | Beschke H, Dahm L, Friedich H. Process for obtaining 3-cyanopyridine:US, 4,482,719[P]. 1981-07-22. |
| [15] | Martin A, Lucke B . Ammoxidation of methylaromatics over vanadium phosphate catalysts. I. Effect of the size, position and electronic properties of substituents on the catalytic conversion of methylaromatics to the corresponding nitriles[J]. Catalysis Today , 1996, 32 (5) : 273-283 |
| [16] | Kumar C P, Reddy K R, Rao V V . Vapour phase ammoxidation of toluene over vanadium oxide supported on Nb2O5-TiO2[J]. Green Chemistry , 2002, 4 (5) : 513-516 DOI:10.1039/B206581A |
| [17] | Toland W G . The formation of nitriles by reaction of terminal methyl groups with sulfur and anhydrous ammonia[J]. The Journal of Organic Chemistry , 1962, 27 (3) : 869-871 DOI:10.1021/jo01050a043 |
| [18] | Chary K V R, Kumar C P, Reddy K R R . Characterization and catalytic properties of MoO3-V2O5/Nb2O5 catalysts[J]. Catalysis Communications , 2002, 3 (1) : 7-13 DOI:10.1016/S1566-7367(01)00065-6 |
| [19] | HONG C, LI Y, LIU L . Ammonia oxidation catalytic synthesis of 2-cyanopyrazine[J]. Journal of Chemistry and Chemical Engineering , 2005, 19 (6) : 808-812 |




