微球通常是指粒径范围在1~300 μm的球状实体,也有小于1 μm纳米粒子和直径达1 000 μm的更大的颗粒[1]。为了满足微球在材料合成、药物筛选、环境监测等多个领域的应用需求,通常在以高分子材料为骨架的基础上,进行各种改性。制备微球的方法有多种,例如交联固化法[2]、溶剂挥发法[3]、液滴微流控技术等。较于前两者,液滴微流控技术可以制备多种性能优良的聚合物粒子。例如在化学分析领域,可用于高效液相色谱填料;在制药方面,将药物镶嵌在微球内部,控制微球大小,可以改善药物在体内的吸收与分布;在吸附表征方面,通过改造微球内部结构,可以增大微球比表面积,进而增加吸附量。综上所述,针对不同的需求,可以衍生出多种架构不同、功能不同的微球。
液滴微流控技术(microfluidics)是指基于微观尺度下,在几十至几百微米的通道内对流体进行操控的一种技术。该技术起源于20世纪50年代,Skegges[4]提出一种间隔式连续流动技术,在流体管道中进行分析化学实验,颠覆了传统实验方法。发展至今,在装置搭建方面经历了3次重大突破:首先是1998年,Xia等[5]提出了关于聚二甲基硅氧烷(PDMS)软刻蚀的方法,PDMS材料的出现是微流控技术的重要突破,为微流控技术的蓬勃发展奠定了坚实的基础;其次是在2001年Thorsen等[6]突破了连续流的限制,实现了液滴的剪切,开启了液滴微流控的历史;最后是2005年,哈佛大学的Utada等[7]采用玻璃毛细管制备了微流控装置,这一举措丰富了微流控技术方法的种类,目前大多数微流控制备微球的实验都是基于毛细管进行的。
不管微流控技术如何变化,顾名思义,始终是“微流”与“控”的组合。“微流”属于流道设计,“控”属于仪器,两者组合完成对单相或者多相流体的精确控制与操作。微流控技术利用互不相溶的液体,在流体剪切力、压力以及表面张力的共同作用下,可形成单分散、粒径可控和分布均匀的微球。针对不同的需求,以微球为载体加入具有不同功能的材料,可以合成高分子微球或者聚合物粒子[8]。微流控技术包含3个重要分支:液滴微流控、数字微流控和连续微流控。其中液滴微流控技术[9]作为微流控芯片研究的重要分支,利用互不相溶的多相液体通过缩颈、拉伸、成球步骤后产生分散微液滴的非连续微流控技术。
本文综述了近年来采用液滴微流控装置制备核壳型[10]、多孔型[11]以及各向异性颗粒[12]等不同形态功能型微球的研究进展,同时也指出了传统方法制备的弊端,从中得到启发。
2 微球的传统制备方法在微流控方法还没有得到普及之前,制备各种微球的传统方法包括喷雾干燥法[13]、悬浮聚合法[14]、离子交联法[15]和乳液蒸发法等。上述方法都存在外力不稳定,不同相混合时剪切力不均匀等弊端。导致得到的微球粒径分布不均匀且粒径难以控制;粒径差异明显,小至十几微米,大至几百微米;甚至可能会使内部活性物流失,改变微球形貌。例如,在吸附领域,某些特定的装置如旋流器对粒径有严格的要求,由于粒径的差异导致微球的体积、密度不均匀,进而造成错误的数据结果[16]。悬浮聚合法虽然是目前最为常见的制造多孔微球手段,但是需要通过机械搅拌或者振荡等人工条件或分散剂的作用,将液相分散成液滴,期间需要添加引发剂和致孔剂,成球后还要去除残留的致孔剂,需要多次清洗,工序非常繁琐;再加上搅拌过程中力的不稳定性,造成微球粒径不均匀,而且内容物质容易从孔道中流出与接收相反应导致双向污染。马欢[17]采用悬浮聚合法制备Li2O微球,需要将Li2O3浆料注入液氮,在低温真空环境下进行煅烧,成本非常昂贵。
液滴微流控技术相对操作简单,制备的微球大小均匀、体系封闭、单分散性好,粒径偏差可以稳定控制在5%以下,特定条件下甚至可以达到1%;而且,试剂消耗量低、实验安全系数高、可以控制内部组成含量、实现更加有序的内部结构;另外,均匀的球形形貌在回收再利用方面的优势也非常突出,因此成为当前微球制备的主要实验手段。
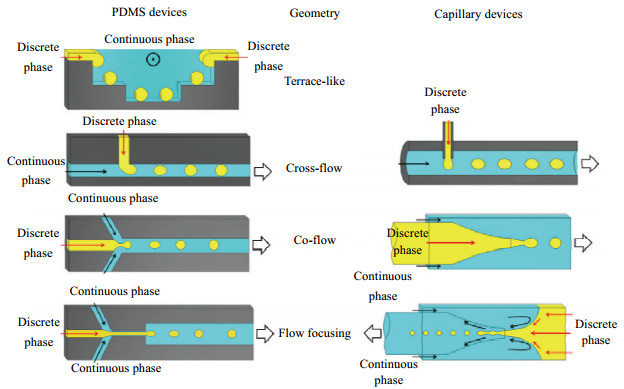
3 液滴微流控研究液滴微流控技术是Thorsen等[6]首次提出,随后Nie等[18-19]先后报道了液滴微流控技术的研究成果:生物相容性极佳的微球,可以运用在医学诊断中;含有单个或多个液芯的聚合物胶囊,用于药物口服。Wang等[20]在2017年将微流控装置分为聚二甲基硅氧烷软刻法(PDMS)装置和毛细管装置。在PDMS装置中,分散相与连续相在同一微通道中进行剪切,制备过程简单,装置气密性好;在毛细管装置中分散相需单独一支通道接入连续流动的管道,在流体界面处剪切成球,效率高且成本低。但是,两种装置依然各有不足:PDMS装置由于其材料本身的性质,在流体通过通道内壁时对疏水性分子进行吸收,进而影响实验的定量分析,即使采用改性表面技术,也很难达到理想效果;毛细管组装的微流控系统,无需对壁面进行修饰,但是对装置的尺寸精度和清洁程度要求极高,实验操作过程中极易造成玻璃通道的堵塞。毛细管装置衍生出了3种结构(如图 1所示):共轴型(co-flow) [21]、聚集型(flow-focusing) [22]及T型(T-injunction) [23]微流控装置。
|
图 1 PDMS装置(左)和毛细管装置(右)制备微球的装置结构示意图 Fig.1 Schematic diagram of the structure of the PDMS device (left) and capillary device (right) for preparing microspheres |
通过图 1的基本装置或加以改进,可以完成对液滴的分裂、融合、分选、捕获以及定位,制备的液滴单分散性很好,有助于定量研究;同时反应速度较快,试剂消耗量少,能节省大量试剂,操作也较为安全。经过对试剂的选择,可以设计出水包油(O/W) [24]、水包气(G/W)[25]等乳液,通过增加毛细管装置的级数或在PDMS上开更多通道完成更为复杂的油包水包气(G/W/O)[26]、水包油包水(W1/O/W2)[27]液滴和复合乳液[28]。产生的这些液滴通过UV照射、加热[29]、化学反应[30]或溶剂蒸发[31]等多种手段,固化得到单分散的颗粒或者胶囊。通过进一步的后续处理,可以得到诸如各向同性均匀微球、核-壳型微球、Janus等复杂的颗粒,这些粒子可以运用在生物探针[32]、表面增强拉曼光谱技术(SERS)检测[33]、重金属吸附[34]、药物控释[35]、环境检测[36]多个研究领域,也可以在物理学中光[37]、热[38]、磁[39]等各种相应特性中发挥作用。
近年来,利用液滴微流控技术已经成功制备出核壳型微球、多孔型微球、各向异性微球、中空微球等多种特殊结构的微球。鉴于在吸附、环境监测、药物传递、颗粒示踪等领域的应用需求,研究工作以核壳型、多孔型和各向异性微球的制备居多。
3.1 核壳型微球核壳结构通常以内部的核和包覆在外部的壳构成,具有优异的化学和物理性能。一般通过分子间的作用力将两者结合,是一种构造新颖的复合材料。传统核壳型微球制备通常采用乳液聚合法,步骤多,操作复杂,影响因素包括乳化剂的种类、用量和亲水性等。
通过微流控装置可以对核壳结构微粒的组成成分、粒径大小进行针对性设计,还可以包埋不同组分和不同尺寸的内核,从而具备磁、光、生物反应等不同特性。这类微球在微反应器、示踪颗粒等多个不同领域有着广阔的前景,例如在药物上的靶向传递[40]等。一般而言,内核与外壳由不同材料组成,外壳在保护内核不受外界环境影响的同时还能增加微球或颗粒的机械强度和化学性能;限制微球个体的体积变化,保证完整性;确保分散性保护核心不聚集成大颗粒;限制外部离子选择性进入核心,保护活性核。微通道内流体相的物理参数和壁面材料,是形成核壳型的关键。王號元等[41]在水包油乳液体系基础上,考虑离散相物性、壁面效应和接触角等多个参数,对液滴的稳定性进行了模拟计算,研究了离散相在连续相剪切作用下,形成核壳型结构的机理,明确了液滴形成的稳定性与流体参数、微通道材料的相关性。
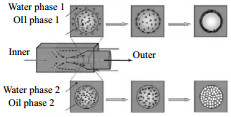
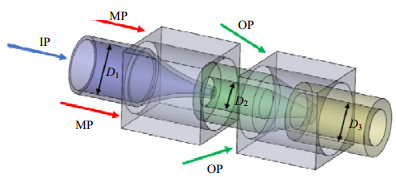
如图 2所示,是一种2级的共轴型微流控装置。由3支圆管和2支方管组成,一共有三相液体,分别是内相(IP)、中间相(MP)和外相(OP)。内相经中间相剪切形成分散的、独立的小液滴后进入2级管道,由流速较快的外相液体包裹,从而形成微球。通常MP以紫外光聚合单体为基底,如交联剂二甲基丙烯酸二醇酯(EDGMA)等[42],添加表面活性剂和光引发剂,这样在紫外灯照射下液滴可以得到固化,而IP和OP则根据乳液模板选择成分。
|
图 2 三相液体进口位置(D为各圆管的直径) Fig.2 Schematic diagram of flow from channels of inner phase (IP), middle phase (MP) and outer phase (OP) (D is the diameter of each round tube) |
Gong等[43]利用液滴微流控技术,以阿司匹林溶液为分散相作为内核,将Fe3O4颗粒添加到壳聚糖溶液中作为连续相,采用PDMS为板材制作聚焦型微流控装置,合成了具有核壳结构的液滴,再添加戊二醛与壳聚糖发生席夫碱反应,得到以壳聚糖为外壳,阿司匹林为内核且嵌有Fe3O4颗粒的微球。这样的微球由于外壳具有极佳的生物相容性和无毒性,能够很好地封存阿司匹林,具有缓释作用。
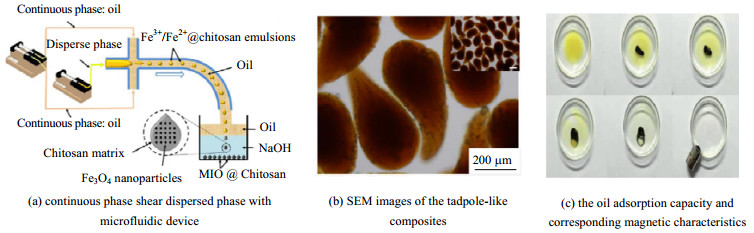
Yang等[44]将FeCl2和FeCl3按比例混入壳聚糖溶液作为分散相,添加油相剪切,形成的单分散液滴进入NaOH水溶液中,干燥固化后,得到内部含有Fe3O4纳米颗粒的蝌蚪型微球。这类微球对油相展现出极好的吸附能力,在磁铁作用下还具备磁响应特性,利于回收再利用。如图 3所示磁性微球的制备过程以及微球在40 s内完成吸附同时展现出磁响应特性。
|
图 3 利用微流控装置制备得到的具有磁性的壳聚糖微球 Fig.3 Magnetic chitosan microspheres prepared with a microfluidic device |
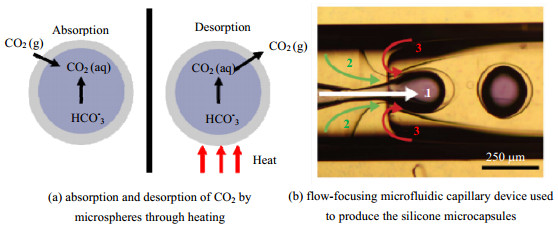
Vericella等[45]采用聚焦型微流控装置,制备了具有高渗透性的以硅酮为外壳,内含碳酸盐液芯的核壳型微胶囊,通过这种封装的形态可以完成对CO2的捕获,与普通的液体吸附剂相比,能大幅提高对CO2吸附量。如图 4所示,CO2通过高渗透性的硅酮外壳扩散到内部,被液态的碳酸盐内芯吸收,又通过加热释放CO2,实现CO2的捕获与再生循环。
|
图 4 通过聚焦型装置制备得到的微球完成对CO2的吸收与解吸 Fig.4 Microspheres prepared by a focusing device for CO2 absorption and desorption |
核壳型微球是将不同材料和结构结合起来,内部相互协同稳定的活性粒子。这样的形态衍生了丰富的架构和功能:对结构而言,有狭义的核壳结构、蛋黄壳结构[46]、中空结构。区别在于内部空间的利用,核与壳之间的腔体是否存在空隙或由多相组成,以及核的数量;对功能而言,得益于核壳微球的结构能够保护并封存内部物质,具有优越的转换和储存性能。在生物医学研究领域,核壳微球能够在特定环境中打开外壳,释放内核用于靶向传递。核壳微球也可以与金属氧化物结合,在生物电池,催化剂等方面发挥作用。
3.2 多孔结构微球多孔结构微球具有多孔结构,因此微球的密度低,比表面积大,渗透性强。由于孔隙率大,在吸附方面的应用尤为广泛,尤其在催化和储能等领域,另外在生物学的组织再生方面也具有极佳的应用前景。随着孔隙率的增加,不仅在微球表面,微球内部也会释放更多的吸附位点,从而提升微球的吸附能力。Wang等[47]以液滴微流控方法制备了形貌均一的壳聚糖多孔微球,通过添加聚乙烯亚胺(PEI)增添吸附位点增强化学吸附能力,对重金属离子的吸附量提升了3倍。
制备多孔微球的方法有很多,诸如反向悬浮聚合法、沉淀聚合法等,对微球粒径、粒径偏差、制备方法的难易程度综合比较,还是液滴微流控方法更加优越。采用微流控装置制备多孔微球,无论采用模板法还是添加制孔剂,孔径的偏差都较小,而孔径是影响微球选择性吸附的主要因素。表 1给出了不同制备方法得到的微球的孔径和孔径偏差数据。
|
|
表 1 不同制备多孔结构微球方法的比较[20] Table 1 Comparison of different methods for preparing porous microspheres [20] |
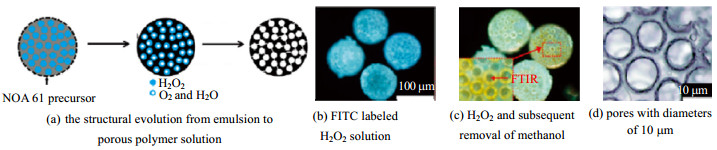
多孔微球的制备方法与核-壳型微球类似,可以使用高内向复合乳液(HIPE)体系,利用气体的挥发制作模板,如H2O2、NH4HCO3等;溶液在内相中混合,于光照条件下会分解成不溶于微球的气体,如:O2、CO2、NH3、N2等。如图 5所示,将内部含有H2O2的乳液通过UV光线照射,H2O2受热分解,产生气体并逸出,形成多孔结构。
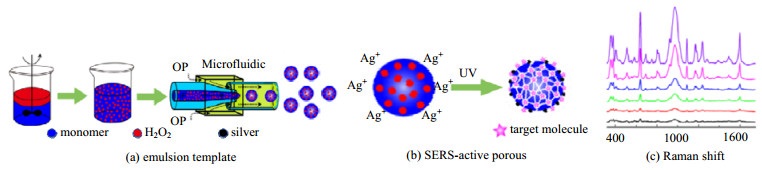
王飞[33]利用内相含有H2O2的复合乳液,外相为水相,添加黏度调节剂,在紫外灯照射下,H2O2分解出O2向外逸出,形成孔道,基于表面增强拉曼光谱技术(SERS),通过激光照射,还原接收AgNO3溶液,在多孔微球表面形成银纳米簇,从而制备出表面具有SERS活性的多孔微球,将其运用在污染物的吸附和表征。在微球制备过程中,由于气体产生的这些孔道大小不均匀且无规则,孔隙尺寸在1~100 μm,而且在光照下壳体会固化,因此需要精准控制试剂用量以及光照强度,才能保证产生的气体在固化前逸出,微球制备过程及SERS检测如图 6所示。
|
图 6 HIPE体系制备多孔微球用于SERS检测[33] Fig.6 Preparation of porous microspheres by HIPE system for SERS detection [33] |
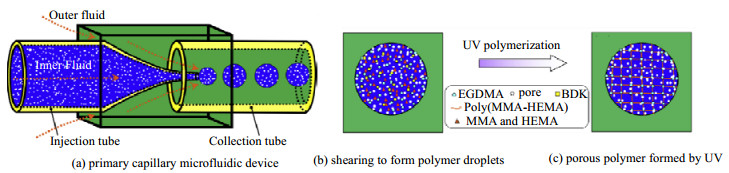
Yu等[56]利用液滴微流控装置制备了大孔的单分散聚甲基丙烯酸甲酯-羟乙基甲基丙烯酸酯(PMMA-HEMA)微球。如图 7所示,采用均相乳化法制备油包水(W/O)为内相,进入外相后,形成W1/O/W2型乳液,在自由基聚合过程中,包含了大量的微小水滴,成球后浸入水中,原本嵌入的小水滴就会松动离开,留下了均匀一致的大孔结构微球。这类微球可以大幅度提高对油的吸附能力,在油-水分离领域具有很好的应用前景。尽管在装置上采用的是简单的共轴型结构,但是在一级装置中就能做到W1/O/W2型模板,而且不必担心会有残留的杂质,更方便地控制孔径大小。
|
图 7 毛细管微流控装置制备均匀多孔聚合物 Fig.7 Preparation of homogeneous porous polymer by a capillary microfluidic device |
Wang等[57]对聚焦型的微流控装置进行了改进,气体和液体分别从两个相反的方向进行对冲进入芯片,形成了规则有序的蜂巢型多孔微球;在后续煅烧操作中,碳纤维溶液形成的微球,会自发形成无规则的孔道。Ju等[58]在自制的T型微流控装置中制备了多种尺寸可控的中空含碳无机氧化物核壳和中空微球,如图 8所示的步骤:功能性丙烯酸酯(FA)单体和正硅酸乙酯(TEOS)在水中发生聚合反应,在浓硫酸的作用下得到PFA微球和SiO2,由于静电作用,SiO2附着在微球表面,通过煅烧得到介孔率为89%的中空的SiO2微球。PFA微球与传统模板法制备的多孔微球相比,增加了中空结构,提升了吸附容量。
|
图 8 自制T型微流控装置制备多孔碳球 Fig.8 Preparation of porous carbon spheres by homemade T-type microfluidic device |
多孔微球与核壳微球制备的流程相类似,因此两者在结构上也相似。多孔微球通过物理方法或化学反应在核壳微球的基础上制备成孔。由于孔隙率较大,与核壳微球多孔微球相比,多孔微球的机械性能较差,在强度和硬度方面也不如核壳型。
3.3 各向异性微球各向异性颗粒,具有非对称的形状或不均匀的性质,在自然界中广泛存在,如生物细胞、花粉颗粒等。这类颗粒表现出不同于其他类型微球的物理化学性质,在催化剂、生物医药,示踪成像等多种领域应用广泛。各向异性颗粒的分类方法有很多,主要有Janus型颗粒(Janus particle) [56]、patchy型颗粒(patchy particle) [57]、多组分颗粒(multicompartment particle) [58],如图 9所示,可以衍生出8种类型[59]。其中Janus颗粒,是以双面罗马神命名,具有严格的双相对称几何结构,拥有不同的成分和特性,大量运用在无机物、有机物材料中。patchy型颗粒能够精确控制且排布粒子之间的相对位置,具有高度自序的自组装功能,因此有着多种分类,如链状、螺旋状等[60]。而multicompartment颗粒,是一种多相分离的核壳结构,一般由亲水性外壳以及疏水性不同的内核构成,不同组分在结构上是独立的,但是相邻组分具有协同作用,表现出高度的功能性,被广泛应用于催化[61]等领域。
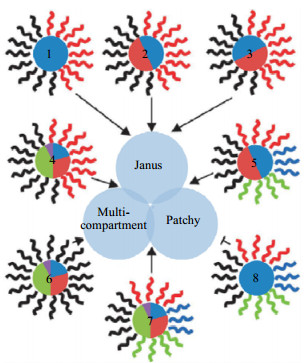
|
图 9 不同组合下的各向异性颗粒结构示意图[59] Fig.9 Schematic diagram of anisotropic particle structure in different combinations [59] |
非球形颗粒是一种典型的各向异性颗粒,利用液滴微流控装置制备非球形颗粒需要改变流体通道的形貌或者是改变分散相黏度来调节颗粒的最终形状,对形貌加以约束,可以制备出椭球状、棒状等颗粒[62-63]。模板聚合法[64-65]、机械拉伸法[66-67]、激光3D直写法[68]也可以制备各向异性微球,但是传统制备方法在粒径精度控制方面略显不足。
Shang等[69]在2013年首次采用玻璃毛细管装置制备并研究了SiO2磁性纳米颗粒,一面是光子晶体,一面是磁性半球的Janus颗粒,光子晶体可以在扫描电镜下观察,而磁性半球可以在磁场的诱导下运动,这类微球具有重要的实用价值,在流场、磁场内可观察并捕捉其运动轨迹。Sanchez[70]利用Janus颗粒的成像和活细胞跟踪技术,通过Janus探针模拟在人体内所表现出的平移和旋转,研究细胞与粒子之间的吞噬、扩散等复杂的相互作用。另外,可以通过改变外部磁场控制具备磁性的Janus颗粒的方向和位置,可以应用于磁共振成像和药物传递,对细胞生物学的基础研究具有重要意义。
邱阳[71]提出了以渗透压原理及聚合层类膜通道为基础的制备方法,首次合成了具有指针状的各向异性颗粒。如图 10所示,偏心状态下的液滴,在UV照射下,微球发生链式聚合反应,形成网络,造成微球内部与外部孔隙率的差异,构成类膜通道。在接受相与内相不同浓度差下,内核发生扩散并依据浓度差的大小发“迁移”,形成视觉上的指针状,在内相中添加磁性材料如Fe3O4微小颗粒后,颗粒具备了定性且十分直观的指向性功能。
|
图 10 指针型颗粒的形成机理 Fig.10 Formation mechanism of pointer type particles |
Ghosh等[72]基于液滴微流控的合成方法,制备了雪人形状的Janus水凝胶颗粒。对PDMS板材进行表面改性处理,内相N-异丙基丙烯酰胺(NIPAM)溶液与油相在连接处发生剪切,分裂成均匀的液滴后进行部分蒸发处理;由于水相与油相的界面张力和化学性质不同,液滴变形为诺尔曼型Janus颗粒;在UV照射下,以布朗运动为主而非沉降作用完成交联,具有高热反应性和自组装特性。由于具有双各向异性,这些粒子可以作为凝胶形成模拟胶体系统。如图 11所示。
|
图 11 雪人状Janus颗粒的微流控装置以及蒸发后的光聚合演化过程 Fig.11 Schematic diagram of the microfluidic device for yeti-like Janus particles and the photopolymerization evolution process after evaporation |
Wu等[73]基于液滴微流控装置制备了具有花生形状的各向异性颗粒结合磁性粒子,实现了对应的旋转,为特殊磁性载体提供了新的思路。吴子谦[74]通过观察蜘蛛丝上纺锤状隆起的生物现象,利用微流控装置制备了有仿生价值的纺锤状石墨烯纤维,在水环境中实现了对油类物质的吸附和聚集。
通常而言,制备各向异性微球至少需2个分散相:当这2个分散相在微通道内发生混合,没有清晰的对称性时,所制备的颗粒只是一个普通的均质球,因此有学者在通道中再增加一个通道来隔离2个分散相保持对称性。进入共用通道的2个分散相在相同流速下应具备同样的黏度,以避免因黏度不均匀造成颗粒成球失败;当2个分散相不相溶时,由于液-液的界面张力,就有可能出现3种形态[75]:完全吞噬(核壳型)、部分吞噬(Janus)和没有吞噬(2个单独的液滴),而这3种形态会发生相互转换,所以要在适当时机通过光聚合等手段固化颗粒,锁住分散相。
4 总结与展望本文综述了传统方法在制备功能型微球技术方面的缺陷与瓶颈,突出液滴微流控技术的便利与优势,总结了液滴微流控技术制备核壳型微球、多孔结构微球和各向异性微球的装置和方法、微球的结构、功能和应用等。液滴微流控技术与医药、生物、化学、机械、物理等学科不断地深入结合,也促进了液滴微流控技术的蓬勃发展。
然而,微流控技术依然存在许多不足。首先,实验环境较为苛刻,难以批量化生产;其次,对于成球材料物性的要求非常严格,限制了微球结构和功能的多样化;再次,功能性微球在投入到检测、吸附、细胞培养等实验或应用后,回收再利用难度较大;最后,多相流体在微流控装置中运动和传质机理尚不明确。如何实现对微球孔道尺寸的控制,使其拥有封装多种活性材料的能力,是未来微流控技术研究的主要方向。
| [1] |
LI X, WEI Y, MA G H, et al. Recent research and development prospects for sustained-release microspheres[J]. Journal of Beijing University of Chemical Technonlogy, 2017, 44(6): 1-11. |
| [2] |
THANONCHAT I, YAOWALAK S, PRASONG S, et al. Genipin-cross-linked silk fibroin microspheres prepared by the simple water-in-oil emulsion solvent diffusion method[J]. Powder Technology, 2010, 203(3): 603-608. DOI:10.1016/j.powtec.2010.06.027 |
| [3] |
ZHANG Q, HAN Y, WANG W C, et al. Preparation of fluorescent polystyrene micropheres by grad-ual solvent evaporation method[J]. European Polymer Journal, 2009, 45(2): 550-556. |
| [4] |
SKEGGS L T. An automatic method for colorimetric analysis[J]. American Journal of Clinical Pathology, 1957, 27(8): 311-322. |
| [5] |
XIA Y, WHITESIDES G M. Soft lithography[J]. Encyclopedia of Nanotechnology, 1998, 37(5): 153-184. |
| [6] |
THORSEN T, ROBERTS R W, ARNOLD F H, et al. Dynamic pattern formation in a vesicle-generating microfluidic device[J]. Physical Review Letters, 2001, 86(18): 4163-4166. DOI:10.1103/PhysRevLett.86.4163 |
| [7] |
UTADA A S, LORENCEAU E, LINK D R, et al. Monodisperse double emulsions generated from a microcapillary device[J]. Science, 2005, 308(5721): 537-541. DOI:10.1126/science.1109164 |
| [8] |
TEH S Y, LIN R, HUNG L H, et al. Droplet microfluidics[J]. Lab on a Chip, 2008, 8(2): 198-220. |
| [9] |
WANG J T, WANG J, HAN J J. Fabrication of advanced particles and particle-based materials assisted by droplet-based microfluidics[J]. Small, 2011, 7(13): 1728-1754. DOI:10.1002/smll.201001913 |
| [10] |
邱阳, 陈建琦, 徐银香, 等. 复杂结构核-壳微颗粒的微流控制备方法[J]. 华东理工大学学报, 2015, 41(1): 103-110. QIU Y, CHEN J Q, XU Y X, et al. Preparation method of microflow control for complex core-shell microparticles[J]. Journal of East China University of Science and Technology, 2015, 41(1): 103-110. |
| [11] |
STUDART A R, STUDER J, XU L, et al. Hierarchical porous material made by drying complex suspensions[J]. Langmuir, 2011, 27(3): 955-964. |
| [12] |
HU J, ZHOU S, SUN Y, et al. Fabrication, properties and applications of Janus particles[J]. Chemical Society Reviews, 2012, 41(11): 4356-4378. DOI:10.1039/c2cs35032g |
| [13] |
ZOU X, ZHAO X, YE L, et al. Preparation and drug release behavior of pH-responsive bovine serum albumin-loaded chitosan microspheres[J]. Journal of Industrial and Engineering Chemistry, 2015, 21(25): 1389-1397. |
| [14] |
VIVALDO-LIMA E, WOOD P E, HAMIELEC A E, et al. An updated review on suspension polymerization[J]. Industrial & Engineering Chemistry Research, 1997, 36(4): 939-965. |
| [15] |
GOKMEN M T, DU PREZ F E. Porous polymer particles-a comprehensive guide to synthesis, characterization, functionalization and application[J]. Progress in Polymer Science, 2012, 37(3): 365-405. DOI:10.1016/j.progpolymsci.2011.07.006 |
| [16] |
阮驰, 孙传东. 水流场PIV测试系统示踪粒子特性研究[J]. 实验流体力学, 2006(2): 72-77. RUAN C, SUN C D. Study on the characteristics of tracer particles in PIV test system of water flow field[J]. Experimental Fluid Mechanics, 2006(2): 72-77. |
| [17] |
马欢. 冷冻干燥法制备Li2O氚增殖剂陶瓷小球[J]. 强激光与粒子束, 2018, 30(11): 1-4. MA H. Preparation of Li2O tritium breeder ceramic pellets by freeze-drying[J]. High Power Laser and Particle Beams, 2018, 30(11): 1-4. |
| [18] |
NIE Z, XU S, SEO M, et al. Polymer particles with various shapes and morphologies produced in continuous microfluidic reactors[J]. Journal of the American Chemical Society, 2005, 127(22): 8058-8063. DOI:10.1021/ja042494w |
| [19] |
SEO M, NIE Z, XU S, et al. Continuous microfluidic reactors for polymer particles[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2005, 21(25): 11614-11622. |
| [20] |
WANG B J, PEPIJN P, WANG H Z, et al. Macroporous materials: Microfluidic fabrication, functionalization and applications[J]. Chemical Society Reviews, 2017, 46(3): 855-914. DOI:10.1039/C5CS00065C |
| [21] |
UTADA A S, CHU L Y, FERNANDEZ-NIEVES A, et al. Dripping, jetting, drops, and wetting: The magic of microfluidics[J]. MRS Bulletin, 2007, 32(9): 702-708. DOI:10.1557/mrs2007.145 |
| [22] |
TUMARKIN E, KUMACHEVA E. ChemInform abstract: Microfluidic generation of microgels from synthetic and natural polymers[J]. Chemical Society Reviews, 2009, 38(8): 2161-2168. DOI:10.1039/b809915b |
| [23] |
TAN W H, TAKEUCHI S. Monodisperse alginate hydrogel microbeads for cell encapsulation & dagger[J]. Advanced Materials, 2007, 19(18): 2696-2701. DOI:10.1002/adma.200700433 |
| [24] |
XU Q, HASHIMOTO M, DANG T T, et al. Preparation of monodisperse biodegradable polymer microparticlesusing a microfluidic flow-focusing device for controlled drug delivery[J]. Small, 2009, 5(13): 1575-1581. DOI:10.1002/smll.200801855 |
| [25] |
ZHANG S B, YAN H L, GENG Y H, et al. Equilibrium morphology of gas-liquid Janus droplets: A numerical analysis of buoyancy effect[J]. Chinese Jounal of Chemical Engineering, 2018, 26(10): 2121-2126. DOI:10.1016/j.cjche.2018.06.007 |
| [26] |
WANG W T, CHEN R, XU J H, et al. One-step microfluidic production of gas-in-water-in-oil multi-cores double emulsions[J]. Chemical Engineering Journal, 2015, 263(1): 412-418. |
| [27] |
BAI Z P, WANG B, CHEN H W, et al. Spatial wettability patterning of glass micro chips for water-in-oil-water(W/O/W)double emulsion preparation[J]. Sensors and Actuators B: Chemical, 2015, 215(1): 330-336. |
| [28] |
CHU L Y, UTADA A S, SHAH R K, et al. Controllable monodisperse multiple emulsions[J]. Angenwandte Chemie-International Edition, 2007, 46(47): 8970-8974. DOI:10.1002/anie.200701358 |
| [29] |
NISISAKO T, TORⅡ T, TAKAHASHI T, et al. Synthesis of monodispersebicolored Janus particles with electrical anisotropy using a microfluidicco-flow system[J]. Advanced Materials, 2006, 18(9): 1152-1156. DOI:10.1002/adma.200502431 |
| [30] |
LIU L, YANG J P, JU X J, et al. Monodispersecore-shell chitosan microcapsules for pH-responsive burst release ofhydrophobic drugs[J]. Soft Matter, 2011, 7(10): 4821-4827. DOI:10.1039/c0sm01393e |
| [31] |
KIM S W, HWANGBO K H, LEE J H, et al. Microfluidic fabrication ofmicroparticles with multiple structures from a biodegradable polymerblend[J]. RSC Advances, 2014, 4(87): 46536-46540. DOI:10.1039/C4RA05864J |
| [32] |
KUNAHWANG D. Microfluidic-based synthesis of non-spherical magnetic hydrogel microparticles[J]. Lab on a Chip, 2008, 8(10): 1640-1647. DOI:10.1039/b805176c |
| [33] |
王飞.废水中细颗粒物过滤去除机理研究及应用[D].上海: 华东理工大学, 2016. WANG F. Research and application of filtration and removal mechanism of fine particulate matter in wastewater[D]. Shanghai: East China University of Science and Technology, 2016. |
| [34] |
WANG B J, BAI Z S, JIANG H R, et al. Selective heavy mental removal and water purification by microfluidically-generated chitosan microspheres: Characteristics, modeling and application[J]. Journal of Hazardous Materials, 2019, 364(4): 192-205. |
| [35] |
YU Z, ZHENG Y, PARKER R M, et al. Microfluidic droplet-facilitated hierarchical assembly for dual cargo loading and synergistic delivery[J]. ACS Applied Materials & Interfaces, 2016, 8(13): 8811-8820. |
| [36] |
GARCIA J, GREENWAY G M, HARDEGE J D, et al. A prototype microfluidic chip using fluorescent yeast for detection of toxic compounds[J]. Biosensors and Bioelectronics, 2009, 24(5): 1508-1511. DOI:10.1016/j.bios.2008.07.074 |
| [37] |
FAN J, LI Y, BISOYI H K, et al. Light-directing omnidirectional circularly polarized reflection from liquid-crystal droplets[J]. Angenwandete Chemie-International Edition, 2015, 54(7): 2160-2164. DOI:10.1002/anie.201410788 |
| [38] |
SHAH R K, KIM J W, AGRESTI J J, et al. Fabrication ofmonodisperse thermosensitive microgels and gel capsules in microfluidicdevices[J]. Soft Matter, 2008, 4(12): 2303-2309. DOI:10.1039/b808653m |
| [39] |
SHANG L, SHANGGUAN F, CHENG Y, et al. Microfluidic generation of magneto responsive Janus photonic crystal particles[J]. Nanoscale, 2013, 5(20): 9553-9557. DOI:10.1039/c3nr03218c |
| [40] |
GONG X Q, PENG S L, WEN W J, et al. Design and fabrication of magnetically functionalized core/shell microspheres for smart drug delivery[J]. Advanced Functional Materials, 2009, 19(2): 292-297. DOI:10.1002/adfm.200801315 |
| [41] |
王號元, 邓朝俊, 王翰霖, 等. 共轴流水包油型微液滴形成过程的实验与数值模拟研究[J]. 高校化学工程学报, 2017, 31(2): 291-298. WANG H Y, DENG C J, WANG H L, et al. Experimental and numerical investigation of oil-in-water micro-droplet formation in a co- Flowing System[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(2): 291-298. |
| [42] |
NORHAYATI A, MOHAMMAD Z Y, RABIATULADAWIAH M. Synthesis and characterization of poly(HEMA-co-EGDMA-co-VBC) by modified suspension polymerization: Effects of polymerization parameters reaction on chemical and thermal properties of polymer[J]. Materials Today, 2018, 5(10): 22010-22019. |
| [43] |
GONG X, PENG S, WEN W, et al. Design and fabrication of magnetically functionalized core/shell microspheres for smart drug delivery[J]. Advanced Functional Materials, 2009, 19(2): 292-297. DOI:10.1002/adfm.200801315 |
| [44] |
YANG C H, WANG C Y, HUANG K S, et al. Microfluidic one-step synthesis of Fe3O4-chitosan composite particles and their applications[J]. Internation Journal of Pharmacentics, 2014, 463(2): 155-160. |
| [45] |
VERICELLA J J, SARAH E, JOSHUAH K, et al. Encapsulated liquid sorbents for carbon dioxide capture[J]. Nature Communications, 2015, 6(1): 24-31. |
| [46] |
LIU W, ZHAO Y J, ZENG C F, et al. Microfluidic preparation of yolk/shell ZIF-8/alginate hybrid microcapsules from Pickering emulsion[J]. Chemical Engineering Journal, 2017, 307(1): 408-417. |
| [47] |
WANG B J, ZHU Y, BAI Z S, et al. Functionalized chitosan biosorbents with ultra-high performance, mechanical strength and tunable selectivity for heavy metals in wastewater treatment[J]. Chemical Engineering Journal, 2017, 325(19): 350-359. |
| [48] |
OKAY O. Macroporous copolymer networks[J]. Progress in Polymer Science, 2000, 25(6): 711-779. DOI:10.1016/S0079-6700(00)00015-0 |
| [49] |
GOKMEN M T, DU PREZ F E. Porous polymer particles-A comprehensive guide to synthesis, characterization, functionalization and applications[J]. Progress in Polymer Science, 2012, 37(3): 365-405. DOI:10.1016/j.progpolymsci.2011.07.006 |
| [50] |
DOWDING P J, VINCENT B, DOWDING P J, et al. Suspension polymerization to form polymer beads[J]. Colloids Surf A: Physicochemical and Engineering Aspects, 2000, 161(2): 259-269. DOI:10.1016/S0927-7757(99)00375-1 |
| [51] |
HAGINKAK J. Monodispersed, molecularly imprinted polymers as affinity-based chromatography media[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Science, 2008, 866(1/2): 3-13. |
| [52] |
VLADISAVLEJVICx G T, WILLIAMS R A. Recent developments in manufacturing emulsions and particulate products using membranes[J]. Advances in Colloid and Interface Science, 2005, 113(1): 1-20. |
| [53] |
ZHANG H, JU X J, XIE R, et al. A microfluidic approach fabricate monodisperse hollow or porous poly(HEMA-MMA) microspheres using single emulsions as templates[J]. Journal of Colloid and Interface Science, 2009, 336(1): 235-243. DOI:10.1016/j.jcis.2009.03.070 |
| [54] |
OH J K, DRUMRIGHT R, SIEGWART D J, et al. The development of microgels/nanogels for drug delivery applications[J]. Progress in Polymer Science, 2008, 33(4): 448-477. DOI:10.1016/j.progpolymsci.2008.01.002 |
| [55] |
GONG X, WEN W, SHENG P. Microfluidic fabrication of porous polymer microspheres: Dual reactions in single droplets[J]. Langmuir, 2009, 25(12): 7072-7077. DOI:10.1021/la900120c |
| [56] |
YU Y L, ZHAO M X, Gao X R, et al. Monodisperse microporous microspheres prepared by microfluidic methods and their oil adsorption performance[J]. Colloids and Surface A, 2019, 579(20): 172-181. |
| [57] |
WANG C C, YANG K C, LIN K H, et al. A biomimetic honeycomb-like scaffold prepared by flow-focusing technology for cartilage regeneration[J]. Biotechnology and Bioengineering, 2014, 111(11): 2338-2348. DOI:10.1002/bit.25295 |
| [58] |
JU M H, LI Y P, WANG C Q, et al. Preparation of size-controllable monodispersed carbon@silica core-shell microspheres and hollow silica microspheres[J]. Microporous and Mesoporous Materials, 2017, 247(1): 75-85. |
| [59] |
WURM F, KILBINGER A F M. Polymeric janus particles[J]. Angewandte Chemie International Edition, 2009, 48(45): 8412-8421. DOI:10.1002/anie.200901735 |
| [60] |
PAWAR A B, KRETZSCHMAR I. Fabrication, assembly, and application of patchy particles[J]. Macromolecular Rapid Communications, 2010, 31(2): 150-168. DOI:10.1002/marc.200900614 |
| [61] |
LUTZ J F, LASCHEWSKY A. Multicompartment Micelles: Has the long‐standing dream become a reality?[J]. Macromolecular Chemistry and Physics, 2005, 206(8): 813-817. DOI:10.1002/macp.200500067 |
| [62] |
DU J Z, RACHEL K O. Anisotropic particles with patchy, multicompartment and Janus architectures: Preparation and application[J]. Chemical Society Review, 2011, 40(5): 2402-2418. DOI:10.1039/c0cs00216j |
| [63] |
ZHANG Z L, GLOTZER S C. Self-assembly of patchy particles[J]. Nano Letters, 2004, 4(8): 1407-1413. DOI:10.1021/nl0493500 |
| [64] |
DANIEL M C, ASTRUC D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology[J]. Chemical Reviews, 2004, 104(1): 293-346. DOI:10.1021/cr030698+ |
| [65] |
ROLLAND J P, MAYNOR B W, EULISS L E, et al. Direct fabrication and harvesting of monodisperse, shape-specific nanobiomaterials[J]. Journal of the American Chemical Society, 2005, 127(28): 10096-10100. DOI:10.1021/ja051977c |
| [66] |
CRASSOUS J J, DIETSCH H, PFLEIDERER P, et al. Preparation and characterization of ellipsoidal-shaped thermosensitive microgel colloids with tailored aspect ratios[J]. Soft Matter, 2012, 8(13): 3538-3548. |
| [67] |
CRASSOUS J J, MIHUT A M, MANSSON L K, et al. Anisotropic responsive microgels with tuneable shape and interactions[J]. Nanoscale, 2015, 7(38): 15971-15982. DOI:10.1039/C5NR03827H |
| [68] |
PEYER K E, ZHANG L, NELSON B J. Bio-inspired magnetic swimming microrobots for biomedical applications[J]. Nanoscale, 2013, 5(4): 1259-1272. DOI:10.1039/C2NR32554C |
| [69] |
SHANG L, SHANGGUAN F, CHENG Y, et al. Microfluidic generation of magneto responsive Janus photonic crystal particles[J]. Nanoscale, 2013, 5(20): 9553-9557. DOI:10.1039/c3nr03218c |
| [70] |
SANCHEZ L, PATTON P, ANTHONY S M, et al. Tracking single-particle rotation during macrophage uptake[J]. Soft Matter, 2015, 11(26): 5346-5352. DOI:10.1039/C5SM00893J |
| [71] |
邱阳.指针形与patchy-porous型各向异性颗粒的制备、表征及调控[D].上海: 华东理工大学, 2015. QIU Y. Preparation, characterization and regulation of por ous and patchy anisotropic granules[D]. Shanghai: East China University of Science and Technology, 2015. |
| [72] |
GHOSH S, PETER S. Microfluidic production of snowman-shaped Janus hydrogel particles[J]. Colloids and Surface A, 2019, 573(14): 205-210. |
| [73] |
WU Z Q, YU Y R, ZOU M H, et al. Peanut-inspired anisotropic microparticles from microfluidics[J]. Composites Communicati ons, 2018, 10: 129-135. |
| [74] |
吴子谦.微流控制备各向异性微载体研究[D].南京: 东南大学, 2018. WU Z Q. Microfluidic control is studied for anisotropic microcarriers[D]. Nanjing: Southeast University, 2018. |
| [75] |
TAKASI N, TAKESHI H. Microfluidic fabrication of oil-filled polymeric microcapsules with independently controllable size and shell thickness via Janus to core–shell evolution of biphasic droplets[J]. Sensors and Actuators B: Chemical, 2016, 223(1): 209-216. |