美拉德反应指的是含氨基的化合物与含羰基的化合物之间发生的复杂化学反应[1],由初级阶段、中间阶段以及后期阶段3个阶段构成[2],初始阶段反应体系的还原力显著提高,体系中蛋白质/肽的乳化、凝胶特性以及溶解性等功能性质会得到明显提高[3]。因此通过美拉德反应改善多糖和蛋白质/肽类物质功能特性[4]与生物活性的研究越来越受到人们的关注。
燕麦β-葡聚糖(oat β-glucan,OG)具有多种生理保健功能,如降低血脂、降低血糖、调节肠道菌群等,同时作为一种高分子糖类,又具有一定的乳化性。但是在食品医药等领域的应用,常因乳化性不够而受到限制。大豆分离蛋白(soybean protein isolate,SPI)来源广泛,价格低廉,具有较高的营养价值,但因溶解性、乳化性以及起泡性等功能性质在各个领域的使用具有一定的局限性,因此需要对蛋白进行改性提高蛋白的加工特性。
文献中关于OG的美拉德反应研究极为罕见。徐宏蕾[5]研究了OG分别与L-谷氨酰胺、力肽(L-丙氨酰-L-谷胺酰胺)和L-谷胱甘肽之间的美拉德反应,由于肽链太短,且亲水性强,所以乳化性的提高不显著,乳化活性和乳化稳定性仅提高了20% 左右。从结构来看,OG与其他葡聚糖相比又具有自身的特殊性,例如酵母β-葡聚糖由β-1, 3键构成的直链结构,溶解性差,OG由β-1, 3和β-1, 4键构成,溶解性相对较好,应用范围更广。文献中关于SPI的美拉德反应研究相对多一些,研究涉及SPI分别与木糖、果糖、半乳糖等发生美拉德反应后,乳化分散性及溶解性等有不同程度的提高。何婉莹等[6]利用葡聚糖与SPI进行反应,得到的美拉德反应产物(Maillard reaction productions,MRPs)与SPI相比,溶解度提高了40.48%,乳化活性和乳化稳定性分别提高了69.76% 和62.11%。Li等[7]采用湿法美拉德反应制备SPI和葡萄糖的复合物,发现美拉德反应能够显著提高SPI的表面性能,包括乳化性能和发泡性能,乳化活性的吸光度和乳化稳定性最大为0.6和23.5 min。
鉴此,本研究着重研究OG和SPI的美拉德反应,包括反应条件的优化、产物结构的表征及性能测试,这一研究为拓宽燕麦β-葡聚糖和SPI的生产化应用提供了理论基础。
2 实验材料与方法 2.1 原料和主要试剂原料:大豆分离蛋白(质量分数≥95%),江苏富盛德生物工程有限公司;燕麦β-葡聚糖(质量分数≥85%),青岛凤飞生物科技有限公司。
主要试剂(所用到的试剂均为分析纯):牛血清蛋白,北京百灵威科技有限公司;SDS-PAGE凝胶制备试剂盒,北京索莱宝科技有限公司;四硼酸钠,天津市登峰化学试剂厂;考马斯亮蓝G-250,合肥千胜生物科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS),合肥巴斯夫生物科技有限公司;甲醇、β-巯基乙醇、邻苯二甲醛(o-phthalaldehyde,OPA),上海易恩化学技术有限公司;金龙鱼油,秦皇岛金海食品工业有限公司。
2.2 主要仪器设备DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;FD-1A-50真空冷冻干燥机,北京博医康实验仪器有限公司;752型紫外分光光度计,上海光谱仪器有限公司;F-4600荧光分光光度计,日本Hitachi公司;H1650高速台式离心机,长沙湘仪离心机仪器有限公司;FS-1可调高速匀浆机,方科仪器有限公司;CR400色差仪,日本柯尼卡美能达公司。
2.3 实验方法 2.3.1 湿法制备OG─SPI复合物单因素试验 2.3.1.1 时间对美拉德反应的影响反应时间分别为60、80、100、120、140 min。称取1 g SPI溶于100 mL去离子水中,磁力搅拌30 min,按照OG与SPI的质量比为1:1称取OG溶于水中,用0.1 mol⋅L−1盐酸调节pH至7.5,4 ℃冰箱中水合过夜。设置水浴锅温度为35 ℃,搅拌2.5 h,调节温度至85 ℃,反应一定时间结束后立即冰浴5 min,将样品冻干保存。
2.3.1.2 温度对美拉德反应的影响反应温度分别为80、85、90、95、100 ℃。称取1 g SPI溶于100 mL去离子水中,磁力搅拌30 min,按照OG与SPI的质量比为1:1称取OG溶于水中,用0.1 mol⋅L−1盐酸调节pH至7.5,4 ℃冰箱中水合过夜。设置水浴锅温度为35 ℃,搅拌2.5 h,调节至一定温度,反应100 min后立即冰浴5 min,样品冻干保存。
2.3.1.3 pH对美拉德反应的影响反应pH分别为7、7.5、8、8.5、9、10、11。称取1 g SPI溶于100 mL去离子水中,磁力搅拌30 min,按照OG与SPI的质量比为1:1称取OG溶于水中,用0.1 mol⋅L−1盐酸调节至一定pH,4 ℃冰箱中水合过夜。设置水浴锅温度为35 ℃,搅拌2.5 h,调节温度为至85 ℃,反应100 min后立即冰浴5 min,将样品冻干保存。
2.3.1.4 质量比对美拉德反应的影响SPI与OG的质量比分别为3:1、2:1、1:1、1:1.2、1:1.5、1:2以及1:3,称取1 g SPI溶于100 mL去离子水中,按照一定质量比称取OG溶于水中,用0.1 mol⋅L−1盐酸调节pH至7.5,4 ℃冰箱中水合过夜。设置水浴锅温度为35 ℃,搅拌2.5 h,调节温度至85 ℃,反应100 min后立即冰浴5 min,将样品冻干保存。
在后续实验中,采用最佳工艺条件制备MRPs并对单一的SPI和OG分别做相同的处理,未处理的SPI与OG的混合物记作混合物1;经处理后再次混合的SPI与OG记作混合物2。
2.3.2 OG─SPI复合物相关指标的测定 2.3.2.1 接枝度的测定OPA(邻苯二甲醛)试剂现配现用。称取一定量样品溶于去离子水中,6 000 r⋅min−1离心20 min,取上清200 µL加到4 mL OPA试剂中,35 ℃下避光反应2 min,在340 nm下测定吸光度值A,空白组中加入200 µL去离子水,计算接枝度(因接枝度计算的是比值,吸光度可反映蛋白中游离氨基酸的质量分数,因此利用吸光度的比值计算接枝度)[8]的公式如下:
| $ 接枝度=\frac{{A}_{\text{0}}-{A}_{\text{1}}}{{A}_{\text{0}}}\times 100\% $ | (1) |
式中:A0为未反应时的吸光度值,L⋅(g⋅cm)−1;A1为反应后的吸光度值,L⋅(g⋅cm) −1。
2.3.2.2 色差的测定用色差仪测定。称取0.1 g美拉德产物溶于10 mL去离子水中,6 000 r⋅min−1离心20 min,取上清液置于玻璃比色皿中测定色度值L、a、b(L为亮度,a为红度,b为黄度)[9],选择色度值L进行绘图。
2.3.2.3 溶解性的测定采用牛血清蛋白绘制标准曲线,得到标准方程y=0.006 5x+0.102 6,相关系数R2=0.999 9。称取适量样品溶解,离心后取上清液1 mL加入5 mL考马斯亮蓝G-250,空白组以去离子水代替样品溶液,避光反应3 min,在595 nm处测吸光度,计算蛋白浓度。
2.3.2.4 乳化特性的测定称取各样品0.1 g溶解在10 mL pH=7的磷酸缓冲液(0.1 mol⋅L−1)中,将样品溶液与金龙鱼油按3:1的质量比于50 mL离心管中进行混合,在12 000 r⋅min−1下匀浆1 min,从乳液底部迅速吸取50 µL于5 mL质量分数为0.1% SDS溶液中,以SDS溶液作空白,在500 nm下测定吸光度A0[10]。静置10 min,重复上述方法,测定10 min后的吸光度值A10。计算公式如下[7]:
| $ 乳化活性{\text{(m}}^{\text{2}}\cdot {\text{g}}^{-\text{1}}\text{)}=\frac{\text{2}\times \text{2}\text{.303}\times N\times {A}_{\text{0}}}{{\rho }_\text{B}\times {\varphi }_\text{B}\times {\text{10}}^{\text{4}}} $ | (2) |
| $ 乳化稳定性\text{(}\mathrm{min})=\frac{{A}_{\text{0}}}{{A}_{\text{0}}-{A}_{\text{10}}}\times t $ | (3) |
式中:N为稀释倍数,本实验中稀释100倍;ρB为样品质量浓度,g⋅mL−1;φB为金龙鱼油的体积分数,%;t为静置时间,min。
2.3.2.5 起泡特性的测定称取一定量样品搅拌溶解,蛋白质量分数为0.1%,取V=20 mL样品溶液至50 mL离心管中,在12 000 r⋅min−1下匀浆1 min,立刻测量离心管内液体和泡沫总容积V0(mL)。静置30 min后再次记录总容积V30[11]。计算公式如下:
| $ 起泡能力=\frac{{V}_{\text{0}}-V}{V}\times 100\text{%} $ | (4) |
| $ 起泡稳定性=\frac{{V}_{\text{30}}-V}{{V}_{\text{0}}-V}\times 100\text{%} $ | (5) |
配制蛋白质量分数为0.1% 的样品溶液,与稀释4倍的上样缓冲液混合,98 ℃金属浴10 min。采用质量分数为12% 的分离胶和质量分数为5% 的浓缩胶,Marker上样量为5 µL,样品溶液上样量为10 µL。起始电压为80 V,样品进入分离胶后将电压升至120 V,跑胶结束后取出,用考马斯亮蓝R-250染色,然后进行脱色,脱色结束后即可观察电泳条带。
2.3.2.7 傅里叶红外光谱的测定称取适量的样品放入研磨钵中,再加入KBr混合,研磨成粉末后压成薄片,用傅里叶红外光谱仪测定500~4 000 cm−1内的吸收光谱。
2.3.2.8 内源荧光光谱的测定用50 m⋅mol⋅L−1磷酸缓冲液(pH7.4)溶解样品,蛋白质量分数为0.1%。测定条件:激发波长为334 nm,扫描发射波长为300~400 nm,狭缝宽度均为5 nm,扫描速度为1 200 nm⋅min−1,电压为400 V[12]。
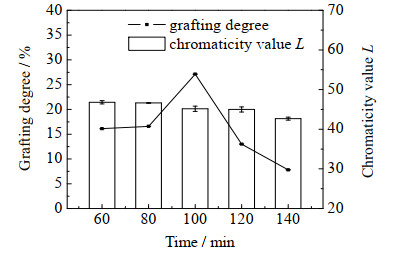
3 结果与分析 3.1 湿法制备OG─SPI复合物单因素试验 3.1.1 时间对美拉德反应的影响如图 1所示为时间对美拉德反应的影响。由图 1可以看出,在60~140 min内,接枝度随时间的延长先增大后降低。这是因为蛋白质在持续加热的过程中结构发生变化,SPI的疏水性氨基逐渐暴露出来,OG与SPI不断反应,接枝度也不断升高;反应进行到100 min后,加热时间过长,SPI的结构遭到一定程度的破坏,且美拉德反应后期复合物转化为大量类黑精,不利于OG与SPI继续反应,接枝度随之下降。色度值L随反应时间的延长不断降低,说明美拉德反应的褐变程度与时间成正比,OG与SPI生成的复合物颜色不断加深。综上,在后续实验中使用100 min作为反应时间。
|
图 1 时间对OG─SPI美拉德反应的影响 Fig.1 Effects of time on Maillard reaction of OG─SPI |
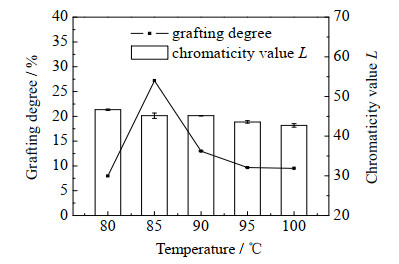
如图 2所示为温度对OG─SPI美拉德反应的影响, 从图 2中可以看出,在80~100 ℃内,接枝度先增加后下降,这是因为在一定温度内,蛋白质的溶解度增大,溶液中游离氨基的量增多,促进了OG与SPI的接枝反应;当温度高于85 ℃时,一方面是因为高温破坏了蛋白质的结构,导致反应受到限制,另一方面是由于温度越高反应越剧烈,高温下美拉德反应更快进入后期,类黑精也逐渐累积,影响OG与SPI的中间产物的合成,使得接枝度下降。对于色度值L而言,随温度的升高L值降低,说明美拉德反应越来越剧烈,颜色越来越深,但颜色总体变化不大[13],这与徐真真等[14]的研究结果一致。综上后续实验选择85 ℃为反应温度。
|
图 2 温度对OG─SPI美拉德反应的影响 Fig.2 Effects of temperature on Maillard reaction of OG─SPI |
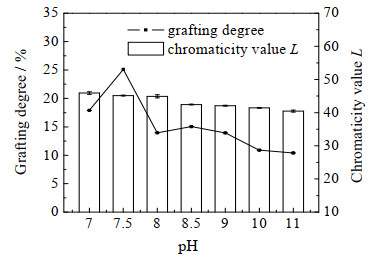
蛋白质在碱性环境下的溶解度较酸性环境下的大,有利于与多糖发生美拉德反应[15]。如图 3所示,当pH=7.5时接枝度最大,在强碱条件下有明显的下降,这是由于pH过高时,强碱环境会破坏蛋白质的一级结构,所以糖基化反应体系的碱性不能过强[8]。色度值L随pH值的升高不断降低,当pH=7.5时虽然接枝度最大,但反应后期阶段受到抑制,所以反应颜色程度没有达到峰值,随着pH的升高,OG与SPI的美拉德产物颜色加深。综上,当pH=7.5时接枝度最高,褐变程度也相对较低,后续实验中选取pH=7.5作为反应的pH。
|
图 3 pH对OG─SPI美拉德反应的影响 Fig.3 Effects of pH on Maillard reaction of OG─SPI |
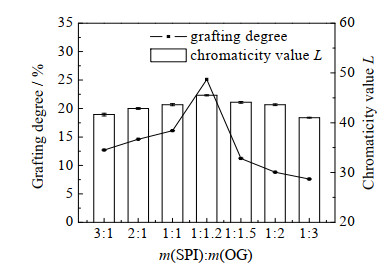
质量比对美拉德反应的影响如图 4所示。当SPI与OG的质量比m(SPI): m(OG)=1:1.2时,接枝度最高,色度值L最大,这是因为蛋白质与多糖质量比合适时使得美拉德反应没有进一步向高级阶段发生,因此褐变程度也较小;而且1:1低于1:1.2时的接枝度,可能是糖稍微过量可以在一定程度上抑制蛋白质的团聚。当质量比为1:2、1:3、2:1、1:1.5以及3:1时,接枝度较低,色度值L也较小,这是由于OG与SPI反应物过量较多,在反应物充足的情况下使得美拉德反应向更高程度进行,褐变程度较高[16]。综上,在后续实验中选取1:1.2作为反应质量比。
|
图 4 质量比对OG─SPI美拉德反应的影响 Fig.4 Effects of mass ratio on Maillard reaction of OG─SPI |
未改性的蛋白质溶解性较低,限制了其广泛使用。如图 5所示为样品的溶解性,从图 5(a)中可以看到,0时刻未改性的混合物1中SPI的溶解度相对较低,单一SPI加热后溶解性有所上升,这可能是因为在一定温度和时间内加热蛋白能促进蛋白溶解,但这二者均不如经美拉德反应后SPI的溶解性,经过改性后的SPI溶解性最高达到93.97%,这是由于SPI与OG反应,引入了亲水性羟基,其溶解性显著提高[12]。从图(b)中可知,美拉德反应后SPI等电点处溶解度从0.99% 增加到3.41%,尤其是在碱性范围内蛋白溶解度比酸性范围变化明显,pH=7时变化最大,溶解度提高到93%。上述结果表明美拉德反应能够改善蛋白质的溶解性[17-18],同时可以说明弱碱性环境下SPI溶解度高,能够与OG充分反应,更有利于美拉德反应的进行。
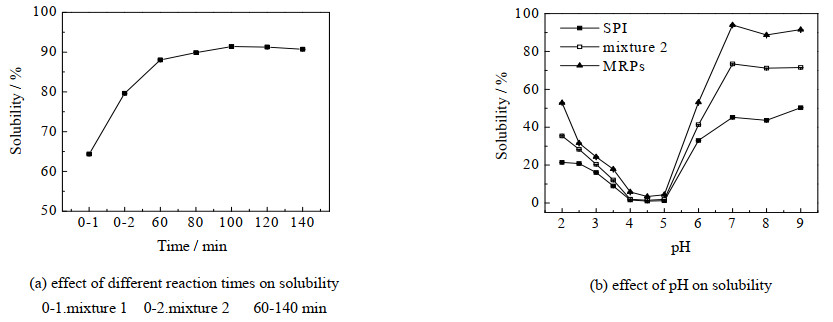
|
图 5 样品的溶解性图 Fig.5 Solubility profiles of the samples |
蛋白质经糖基化改性可以改善蛋白的乳化特性。如图 6所示为不同样品的乳化特性。从图 6中看出,OG的乳化活性很小,复合物中主要依靠SPI发挥乳化性能。与原SPI、处理后的单一SPI和混合物相比,MRPs的乳化特性有所提高,随着反应时间的延长呈现先增加后下降的趋势。其中0-60 min内MRPs的乳化特性没有明显变化,这是由于60 min的反应时间过短,游离氨基暴露较少,美拉德反应基本没有进行;60~100 min内不断增加,在100 min时乳化特性最大,乳化活性和乳化稳定性分别是38.268 m2⋅g−1和67.5 min,这比朱秀清等[19]研究结果有所提高,此时由于反应不断进行,SPI的游离氨基逐渐暴露出来,与OG反应生成更多的MRPs,乳化特性也随之提高[20],时间超过100 min后,美拉德反应持续进行,SPI与OG充分结合,变得更加亲水,界面活性下降,乳化活性和乳化稳定性就随之降低,这与王一熹等[21]的研究结果一致。
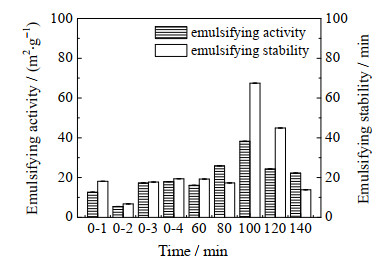
|
图 6 样品的乳化特性图 Fig.6 Emulsifying performance of the samples 0-1. treated SPI 0-2. treated OG 0-3. mixture 1 0-4. mixture 2 60-140 min. MRPs at different times |
蛋白质具有一定的起泡性[22]。如图 7所示为不同样品的起泡特性。从图 7中可以看到,OG的起泡性能很小。与未改性的SPI和混合物相比,MRPs的起泡能力随着反应的进行先增加后减小,120 min时达到最大值,略高于100 min时的起泡能力,这是因为SPI与OG发生了交联反应,糖分子的存在可以增大复合物体系的黏度,从而增强起泡能力,到后期MRPs部分生成类黑精,蛋白质的起泡能力有所降低;起泡稳定性也是先增加后减小,在80~100 min内基本没有变化,这是由于多糖的分子结构中具有大量的羟基,羟基可以增大蛋白质分子间的静电吸引力,形成的泡沫更加稳定,100~140 min起泡能力有所下降,应该是由于MRPs到后期生成类黑精导致复合物的量减少,起泡能力下降,但起泡稳定性没有太大变化。
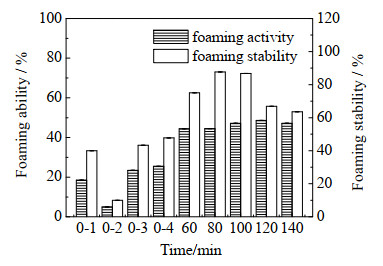
|
图 7 样品的起泡特性图 Fig.7 Foaming performance of the samples 0-1. treated SPI 0-2. treated OG 0-3. mixture 1 0-4. mixture 2 60-140 min. MRPs at different times |
SDS-PAGE电泳具有分子筛作用,蛋白质的迁移速率取决于它的相对分子质量Mw,可以反映蛋白质分子量的变化。如图 8所示,OG的条带几乎看不见,含有的极少量杂蛋白对实验未产生太大影响。在分离胶的上端,泳道6的颜色深于其他泳道,在Mw=25~100 kDa时,泳道6的颜色比泳道1、2、4、5要浅,这是由于蛋白质相对分子质量较高的物质迁移速率慢,而且小分子蛋白的量有所减少,说明有大分子聚合物的生成;同样可以验证MRPs的生成。这与朱巧梅等[23]的研究结果一致。
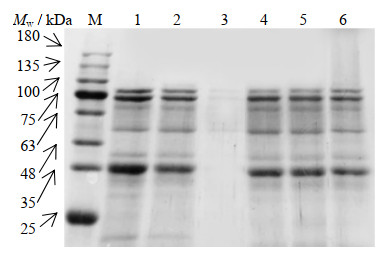
|
图 8 样品的SDS-PAGE电泳图 Fig.8 SDS-PAGE spectra of the sample M. Mark 1. SPI 2. treated SPI 3. treated OG 4. mixture 1 5. mixture 2 6. MRPs |
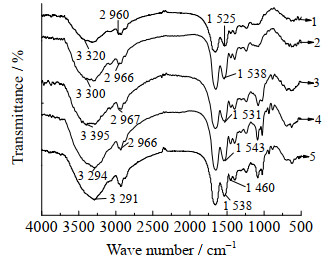
图 9为各样品的红外光谱图,从图中可以观察到官能团的振动变化情况。与其他样品相比,MRPs的吸收峰在3 200~3 700 cm−1内增强且峰稍变宽,这是由于糖链的引入使羟基的伸缩振动增加;3 300~3 500 cm−1是N─H的伸缩振动,MRPs在此范围内的峰蓝移,可能是由于SPI与OG相互作用形成了酰胺[24];2 966 cm−1处MRPs出现峰的消失;与混合物2相比较,MRPs在1 460 cm−1附近的峰变弱,说明SPI中游离氨基的量发生反应而减少。以上结论同样可以表明SPI与OG发生美拉德反应[25]。
|
图 9 样品的红外光谱图 Fig.9 FT-IR spectra of the samples 1. SPI 2. treated SPI 3. mixture 1 4. mixture 2 5. MRPs |
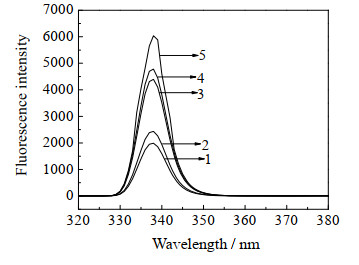
荧光物质是美拉德反应高级阶段产生的小分子物质[19],是黑色素的前体。图 10为各样品的荧光光谱图。从图 10中可以看到,SPI经加热处理后荧光强度有所提高,这可能是由于加热使蛋白质分子展开,一些发光基团暴露出来,导致荧光强度增加;与SPI以及混合物相比,MRPs的荧光强度最大,这说明SPI和OG经美拉德反应有特征荧光物质产生,进一步导致复合物荧光强度增加。综上,荧光物质的产生也能证明SPI发生了糖基化。
|
图 10 样品的内源荧光光谱图 Fig.10 Endogenous fluorescence spectra of the samples 1. mixture 1 2. SPI 3. treated SPI 4. mixture 2 5. MRPs |
OG和SPI采用湿法美拉德反应对SPI进行改性,探讨了工艺参数对反应的影响,结果表明100 min、85 ℃、pH为7.5、蛋白与多糖质量比1:1.2是糖基化反应最佳条件;通过测定改性前后SPI的溶解性、乳化特性以及起泡特性可以发现均有所提高,说明与OG发生美拉德反应能够改善SPI的功能性质。结构表征方面:SDS-PAGE凝胶电泳图可以看到MRPs的分离胶上端颜色比原SPI和混合物的泳道颜色深,在蛋白质相对分子质量处于25~100 kDa内泳道颜色最浅,表明小分子蛋白减少,生成了大分子物质;红外光谱中羟基的伸缩振动增强,内源荧光光谱分析表明有荧光小分子物质的产生,同样可以证明OG与SPI发生了美拉德反应。该研究为拓宽OG和SPI在各个领域的应用提供了理论方面的参考。
| [1] |
MASATSUNE M. Browning and pigmentation in food through the Maillard reaction[J]. Glycoconjugate Journal, 2021, 38(3): 283-292. DOI:10.1007/s10719-020-09943-x |
| [2] |
MAJID N, FERESHTEH F, ZAHRA Z, et al. Antioxidant potential and antimicrobial activity of chitosan-inulin conjugates obtained through the Maillard reaction[J]. Food Science and Biotechnology, 2019, 28(6): 1861-1869. DOI:10.1007/s10068-019-00635-3 |
| [3] |
LI N, ETZEL M R. Hydrolysis of whey protein-dextran glycates made using the Maillard reaction[J]. Foods, 2019, 8(12): 686-686. DOI:10.3390/foods8120686 |
| [4] |
MELTEM I E, MEHMET H. Effect of ultrasound pretreatment on the functional and antioxidant properties of fermented and germinated lupin protein isolates grafted with glucose[J]. Journal of the Science of Food and Agriculture, 2022, 102(2): 550-556. DOI:10.1002/jsfa.11383 |
| [5] |
徐宏蕾. 美拉德反应对燕麦β-葡聚糖的乳化性及流变性的影响研究[D]. 上海: 上海海洋大学, 2017. XU H L. Effect of Maillard reaction on emulsification and rheology of oat β-glucan [D]. Shanghai: Shanghai Ocean University, 2017. |
| [6] |
何婉莹, 李小燕, 孙晓雯, 等. 葡聚糖-大豆分离蛋白耦联接枝工艺优化及接枝产物理化特性研究[J]. 食品工业科技, 2018, 39(4): 54-59. HE W Y, LI X Y, SUN X W, et al. Optimization of grafting reaction process between soy protein isolate and dextran and research on physicochemical properties of conjugates[J]. Science and Technology of Food Industry, 2018, 39(4): 54-59. |
| [7] |
LI R, CUI Q, WANG G R, et al. Relationship between surface functional properties and flexibility of soy protein isolate-glucose conjugates[J]. Food Hydrocolloids, 2019, 95: 349-357. DOI:10.1016/j.foodhyd.2019.04.030 |
| [8] |
李灵诚. 大米蛋白糖基化接枝产物的制备及理化与功能特性研究[D]. 南宁: 广西大学, 2020. LI L C. Study on the preparation, physicochemical and functional characteristics of glycosylated graft products of rice protein [D]. Nanning: Guangxi University, 2020. |
| [9] |
SUN Y F, LIN L, ZHANG P Y. Color development kinetics of Maillard reactions[J]. Industrial & Engineering Chemistry Research, 2021, 60(9): 3495-3501. |
| [10] |
MENGIBAR M, MIRALLES B, HERAS á. Use of soluble chitosan in Maillard reaction products with β-lactoglobulin. Emulsifying and antioxidant properties[J]. LWT - Food Science and Technology, 2017, 75: 440-446. DOI:10.1016/j.lwt.2016.09.016 |
| [11] |
徐晶, 刘晓兰, 郑喜群. 玉米谷蛋白的美拉德糖基化改性[J]. 食品科技, 2016, 41(7): 244-250. XU J, LIU X L, ZHENG X Q. Maillard glycosylation modification of corn gluten[J]. Food Science and Technology, 2016, 41(7): 244-250. |
| [12] |
WANG L H, SUN X, HUANG G Q, et al. Conjugation of soybean protein isolate with xylose/fructose through wet-heating Maillard reaction[J]. Journal of Food Measurement and Characterization, 2018, 12(4): 2718-2724. DOI:10.1007/s11694-018-9889-y |
| [13] |
WANG W Q, YUAN P P, ZHOU J Y, et al. Effect of temperature and pH on the gelation, rheology, texture, and structural properties of whey protein and sugar gels based on Maillard reaction[J]. Journal of Food Science, 2021, 86(4): 1228-1242. DOI:10.1111/1750-3841.15659 |
| [14] |
徐真真, 黄国清, 肖军霞. 干热条件下大豆分离蛋白—木糖美拉德反应研究[J]. 粮油食品科技, 2015, 23(2): 26-30. XU Z Z, HUANG G Q, XIAO J X. Study on Maillard reaction of soybean protein isolate-xylose under dry and hot conditions[J]. Science and Technology of Cereals, Oils and Foods, 2015, 23(2): 26-30. DOI:10.3969/j.issn.1007-7561.2015.02.007 |
| [15] |
龚平, 阚建全. 美拉德反应产物性质的研究进展[J]. 食品与发酵工业, 2009, 35(4): 141-146. GONG P, KAN J Q. Research progress on properties of Maillard reaction products[J]. Food and Fermentation Industries, 2009, 35(4): 141-146. |
| [16] |
王祺. 糖基化(果胶)改性对卵白蛋白功能特性的影响、机制初探及应用[D]. 长春: 吉林大学, 2019. WANG Q. The effect of glycosylation (pectin) modification on the functional characteristics of ovalbumin, its mechanism and application [D]. Changchun: Jilin University, 2019. |
| [17] |
ZHA F C, YANG Z Y, RAO J J, et al. Gum arabic-mediated synthesis of glyco-pea protein hydrolysate via Maillard reaction improves solubility, flavor profile, and functionality of plant protein[J]. Journal of Agricultural and Food Chemistry, 2019, 67(36): 10195-10206. DOI:10.1021/acs.jafc.9b04099 |
| [18] |
SONG Y L, YANG S M, LI J H. Effect of Maillard reaction conditions on the solubility and molecular properties of wheat gluten-maltose conjugates[J]. Food Science & Nutrition, 2020, 8(11): 5898-5906. |
| [19] |
朱秀清, 杜晓倩, 胡淼, 等. 大豆分离蛋白-葡聚糖非共价聚合物结构及功能性研究[J]. 农业机械学报, 2022, 53(1): 398-405. ZHU X Q, DU X Q, HU M, et al. Study on the structure and function of soybean protein isolate-dextran non-covalent polymer[J]. Transactions of the Chinese Society for Agricultural, 2022, 53(1): 398-405. |
| [20] |
LIU G, YUAN D, WANG Q, et al. Maillard-reaction-functionalized egg ovalbumin stabilizes oil nanoemulsions[J]. Journal of Agricultural and Food Chemistry, 2018, 66(16): 4251-4258. |
| [21] |
王一熹. 半干法改性对大豆分离蛋白特性的影响[D]. 泰安: 山东农业大学, 2016. WANG Y X. Effect of semi-dry modification on the characteristics of soybean protein isolate [D]. Taian: Shandong Agricultural University, 2016. |
| [22] |
魏宣彪, 刘桂敏, 吴兆亮, 等. pH对酪蛋白/十二烷基硫酸钠体系泡沫性能及泡沫分离酪蛋白的影响[J]. 高校化学工程学报, 2010, 24(6): 949-953. WEI X B, LIU G M, WU Z L, et al. Effect of pH casein/sodium dodecyl sulfate system on foam performance and foam separation of casein[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(6): 949-953. |
| [23] |
朱巧梅, 于晓雯, 陈海涛, 等. 玉米纤维胶-乳清分离蛋白Maillard共聚物对姜黄素乳液稳定性和消化特性的影响[J]. 食品科学, 2021, 42(15): 10-18. ZHU Q M, YU X W, CHEN H T, et al. Effect of corn gluten-whey protein isolation Maillard copolymer on the stability and digestibility of curcumin emulsion[J]. Food Science, 2021, 42(15): 10-18. |
| [24] |
ZHANG Z, WANG X, YU J, et al. Freeze-thaw stability of oil-in-water emulsions stabilized by soy protein isolate-dextran conjugates[J]. LWT - Food Science and Technology, 2017, 78: 241-249. |
| [25] |
LIU S L, ZHAO P C, ZHANG J J, et al. Physicochemical and functional properties of silver carp (hypophthalmichthys molitrix) myofibrillar protein glycated with konjac oligo-glucomannan[J]. Food Hydrocolloids, 2017, 67: 216-223. |




