二烯丙基胺(DAA)是一种多功能有机胺,其结构中含有两个烯丙基和一个氨基,可用于多种化学合成反应和高分子聚合[1~4],广泛用于制作交联型无醛固色剂、制药中间体、离子净水剂、以及染料、涂料和树脂改良剂等的中间体[5~9]。目前合成路线有两条:烯丙醇与氨气反应制取DAA[10];烯丙基氯氨解制取DAA[11, 12]。第一条合成路线转化率和选择性较低,Carroll等[10]以H3PO4/SiO2和LaPO4为催化剂,将烯丙醇和氨气在320℃下通过固定床反应器,转化率仅有25%,选择性只有9%,没有工业竞争力。第二条合成路线多以水为介质,氯丙烯反应活性较高,容易与氨反应,反应条件温和。据日本专利[12]报道,氯丙烯滴加至氨水中,滴加时间3 h,温度为70℃,滴加完毕再反应1 h,DAA选择性达到33.5%,反应同时生成单烯丙基胺(MAA)与三烯丙基胺(TAA),都具有较高价值[13~15]。还有在非水介质中反应的报道,如刘锋等[16]报道以氯化亚铜为催化剂、乙醇为溶剂,通入液氨,釜内压力0.6 MPa,45℃反应6 h,DAA选择性为24.2%,主要生成MAA;唐炳涛等[17]报道以氯化亚铜为催化剂,液氨为反应介质,用氮气加压至3.1 MPa,45℃反应8 h,DAA选择性最高可达69.4%,这是目前文献报道的最高选择性。非水介质中的反应一般在加压条件下进行,操作不便,设备投资较大,氨的损耗较大。氨水与氯丙烯为原料合成DAA的工艺具有原料易得、操作简单、安全,主要缺点是反应选择性低,造成废液量大(每吨产品产生10~12吨含氨含氯废水),从而造成生产成本高。
为开发操作方便、选择性高、污染小、成本低的DAA合成技术,针对氨水、氯丙烯非均相氨解体系的特点,本研究提出反应萃取新工艺。通过萃取剂、相转移促进剂的筛选建立反应萃取体系,考察了氨解催化剂,并优化了反应条件,使DAA选择性达到91.0%。为低成本、低污染生产DAA提供了一种全新的工艺,也为具有类似反应特点的过程开发提供了有益的指导。
2 实验部分 2.1 主要仪器PROTÉGÉ 460型傅里叶变换红外光谱仪,美国Varian公司生产;Avance Ⅲ500MHz型核磁共振波谱仪,德国Bruker公司生产;Shimadzu GCMS-2010型气相色谱-质谱联用仪,日本岛津公司生产;GC-7800气相色谱仪,滕州京鲁伟业科学仪器有限公司生产,30 m×0.250 mm×0.25 μm DB-210毛细管柱;DC-3005A型酒精低温恒温槽,宁波市天恒仪器厂生产;Vista-AX型等离子体发射光谱仪,美国Varian公司生产。
2.2 试剂氨水(25%~28%)、苯、甲醇、乙醇、无水碳酸钾、碘化钾等皆为分析纯,上海凌峰化学试剂有限公司生产;氯丙烯、氯化亚铜、溴化亚铜、四丁基溴化铵(TBAB)、十六烷基三甲基溴化铵(CTAB)、苄基三乙基氯化铵(BTEC)、十二烷基苄基二甲基氯化铵(DBDC)、氯化十六烷基吡啶(CPC)等皆为化学纯,国药集团化学试剂有限公司生产。
2.3 氯丙烯氨解反应操作操作过程分两种:(A)反应萃取操作;(B)常规操作,不加萃取剂和相转移促进剂。典型的操作方法是:
(A) 将255 g浓度为25%的氨水(3.75 mol)、1.5 g氯化亚铜(催化剂)、120 g氯苯(萃取剂)、1.0 g TBAB(相转移促进剂)加入带机械搅拌和回流冷凝管(用5℃酒精作冷却介质)的500 mL的圆底烧瓶中。保持在25℃,2 h内滴加58.5 g氯丙烯(0.75 mol),滴完后在35℃反应3 h,结束反应。随后,将反应混合物在约15块理论板的精馏塔进行精馏,分别收集42~46℃ (氯丙烯,含量99.2%)馏分、54~58℃ (MAA,含量98.9%)馏分、107~111℃ (DAA,含量98.8%)馏分、153~157℃ (TAA,含量98.1%)馏分。
水相循环反应操作是:在反应结束后将反应液静置0.5 h,分出油层(含产品),去精馏分离产品。水层含过量的氨水、催化剂及单烯丙基胺,补充通氨气饱和后循环使用。随着通氨循环3次后,会有固体氯化铵析出。滤出固体氯化铵,用ICP分析技术测定溶液铜离子浓度,补充氯化亚铜,使循环水相中铜离子浓度保持在0.35%左右,用于下一次反应。
(B) 将255 g浓度为25%的氨水(3.75 mol)、和1.5 g氯化亚铜(催化剂)加入带机械搅拌和回流冷凝管(用5℃酒精作冷却介质)的500 mL的圆底烧瓶中。保持在35℃,2 h内滴加58.5 g氯丙烯(0.75 mol)。滴完后继续在35℃反应3 h,结束反应。产品精馏方法同(A)。
2.4 产物分析方法 2.4.1 定量分析采用气相色谱仪(GC),正庚烷作为内标物进行定量分析。分析条件:汽化温度200℃,检测温度200℃,采取程序升温,初始温度40℃保持2 min,升温速率10℃·min-1,终温160℃,终温时间2 min,进样量0. 2 μL。
2.4.2 定性分析与产品结构确认气质联用分析仪(GC-MS),分析条件:汽化温度200℃,检测器200℃,程序升温,50℃保留1 min后,以20℃·min-1升至160℃,保留2 min,进样量为0. 2 μL。
液膜法进行FT-IR分析;以氘代氯仿为溶剂,测定1H-NMR。
2.4.3 收率计算氨解反应体系复杂,选择性、转化率都是根据反应后精馏分离产物数据计算得出。收率在本实验中定义如下:
氯丙烯的转化率(X) = (投入氯丙烯量(g) -反应后精馏回收得到的氯丙烯量(g))/投入氯丙烯量(g)×100%
DAA的选择性(SDAA) =精馏得到的DAA量(g)/总产物量(g)×100%(总产物量是:精馏得到的MAA、DAA、TAA及釜残液总和(g))
DAA的收率(YDAA) =氯丙烯的转化率×DAA的选择性
3 结果与讨论 3.1 液-液相转移反应体系的建立 3.1.1 萃取剂的筛选氯丙烯氨解反应是SN2亲核取代反应。烷基化后生成的胺会发生多烷基化反应,生成伯仲叔胺,甚至会生成季铵。反应式见示意图 1。
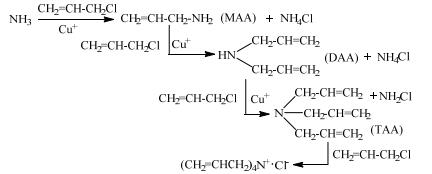
|
示意图 1 氨水氨解氯丙烯反应过程 Scheme1 Ammonolysis of ally chloride using ammonia solution |
当氨被催化烷基化生成单烯丙基胺(MAA)后,由于烷基的供电子效应,N原子的亲核性增强,从而使MAA较原料NH3更易于在铜离子催化下发生亲核烷基化,生成DAA。同样原因,目标产物DAA又更易于在铜离子催化下发生亲核烷基化,进一步生成TAA,它无需催化剂作用,即可与氯丙烯发生亲核加成,生成季铵盐。烷基化反应的活性顺序是:DAA > MAA > TAA[16]。这说明:目标产物DAA是最不稳定的中间产物,用通常的操作方式,氨水与氯丙烯反应很难高选择性地得到DAA。如Pazxdzioch等列出了31个不同条件的实验数据,DAA的最高选择性为47.1%[11]。对于这类目标产物为不稳定的中间产物的非均相反应,采用液-液相转移反应萃取技术,往往会取得很好的效果[18]。于是,针对本研究对象易于发生连串副反应的特点,作者试图建立液-液相转移反应体系,以期得到高收率的DAA。
欲达成这样的目标,萃取剂是关键因素。TBAB为相转移促进剂,考察了一系列溶剂的反应萃取效果,结果列于表 1。
|
|
表 1 溶剂对氯丙烯转化率(X)、产品选择性(S)和产品收率(Y)的影响 Table 1 Effects of solvents on allyl chloride conversion (X), product selectivity (S) and product yield (Y) |
从表 1结果看出:不加有机萃取剂和相转移促进剂的常规操作方式,目标产物DAA的选择性只有41.6%。加入有机萃取剂后,DAA的选择性都有明显提高。反应混合物中,NH3和催化剂氯化亚铜是在水相,氯丙烯微溶于水,氨解反应发生在水相。第一步氨解产物MAA易溶于水,它继续与氯丙烯在水相反应生成DAA。生成的DAA也可溶于水,但有较大的亲油性,在有机萃取剂和相转移促进剂的作用下,DAA就及时离开水相反应区而进入油相,阻断DAA与水相氯化亚铜催化剂的接触,避免DAA继续烯丙基化生成TAA,从而提高DAA的选择性。尤以邻氯甲苯、氯苯、苯甲醚、苯等的反应萃取效果较好。邻氯甲苯、苯甲醚价格高,选择苯、氯苯等廉价溶剂,利于节约成本。DAA沸点为111-112℃,氯苯沸点为132℃,沸点相差大,以氯苯为溶剂,利于精馏提纯。综合考虑DAA收率、成本和分离效率,认为氯苯是最合适的反应萃取剂。
3.1.2 相转移促进剂的筛选反应萃取体系中,相转移促进剂也是一个重要因素。本研究以氯苯为反应萃取剂,考察了5种典型的相转移促进剂,结果列于表 2。
|
|
表 2 相转移促进剂对氯丙烯转化率(X)、产品选择性(S)和产品收率(Y)的影响 Table 2 Effects of phase transfer promoters on allyl chloride conversion (X), product selectivity(S) and product yield (Y) |
相转移促进剂承担双重作用,既要促进氯丙烯进入水相反应,更要促进生成的DAA及时离开水相反应区,进入有机相,抑制连串副反应生成TAA。从表 2结果看,BTEC的相转移促进效果最好。
综上结果,认为对于氯丙烯水相氨解合成DAA的反应体系,萃取剂起关键作用,相转移促进剂也有较明显的影响。氯苯是合适的反应萃取剂,BTEC是合适的相转移促进剂。
3.2 氨解催化剂的考察氯化亚铜、氯化铜、钯配合物等是氯丙烯氨解常用催化剂[11, 16, 19]。在本反应萃取体系,实验考察了氯化亚铜、溴化亚铜、碘化亚铜、氯化铜、氯化钯、氯化镍、碘化钾等的催化效果。实验发现氯化镍没有催化活性,其余结果列于表 3。
|
|
表 3 催化剂对氯丙烯转化率(X)、产品选择性(S)和产品收率(Y)的影响 Table 3 Effects of catalysts on allyl chloride conversion (X), product selectivity (S) and product yield (Y) |
从表 3结果看出:除氯化铜催化活性较低外,其余催化剂的催化活性都较好,但目标产物DAA的选择性存在明显差别。碘化亚铜催化活性最高,氯化亚铜的DAA选择性最高。碘化亚铜具有双重催化作用:一方面是亚铜离子对氨的配位活化作用;另一方面是碘离子的交换作用将氯丙烯转化成活性更高的碘丙烯。但使用碘化亚铜的成本远高于氯化亚铜,故认为氯化亚铜是较合适的氯丙烯氨解合成DAA催化剂。
3.3 反应条件考察实验考察了物料(即氨水、氯化亚铜、BTEC、氯苯)配比、滴加氯丙烯后反应时间和温度等反应条件对反应结果的影响。结果列于表 4。
|
|
表 4 反应条件对氯丙烯转化率和DAA选择性的影响 Table 4 Effects of reaction conditions on allyl chloride conversion (X) and DAA selectivity (S) |
从表 4中1~4实验可以看出,随反应温度升高,转化率升高至完全反应,但DAA选择性在35℃达最高,温度偏低或偏高都对DAA生成不利;比较3,5,6实验可以看出:反应3 h比较合适,继续延长反应时间转化率有所升高,但DAA选择性有下降趋势;比较3,7,8实验可以看出:氨水用量较少时(204 g氨水,摩尔比n(氨):n(氯丙烯) = 4:1),DAA选择性较低(88.4%),当氨水用量较多时(306 g氨水,摩尔比n(氨):n(氯丙烯) = 6:1),DAA选择性较氨水用量为255 g时没有明显变化,说明氨水用量为255 g (即摩尔比n(氨):n(氯丙烯) = 5:1)比较合适;比较3,9,10实验可看出:催化剂氯化亚铜用量较低时,氯丙烯转化率偏低,DAA选择性较高,但氯化亚铜用量较高时,会引起DAA选择性下降,说明氯化亚铜用量1.0 g为宜;比较3,11,12实验可看出:相转移促进剂BTEC用量由0.5 g增大至1.0 g,氯丙烯转化率略有增大,但DAA的选择性没有明显变化,但BTEC用量由1.0 g增大至1.5 g,对反应结果基本没影响,故认为BTEC用量为1.0 g较合适。比较3,13,14,15实验可看出:萃取剂氯苯用量较低时,氯丙烯转化率较高,DAA选择性偏低,但氯苯用量较高时,会引起氯丙烯转化率下降,说明氯苯用量120 g比较合适。
综上,较适宜的工艺条件为在较合适的原料配比(质量比m(氨水(25%)):m(氯丙烯):m(氯化亚铜):m(氯苯):m(BTEC) = 255:58.5:1.5:120:1.0)下,35℃反应3 h,氯丙烯的转化率达95.9%,DAA的选择性达91.9%,收率为88.1%。
3.4 水相循环效果考察从上述研究结果看出,本文提出的反应萃取技术,极大地提高了DAA选择性。另外的优点是方便水相循环,即方便于催化剂、过量的氨及中间产物MAA等循环利用。水相循环反应操作是:在反应结束后将反应液静置0.5 h,分出油层(含产品),水层补充通氨气饱和后循环使用。循环使用效果,列于表 5。
|
|
表 5 水相循环使用效果 Table 5 Results of aqueous phase recycling |
从表 5可以看出:水相循环过程中,氯丙烯转化率(催化活性)呈缓慢的下降趋势,DAA选择性变化不明显。因为在水相循环过程中副产氯化铵浓度累积增加,至第三次开始析出固体氯化铵。在分离氯化铵时会夹带出铜催化剂,所以第三次反应氯丙烯转化率下降较明显。根据水相铜离子浓度监测,在随后的循环过程中,适时补加氯化亚铜以维持水相铜离子重量浓度在0.35%左右。通过9次循环实验(第1次是新鲜料)看出,氯丙烯转化率在92%~96%波动,DAA选择性维持在90%~93%。说明本研究提出的反应萃取新工艺是可行的。
实现水相循环,不但是使催化剂、过量的氨及中间产物MAA等循环利用,避免废液排放(采用本工艺,理论上是没有废液排放。而常规工艺,生产每吨DAA产品产生约10~12吨废水),而且方便地将副产物氯化铵以固体形式在循环过程中析出。
3.5 产物分析鉴定 3.5.1 FT-IR分析对精馏所得DAA产品进行了FT-IR分析,见图 1。
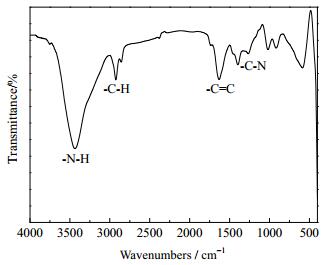
|
图 1 DAA的FT-IR谱图 Fig.1 FT-IR spectra of diallylamine |
图 1是蒸馏所得产品液的红外吸收光谱。可以看出,3448.47 cm-1处为DAA中N-H仲胺基团的振动特征吸收峰;2923.08 cm-1处为是C=C双键上C-H的特征伸缩振动峰;1654.40 cm-1处为C=C双键的振动吸收峰;1261.52 cm-1为C-N键的振动吸收峰。
3.5.2 1H-NMR分析对精馏所得DAA产品进行氢核磁谱分析,结果见图 2。
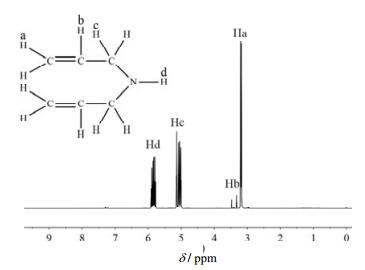
|
图 2 二烯丙基胺的核磁氢谱 Fig.2 1H-NMR spectrum of diallylamine |
由图 2可以看出,实验所得DAA产品的1H-NMR(CDCl3,500 MHZ):δ = (3.1~3.3) ppm处为双键末端CH2上Ha,δ =(3.35~3.5) ppm处为双键中间的CH上的Hb,δ =(5.1~5.3) ppm处为烯丙基与N相连的CH2上的Hc,δ = (5.7~5.9) ppm处为NH上的Hd。氢核磁谱与DAA结构完全对应。
3.5.3 GC-MS分析对精馏所得DAA产品进行GC-MS分析,总离子流图如图 3所示。
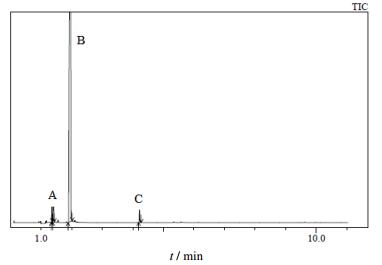
|
图 3 DAA产品的总离子流图 Fig.3 Total ion current chromatogram of DAA |
图 3中B峰(1.966 min)的质谱图与DAA标准质谱图如图 4所示。

|
图 4 B峰(1.966 min)的质谱图(a)与DAA标准质谱图(b) Fig.4 Mass spectrum of peak B(1.966 min) (a) and mass spectrum of DAA standard (b) |
图 4中主要质谱碎片为(m/z):96[M+,20%],82(32%),68(48%),42(13%),41(100%),27(7%),与DAA的标准质谱图[20]吻合。
精馏收集107~111℃馏分DAA产品GC分析含量为98.8%。
4 结论针对目标产物DAA易发生连串副反应的特点,本文提出的液-液相转移反应萃取新工艺,是提高DAA产品选择性的有效方法。实验结果表明,氯苯是合适的反应萃取剂,BTEC是合适的相转移促进剂,氯化亚铜是合适的氨解催化剂。通过对氯丙烯催化氨解液-液相转移反应萃取新工艺中反应条件的考察,确定在较合适的原料配比(质量比m(氨水(25%)):m(氯丙烯):m(氯化亚铜):m(氯苯):m(BTEC) = 255:58.5:1.5:120:1.0)下,35℃反应3 h,氯丙烯的转化率达95.9%,DAA的选择性达91.9%,收率为88.1%。这远超过文献报道的结果(用常规工艺,69.4%的DAA选择性)。
水相循环使用9次,氯丙烯转化率在92%~96%波动,DAA选择性维持在90~93%。表明本研究开发的新工艺便于催化剂、过量的氨及中间产物MAA等循环利用,并将副产物氯化铵以固体形式在循环过程中析出。
| [1] | Vivekanandam T, Gopalan A, Vasudevan T, et al. Sonochemical cyclopolymerization of diallylamine[J]. European Polymer Journal, 2000, 36(2): 385-392. DOI:10.1016/S0014-3057(99)00071-3. |
| [2] | Feng Y J, Tsai F P, Huang S L, et al. Cyclizations of aryl enynes containing propargyl alcohol and diallylamine groups to yield indolecarbaldehydes induced by ruthenium complexes[J]. European Journal of Inorganic Chemistry, 2015, 2014(31): 5406-5414. |
| [3] | Vivekanandam T, Gopalan A, Vasudevan T, et al. Sonochemical cyclopolymerization of diallylamine in the presence of peroxomonosulfate[J]. Journal of Applied Polymer Science, 2005, 98(4): 1548-1553. DOI:10.1002/(ISSN)1097-4628. |
| [4] | Stutz A. Allylamine derivatives & mdash; a new class of active substances in antifungal chemotherapy[J]. Angewandte Chemie International Edition, 2010, 26(4): 320-328. |
| [5] | Ali S, Goni L, Mazumder M, et al. Butler's cyclopolymerizaton protocol in the synthesis of diallylamine salts/sulfur dioxide alternate polymers containing amino acid residues[J]. Journal of Polymer Research, 2017, 24(11): 184-195. DOI:10.1007/s10965-017-1334-0. |
| [6] | Dadwal M, Kesharwani M, Danayak V, et al. Synthetic and theoretical investigations on the construction of oxanorbornenes by a michael addition and intramolecular diels-alder furan reaction[J]. European Journal of Organic Chemistry, 2008, 2008(36): 6106-6118. DOI:10.1002/ejoc.v2008:36. |
| [7] | Takeuchi M, Kondo K, Kuri H, et al. Single diallylamine-type copolymer additive which perfectly bottom-up fills Cu electrodeposition[J]. Journal of the Electrochemical Society, 2012, 159(4): 230-234. DOI:10.1149/2.080204jes. |
| [8] | Tokuda Y, Miyagiishima T, Tomida K, et al. Dual pH-sensitive layer-by-layer films containing amphoteric poly(diallylamine-co-maleic acid)[J]. Journal of Colloid & Interface Science, 2013, 399(3): 26-32. |
| [9] | Satti A, Larpent P, Gunko Y, et al. Improvement of mechanical properties of graphene oxide/poly(allylamine) composites by chemical crosslinking[J]. Carbon, 2010, 48(12): 3376-3381. DOI:10.1016/j.carbon.2010.05.030. |
| [10] | Carroll W, Daughenbaugh R, Dixon D, et al. Allylamine from allyl alcohol[J]. Journal of Molecular Catalysis, 1988, 44(2): 213-215. DOI:10.1016/0304-5102(88)80033-6. |
| [11] | Pazdzioch W, Milchert E. Ammonolysis of allyl chloride by ammonia solution[J]. Industrial & Engineering Chemistry Research, 2002, 41(11): 2602-2610. |
| [12] | Mori Y, Moriya O. Preparation of high purity allylamine: Japan, 01, 246, 244[P]. 1989-10-02. |
| [13] | Kuo P L, Chen W F. Formation of silver nanoparticles under structured amino groups in pseudo-dendritic poly(allylamine) derivatives[J]. Journal of Physical Chemistry B, 2003, 107(41): 11267-11272. DOI:10.1021/jp030116s. |
| [14] | Alcaide B, Almendros P, Alonso J, et al. A novel use of grubbs' carbene. application to the catalytic deprotection of tertiary allylamines[J]. Organic Letters, 2001, 3(23): 3781-3784. DOI:10.1021/ol0167412. |
| [15] | Whittaker A, Rucker R, Lalic G, et al. Catalytic SN2'-selective substitution of allylic chlorides with arylboronic esters[J]. Organic Letters, 2010, 41(49): 3216-3218. |
| [16] | LIU Feng(刘锋), ZHANG Shu-fen(张淑芬), YANG Jin-zong(杨锦宗), et al. Preparation of allylamine by ammonolysis of allyl chloride(烯丙基氯氨解制备烯丙基胺)[J]. Fine Chemical(精细化工), 2001, 18(11): 678-681. DOI:10.3321/j.issn:1003-5214.2001.11.017. |
| [17] | TANG Bing-tao(唐炳涛), ZHANG Shu-fen(张淑芬), YANG Jin-zong(杨锦宗), et al. Study on synthetic of allylamine(烯丙基胺的合成研究)[J]. Journal of Dalian University of Technology(大连理工学报), 2004, 44(2): 224-227. |
| [18] | SHAN Yu-hua(单玉华), WU Guo-ying(邬国英). A liquid-liquid phase transfer reactive extraction process for synthesis of glutaric dialdehyde(液-液相转移反应萃取法合成戊二醛)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 1999, 13(4): 329-334. |
| [19] | Boualy B, Harrad M, Houssame S, et al. Copper(Ⅱ) catalyzed allylic amination of terpenic chlorides in water[J]. Catalysis Communications, 2012, 19(10): 46-50. |
| [20] | Online spectral database for organic compounds, SDBS[EB/OL]. http://riodb01.ibase.aist.go.jp/sdbs/2015-10-21. |




