免疫效应细胞由于其独特的杀瘤能力和治疗优势使其在肿瘤疾病治疗中备受瞩目[1-2]。在治疗过程中,为了获得满意的临床效果,需要分离患者自体免疫效应细胞通过体外扩增技术获得符合临床要求的细胞数量。由于从肿瘤患者体内难以采集大量免疫效应细胞,且收获的细胞质量受患者身体状况影响很大,常常无法实现有效扩增,不仅使患者遭受巨大痛苦,也影响治疗效果[3-4]。因此,如何提高免疫细胞体外扩增效果并维持其杀伤活性是亟待解决的问题[5-7]。
氨基酸作为哺乳动物细胞培养基中的重要成分,其不仅是细胞增殖所需生物大分子的合成原料,某些氨基酸也可作为能源物质为细胞体外扩增提供ATP,除此之外,还可以作为嘌呤、嘧啶、氨基糖和抗氧化剂合成的底物,参与其他生物合成途径去维持细胞的完整和功能[8]。研究发现,当免疫效应细胞被激活时,抑制氨基酸转运蛋白的表达从而阻碍氨基酸的摄取时,会抑制它的扩增和功能[9-13]。同时丙酮酸是多种氨基酸合成的起始化合物,免疫效应细胞受到刺激时会通过丙酮酸羧化酶加速丙酮酸氧化以促进免疫细胞的增殖[14]。由此可见,优化培养基中氨基酸种类和浓度是免疫细胞体外扩增过程中的关键环节。而有血清培养基成分复杂,现有商业化无血清培养基中的氨基酸浓度通常也是保密的,无法使用现有的培养基进行优化以适满足细胞需求[15]。
为此,本文以具有CD3-CD56+表型特征和高细胞毒性的自然杀伤细胞系(natural killer-92 cells, NK-92)细胞为对象[16],在一款自主设计的化学成分简单、明确的无血清培养基SFM-MIN中分析了NK-92体外扩增前期氨基酸的消耗,探查关键营养组分,采用正交实验确定其最适浓度。并在有/无血清培养体系中,以细胞活性、总细胞扩增、培养物中CD3-CD56+细胞比例、胞内ATP含量和细胞杀伤活性为指标,验证了研究结果。为后续开发免疫效应细胞高效扩增的无血清培养基提供了技术支持和依据。
2 材料与方法 2.1 实验材料NK-92细胞来源于人恶性非霍奇金淋巴瘤患者外周血,购自南京科佰生物科技有限公司;α-MEM培养基购自美国Thermo公司;HIPP-T009淋巴细胞无血清培养基购自上海倍谙基生物科技有限公司,其谷氨酰胺和丙酮酸钠浓度分别为3.3和1.0 mmol·L-1;胎牛血清购自美国Hyclone公司;马血清购自以色列Biological Industries公司;白细胞介素2(IL-2)购于美国Peprotech公司;鼠抗人FITC-CD3抗体和鼠抗人PE-CD56抗体购自美国Becton Dickinson公司;二甲基亚砜购自美国Merck公司;丙酮酸钠购自美国Applichem公司;谷氨酰胺购自美国Merck公司;CellTiter-LumiTMPlus发光法细胞活力检测试剂盒购自碧云天生物科技有限公司。SFM-MIN是自配的无血清培养基,其谷氨酰胺和丙酮酸钠浓度分别为0.0和0.0 mmol·L-1。
2.2 方法 2.2.1 细胞培养NK-92细胞以5×105 cells·mL-1的密度接种于添加12.5%胎牛血清和12.5%马血清的α-MEM培养基或无血清培养基T009中,并添加1 000 U·mL-1 IL-2,在37 ℃、5% CO2的饱和湿度培养箱中培养15 d。培养过程中,每天取样计数,并补充新鲜培养基和IL-2,调回最初接种密度。
2.2.2 细胞冻存将处于对数生长期的NK-92细胞以1 000 r·min-1离心5 min,弃上清后悬浮于由90%胎牛血清和10%二甲基亚砜组成的冻存液中,以1×107 cells·mL-1的密度接入1.5 mL的冻存管,每管1 mL,4 ℃放置30 min,-20 ℃放置2 h后转移到-80 ℃冰箱中,24 h后放入液氮中冻存7 d。
2.2.3 细胞表型分析收集(5~10)×105个细胞,加入抗体稀释液1 mL,1 500 r·min-1离心5 min,洗涤2次后,将细胞重悬于100 μL抗体稀释液中。分别将8 μL浓度为0.2 mg·mL-1 FITC-CD3抗体和8 μL浓度为0.2 mg·mL-1 PE-CD56抗体加入至上述细胞悬液中,4 ℃孵育30 min使细胞表面抗原与加入的抗体充分结合,最后加入抗体稀释液1 mL,1 500 r·min-1离心5 min除去未结合的抗体并将细胞重悬于300 μL抗体保存液中,采用FACS Aria Ⅰ流式细胞仪(美国Becton Dickinson公司)分析培养物中CD3-CD56+细胞的比例,结果用FlowJo软件进行处理和分析。
2.2.4 胞内ATP含量测定采用化学发光方法测定胞内ATP含量,取一定量的待测细胞,制备密度为1.5×104 cells·mL-1的细胞悬液,将100 μL细胞悬液加入到事先加有100 μL·孔CellTiter-LumiTMPlus发光检测试剂的96孔板中,以添加100 μL培养基为对照,采用荧光酶标仪进行化学发光检测。
2.2.5 NK-92细胞对K562杀伤活性的检测以NK-92细胞为效应细胞(E),以处于对数生长期的K562细胞为靶细胞(T),利用2个细胞共培养时NK-92细胞对K562细胞的杀伤作用评价NK-92细胞的杀伤活性。分别将1×105个NK-92细胞(E)、1×104个K562细胞(T)、以及上述2种细胞的混合物(ET)接种于装有100 μL无血清培养基的96孔板中,置于37 ℃,5% CO2培养箱共培养4 h后每孔加入10 μL CCK-8试剂,37 ℃孵育2 h后用酶标仪检测效应细胞(E)、K562细胞(T)和2种细胞的混合物(ET)在450 nm处的吸光度ODE、ODT和ODET。按式(1)计算NK-92细胞对K562细胞的杀伤活性:
| $ {\rm{ 杀伤活性 = (1 - \frac{{O{D_{ET}} - O{D_E}}}{{O{D_T}}}) \times 100\% }}$ | (1) |
采用浓度已知的20种氨基酸混合液标准品稀释制成不同浓度的氨基酸标准品混合液,以邻苯二甲醛一氯甲酸芴甲酯(OPA-FMOC)为衍生剂进行柱前衍生[17],根据峰面积和浓度之间的关系绘制氨基酸标准曲线,采用相同方法检测培养基中相对应的20种氨基酸峰面积,根据标准曲线计算各氨基酸的浓度。
2.3 统计学分析应用SPSS统计分析软件对实验结果进行统计学分析,数据以平均值加减标准差的形式表示,p < 0.05表示存在显著性差异。
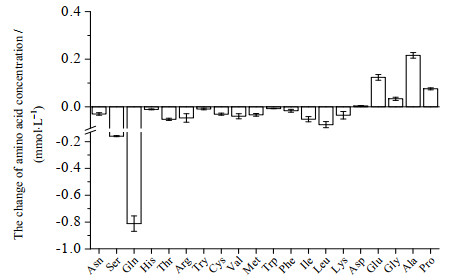
3 结果 3.1 NK-92细胞在培养过程中的氨基酸消耗分析NK-92细胞以1×105 cells·mL-1的密度接种于添加2 mmol·L-1谷氨酰胺的SFM-MIN培养基培养2 d后检测培养基中20种氨基酸浓度,计算培养2 d后各氨基酸浓度变化差值如图 1所示。由图 1可知,NK-92细胞对不同氨基酸的需求存在较大的差异。天冬氨酸、谷氨酸、甘氨酸、丙氨酸和脯氨酸浓度呈升高趋势,其余氨基酸浓度都有不同程度的降低,谷氨酰胺、丝氨酸、亮氨酸、异亮氨酸和苏氨酸这5种氨基酸浓度变化幅度较大,其中以谷氨酰胺变化量最为显著。进一步分析上述消耗较大的氨基酸的代谢特点,发现丝氨酸、苏氨酸亮氨酸和异亮氨酸合成的原料来均与糖代谢过程中的丙酮酸有关。由此可推测,NK-92细胞对谷氨酰胺和丙酮酸两种营养物质有较高的需求。
|
图 1 NK-92细胞在SFM-MIN中培养2 d的氨基酸浓度差(n = 3) Fig.1 Difference of amino acid concentration for NK-92 cells cultured in SFM-MIN for 2 days (n = 3) |
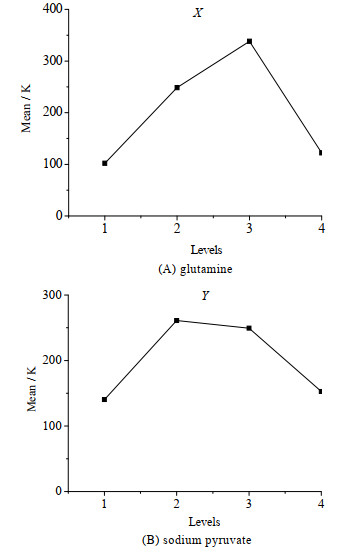
使用minitab软件设计了两因子四水平正交实验,其中X代表培养基中谷氨酰胺浓度,浓度分别为0.0、6.5、13.0、19.5 mmol·L-1,Y代表培养基中丙酮酸钠浓度,浓度为分别为0.0、2.5、5.0、7.5 mmol·L-1 (如表 1),共产生16个正交实验组。将NK-92细胞以1×105 cells·mL-1的密度接种于上述16种实验组无血清培养基中,每48 h取样计数,并补充新鲜培养基和IL-2,调回最初接种密度,培养至10 d时,测定各实验组的总细胞扩增倍数,结果如表 2,图 2和表 3所示。
|
|
表 1 2因子4水平正交设计 Table 1 Two-factor four-level orthogonal design |
|
|
表 2 正交实验结果(n = 3) Table 2 Results of the orthogonal experiments (n = 3) |
|
图 2 均值主效应图(n = 3) Fig.2 Main effect maps of mean values (n = 3) |
|
|
表 3 正交实验结果方差分析 Table 3 Analysis of variance of the orthogonal experiment results (*: p < 0.05) |
N为3个平行实验组的总细胞扩增倍数N1~N3的平均值,进一步求出X、Y 2种因子对应4种不同水平的N值平均值,即K1、K2、K3、K4,得到均值主效应图即图 2。由实验结果可知,在上述添加浓度范围中,谷氨酰胺最适水平为13.0 mmol·L-1,丙酮酸钠最适水平为2.5 mmol·L-1。
将正交实验的数据进行方差分析,结果如表 3所示,谷氨酰胺和丙酮酸钠对总细胞扩增倍数都有显著性的影响(p < 0.05)。
3.3 谷氨酰胺和丙酮酸钠促进未冻存NK-92细胞的扩增效率将提高了谷氨酰胺和丙酮酸钠浓度至上述最适水平的商业化α-MEM有血清培养基和无血清培养基T009为实验组,不额外添加谷氨酰胺和丙酮酸钠的原始培养基为对照组,以细胞活性、总细胞扩增倍数、培养物中CD3-CD56+细胞比例和细胞杀伤活性为指标,评价提高谷氨酰胺和丙酮酸钠浓度对NK-92细胞扩增的影响。
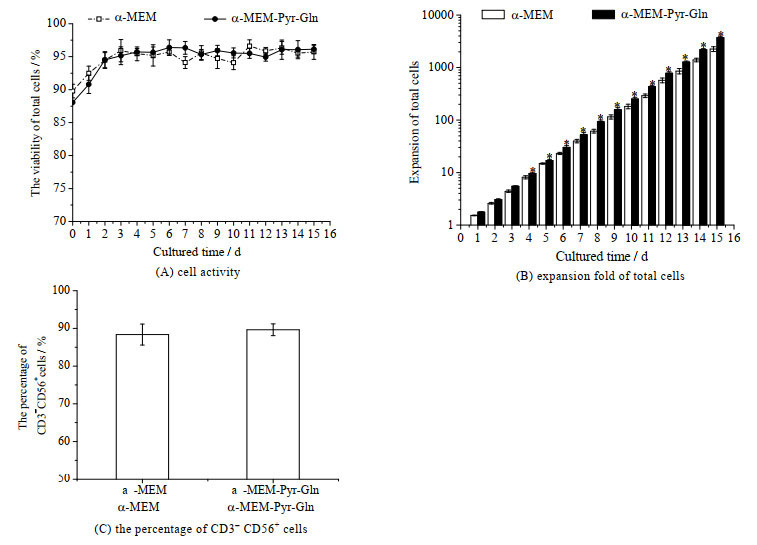
图 3为NK-92细胞在提高了谷氨酰胺和丙酮酸钠浓度的有血清培养基中的扩增情况。从图 3(A)可知,培养过程中实验组NK-92细胞活性与对照组相当;培养15 d后,总细胞扩增倍数为(3 712.85±225.74)倍,显著高于对照组的(2 255.93±243.00)倍(p < 0.05) (图 3(B));培养物中CD3-CD56+细胞比例为(89.63±1.56)%,与对照组中CD3-CD56+细胞比例(88.37±2.74)%相近(图 3(C))。
|
图 3 有血清培养基中谷氨酰胺和丙酮酸钠对NK-92细胞活性、总细胞扩增倍数和CD3-CD56+细胞比例的影响(n = 3) Fig.3 Effects of glutamine and sodium pyruvate on NK-92 cell activity, expansion fold of total cells and the percentage of CD3-CD56+ cells in serum medium (n = 3) *: p < 0.05 |
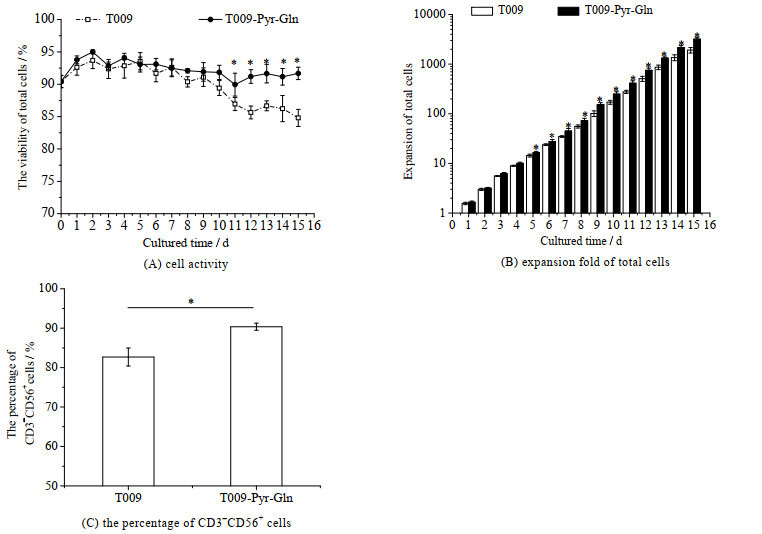
图 4为NK-92细胞在提高了谷氨酰胺和丙酮酸钠浓度的无血清培养基中的扩增情况。从图 4(A)中可见,在培养前期,两种培养基中的NK-92细胞活性相当,但培养到第9 d,对照组中NK-92细胞活性开始降低,而实验组中NK-92细胞的活率可以稳定维持在90%以上;到第11 d时,细胞活性已显著高于对照组(p < 0.05);培养15 d的总细胞扩增为(3 193.59±199.99)倍,显著高于对照组的(1 917.16±242.87)倍(p < 0.05) (图 4(B));培养物中CD3-CD56+细胞比例为(90.37±0.90)%,显著高于对照组中CD3-CD56+细胞比例(82.68±2.28)% (p < 0.05) (图 4(C))。可见,提高培养基丙酮酸钠和谷氨酰胺浓度促进了NK-92细胞的扩增。
|
图 4 无血清培养基中谷氨酰胺和丙酮酸钠对NK-92细胞活性、总细胞扩增倍数和CD3-CD56+细胞比例的影响(n = 3) Fig.4 Effects of glutamine and sodium pyruvate on NK-92 cell activity, expansion fold of total cells and the percentage of CD3-CD56+ cells in serum-free medium (n = 3) *: p < 0.05 |
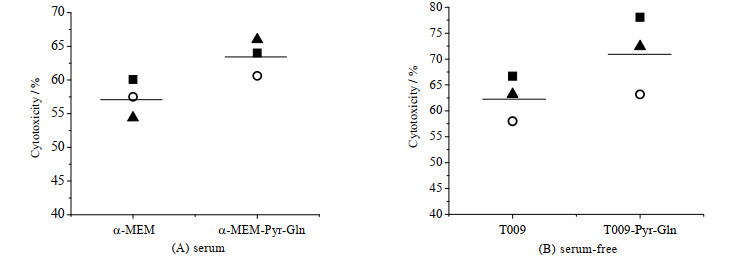
以效靶比10:1将扩增15 d的NK-92细胞与K562共培养,分别评价在提高了谷氨酰胺和丙酮酸钠浓度的有/无血清培养基中扩增后的NK-92细胞的杀伤功能,结果如图 5所示。由图可知,在有/无血清实验组中培养的NK-92细胞的杀伤活性均值分别为63.53%和71.22%,高于对照组57.23%和62.63%。可见,提高培养基中丙酮酸钠和谷氨酰胺浓度提高了NK-92细胞的杀伤活性。
|
图 5 有血清和无血清培养基中谷氨酰胺和丙酮酸钠对NK-92细胞杀伤活性的影响(n = 3) Fig.5 Effects of glutamine and sodium pyruvate on the cytotoxicity of NK-92 cells in serum and serum-free media (n = 3) *: p < 0.05 |
进一步将冻存7 d后复苏的NK-92细胞以5×105 cells·mL-1的密度接种于有/无血清培养基中,以谷氨酰胺和丙酮酸钠浓度提高至上述最适水平为实验组,不额外添加谷氨酰胺和丙酮酸钠的原始培养基为对照组,以细胞活性、总细胞扩增倍数、培养物中CD3-CD56+细胞比例、胞内ATP含量和细胞杀伤活性为指标,评价提高谷氨酰胺和丙酮酸钠浓度对冻存后NK-92细胞生长的影响。
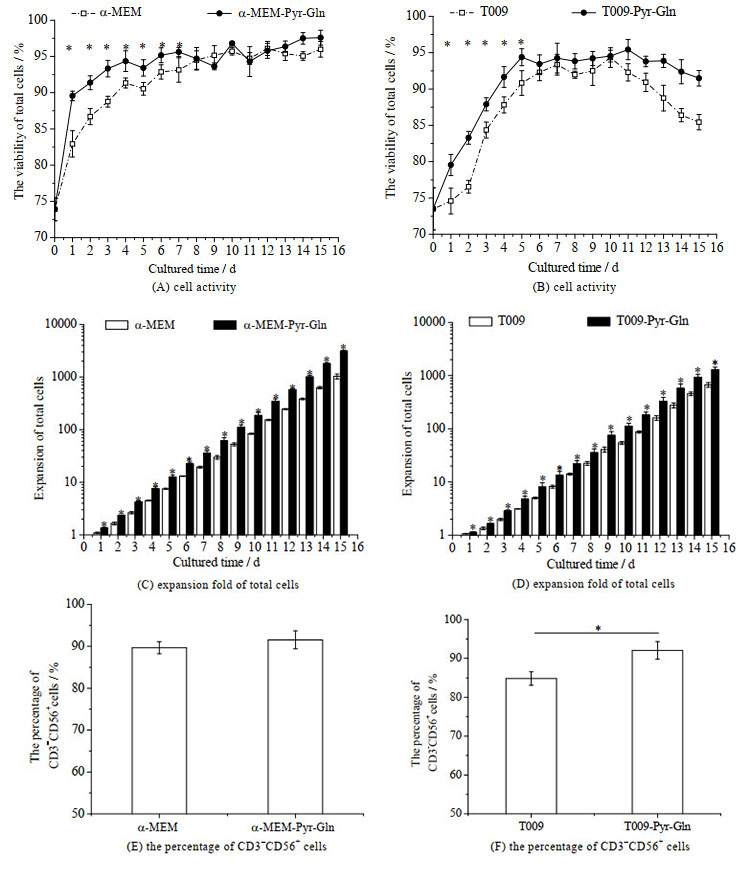
培养过程中的细胞活性、总细胞扩增倍数和培养物中CD3-CD56+细胞比例如图 6所示。由图 6(A)可知,在有血清实验组培养基中培养冻存复苏后的NK-92细胞,培养1 d后,其细胞活性可以快速由73.90%提高到90%以上,而对照组中NK-92细胞活性在第4 d才上升至90%;且在培养的1~7 d,实验组中细胞的活性均显著高于对照组(p < 0.05);由图 6(B)可见,在无血清实验组培养基中,培养1 d后,其细胞活性可以快速由73.90%提高到80%以上,而对照组中NK-92细胞活性在第3 d才上升至80%以上;且在培养的1~5 d,其活性均显著高于对照组(p < 0.05);在有/无血清实验组培养基中,培养15 d的总细胞扩增分为(3 117.74±120.21)倍和(1 282.35±162.68)倍,显著高于对照组的(1 031.86±111.13)倍和(672.06±68.18)倍(p < 0.05) (图 6(C)~(D));同时,在有血清培养基中,培养物中CD3-CD56+细胞比例为(91.53±2.14)%,与对照组中CD3-CD56+细胞比例(89.67±1.44)%相近(图 6(E))。而在无血清培养基中,培养物中CD3-CD56+细胞比例为(92.06±2.28)%,显著高于对照组中CD3-CD56+细胞比例(84.81±1.74)% (p < 0.05) (图 6(F))。可见,提高丙酮酸钠和谷氨酰胺浓度促进了冻存复苏后NK-92细胞的扩增。
|
图 6 有/无血清培养基中谷氨酰胺和丙酮酸钠对冻存后NK-92细胞活性、总细胞扩增倍数和CD3-CD56+细胞比例的影响(n = 3) Fig.6 Effects of glutamine and sodium pyruvate on NK-92 cell activity, expansion fold of total cells and the percentage of CD3-CD56+ cells in serum/serum-free media after cryopreservation (n = 3) *: p < 0.05 |
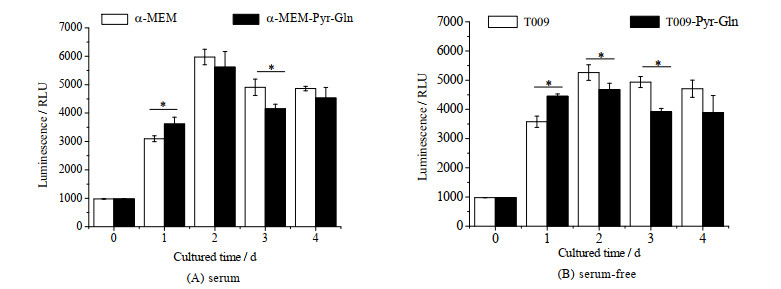
谷氨酰胺和丙酮酸钠与细胞的能量代谢密切相关,ATP是细胞内微环境的重要组成,是细胞合成代谢的关键因子,因此进一步分析NK-92细胞在提高了谷氨酰胺和丙酮酸钠浓度的有/无血清培养基中培养1~4 d的胞内ATP水平,结果如图 7所示。由图可知,冻存后NK-92细胞胞内ATP都呈现先上升后下降的变化趋势,并都高于冻存复苏起始值;培养1 d后,NK-92细胞胞内ATP均迅速回升,但在有/无血清培养基实验组中扩增的细胞胞内ATP水平显著高于对照组(p < 0.05);而在培养第3 d,其细胞胞内ATP水平显著低于对照组(p < 0.05)。由于ATP作为细胞的“能量通货”,其胞内水平是生成和消耗共同作用的结果。提高谷氨酰胺和丙酮酸钠浓度有助于三羧酸循环的转运,从而促进胞内ATP的生成。在培养早期细胞扩增不明显,细胞胞内ATP生成大于消耗,使得培养早期胞内ATP水平高,有助于细胞快速进入扩增状态;而后期细胞进入快速扩增状态,需要更多的ATP支持其快速生长,因而胞内ATP水平低。由此可见,谷氨酰胺和丙酮酸钠的补充提升了细胞的能量代谢水平从而促进了复苏后NK-92细胞的体外扩增。
|
图 7 有血清和无血清培养基中谷氨酰胺和丙酮酸钠对冻存后NK-92细胞胞内ATP的影响(n = 3) Fig.7 Effects of glutamine and sodium pyruvate on intracellular ATP of NK-92 cells in serum and serum-free media after cryopreservation (n = 3) *: p < 0.05 |
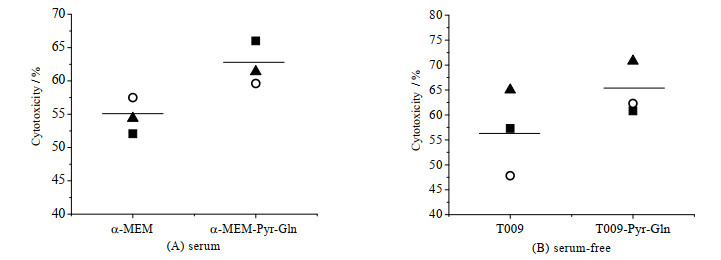
进一步评价扩增后的NK-92细胞的功能,结果如图 8所示。由图可知,在有/无血清实验组中培养冻存复苏的NK-92细胞的杀伤活性均值分别为62.33%和64.63%,高于对照组54.65%和56.70%。可见,补充谷氨酰胺和丙酮酸钠提高了NK-92细胞的杀伤活性。
|
图 8 在有血清和无血清培养基中谷氨酰胺和丙酮酸钠对冻存后NK-92细胞杀伤活性的影响(n = 3) Fig.8 Effects of glutamine and sodium pyruvate on the cytotoxicity of NK-92 cells after cryopreservation in serum and serum-free medium (n = 3) *: p < 0.05 |
本文基于自主设计的成分简单、明确的SFM-MIN无血清培养基分析了NK-92细胞氨基酸代谢特性,发现谷氨酰胺、丝氨酸、亮氨酸、异亮氨酸和苏氨酸这5中氨基酸在培养过程中消耗最为显著,其中尤以谷氨酰胺为甚。考虑苏氨酸,丝氨酸、亮氨酸以及异亮氨酸其合成途径均与丙酮酸有关,因此确定谷氨酰胺和丙酮酸钠为关键营养组分,通过正交实验确定了其最适浓度分别为13.0和2.5 mmol·L-1,并将含12.5%胎牛血清和12.5%马血清的α-MEM培养基和市售的商业化无血清培养基T009中谷氨酰胺和丙酮酸钠的浓度至提高至最适浓度,提高了未冻存和冻存后NK-92细胞的扩增倍数和杀伤活性。该结果为免疫细胞快速、高效扩增提供思路。
| [1] |
FANG F, WEI H X, TIAN Z G. NK cell-based immunotherapy for cancer[J]. Seminars in Immunology, 2017, 37-54. |
| [2] |
KIESSLING A, WEHNER R, BACHMANN M, et al. Advances in specific immunotherapy for prostate cancer[J]. European Urology, 2008, 53(4): 694-708. DOI:10.1016/j.eururo.2007.11.043 |
| [3] |
龚子祯, 蔡海波, 谭文松. 黄原胶支持CIK细胞高密度扩增[J]. 高校化学工程学报, 2019, 33(1): 128-133. GONG Z Z, CAI H B, TAN W S. CIK cells expansion in high density culture containing xanthan gum[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(1): 128-133. |
| [4] |
JING T J, WU C P, LU B F. Cytokine-induced killer cells promote antitumor immunity[J]. Journal of Translational Medicine, 2013, 11(1): 230-235. DOI:10.1186/1479-5876-11-230 |
| [5] |
王晓辉, 马俊, 张俊, 等. 不同冻存条件对细胞因子诱导的杀伤细胞的细胞表型及杀伤活性的影响[J]. 解放军医药杂志, 2017, 29(1): 58-62. WANG X H, MA J, ZHANG J, et al. Effects of different cryopreservation conditions on cell phenotype and killing activity of cytokine induced killer cells[J]. Medical & Pharmaceutical Journal of Chinese People's Liberation Army, 2017, 29(1): 58-62. DOI:10.3969/j.issn.2095-140X.2017.01.015 |
| [6] |
马冬磊, 林科佳, 陈晨, 等. Immune cell SR对冻存PBMNC诱导培养CIK的效果研究[J]. 中国实验血液学杂志, 2018, 26(3): 894-899. MA D L, LIN K J, CHEN C, et al. Efficiency of inducing CIK from cryopreserved PBMNC by using immune cell SR[J]. Journal of Experimental Hematology, 2018, 26(3): 894-899. |
| [7] |
JULIA C S, ANJA G, BEATRICE K, et al. Towards a xeno-free and fully chemically defined cryopreservation medium for maintaining viability, recovery, and antigen-specific functionality of PBMC during long-term storage[J]. Journal of Immunological Methods, 2012, 382(1/2): 24-31. |
| [8] |
GABER T, STREHL C, SAWITZKI B, et al. Cellular energy metabolism in T-lymphocytes[J]. International Reviews of Immunology, 2015, 34(1): 34-49. DOI:10.3109/08830185.2014.956358 |
| [9] |
MARCAIS A, CHERFILS-VICINI J, VIANT C, et al. The metabolic checkpoint kinase mTOR is essential for IL-15 signaling during the development and activation of NK cells[J]. Nature Immunology, 2014, 15(8): 749-757. DOI:10.1038/ni.2936 |
| [10] |
SINEAD E K, VANESSA Z, ROISIN M L, et al. Metabolic reprogramming supports IFN-γ production by CD56bright NK cells[J]. ThE0020Journal of Immunology, 2016, 196(6): 2552-2560. |
| [11] |
VERVERS F A, KALKHOVEN E, BOES M, et al. Immunometabolic activation of invariant natural killer t cells[J]. Frontiers in Immunology, 2018(9): 1192. |
| [12] |
MAH A Y, RASHIDI A, KEPPEL M P, et al. Glycolytic requirement for NK cell cytotoxicity and cytomegalovirus control[J]. JCI Insight, 2017, 2(23): e95128. DOI:10.1172/jci.insight.95128 |
| [13] |
JENSEN H, POTEMPA M, GOTTHART D, et al. Cutting edge:IL-2-induced expression of the amino acid transporters SLC1A5 and CD98 is a prerequisite for NKG2D-mediated activation of human nk cells[J]. Journal of Immunology, 2017, 199(6): 1967-1972. DOI:10.4049/jimmunol.1700497 |
| [14] |
VINICIUS C, MARCELO R M, KEVIN N K, et al. Glutamine:metabolism and immune function, supplementation and clinical translation[J]. Nutrients, 2018, 10(11): 1564. DOI:10.3390/nu10111564 |
| [15] |
李晓璐, 范里, 赵亮, 等. 基于单纯型设计和部件搜索方法的CHO细胞无血清培养基的高通量优化[J]. 高校化学工程学报, 2014, 28(4): 777-783. LI X L, FAN L, ZHAO L, et al. High Through-put screening and optimization of serum-free media development for CHO cells using simplex lattice and elements dialogue design methods[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(4): 777-783. DOI:10.3969/j.issn.1003-9015.2014.04.014 |
| [16] |
WANG Z, GUO L, SONG Y, et al. Augmented anti-tumor activity of NK-92 cells expressing chimeric receptors of TGF-βR Ⅱ and NKG2D[J]. Cancer Immunology, Immunotherapy, 2017, 66(4): 537-548. DOI:10.1007/s00262-017-1959-1 |
| [17] |
孔谦, 陈栋, 陈庄. 柱前衍生-反相高效液相色谱测定茶叶中19种氨基酸含量[J]. 食品科技, 2018, 43(10): 320-325. KONG Q, CHEN D, CHEN Z. Determination of amino acids in tea by reversed high performance liquid chromatography[J]. Food Science and Technology, 2018, 43(10): 320-325. |




