2. 温州生物材料与工程研究所, 浙江 温州 325000
2. Wenzhou Institute of Biomaterials and Engineering, Wenzhou 325000, China
1987年,美国国家科学基金会提出组织工程 ( Tissue Engineering ) 的概念,其概念为依据生命科学与工程学的相关原理,在动物正常和病理状况下,针对其机体的相关结构和功能,研制出用于修复人体病变组织或器官及促进其功能恢复的材料的一门科学。理想的骨组织工程材料应该具有良好的生物相容性、生物降解性、机械性能、三维贯通立体结构和表面活性[1~4]。支架材料、种子细胞和生长因子是骨组织工程学中的三个重要组成部分。骨组织工程通过制备具有良好的生物相容性及生物可降解性的生物支架,使成骨细胞、骨髓干细胞等在其上面粘附与增殖[5, 6]。骨组织修复支架一般需具备以下性能:第一,良好的生物相容性和生物降解性,支架材料在体内的降解不能对机体组织造成局部损伤,而且降解的速度和时间可以调控。第二,一定的抗压强度。支架在植入体内后,必须满足人体力学强度的要求,能够承受一定程度的变形和挤压。第三,一定的孔径、孔隙率和孔隙连通率。良好的孔径和孔隙率有利于细胞的粘附和增殖,对骨组织的修复具有重要作用;良好的孔隙连通率能够保证营养成分和代谢产物及时的输入和输出。研究表明,骨传导所要求的孔径为不小于80~100 μm[7, 8]。
针对的疾病不同,制备支架的方法也会有所相同。通过将骨修复材料制备成微球,然后在一定温度下将微球进行烧结来制备微球支架,是当今研究者通常使用的方法之一。经过烧结,微球之间可以相互粘结,使得微球支架具有一定抗压强度。但抗压强度提高的同时,由于微球之间的粘结程度过大,使得支架的孔隙率和孔隙连通率过低,不利于细胞在支架上的粘附与增殖。因此需要通过调节修复材料的添加量及制备条件来改善微球支架的抗压强度、孔隙率、孔隙连通率和平均孔径,使得各方面均满足骨组织修复的需求。PLGA是一种可生物降解的高分子聚合物,具有良好的生物相容性,因为PLGA降解是通过酯键断裂生成的单体酸、乳酸和羟基乙酸,最终产物为水和二氧化碳,不会产生对机体组织具有刺激性或毒性的物质[9, 10]。β-TCP含有丰富的Ca2+和P3+,且Ca2+和P3+的比例为1.5:1,是目前应用最为广泛的无机材料,在体内降解为Ca2+和P3+并以此提供给新生的骨组织,具有良好的细胞粘附性和生物相容性[11~14]。本实验主要研究的是将PLGA与β-TCP复合来制备微球支架,通过改变β-TCP的含量来调节微球支架的抗压强度、孔隙率及孔隙连通率,使得制备的PLGA/β-TCP微球支架在抗压强度上满足骨组织修复需求,同时其孔隙率和孔隙连通率也利于细胞在支架内部生长。
2 实验(材料和方法) 2.1 原材料PLGA(分子量:3.1万,50:50),济南岱罡生物科技有限公司;β-TCP;聚乙烯醇 (Poly(vinyl alcohol),PVA),分析纯,阿拉丁试剂(上海)有限公司;二氯甲烷(CH2Cl2),分析纯,广州化学试剂公司;无水乙醇,分析纯,广州化学试剂厂;Cell Counting Kit-8 (CCK-8),日本同仁;白鼠骨髓间充质干细胞,美国模式培养物集存库(ATCC);1×磷酸盐缓冲液(1×PBS),厦门海标公司;多聚甲醛,上海昊化化工有限公司;聚乙二醇辛基苯基醚(Triton X-100),上海索莱宝生物科技有限公司;荧光素标记F-肌动蛋白抗体(F-actin/FITC),上海研晶生化试剂有限公司;去离子水,自制。
JB-2磁力搅拌器,上海类此新泾仪器公司;FJ200-s均质机,上海标本;AE240分析天平,METTLER公司;35 L冻干机,美国Virtis公司;CQ-10超声波清洗器,上海超声波仪器厂;CS101-3A BN电热鼓风干燥箱,重庆永生实验仪器厂;STA 449C Jupiter型同步热分析仪,德国耐驰公司;Merlin扫描电子显微镜,德国蔡司公司;Instron 5567万能试验机,美国英斯特朗公司;Microfocus X-Ray HARRIER型Micro-CT仪,Metris UK System 公司;MK3酶标仪,美国Thermo公司;LSM 700激光共聚焦显微镜,德国蔡司公司。
2.2 微球制备将1 g PLGA溶于4 mL CH2Cl2中,超声振动15 min直至PLGA完全溶解。称取不同量的β-TCP(0 g,0.1 g,0.2 g,0.3 g和0.4 g)置于上述液体中,用均质机在5000 r⋅min-1条件下均质3 min使β-TCP均匀分散在液体中。称取3 g PVA置于300 mL去离子水中加热并搅拌,速度为300 r⋅min-1,在PVA完全溶解后缓慢滴加含有β-TCP的PLGA溶液,滴加过程中不断搅拌进而生成微球。搅拌6 h后,待CH2Cl2挥发至尽,取出微球,用去离子水清洗5次微球,再将微球进行冻干处理,去除微球中的水分,得到干燥的微球。
2.3 支架制备实验微球支架采用烧结法制备,将微球进行过筛,选择粒径为300~450 μm的微球,将微球装入到底部直径为5 mm、高度10 mm的柱形模具中,然后将装有微球的模具放在70℃的烘箱中加热1 h,加热结束后取出模具,使其自然冷却至室温,去除模具,得到支架。每个温度下的样品均有3个平行样。
2.4 测试表征微球热分析:采用德国耐驰公司STA 449C Jupiter型同步热分析仪。设定条件为温度变化区间是0℃至490℃,升温速度为10℃⋅min-1,氮气保护环境,测样品的TG (Thermal Gravity,热重法)曲线和DSC (Differential Scanning Calorimetry,差示扫描量热法)曲线。扫描电镜(Scanning Electron Microscopy,SEM)分析:采用德国蔡司公司Merlin扫描电子显微镜进行表面观察,样品观察前先做喷金处理。抗压强度分析:采用美国Instron 5567万能试验机测定微球支架的力学性能。用刀片切削支架两边,使其表面平整并且垂直于高度方向。将样品置于万能机的托盘中心,万能机的下降速率设定为1 mm⋅min-1,将支架压缩至5 mm。断层扫描(Computed Tomography,CT)分析:采用Metris UK System LTD的Microfocus X-Ray HARRIER型Micro-CT仪对微球支架进行断层扫描分析。工作电压为65 KV,电流为78 μA。测试中是沿着支架的高度方向一层层的扫描支架,每层厚度是8.4 μm,得到支架的“剖面图”,同时得到微球支架的孔隙率、孔隙连通率与平均孔径。
2.5 细胞相容性评价实验采用的是白鼠骨髓间充质干细胞。
(1) 将长有细胞的支架放置于96孔板中,用1×PBS漂洗两次。将漂洗后的支架用4%多聚甲醛固定,4 ℃下过夜。用0.1% Triton X-100 通透处理15 min,通透结束后用1×PBS漂洗两次。将漂洗后的支架置于F-actin/FITC中,避光处理1 min。处理完毕后取出支架,1×PBS漂洗两次,然后放置于激光共聚焦显微镜下观察并进行拍照处理。
(2) 避光条件下,CCK-8与培养基按照10:1比例配成工作液。细胞支架吸去培养基后,直接加入500 mL CCK-8工作液中,放入培养箱培养30 min。吹打混匀处理过细胞的CCK-8工作液,吸取100 mL到96孔板,每孔取3个平行样。将孔板置于酶标仪上进行读数,处理结果。
3 结果与讨论 3.1 微球和支架SEM分析图 1为5组微球和支架的SEM。从图A1中能够看到纯PLGA表面非常光滑,从图A2至图A5可以观察到,微球表面随着β-TCP的增多,微球表面的粗糙度逐渐增加。研究表面,适当的粗糙度利于组织修复时细胞和蛋白的吸附,而且β-TCP的降解产物中含有Ca和P离子,两者均为细胞生长的必需元素。从图B1至B5中能够看出,在同一温度下烧结相同时间,与其他4组微球支架相比,PLGA微球支架中球与球之间基本为面接触,粘结程度较大。随着β-TCP量的增多,微球之间的粘结程度逐渐下降。因为PLGA为高分子共聚物,其玻璃转化温度 (Tg) 为45~55℃,当温度高于其玻璃转化温度时,微球表面会熔化,从而微球之间相互粘结形成支架。图A2至A5显示微球表面随着β-TCP的增多粗糙度逐渐增大,并且β-TCP具有极好的热稳定性,因此微球表面的β-TCP在一定程度上阻碍了微球间的粘结,而且随着β-TCP量逐渐上升,阻碍的作用越明显,使得微球之间如图 1中B1至B5所示,由面接触逐渐变为点接触。

|
图 1 微球和支架SEM Fig.1 SEM micrographs of microspheres and scaffolds A1, B1: PLGA A2, B2: PLGA/β-TCP 0.1 A3, B3: PLGA/β-TCP 0.2 A4, B4: PLGA/β-TCP 0.3 A5, B5: PLGA/β-TCP 0.4 |
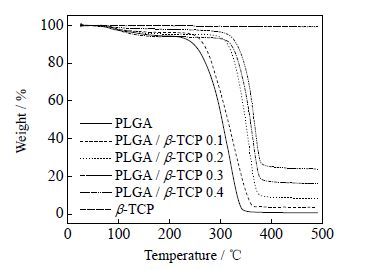
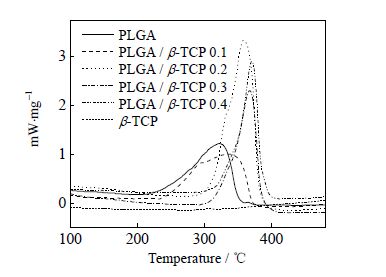
图 2为不同微球和β-TCP的TG曲线对比图。当温度上升至490℃时,β-TCP的质量损失仅为0.69%,说明β-TCP具有极好的热稳定性。5组微球样品加热至490℃时,其质量变化均非常明显,这是因为微球中PLGA在加热过程中分解的缘故。5组微球最终质量剩余量分别为0.67%、3.67%、8.14%、16.15%和23.85% (其理论值分别为0%、9.09%、16.67%、23.08%和28.57%),数据表明在制备过程中部分β-TCP并未添加至微球中。0.67%说明PLGA微球在加热到490℃时并未完全降解完毕,仍有少量残余。对比5组微球的TG曲线,可以看出随着β-TCP的添加量逐渐增加,实际添加至微球中的β-TCP的量也逐渐增多。 图 3为不同微球和β-TCP的DSC曲线对比图,5组样品的最快分解温度分别是322、335、359、367和371℃。可以看出PLGA微球的最快分解温度最低,随着β-TCP不断增加,微球的最快分解温度逐渐上升。这是因为PLGA中含有大量的C=O,并且同种基团之间相互排斥。其中C=O中的O对阳离子有吸附作用,因此在微球制备过程中C=O中的O与β-TCP中的Ca2+相互吸引,进而减弱了C=O与C=O之间的相互排斥,使得微球的稳定性上升。故随着β-TCP的增加,微球的最快降解温度会不断上升。
|
图 2 不同微球和β-TCP 的TG 曲线 Fig.2 TG curves of different microspheres and β-TCP |
|
图 3 不同微球和β-TCP 的DSC 曲线 Fig.3 DSC curves of different microspheres and β-TCP |
图 4是微球支架的抗压强度对比图。从图中可以看出,所有复合β-TCP的微球支架的抗压强度均大于纯PLGA微球支架的抗压强度,表明β-TCP可以明显增强PLGA支架的抗压强度,而且含β-TCP的微球支架抗压强度均在人体松质骨的抗压强度范围内(2~180 MPa)。同一温度下PLGA、PLGA/β-TCP 0.1、PLGA/β-TCP 0.2微球支架抗压强度逐渐增强,三种支架的抗压强度值分别为(1.39 ± 0.08) MPa、(3.50 ± 0.33) MPa和(6.05 ± 0.74) MPa。因为PLGA为高分子聚合物,具有较高的韧性,但抗压强度低;β-TCP为无机材料,具有较高的抗压强度,因此将β-TCP引入到PLGA微球当中,可以提升微球支架的抗压强度,而且随着抗压强度会随β-TCP的增多而增强。图 4中可以看到,随着β-TCP不断增多,微球支架的抗压强度没有持续增加,反而逐渐减小。PLGA/β-TCP 0.3、PLGA/β-TCP 0.4微球支架抗压强度分别为(5.25 ± 0.60) MPa和(3.34 ± 0.42) MPa。导致此现象的原因是由于微球表面的β-TCP过多,微球之间的连接程度太小,从而使得支架的抗压强度减小。这说明β-TCP对PLGA微球支架的抗压强度有双重作用,一是通过β-TCP本身的高强度来增加支架整体的抗压强度;二是通过减小微球之间的粘结来降低支架的抗压强度。

|
图 4 不同支架的抗压强度 Fig.4 Compressive strengths of different scaffolds |
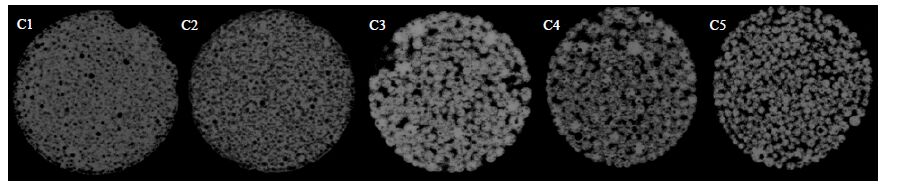
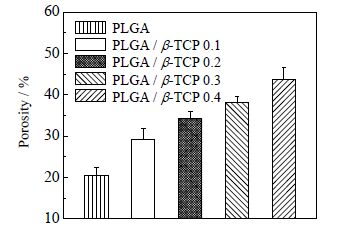
图 5为通过显微CT进行断层扫描后得到的支架图形,从图中可以得到支架内部的孔隙的大小及分布。通过测试分析,70℃温度下PLGA、PLGA/β-TCP 0.1、PLGA/β-TCP 0.2、PLGA/β-TCP 0.3和PLGA/β-TCP 0.4微球支架的平均孔径分别为30.83、51.67、70.73、84.34和89.59 μm。其中PLGA/β-TCP 0.3和PLGA/β-TCP 0.4微球支架的平均孔径大于细胞进入支架的最小孔径(80 μm),因此在此条件下的微球支架表面和内部均能够为细胞的粘附与增值提供良好的附着位点,同时也有利于液体在支架内部的流动。从支架的横向剖面图中也可以清晰的看出支架内部球与球之间的连接程度,其中大部分球之间的连接由面接触逐渐转变为点接触,因此微球支架的孔隙率会不断增大。图 6为5组支架的孔隙率,分别为(20.54 ± 1.97)%,(29.32 ± 2.50)%,(34.21 ± 1.73)%,(38.15 ± 1.38)%和(43.73 ± 2.82)%。从图 5中可以看出当微球之间主要为面接触时,孔隙与孔隙之间的连通率较小,造成支架内部存在许多孤立的孔,而随着β-TCP的不断增加,微球之间的粘结程度逐渐下降,支架中孤立的孔会逐渐减少,使得支架内部的孔隙连通率逐渐上升。图 7为5组支架的孔隙连通率对比图,分别为(9.29 ± 3.58)%、(19.37 ± 4.71)%、(40.94 ± 3.70)%、(60.04 ± 7.47)%和(75.29 ± 6.75)%。
|
图 5 支架断层扫描图像 Fig.5 CT images of different scaffolds C1: PLGA C2: PLGA/β-TCP 0.1 C3: PLGA/β-TCP 0.2 C4: PLGA/β-TCP 0.3 C5: PLGA/β-TCP 0.4 |
|
图 6 不同支架的孔隙率 Fig.6 Porosity of different scaffolds |

|
图 7 不同支架的孔隙连通率 Fig.7 Pore connection rates of different scaffolds |
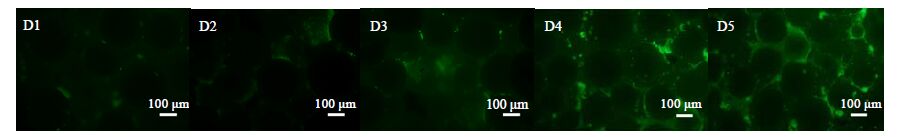
培养4 d后,PLGA支架、PLGA/β-TCP 0.1支架、PLGA/β-TCP 0.2支架、PLGA/β-TCP 0.3支架和PLGA/β-TCP 0.4支架的激光共聚焦图如图 8所示。从图中可以看到随着支架中β-TCP的增多,相同时间内粘附在支架上细胞的数目也会增加,说明β-TCP提升了支架的细胞相容性。
|
图 8 细胞粘附支架的激光共聚焦图像 Fig.8 Confocal laser scanning microscope images of cell adhesion and growth on scaffolds D1: PLGA D2: PLGA/β-TCP 0.1 D3: PLGA/β-TCP 0.2 D4: PLGA/β-TCP 0.3 D5: PLGA/β-TCP 0.4 |
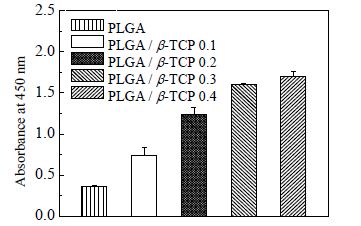
从图 9的结果分析,在培养4 d后,与纯PLGA支架相比,其他4组支架的细胞数目明显较多,说明β-TCP的加入,有利于细胞的增殖。其原因主要有两个:一是β-TCP的加入使得微球表面变得粗糙,不利于微球之间的粘连,因此孔隙率上升,为细胞增加了附着位点。第二是Ca和P元素为细胞增殖所必需元素,因此β-TCP的引入有利于细胞的增殖。图 9说明β-TCP越多,越利于细胞的增殖。
|
图 9 CCK-8 表征支架的细胞增殖 Fig.9 CCK-8 assay results of cell proliferation on scaffolds |
随着β-TCP量的不断增加,PLGA微球表面的粗糙度增加。在支架制备过程中,微球表面的β-TCP对微球之间的粘结有阻碍作用,随着β-TCP的增多微球之间的粘结程度会逐渐减小,孔隙率、孔隙连通率和平均孔径会随之升高,且β-TCP在含量高于0.3 g时,微球平均孔径大于80 μm,高于细胞在支架内部生长所需要的最小孔径。支架的抗压强度会先增加后减小,在β-TCP为0.2 g时抗压强度最大。支架的细胞相容性会随着β-TCP 的增多而增强。数据显示,PLGA/β-TCP 0.2 微球支架具有最高的抗压强度,但平均孔径低于80 μm,不利于细胞在支架内部生长。PLGA/β-TCP 0.4 微球支架虽具有最好的细胞相容性,但抗压强度偏低,限制了其在骨组织修复上的应用。因此从抗压强度、支架平均孔径和细胞相容性等方面综合分析,PLGA/β-TCP 0.3 微球支架在骨修复方面具备较好的应用价值。
| [1] | MENG Yong-chun (孟永春). Research on the interaction mechanical between the collagen and bioactive glass and their composite as bone repair material (胶原与生物活性玻璃作用机理及其复合骨修复材料的研究) [D]. Guangzhou (广州): South China University of Technology (华南理工大学), 2010. http://cdmd.cnki.com.cn/article/cdmd-10561-1011044051.htm |
| [2] | Masson N C, DeSouza E F, Galembeck F . Calcium and iron (III) polyphosphate gel formation and aging[J]. Colloid Surface A:Physicochemical and Engineering Aspects , 1997, 121 (2-3) : 247-255 DOI:10.1016/S0927-7757(96)03985-4 |
| [3] | Roy T D, Simon J L, Ricci J L . Performance of degradable composite bone repair products made via three-dimensional fabrication techniques[J]. Journal of Biomedical Materials Research Part A , 2003, 66A (2) : 283-291 DOI:10.1002/(ISSN)1097-4636 |
| [4] | Specchia N, Pagnotta A, Greco F. Can porosity influence the osteoconductive properties of synthetic hydroxyapatite?[C]. Switzerlard, Key Engineering Materials, 2000:355-358. http://cn.bing.com/academic/profile?id=2147239509&encoded=0&v=paper_preview&mkt=zh-cn |
| [5] | Wang M . Developing bioactive composite materials for tissue replacement[J]. Biomaterials , 2003, 24 (13) : 2133-2151 DOI:10.1016/S0142-9612(03)00037-1 |
| [6] | Zhou X, Yan Y N, Wang S G . Fabrication of porous scaffolds for bone tissue engineering via low-temperature deposition[J]. Scripta Materialia , 2002, 46 (11) : 771-776 DOI:10.1016/S1359-6462(02)00071-4 |
| [7] | Farooq A, Yar M, Khan A S . Synthesis of piroxicam loaded novel electrospun biodegradable nanocomposite scaffolds for periodontal regeneration[J]. Materials Science and Engineering:C Materials for Biological Application , 2015, 56 (1) : 104-113 |
| [8] | Zhang J, Deng A P, Yang Y . HPLC detection of loss rate and cell migration of HUVECs in a proanthocyanidin cross-linked recombinant human collagen-peptide (RHC)-chitosan scaffold[J]. Materials Science and Engineering:C Materials for Biological Application , 2015, 56 : 555-563 DOI:10.1016/j.msec.2015.07.019 |
| [9] | SONG Ke-dong(宋克东), LIU Tian-qing(刘天庆), GUO Wen-hua(郭文华) . Sustained releasable chitosan scaffolds embedded with PLGA microspheres(包埋PLGA微球的可控释壳聚糖支架材料的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2010, 24 (6) : 985-992 |
| [10] | Ma Z G, Zhao N, Xiong C D . Degradation and miscibility of poly(DL-lactic acid)/poly(glycolic acid) composite films:effect of poly(DL-lactic-co-glycolic acid)[J]. Bulletin of Materials Science , 2012, 35 (4) : 575-578 DOI:10.1007/s12034-012-0326-2 |
| [11] | Moreira A D, Sader M S, Soares G D . Strontium incorporation on microspheres of alginate/β-tricalcium phosphate as delivery matrices[J]. Materials Research Ibero American Journal of Materials , 2014, 17 (4) : 967-973 |
| [12] | Lee H B, Lim H J, Cho M . Clinical significance of beta-tricalcium phosphate and polyphosphate for mastoid cavity obliteration during middle ear surgery:Human and Animal Study[J]. Clinical and Experimental Otorhinolaryngology , 2013, 6 (3) : 127-134 DOI:10.3342/ceo.2013.6.3.127 |
| [13] | Rodrigues P L, Almeida F S, Motisuke M . Effect of alumina addition on the physical and mechanical properties of β-tricalcium phosphate[J]. Ceramic , 2012, 58 (347) : 368-373 |
| [14] | Yang L, Sun H Y, Qi N M . The effects of beta-tricalcium phosphate 3D scaffold in-situ cryopreservation on the migration rate and osteogenic ability of mesenchymal stem cells[J]. Biotechnology and Bioprocess Engineering , 2012, 17 (1) : 195-202 DOI:10.1007/s12257-011-0132-5 |




