2. 浙江工业大学 温州科学技术研究院,浙江 温州 325011
2. Wenzhou Institute of Science and Technology, Zhejiang University of Technology, Wenzhou 325011, China
硫酸钡(BaSO4)是一种理化性质优良的化工原料,具有无毒害、高密度、高白度,能吸收X射线和耐酸碱等性能,作为功能环保材料广泛用于涂料、油墨、造纸、橡胶、塑料、陶瓷、医疗等领域[1-3]。目前,国内生产BaSO4大多采用较为成熟的芒硝-黑灰法工艺,生产的BaSO4粒度分布广、纯度低,只能作为一般涂料使用,大大限制了BaSO4在高档油漆、涂料中的使用。为了得到高品质的沉淀BaSO4,许多学者不断探索新的方法,目前主要有直接沉淀法[4-5]、络合沉淀法[6-8]、微反应器法[9]、微乳液法[10]和表面活性剂法[11-12]等。其中直接沉淀法具有工艺简单、能耗低、生产周期短、适应性强等优点,但直接沉淀法难以控制BaSO4产品的形貌和粒度,导致所得BaSO4稳定性差。因此,通过改进直接沉淀法制备粒度小、形貌规整的沉淀BaSO4是当务之急。
络合沉淀法是近年来得到广泛关注的一种制备沉淀BaSO4的湿化学方法,其特点之一就是通过络合剂来实现对BaSO4粒度和形貌的控制,便于研究BaSO4的各种特性。ZHANG等利用EDTA在液-液反应中制备出了粒径1 μm的球状BaSO4,EDTA与BaSO4相互作用机制主要归因于Ba2+与羧酸酯基团的相互作用[13-14]。目前,EDTA络合法仅仅局限于液-液沉淀反应制备球状BaSO4,其在固-液反应制备沉淀BaSO4的应用中鲜有报道。
本文以BaCO3、Na2SO4为原料,采用EDTA络合-球磨法在室温条件下制备超细沉淀BaSO4。络合剂EDTA与Ba2+发生络合反应,生成稳定的EDTA-Ba络合物,减少反应体系中游离Ba2+的数量。沉淀剂SO42-加入后与Ba2+进行沉淀反应,获得粒度均匀、分散性好的BaSO4颗粒。本文系统考察BaCO3浓度、反应时间、EDTA添加量、Na2SO4添加速度、络合转速和络合时间对BaSO4颗粒粒度及形貌的影响,并对反应机理进行探究。
2 实验 2.1 试剂与仪器试剂原料:碳酸钡(BaCO3),硫酸钠(Na2SO4),乙二胺四乙酸二钠(EDTA),硫酸,氢氧化钠,所用试剂均为分析纯,实验用水为去离子水。
表征仪器:X射线衍射仪(XRD),日本Ultima型,扫描区间为10°~80°,扫描速度10°·min-1;丹东百特激光粒度分析仪,BT-9300H;傅里叶红外光谱仪(FTIR),Nicolet型,KBr压片制样,波数范围为4 000~500 cm−1;场发射扫描电子显微镜(FE-SEM),美国NanoNova450。
2.2 超细BaSO4制备称取0.2 mol BaCO3于立式搅拌球磨罐中,加入1 L去离子水和710 g氧化锆球磨珠,室温下以500 r·min-1搅拌15 min后加入0.2 mol EDTA,以150 r·min-1搅拌络合30 min。随后称取0.24 mol Na2SO4,配置为溶液以20 mL·min-1的速度滴加到球磨罐中,滴加完毕后每隔1 h测定溶液pH,并用NaOH或H2SO4调控反应体系pH = 9。分别在反应进行1,2,3,4,5和7 h时取样,测试产物粒度。反应结束后,将得到的乳浊液进行抽滤、洗涤、烘干、研磨后即得到超细沉淀BaSO4。
2.3 BaSO4纯度的测试方法依据GB/T 2899-2008《工业沉淀BaSO4》,采用以下方法测试BaSO4含量:取质量M(g)产物于烧杯中,加入足量20%的盐酸,充分反应后称量剩余产物质量m(g),由式(1)得出BaSO4的纯度ω(%):
| $ \omega=\frac{m}{M} \times 100 \% $ | (1) |
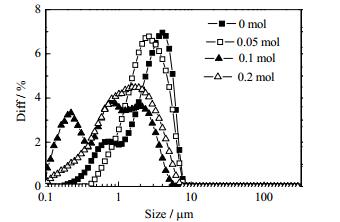
图 1为不同EDTA添加量对生成BaSO4的粒度分布曲线图。当未添加EDTA时,BaSO4的粒径分布在0.1~10 μm,加入0.05 mol EDTA后,BaSO4的平均粒径为2.39 μm,较不添加EDTA时有所下降。当EDTA添加量为0.1和0.2 mol时,生成的BaSO4平均粒径为0.814和1.306 μm,,说明EDTA作为反应控制剂能有效调控生成的BaSO4粒径。在EDTA添加量为0.2 mol时得到BaSO4粒径较EDTA添加量为0.1 mol时变化不大,推测原因为EDTA的添加导致体系Ba2+形成的更为稳定的Ba-EDTA网络结构,更有效地控制了反应体系中游离Ba2+的浓度,从而生成粒度更小的BaSO4颗粒。考虑到实验成本,EDTA优化添加量为0.1 mol。
|
图 1 不同EDTA添加量制备所得BaSO4颗粒的粒度分布图 Fig.1 Particle size distributions of BaSO4 particles obtained with different concentrations of EDTA |
未加EDTA和添加0.1 mol EDTA制备的BaSO4形貌图如图 2所示。由图 2(a)可见,未添加EDTA制备的BaSO4颗粒较大,颗粒形状不规则;由图 2(b)可见,添加EDTA制备的BaSO4颗粒较小,颗粒形状呈较规则的棒状,说明EDTA可以有效地改善和控制BaSO4的形貌。颗粒沉淀通常需经晶核形成和晶核长大两个过程[15],添加EDTA制备BaSO4反应过程中,主要分为络合反应和沉淀反应,反应方程式如下:

|
图 2 未添加EDTA(a)和添加EDTA BaSO4(b)颗粒的SEM图 Fig.2 SEM micrographs of BaSO4 particles obtained without (a) and with (b) EDTA |
络合反应:
沉淀反应:
未添加络合剂EDTA时,由于BaSO4的溶度积很小(Ksp = 1.1×10-10),当Ba2+与SO42-接触瞬间沉淀反应就已经完成,同时产生大量晶核,此时晶粒细小,比表面积大,表面能高,极容易发生团聚。
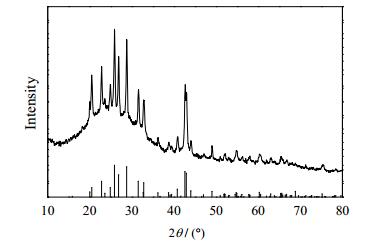
图 3为添加0.1 mol EDTA制备BaSO4的XRD图。从图中可以看出,每个特征峰都与正交晶系BaSO4标准卡片((PDF#24−1035)一一对应,峰形尖锐,无杂质相,说明产物为晶相完整的正交晶系BaSO4,添加EDTA未改变BaSO4的晶相结构[16]。由Scherrer公式计算2θ = 25.88°衍射峰得到BaSO4的晶粒尺寸为39.3 nm。
|
图 3 添加EDTA制备的BaSO4的XRD图谱 Fig.3 XRD pattern of BaSO4 particles obtained with EDTA |
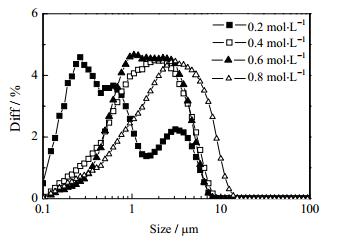
控制实验条件为:x(BaCO3):x(EDTA):x(Na2SO4) = 1:0.5:1.2,反应体系pH = 9,搅拌7 h反应得到的沉淀BaSO4为测试样品,考察不同BaCO3浓度对制备得到的沉淀BaSO4的粒度的影响,结果如图 4所示。由图 4可以看出,随着BaCO3浓度的增大,BaSO4的平均粒径由0.503增大到2.105 μm,粒径分布在0.1~10 μm,这是由于过饱和度是晶体形成和晶体生长的主要驱动力,随着BaCO3浓度增大,混合溶液的过饱和度会增大,晶核形成和生长速率也会增大[17-18],BaSO4成核速率低于生长速率时会导致平均粒径的增大。
|
图 4 不同BaCO3浓度制得的BaSO4的粒度分布图 Fig.4 Particle size distributions of BaSO4 particles obtained with different concentrations of BaCO3 |
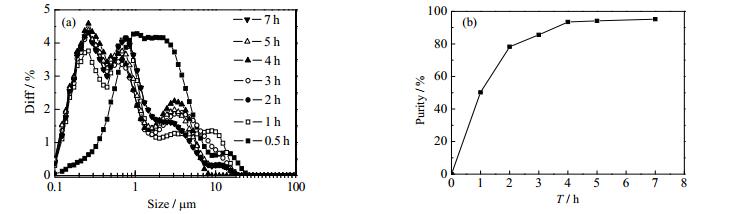
控制实验条件为:BaCO3浓度为0.2 mol·L-1,x(BaCO3):x(EDTA):x(Na2SO4) = 1:0.5:1.2,反应体系pH = 9,搅拌反应一定时间(0.5、1、2、3、4、5、7 h)后得到的沉淀BaSO4为测试样品,考察不同反应时间对制备得到的沉淀BaSO4的粒度和纯度的影响。图 5(a)为不同反应时间制备的BaSO4的粒度曲线图。可以看出,随着反应时间的增加,BaSO4粒径逐渐减小,并且粒径小于2 μm的粒子含量增大,在反应4 h时的产物平均粒为0.503 μm,分布范围为0.1~5.61 μm,纯度达到了93.42%。结合实验效率和节约能源来看,4 h的反应时间是较为合适。
|
图 5 不同反应时间制得的BaSO4的粒度分布图(a)和纯度图(b) Fig.5 Particle size distributions (a) and purity (b) of BaSO4 particles obtained under different reaction times |
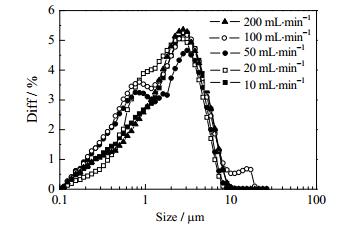
控制实验条件为:BaCO3浓度为0.2 mol·L-1,x(BaCO3):x(EDTA):x(Na2SO4) = 1:0.5:1.2,反应体系pH = 9,搅拌反应7 h后得到的沉淀BaSO4为测试样品,以5种滴加速度向乳浊液中加入Na2SO4溶液来研究沉淀剂加入速率对制备的BaSO4粒度的影响,BaSO4的粒度分布如图 6所示。
|
图 6 不同Na2SO4溶液滴加速度制得的BaSO4粒度分布图 Fig.6 Particle size distributions of BaSO4 particles obtained with different dropping speeds of Na2SO4 |
由图 6可见,5种滴速条件下得到的BaSO4的粒度变化不大,这是因为EDTA与Ba2+形成的Ba-EDTA络合网络很好的控制体系中的Ba2+的浓度,避免了SO42-急剧增多时大量BaSO4晶核生成而引起的团聚。
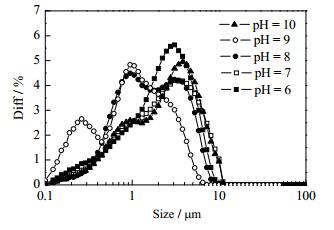
3.5 pH对BaSO4粒度和形貌的影响控制实验条件为:BaCO3浓度为0.2 mol·L-1,x(BaCO3):x(EDTA):x(Na2SO4) = 1:0.5:1.2,搅拌反应7 h得到的沉淀BaSO4为测试样品,考察不同反应体系pH对制备的沉淀BaSO4的粒度和形貌的影响。由图 7可以看出,随着pH的增大,BaSO4平均粒径先减小后增大,pH = 10时粒径发生显著增大,同时形貌也相应的发生了转变。根据络合条件形成常数方程:
| $ \lg K_{\mathrm{M}-\mathrm{EDTA}}^{\prime}=\lg K_{\mathrm{M}-\mathrm{EDTA}}-\lg \alpha_{\mathrm{EDT} A(\mathrm{H})} $ | (2) |
|
图 7 不同反应体系pH制得的BaSO4的粒度分布图 Fig.7 Particle size distributions of BaSO4 particles obtained with different pH |
其中,KM-EDTA为稳定常数,
|
|
表 1 不同pH条件下Ba-EDTA配合物的lgKM-EDTA、 |

|
图 8 不同pH条件下制备所得BaSO4颗粒的SEM图 Fig.8 SEM micrographs of BaSO4 particles obtained at different pH (a) pH = 6 (b) pH = 7 (c) pH = 8 (d) pH = 9 (e) pH = 10 |
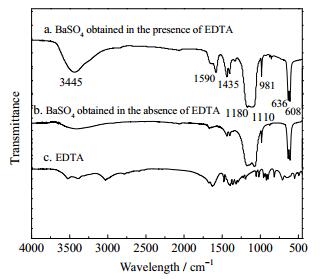
为了探究最优条件下制备的BaSO4颗粒的表面性质,利用KBr压片法对样品进行红外光谱分析,所得光谱图如图 9所示。由图 9可知,位于1 180,1 110,981,636和608 cm-1处的吸收峰为BaSO4的特征吸收峰[20]。位于3 445 cm-1处平滑且宽的峰为样品中所含水分子的伸缩振动峰,1 435 cm-1处为OH的弯曲振动吸收峰。已有文献指出非电离化和非配位的COOH的不对称拉伸特征峰范围是1 750~1 700 cm-1,离子化或配位的COO-的伸缩振动吸收峰处在范围在1 650~1 590 cm-1,且COO-的出现位置与金属离子的的性质有着密切关系[21]。图 9a中1 590 cm-1处出现了COO-的伸缩振动吸收峰,表明EDTA吸附在BaSO4表面,相比于其他特征吸收峰该峰较弱,可能原因是大部分EDTA在离心洗涤的过程中流失。
|
图 9 优化条件下添加EDTA和未添加EDTA制备的BaSO4颗粒的FTIR图 Fig.9 FTIR spectra of BaSO4 particles obtained with and without EDTA under optimum reaction conditions |
以BaCO3为钡源,采用EDTA络合-球磨法在室温下制备了粒度均匀、棒状团簇状的沉淀BaSO4,SEM观测BaSO4平均粒径约为130 nm。确定的优化工艺条件为BaCO3浓度为0.2 mol·L-1,BaCO3、EDTA、Na2SO4摩尔质量比为1:0.5:1.2,反应体系pH = 8,反应时间4 h。随着反应时间的增长,BaSO4平均粒径减小,优化反应时间4 h时BaSO4纯度为93.42%;BaSO4的平均粒径随着BaCO3浓度增大而增大,其粒度分布变化不大。FTIR分析表明,少量EDTA吸附在BaSO4表面。
| [1] |
MATHUR S, SHEN H, ALTMAYER J. Nanostructured functional ceramic coatings prepared by molecule-based chemical vapor deposition[J]. Reviews on Advanced Materials Science, 2007, 15(1): 16-23. |
| [2] |
SUN Y Y, ZHANG F, WU D X, et al. Roles of polyacrylate dispersant in the synthesis of well-dispersed BaSO4 nanoparticles by simple precipitation[J]. Particuology, 2014, 14(3): 33-37. |
| [3] |
王晓辉, 蒋斌波, 陈纪忠. 溶析结晶法制备高纯度亚微米硫酸钡粒子[J]. 无机材料学报, 2005, 20(4): 801-807. WANG X H, JIANG B B, CHEN J Z. Preparation of barium sulfate submicro-particals with high purity by solvening-out process[J]. Journal of Inorganic Materials, 2005, 20(4): 801-807. DOI:10.3321/j.issn:1000-324X.2005.04.006 |
| [4] |
NANDAKUMAR N, KURIAN P. Chemosynthesis of monodispersed porous BaSO4 nano powder by polymeric template process and its characterisation[J]. Powder Technology, 2012, 224: 51-56. DOI:10.1016/j.powtec.2012.02.022 |
| [5] |
WONG D C Y, JAWORSKI Z, NIENOW A W. Effect of ion excess on particle size and morphology during barium sulphate precipitation: An experimental study[J]. Chemical Engineering Science, 2001, 56(3): 727-734. DOI:10.1016/S0009-2509(00)00282-7 |
| [6] |
CHEN Q, SHEN X. Formation of mesoporous BaSO4 microspheres with a larger pore size via Ostwald pipening at room temperature[J]. Crystal Growth & Design, 2010, 10(9): 3838-3842. |
| [7] |
HU L, WANG G, YANG C, et al. Fabrication of submicron barium sulfate aggregates in the presence of ethylenediaminetetraacetic acid anions[J]. Particuology, 2015, 22(5): 157-162. |
| [8] |
ZHAO Y H, LIU J R. Effect of EDTA and phosphate on particle size during precipitation of nanosized baso4 particles[J]. Chemistry Letters, 2006, 35(9): 1040-1041. DOI:10.1246/cl.2006.1040 |
| [9] |
赵华, 刘洪杰, 朱建伟, 等. 微反应器制备纳米BaSO4研究[J]. 无机盐工业, 2008, 40(1): 29-31. ZHAO H, LIU H J, ZHU J W, et al. Preparation of nano-sized barium sulfate by micro-reactor[J]. Inorganic Chemicals Industry, 2008, 40(1): 29-31. DOI:10.3969/j.issn.1006-4990.2008.01.010 |
| [10] |
NIEMANN B, KAI S. Reduced discrete population balance model for precipitation of barium sulfate nanoparticles in non-ionic microemulsions[J]. Chemical Engineering Journal, 2008, 143(1-3): 314-325. DOI:10.1016/j.cej.2008.06.012 |
| [11] |
HU L, WANG G, CAO R, et al. Fabrication and surface properties of hydrophobic barium sulfate aggregates based on sodium cocoate modification[J]. Applied Surface Science, 2014, 315(1): 184-189. |
| [12] |
LI J, LIU D, JIANG H, et al. Effects of polyacrylic acid additive on barium sulfate particle morphology[J]. Materials Chemistry & Physics, 2016, 175: 180-187. |
| [13] |
JONES F, JONES P, OGDEN M I, et al. The interaction of EDTA with barium sulfate[J]. Journal of Colloid & Interface Science, 2007, 316(2): 553-561. |
| [14] |
ZHANG M, ZHANG B, LI X, et al. Synthesis and surface properties of submicron barium sulfate particles[J]. Applied Surface Science, 2011, 258(1): 24-29. DOI:10.1016/j.apsusc.2011.07.137 |
| [15] |
黄洁芳, 刘俊康. 粒度及分布可控的亚微米级硫酸钡的制备研究[J]. 应用化工, 2015, 44(3): 423-427. HUANG J F, LIU J K. Synthesis of sub-micron grade barium sulfate with controllable particle size and distribution[J]. Applied Chemical Industry, 2015, 44(3): 423-427. |
| [16] |
WANG S, LIU R, YAO J, et al. Fabrication of mesoporous magnesium substituted β-tricalcium phosphate nanospheres by self-transformation and assembly involving EDTA ions[J]. Microporous & Mesoporous Materials, 2013, 179(4): 172-181. |
| [17] |
RENZO F D. Zeolites as tailor-made catalysts: Control of the crystal size[J]. Catalysis Today, 1998, 41(1-3): 37-40. DOI:10.1016/S0920-5861(98)00036-4 |
| [18] |
林晓, 李新海, 周湘君, 等. 络合法制备纳米BaSO4及其影响因素的分析[J]. 广东微量元素科学, 2010, 17(4): 25-32. LIN X, LI X H, ZHOU X J, et al. Preparation of nanobarium sulfate complexation and analysis of its impact factors[J]. Guangdong Trace Elements Science, 2010, 17(4): 25-32. DOI:10.3969/j.issn.1006-446X.2010.04.005 |
| [19] |
张明, 李新海, 胡启阳, 等. EDTA络合法合成硫酸钡微粒[J]. 中国有色金属学报, 2009, 19(8): 1511-1516. ZHANG M, LI X H, HU Q Y, et al. Synthesis of barium sulfate particles by complexation method in presence of EDTA[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(8): 1511-1516. DOI:10.3321/j.issn:1004-0609.2009.08.025 |
| [20] |
BALA H, FU W Y, ZHAO J Z, et al. Preparation of BaSO4 nanoparticles with self-dispersing properties[J]. Colloids and Surfaces, 2005, 252: 129-134. DOI:10.1016/j.colsurfa.2004.10.064 |
| [21] |
NAKAMOTO K. Infrared and ramanspectra of inorganic and coordination compounds, parts A and B[J]. Theory & Applications in Inorganic Chemistry, 1963, p(5): 88-97. |




