2. 五邑大学 生物科技与大健康学院, 广东 江门 529020;
3. 汕头大学 海洋灾害预警与防护广东省重点实验室, 广东 汕头 515063
2. School of Biotechnology and Health, Wuyi University, Jiangmen 529020, China;
3. Guangdong Provincial Key Laboratory of Marine Disaster Prediction and Prevention, Shantou University, Shantou 515063, China
药物及个人护理品(PPCPs)广泛应用于人们的生活,因此在水环境中被频繁检出(浓度数量级为ng·L−1~mg·L−1)[1-5]。近年来PPCPs类新污染物的去除引起了人们极大关注。研究表明,基于波长为254 nm紫外光(UV)联合NaClO工艺可以生成羟基自由基(HO⋅)等强氧化性自由基,并以活性自由基为主导通过取代(脱氢)、加成和电子转移等反应实现对PPCPs等新污染物的去除[6-9]。与UV相比,真空紫外线(VUV,波长为100~200 nm)具有更强的辐射能量,不仅可以直接光解有机污染物,还可以直接光解水产生HO⋅、氢原子(H⋅)和水合电子等自由基去除目标物[10]。VUV/UV/NaClO及UV/NaClO工艺去除PPCPs类污染物已有诸多报道,但pH、CO32−、NO3−和腐殖酸(HA)等水质因素对2种工艺的对比影响尚有待进一步研究。
百里香酚(Tml)通常用于制作香料、保鲜剂及杀虫剂,在地表水和污水等水体环境中均有检出,浓度范围为ng·L–1~ μg·L–1[11-13]。Tml具有较强的生化活性、毒性、环境持久性和生物累积性,对人类健康和生态安全具有潜在的危害[14]。在VUV/UV/NaClO工艺去除Tml过程中,自由基的稳态浓度及NaClO浓度对Tml去除及协同效应的影响已有初步研究,但未涉及协同工艺应用于水处理的安全性 [10]。鉴此,本研究以Tml为目标污染物,采用VUV/UV/NaClO和UV/NaClO工艺对比考察了pH、CO32−、NO3−和腐殖酸(HA)对Tml去除的影响。鉴定了降解产物、提出了Tml的可能降解途径并识别了毒性产物,考察生态安全性,以期为全面评估VUV/UV/NaClO工艺降解水环境中微量污染物提供理论支撑和基础数据。
2 材料与方法 2.1 试验试剂与仪器Tml (德国Dr.Ehrenstorfer公司,质量分数 > 99.9%);次氯酸钠(NaClO) (上海国药集团,CP,活性氯体积分数≥5.2%);乙酸(上海国药集团,AR);盐酸(上海国药集团,AR,质量分数为36%~38%);五水合硫代硫酸钠(Na2S2O3⋅5H2O)(上海安谱公司,AR);硝基苯(NB,质量分数为99%);苯甲酸(BA,质量分数为99.5%);氢氧化钠(天津科密欧,AR,质量分数≥96.0%);甲醇(HPLC级,德国Merck);乙腈(HPLC级,德国Merck);叔丁醇(TBA)(上海安谱公司,AR);ExTab余氯试剂药片(上海三信仪表厂);BioFix® Lumi Multi-Shot冻干细菌及激活液;HA (上海Aladdin)。
高效液相色谱仪(Agilent 1260 LC,美国);VUV/UV和UV低压汞灯(波长为185/254 nm和254 nm,北京航天宏达);液相色谱质谱联用仪(LCMS–1200,安捷伦科技有限公司);发光细菌毒性检测仪(LumiFox6800,深圳朗石科学仪器);紫外线强度计(TN–2365A,台湾泰纳);恒温振荡器(VORTEX 3,德国IKA);余氯计(CL200,上海三信仪表厂);真空干燥箱(DZF-6050,上海精宏);纯水机(Milipore,美国);磁力恒温搅拌器(HJ-6A,江苏金坛峥嵘仪器);pH计(Ohaus,美国)。
2.2 实验方法如图 1所示,反应装置主体由2种UV光源(185/254 nm、254 nm)和容量为300 mL特制圆筒形石英玻璃器皿组成,外置高纯石英套管(厚度为1 mm,内径为22 mm,长为250 mm)。实验温度为25 ℃,实验用水均为Milli–Q超纯水(电导率≤18.2 MΩ)。实验前用HCl或NaOH溶液调节溶液pH至设定值,反应溶液中Tml初始质量浓度均为500 µg·L−1,加入0.2~0.4 mg·L−1 NaClO的同时打开UV灯开关(预热20 min),反应开始。每隔一定时间取出1 mL样品,并立即用过量Na2S2O3⋅5H2O(0.01 mL,0.01 mol·L−1)淬灭,随后送入HPLC检测Tml残余浓度。其中,ρ0为反应溶液Tml初始质量浓度(mg·L−1),ρt为反应t时刻的Tml质量浓度(mg·L−1)。各项实验重复进行3次。
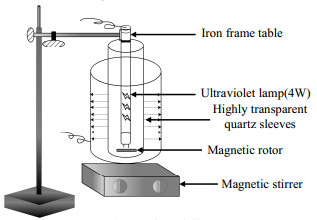
|
图 1 光解反应装置 Fig.1 Schematic diagram of the VUV/UV irradiation setup |
采用液质联用仪(LC–MS)检测VUV/UV/NaClO工艺降解Tml过程中生成的中间产物。
LC–MS仪器条件:HILIC柱(LUNA® HILIC 250 mm× 4.6 mm,Phenomenex®,美国)。流动相乙腈与纯水的体积比为55:45,流动相流速为0.6 mL·min−1;柱温为25 ℃,进样体积为5 μL。质谱条件:采用正电喷雾电离(ESI+)和负电喷雾电离(ESI−)全扫描模式(质荷比m/z:50~1 000)。全扫描模式的条件为:离子喷涂电压为5 000 V;离子源温度为550 ℃;载气为氮气,体积流量为30.0 L·h−1;中间碰撞气体为氮气;离子源气体的体积流量为40 L·h−1。
2.4 毒性评估方法 2.4.1 急性毒性采用发光细菌法,利用明亮发光杆菌测定样品的急性毒性,将活化后的细菌液与待测水样混合,测定混合液初始发光强度Ec(%)与30 min后的发光强度Es(%),二者差值即为待测反应液的相对抑制率I(%),通过I来表征急性毒性的大小[15],如式(1)所示。
| $I=\frac{E_{\mathrm{c}}-E_{\mathrm{s}}}{E_{\mathrm{c}}} \times 100 \%$ | (1) |
实验采用ECOSAR软件计算Tml及其降解产物的生态毒性。
2.4.3 树脂吸附分离取反应过程中对应时间点毒性较高的水样,将水样经蠕动泵充入XAD-8树脂柱中,以乙腈与纯水体积比分别为0%、10%、20%、50%、80% 和100% 的冲洗液进行洗脱分离,得到6组洗脱样品(M0、M10、M20、M50、M80和M100),再经固相小柱萃取洗脱[16]。洗脱液氮吹定容后鉴定分离纯化后的中间产物,确定毒性产物的生成与急性毒性变化的对应关系。
2.5 经济效益评估为考察2种工艺对Tml去除的经济效益,采用单位体积(1 m³)去除能耗(EEO-UV)对Tml在每立方米水溶液中降解一个数量级所消耗的电能进行定量计算,单位为kW⋅h·m−3。综合考虑电能的消耗EEO–(VUV)UV和氧化剂的消耗EEO–OX,总能耗EEO-Total计算方法见式(2)。工艺总成本OTotal为电力成本O(VUV)UV与氧化剂费用OOX之和,单位为CNY⋅m−3,可以通过式(3)~(6)计算所得[17]
| $E_{\text {EO-Total }}=E_{\text {EO-(VUV)UV }}+E_{\text {EO-OX }}$ | (2) |
| $E_{\mathrm{EO}-(\mathrm{VUV}) \mathrm{UV}}=\frac{1000 P t}{V \log \frac{\rho_{\mathrm{PP}, 0}}{\rho_{\mathrm{PP}, \mathrm{t}}}}=\frac{2303 P t}{V k_{\mathrm{obs}}}$ | (3) |
| $O_{(\mathrm{VUV}) \mathrm{UV}}=E_{\mathrm{EO}-(\mathrm{VUV}) \mathrm{UV}} \times \alpha$ | (4) |
| $O_{\mathrm{OX}}=E_{\mathrm{EO}-\mathrm{OX}} \times \beta_{\mathrm{OX}}=\frac{\rho_{\mathrm{OX}, 0}}{\log \frac{\rho_{\mathrm{PP}, 0}}{\rho_{\mathrm{PP}, t}}}=\frac{2.303 \rho_{\mathrm{OX}, 0}}{k_{\mathrm{obs}}} \times \beta_{\mathrm{OX}}$ | (5) |
| $O_{\text {Total }}=O_{(\mathrm{VUV}) \mathrm{UV}}+O_{\mathrm{OX}}$ | (6) |
式中:P为UV汞灯输入功率,kW;t为反应时间,h;V为反应体积,L;kobs为拟一级动力学常数,min−1;ρPP, 0为反应溶液初始污染物质量浓度,mg·L−1;ρPP, t为反应t时刻污染物质量浓度,mg·L−1;ρOX, 0为氧化剂投加量,mg·L−1;α为电费,CNY⋅kW−1⋅h−1;
pH是高级氧化工艺(AOPs)中重要的影响因素[18],因此考察了pH值对Tml去除的影响(见图 2,图中cTml, 0为Tml的初始浓度,ρNaClO, 0为NaClO的初始质量浓度)。
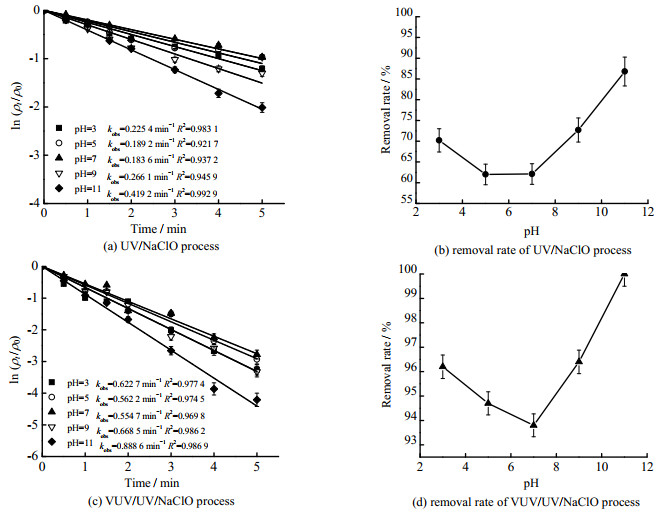
|
图 2 pH对UV/NaClO和VUV/UV/NaClO工艺去除Tml的影响 Fig.2 Effects of pH on Tml degradation during UV/NaClO and VUV/UV/NaClO processes Notes: cTml, 0=3.33 μmol·L−1; ρNaClO, 0=0.3 mg·L−1; pH=7.0 ±0.2 |
当pH值分别为3、5、7、9、11时,UV/NaClO和VUV/UV/NaClO反应体系中Tml去除的拟一级反应动力学常数kobs分别为0.225 4、0.189 2、0.183 6、0.266 1、0.419 2 min−1和0.622 7、0.562 2、0.554 7、0.668 5、0.888 6 min−1,见图 2(a)、(c),2种工艺中Tml的去除率分别为70.2%,62.0%,62.1%,72.7%,86.6%和96.2%,94.7%,93.8%,96.4%,100%。见图 2(b)、(d),从图中可看出,kobs均随着pH的增大先减少后增加,且均在pH=7时达到最小,分别为0.183 6和0.554 7 min−1。这主要是由于反应体系中的HOCl在酸性条件下具有更高的摩尔吸收系数与量子产率,HO⋅和活性氯自由基(RCSs)的氧化还原电位和稳态浓度会随着溶液酸性的增强而增加[19-20]。
其次由于Tml结构中含有酸度系数pKa为10的酚羟基(呈弱酸性),在高pH值条件下能脱去质子(H)产生共轭碱(去质子化反应),从而抵消碱性环境对自由基的不利影响,同时有利于HO⋅的生成[21],因此kobs随着pH升高呈先减少后增加的趋势。实验中不同pH条件下VUV/UV/NaClO工艺中的kobs为UV/NaClO工艺中相应kobs值的2.12~3.02倍,表明与UV/NaClO工艺相比,不同pH条件下VUV/UV/NaClO工艺具有更好的Tml去除效果,且pH对VUV/UV/NaClO工艺的影响更大,这主要是因为与UV相比,真空紫外具有更高的能量密度,VUV/UV/NaClO工艺在反应中生成更多的HO⋅和RCSs的同时也能与氧化剂之间获得更好的协同效应[22]。
3.1.2 CO32−对Tml去除的影响广泛存在于天然水体中的CO32−可能会对AOPs产生影响[23],因此考察了CO32−投加量对UV/NaClO和VUV/UV/NaClO工艺降解Tml的影响(见图 3)。
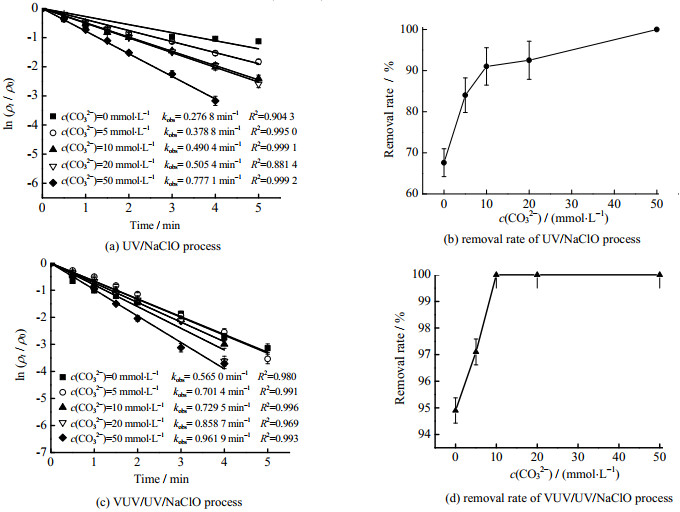
|
图 3 CO32−对UV/NaClO和VUV/UV/NaClO工艺去除Tml的影响 Fig.3 Effects of CO32− on Tml degradation during UV/NaClO and VUV/UV/NaClO processes Notes: cTml, 0=3.33 μmol·L−1; ρNaClO, 0=0.3 mg·L−1; pH=7.0±0.2 |
当CO32−浓度c(CO32−)分别为0、5、10、20和50 mmol⋅L−1时,UV/NaClO和VUV/UV/NaClO工艺中kobs分别为0.276 8、0.378 8、0.490 4、0.505 4、0.777 1 min−1和0.565 0、0.701 4、0.729 5、0.858 7、0.961 9 min−1,见图 3(a)、(c),kobs均随着CO32−浓度的增加而增大,表明CO32−对Tml的去除有促进作用。这主要是因为CO32−在溶液中会形成CO32−/HCO3−体系,VUV/UV辐射下会与溶液中HO⋅和Cl⋅发生反应产生碳酸根自由基(CO3−⋅)(kHO−- CO3−•=8.5 × 106 mol−1·L⋅s−1,kCl⋅- CO3−•=2.2 × 108 mol−1·L⋅s−1) (式(7) ~(11))[24]。CO3−⋅的氧化还原电位(E0=1.78 V)虽低于HO⋅和Cl⋅,但其相较于HO和Cl⋅对有机污染物的选择性更强,尤其对富含电子官能团结构的酚类及含氮类PPCPs表现出较高的选择性[25],因此对Tml的去除有明显的促进作用。相较于UV/NaClO工艺,不同CO32−投加量时VUV/UV/NaClO工艺中的kobs值提高了23.8%~104.1%,表明在不同CO32−投加量下VUV/UV/NaClO工艺对Tml的降解效果更好,此外由于VUV辐射的能量密度更大,VUV照射CO32−可能生成更多的CO3−⋅,因此VUV/UV/NaClO工艺对Tml去除的促进效果更为显著[26]。
| $ \mathrm{Cl} \cdot+\mathrm{OCl}^{-} \rightarrow \mathrm{Cl}^{-}+\mathrm{ClO} \cdot$ | (7) |
| $ \mathrm{NOM}+\mathrm{Cl} \cdot \rightarrow \text { products } $ | (8) |
| $ \mathrm{NOM}+\mathrm{HO} \cdot \rightarrow \text { products }$ | (9) |
| $ \mathrm{HCO}_3^{-}+\mathrm{HO} \cdot \rightarrow \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_3^{-} \cdot $ | (10) |
| $ \mathrm{HCO}_3^{-}+\mathrm{Cl} \cdot \rightarrow \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_3^{-} \cdot$ | (11) |
NO3−广泛存在于自然地表水中,可能会对AOPs污染物的降解产生影响[27],因此考察了NO3−对Tml去除的影响(见图 4)。
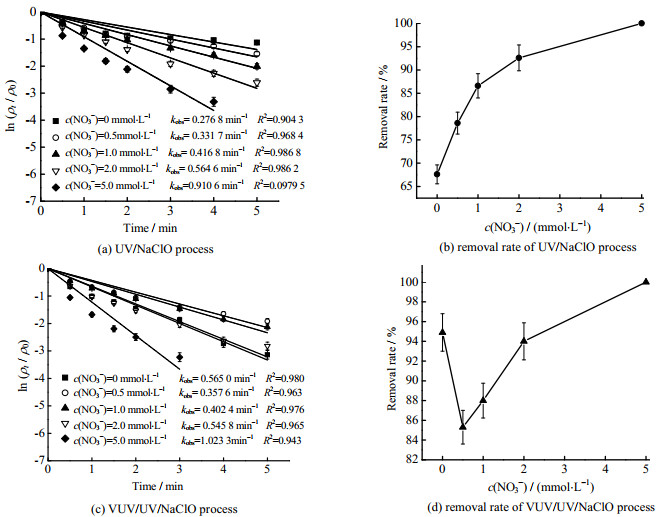
|
图 4 NO3−对UV/NaClO和VUV/UV/NaClO工艺去除Tml的影响 Fig.4 Effects of NO3−on Tml degradation using UV/NaClO and VUV/UV/NaClO processes Notes: cTml, 0=3.33 μmol·L−1; ρNaClO, 0=0.3 mg·L−1; pH=7.0±0.2 |
当NO3−的浓度c(NO3−)分别为0、0.5、1.0、2.0和5.0 mmol⋅L−1时,UV/NaClO和VUV/UV/NaClO工艺中kobs分别为0.276 8、0.331 7、0.416 8、0.564 6、0.910 6 min−1和0.565 0、0.357 6、0.402 4、0.545 8、1.023 3 min−1。UV/NaClO工艺中kobs随着NO3−浓度的增加而增加,而VUV/UV/NaClO工艺中kobs随着NO3−浓度的增加先下降后增加,NO3−投加量最高时,2种工艺的kobs亦达到最高值。低浓度NO3− (0.5、1.0 mmol⋅L−1时)可以轻微抑制VUV/UV/NaClO工艺中Tml的去除,但NO3−大于1.0 mmol⋅L−1时,则促进Tml的去除。其主要原因是,NO3−吸收VUV/UV辐射后会生成O−⋅等ROS和NO2⋅等含氮自由基(RNS),其中O−⋅能与H2O反应生成HO⋅ (式(12))[28],并且HO⋅又能与反应体系中的HOCl进一步反应生成选择性更强的ClO⋅(式(13))[29],从而促进Tml的降解。但c(NO3−)=0.5 mmol⋅L−1时,VUV/UV/NaClO工艺中Tml的kobs下降了36.7%,这可能是由于NO2⋅的清除作用(式(16)),生成的HO⋅增强作用有限导致VUV/UV/NaClO工艺的边际效应(式(14) ~ (16))[30]。对于UV/NaClO工艺来说,氧化剂和UV对Tml的降解贡献率比VUV/UV/NaClO工艺更高,而在VUV/UV/NaClO工艺中HO⋅和Cl⋅的贡献率更高,这可能是VUV/UVNaClO工艺中出现边际效应的原因[10]。相对于UV/NaClO工艺,不同NO3−投加量下VUV/UV/NaClO工艺中的kobs增加了3.4%~31.0%,表明NO3−对VUV/UV/NaClO工艺的促进或抑制更为显著。这主要是因为水对VUV的吸光系数更大,VUV照射NO3−会生成更多的O−⋅和HO⋅等自由基[30-31]。
| $ \mathrm{O}^{-} \cdot+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{HO} \cdot+\mathrm{HO}^{-} $ | (12) |
| $ \mathrm{HO} \cdot+\mathrm{HClO} \rightarrow \mathrm{ClO} \cdot+\mathrm{H}_2 \mathrm{O}$ | (13) |
| $ \mathrm{NO}_3^{-} \rightarrow \mathrm{NO}_2^{-}+1 / 2 \mathrm{O}_2 $ | (14) |
| $ \mathrm{NO}_3^{-} \rightarrow \mathrm{NO}_2^{-} \cdot+\mathrm{O}^{-} \cdot $ | (15) |
| $\mathrm{HO} \cdot+\mathrm{NO}_2^{-} \rightarrow \mathrm{NO}_2 \cdot+\mathrm{HO}^{-}$ | (16) |
水体中普遍存在的天然有机物(NOM)会影响污染物的降解[32]。实验考察了HA质量浓度对Tml降解的影响(见图 5)。
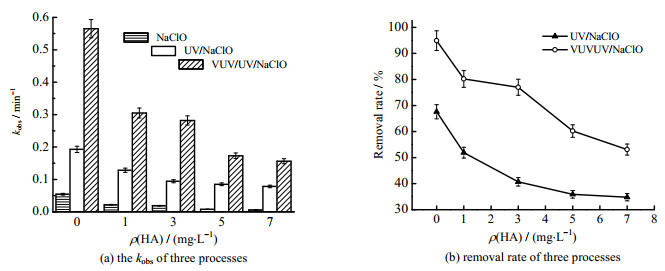
|
图 5 HA对NaClO、UV/NaClO和VUV/UV/NaClO工艺降解Tml的影响 Fig.5 Effects of HA on Tml degradation during NaClO, UV/NaClO and VUV/UV/NaClO processes Notes: cTml, 0=3.33 μmol·L−1; ρNaClO, 0=0.3 mg·L−1; pH=7.0±0.2 |
当不同HA质量浓度ρ(HA)下,不同工艺中kobs的大小为VUV/UV/NaClO > UV/NaClO > NaClO,表明VUV/UV/NaClO对Tml的降解效果最好。随着HA质量浓度从0 mg·L−1增加至7 mg·L−1,VUV/UV/NaClO、UV/NaClO和NaClO 3种工艺中kobs分别从0.565 0、0.192 7和0.054 2 min−1降低至0.156 2、0.078 3和0.005 7 min−1,2种工艺中Tml的去除率分别为67.6%,51.9%,40.7%,35.9%,34.8% 和94.9%,80.2%,77.0%,60.2%,53.1%,表明HA对Tml的降解具有显著的抑制作用。这主要是因为:(1)HA能作为自由基淬灭剂与Cl⋅和HO⋅反应(式(8)和(9)),从而消耗一部分体系中生成的自由基,削弱了氧化工艺对Tml的去除作用[33];(2)HA与有机污染物对NaClO形成竞争,使得NaClO与目标污染物的反应在一定程度上受阻[34]。有研究表明AOPs中低浓度HA可以通过生成活性物种促进污染物的去除[35],但本实验并没有发现这一现象。
3.2 VUV/UV/NaClO降解Tml的中间产物鉴定识别和机制分析采用高斯软件(Gaussian 09)对Tml分子结构进行优化并编号,计算得到福井指数,评估Tml分子上的反应位点,结果如图 6所示。
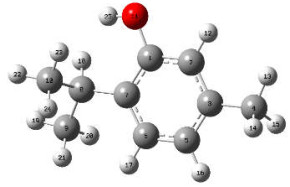
|
图 6 优化后的Tml分子结构模型 Fig.6 Optimized chemical structure of Tml Notes: C atoms are numbered 1 to 10 in gray; O atoms are numbered 11 in red |
通过计算福井指数可推测出分子结构中易受攻击的原子位点,以及易受亲核攻击(f+)、亲电攻击(f−)和自由基攻击(f0)的倾向性,当对应原子的f0值相对较大时,更容易被自由基攻击[36-37]。
为了进一步阐明Tml的降解途径,计算了代表Tml分子上原子受自由基攻击的自然电荷分布(NPA)和福井指数f,结果如表 1所示,表中C1~ C10为编号1~10的C原子;O11为编号11的O原子。其中C1、C5、C7和O11易受亲电攻击,C2、C3、C6和C7易受亲核攻击,C3、C5、C7和O11易受自由基攻击,可以看出易受攻击的位点主要集中在Tml的酚羟基及其邻位、间位和对位。
|
|
表 1 Tml的自然电荷分布(NPA)和福井指数(f) Table 1 Natural population analysis (NPA) of charge distribution and Fukui index (f) of Tml |
采用LC–MS对工艺中Tml的降解产物进行分析,结果见表 2。根据表 2中LC–MS检测结果可知,VUV/UV/NaClO工艺对Tml的降解过程生成了氯代加成/取代产物:氯麝酚(m/z:184)、羟基化产物:百里香氢醌(m/z:166)和氧化产物:百里醌(m/z:164),以及对二甲基醌(m/z:136)、丙酸乙烯基酯(m/z:100)和戊醛(m/z:86)等中间产物。主要的中间产物可能包括P1(氯麝酚,m/z:184)、P3(百里香氢醌,m/z:166)、P5(百里醌,m/z:164)、P8(对二甲基醌,m/z:136)和P9(甲基苯醌,m/z:122)等。其中主要的氯代产物为P1(氯麝酚),推测是NaClO和RCSs的氧化产物。
|
|
表 2 Tml降解中间产物LC-MS谱图 Table 2 LC/MS spectra of intermediate products of Tml |
如图 7所示,根据Tml降解产物检测结果,结合密度泛函理论(DFT)计算Tml反应活性位点,提出如下VUV/UV/NaClO工艺降解Tml的可能反应路径。
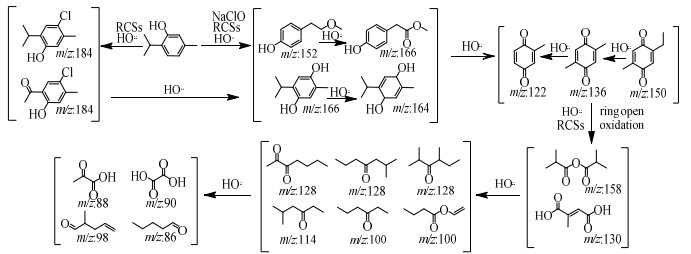
|
图 7 VUV/UV/NaClO工艺降解Tml的可能反应途径 Fig.7 Proposed degradation pathways of Tml during VUV/UV/NaClO processes |
综合DFT计算和LC–MS检测结果进行分析,羟基化容易发生在前沿电子密度(FEDs)较高的位置,Tml结构中的C3(f0=0.086 3)、C5(f0=0.086 7)和C7(f0=0.091 7)拥有最高的f0值,最容易受到自由基的攻击。HO⋅和Cl⋅可通过夺氢、羟基化和亲电加成与Tml反应[38],形成产物P1、P3或P2;进而通过HO⋅、Cl⋅和RCSs的作用在C1(f0=0.066 3)和C5(f0=0.086 7)发生亲电加成反应生成含有羰基的P5、P6、P8和P9,因为通常HO⋅和Cl⋅等RCSs更倾向于与不饱和芳香族化合物中的C═C键发生亲电加成而非夺氢反应[39]。这些芳香环化合物可在自由基的氧化作用下进一步被氧化分解为2-己酮、中康酸、草酸、丙酮酸和戊醛等小分子有机化合物[40-41]。水杨酸(SA)与Tml结构十分相似,Hu等[40]和Zupanc等[42]关于降解SA的研究结论与本研究一致。
3.3 VUV/UV/NaClO降解Tml过程中的毒性评估 3.3.1 急性毒性变化对VUV/UV/NaClO工艺降解Tml过程中不同反应时间的溶液进行取样,利用发光细菌进行急性毒性检测,结果见图 8。
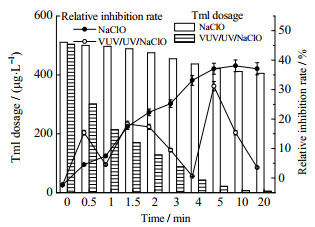
|
图 8 NaClO和VUV/UV/NaClO工艺降解Tml过程中急性毒性变化 Fig.8 Profiles of acute toxicity of Tml degradation during NaClO and VUV/UV/NaClO processes Notes: cTml, 0=3.33 μmol·L−1; ρNaClO, 0=0.3 mg·L−1; |
Tml溶液的初始相对抑制率为−2%,反应开始后,NaClO和VUV/UV/NaClO工艺中反应溶液的相对抑制率分别上升至5%和16%,但随着降解进行到0.5~1 min,VUV/UV/NaClO降解体系的相对抑制率由16%降低至5%,可能的原因是初始阶段生成的产物具有较高的细菌毒性,导致了毒性升高。反应进行至1~1.5 min相对抑制率继续升高至19%,而后再次出现下降,至10% (3 min),但在反应进行到4 min时相对抑制率出现了增加,直至5 min时达到急性毒性高点(相对抑制率为32%)。推测可能的原因是:反应开始至0.5 min时生成了毒性较大的氯代产物(氯麝酚、m/z:184)和醌类苯系物(百里香氢醌、百里醌);反应至1.5 min时毒性再升高,可能生成了对甲氧基乙基苯酚、对二甲基醌和甲基苯醌等毒性产物;4 ~5 min时毒性又上升,可能是由于反应后期的开环产物中生成了丙酸乙烯基酯和戊醛类的小分子毒性产物。随着反应的继续进行,反应5 min后有毒产物被进一步分解从而降低了反应溶液的急性毒性[18]。而在单独NaClO降解Tml体系中,相对抑制率表示的急性毒性持续上升,5 min后上升趋势趋于平缓;其中的原因可能是NaClO投加量初始浓度较低(0.3 mg·L−1),故而氧化能力有限,且反应后期逐渐被消耗完全,难以进一步氧化分解已经生成的氯代中间产物。上述推测均在后续ECOSAR软件分析各降解产物对鱼类、水蚤和绿藻的急性毒性和慢性毒性实验结果中得到证实。
从发光细菌急性毒性变化结果可以看出,2种工艺去除Tml的过程中均产生了急性毒性更高的副产物。然而,要确定哪些产物导致急性毒性的升高,需通过相应标准品来确定产物与毒性之间的关系。因此,采用ECOSAR软件模拟了产物生态毒性来进一步细化产物和毒性之间的相关性。
3.3.2 ECOSAR生态毒性预测采用ECOSAR毒性预测软件[43],将实验获得的毒性数据与程序预测结果进行比较,模拟评估Tml及其降解产物对3种水中动植物急、慢性毒性大小,结果见图 9。
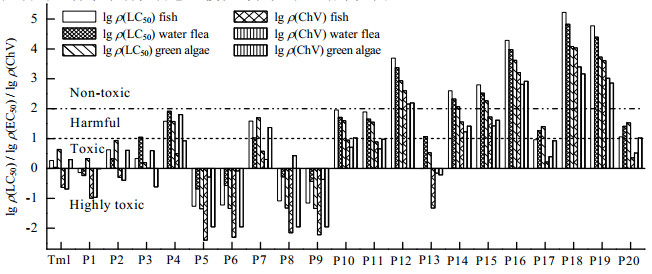
|
图 9 Tml及其降解产物的急性毒性(lg ρ(LC50)/lg ρ(EC50)和慢性毒性(lg ρ(ChV)) Fig.9 Acute toxicity (lg ρ(LC50)/lg ρ(EC50) and chronic toxicity (lg ρ(ChV) of Tml and its degradation products |
参照全球化学品统一分类和标签制度的毒性评估等级可知[44]:Tml对鱼类的96 h半数致死质量浓度ρ(LC50)为1.837 mg·L−1,对水蚤的48 h ρ(LC50)为1.087 mg·L−1,对绿藻的96 h半数有效质量浓度ρ(EC50)为4.313 mg·L−1,均表现为有毒或剧毒;根据计算所得Tml对3种水生生物对应的慢性毒性ρ(ChV)值分别为0.232、0.206和1.988 mg·L−1,进一步判定为剧毒、剧毒和有毒。
根据表 3中Tml降解产物的ρ(LC50)和ρ(ChV)值可知,Tml的降解产物中对水生动植物存在毒害作用的接近50%,且这些产物显示出比Tml更高的毒性。除百里香氢醌和丙酸乙烯基酯对水蚤的48 h急性毒性等级为有害外,其余毒性产物对3种水生动植物的急、慢性毒性均达到剧毒或有毒等级;而另外一半可能产物对鱼类、水蚤和绿藻3种水生动植物基本不会产生毒副作用或仅为有害作用程度。该评估结果也进一步解释了发光细菌急性毒性实验中,Tml降解过程中生成的毒性产物使反应溶液的急性毒性大于初始溶液毒性的原因。
|
|
表 3 Tml降解产物半数致死浓度ρ(LC50)和慢性毒性ρ(ChV) Table 3 Median lethal concentration ρ(LC50) and chronic toxicity ρ(ChV) of Tml degradation products |
值得注意的是,可能生成的小分子产物中的丙酸乙烯基酯(m/z:100)、甲基戊醛(m/z:98)和戊醛(m/z:86)均表现出了较强的毒性;其中,丙酸乙烯基酯对鱼类、水蚤和绿藻的ChV值均达到了剧毒等级,这也与发光细菌急性毒性实验结果相一致。
由发光细菌急性毒性变化(见图 8)可知,反应时间为5 min时,VUV/UV/NaClO工艺反应溶液的急性毒性均相对较高。为了进一步明确溶液的急性毒性和产物之间的关系,取5 min时的反应溶液进行树脂分级分离处理,通过LC–MS进一步鉴定生成的毒性产物,结果如表 4所示。
|
|
表 4 Tml的降解产物 Table 4 Tml degradation products separated by a resin column |
根据分离组分检测结果结合ECOSAR软件模拟,5组含不同比例有机相的洗脱液样品中分别检测出甲基戊醛(m/z:98)、甲基苯醌(m/z:122)、对二甲基醌(m/z:136)和丙酸乙烯基酯等剧毒、部分剧毒或有毒和部分有毒的中间产物,以及丙酮酸(m/z:88)、草酸(m/z:90)和中康酸(m/z:130)等无毒害作用的有机产物。上述结果为发光细菌急性毒性实验中反应5 min时急性毒性增加提供了佐证。
3.4 VUV/UV/NaClO及UV/NaClO降解工艺经济效益评估紫外/氯结合的AOPs有效提高了对污染物的去除效果,但反应过程中紫外光源的使用需要消耗不少的电能,并且氧化剂作为自由基的载体,将其加入反应中也需要耗费一定的成本。为了对降解工艺在实际应用过程中的经济效益进行有效评估,实验中评估了VUV/UV/NaClO和UV/NaClO工艺降解Tml的单位去除总能耗EEO–Total和工艺总成本OTotal,并考察不同NaClO质量浓度(0 ~0.4 mg·L−1)下所需的OTotal值。
参考2021年中国一般工业用电价格标准(0.86~1.80 CNY⋅kW−1⋅h−1),不考虑阶梯电价,实验中设定电费为0.9 CNY⋅kW−1⋅h−1,NaClO单价为0.5 CNY⋅kg−1 [24],具体计算过程见式(2)~(6),OTotal随NaClO质量浓度的变化情况如图 10所示。
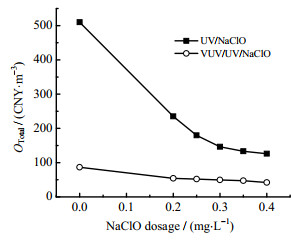
|
图 10 UV/NaClO和VUV/UV/NaClO工艺在不同NaClO投加量下的经济评估 Fig.10 Economic evaluation of UV/NaClO and VUV/UV/NaClO processes with different NaClO dosages |
由图 10可知,VUV/UV/NaClO与UV/NaClO工艺中Tml降解的OTotal均随NaClO投加量的增加而减小。单独VUV/UV和UV降解Tml所需OTotal分别为86.47和509.89 CNY ⋅m−3;在NaClO投加量为0.2 ~0.4 mg·L−1时,VUV/UV/NaClO和UV/NaClO工艺降解Tml所需的OTotal分别从86.47和509.89 CNY ⋅m−3降低至42.17和125.93 CNY⋅m−3。相对于UV,UV/NaClO工艺可以显著降低处理成本,而VUV/UV与UV/NaClO工艺虽然kobs相近,但前者只需消耗一定的电能而无需消耗NaClO,故实际耗费的总成本更低。VUV/UV/NaClO工艺降解Tml的kobs比VUV/UV和UV/NaClO更大,且VUV/UV/NaClO工艺节约的电力成本远大于投加NaClO的使用成本。VUV/UV/NaClO工艺去除Tml的总成本最低,在实际水处理应用中的经济效益更好。目前,对于VUV/UV/NaClO工艺去除PPCPs类污染物的降解动力学和毒性产物生成的研究还较少,且由于VUV/UV/NaClO工艺反应体系复杂,该工艺在实际降解PPCPs的应用中仍面临诸多挑战,例如反应装置的设计、光源的选择和成本优化等。尽管如此,VUV/UV/NaClO工艺能生成更多RCSs以及与氧化剂工艺之间获得较好的协同效应,从而具有良好的应用前景。
4 结论1) VUV/UV/NaClO和UV/NaClO反应体系中,Tml去除的kobs随pH的增大先减少后增加,且均在pH=7时达到最小,分别为0.183 6 min−1和0.554 7 min−1,CO32−的存在有利于Tml的去除,在VUV/UV/NaClO工艺中,低浓度NO3−对Tml的去除有轻微抑制作用,高浓度则反之,而在UV/NaClO工艺中,NO3−的存在有利于Tml的去除,HA对Tml的去除效果有抑制作用。在同样的反应条件下,不同水质因素对VUV/UV/NaClO工艺的促进或抑制作用更为显著,约为UV/NaClO工艺的1.05~3.57倍。
2) Tml在VUV/UV/NaClO工艺中主要发生了取代、加成和氧化分解反应,生成了氯代、醌和醛类中间产物。VUV/UV/NaClO和UV/NaClO 2种工艺中反应溶液急性毒性先增加再降低,反应后期和中期分别生成了丙酸乙烯基酯、戊醛类毒性较强的小分子有机物,以及甲基戊醛、甲基苯醌和对二甲基醌等剧毒产物,导致Tml去除过程中急性毒性的增加。
3) 相较UV/NaClO工艺,VUV/UV/NaClO工艺具有较好的Tml去除率和较低的总能耗EEO–Total和较低的工艺总成本OTotal。
| [1] |
BAEZA C, KNAPPE D R U. Transformation kinetics of biochemically active compounds in low-pressure UV Photolysis and UV/H2O2 advanced oxidation processes[J]. Water Research, 2011, 45(15): 4531-4543. DOI:10.1016/j.watres.2011.05.039 |
| [2] |
COUTO C F, LANGE L C, AMARAL M C S. Occurrence, fate and removal of pharmaceutically active compounds (PhACs) in water and wastewater treatment plants-A review[J]. Journal of Water Process Engineering, 2019, 32(1): 100927. |
| [3] |
SCHWAB B W, HAYES E P, FIORI J M, et al. Human pharmaceuticals in US surface waters: A human health risk assessment[J]. Regulatory Toxicology and Pharmacology, 2005, 42(3): 296-312. DOI:10.1016/j.yrtph.2005.05.005 |
| [4] |
ESPLUGAS S, GIMÉNEZ J, CONTRERAS S, et al. Comparison of different advanced oxidation processes for phenol degradation[J]. Water Research, 2002, 36(4): 1034-1042. DOI:10.1016/S0043-1354(01)00301-3 |
| [5] |
刘淑丽. UV/H2O2高级氧化水中典型致臭物质的试验研究及在净水厂中的应用[D]. 济南: 山东建筑大学, 2020. LIU S L. Experimental study on typical odorant in UV/H2O2 advanced oxidized water and its application in water purification plant [D]. Jinan: Shandong University of Architecture and Engineer, 2020. |
| [6] |
GONZALEZ M G, OLIVEROS E, WÖRNER M, et al. Vacuum-ultraviolet photolysis of aqueous reaction systems[J]. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2004, 5(3): 225-246. DOI:10.1016/j.jphotochemrev.2004.10.002 |
| [7] |
刘晶冰, 燕磊, 白文荣, 等. 高级氧化技术在水处理的研究进展[J]. 水处理技术, 2011, 37(3): 11-17. LIU J B, YAN L, BAI W R, et al. Study progress of water treatment by advanced oxidation processes[J]. Technology of Water Treatment, 2011, 37(3): 11-17. |
| [8] |
孙子为, 归谈纯, 高乃云, 等. 高级氧化技术降解水体中抗生素的研究进展[J]. 四川环境, 2014, 33(5): 146-153. SUN Z W, GUI T C, GAO N Y, et al. Research progress on degradation of antibiotics via advanced oxidation processes[J]. Sichuan Environment, 2014, 33(5): 146-153. |
| [9] |
LI S M, AO X W, LI C, et al. Insight into PPCP degradation by UV/NH2Cl and comparison with UV/NaClO: Kinetics, reaction mechanism, and DBP formation[J]. Water Research, 2020, 182: 115967. DOI:10.1016/j.watres.2020.115967 |
| [10] |
肖习羽, 李青松, 吴俊文, 等. VUV/UV/NaClO工艺降解百里香酚协同效应及活性物质贡献[J]. 化工学报, 2022, 73(5): 2233-2241. XIAO X Y, LI Q S, WU J W, et al. Synergistic effect of thymol degradation by VUV/UV/NaClO technique and its major contributor of active species[J]. CIESC Journal, 2022, 73(5): 2233-2241. |
| [11] |
张静, 冯岗, 袁旭超, 等. 百里香酚抑菌活性初探[J]. 中国农学通报, 2009, 25(21): 277-280. ZHANG J, FENG G, YUAN X C, et al. Preliminary study on the antifungal activity of thymol[J]. Chinese Agricultural Science Bulletin, 2009, 25(21): 277-280. |
| [12] |
GHASEMI G, ALIREZALU A, GHOSTA Y, et al. Composition, antifungal, phytotoxic, and insecticidal activities of thymus kotschyanus essential oil[J]. Molecules, 2020, 25(5): 1152. DOI:10.3390/molecules25051152 |
| [13] |
梅雪冰, 隋倩, 张紫薇, 等. 不同特征污染源中指示性药物和个人护理品识别与筛选[J]. 中国环境科学, 2019, 39(3): 1173-1180. MEI X B, SUI Q, ZHANG Z W, et al. Identification of indicator pharmaceutical and personal care products (PPCPs) in different emission sources[J]. China Environmental Science, 2019, 39(3): 1173-1180. DOI:10.3969/j.issn.1000-6923.2019.03.034 |
| [14] |
黄崇波, 郭志强, 刁慧, 等. 百里香酚对肉兔生长性能、小肠黏膜形态结构和免疫器官的影响[J]. 中国畜牧杂志, 2021, 57(3): 164-168. HUANG C B, GUO Z Q, DIAO H, et al. Effects of thymol on growth performance, intestinal morphology and immune organs of rabbits[J]. Chinese Journal of Animal Science, 2021, 57(3): 164-168. |
| [15] |
YP A, SSC A, XIN Y A, et al. UV/chlorine treatment of carbamazepine: Transformation products and their formation kinetics[J]. Water Research: A Journal of the International Water Association, 2017, 116(3): 254-265. |
| [16] |
彭芳刚, 吴卫国, 李绮丽, 等. 红莲外皮原花青素各级分的分析鉴定[J]. 食品科学, 2014, 35(12): 212-217. PENG F G, WU W G, LI Q L, et al. Analysis of proanthocyanidin fractions from red skin lotus seed[J]. Food Science, 2014, 35(12): 212-217. |
| [17] |
LU X, SHAO Y S, GAO N Y, et al. Investigation of clofibric acid removal by UV/persulfate and UV/chlorine processes: Kinetics and formation of disinfection byproducts during subsequent chlor(am)ination[J]. Chemical Engineering Journal, 2018, 331: 364-371. DOI:10.1016/j.cej.2017.08.117 |
| [18] |
LI M K, WANG C, YAU M, et al. Sulfamethazine degradation in water by the VUV/UV process: Kinetics, mechanism and antibacterial activity determination based on a mini-fluidic VUV/UV photoreaction system[J]. Water Research, 2017, 108: 348-355. DOI:10.1016/j.watres.2016.11.018 |
| [19] |
YANG L X, LI M K, LI W T, et al. A green method to determine VUV (185nm) fluence rate based on hydrogen peroxide production in aqueous solution[J]. Photochemistry and Photobiology, 2018, 94(4): 821-824. DOI:10.1111/php.12913 |
| [20] |
FANG J Y, FU Y, SHANG C. The roles of reactive species in micropollutant degradation in the UV/free chlorine system[J]. Environmental Science & Technology, 2014, 48(3): 1859-1868. |
| [21] |
WANG D, BOLTON J R, HOFMANN R. Medium pressure UV combined with chlorine advanced oxidation for trichloroethylene destruction in a model water[J]. Water Research, 2012, 46(15): 4677-4686. |
| [22] |
MOUSSAVI G, POURAKBAR M, SHEKOOHIYAN S, et al. The photochemical decomposition and detoxification of bisphenol A in the VUV/H2O2 process: Degradation, mineralization, and cytotoxicity[J]. Chemical Engineering Journal, 2018, 331(9): 755-764. |
| [23] |
WOJNÁROVITS L, TÓTH T, TAKÁCS E. Rate constants of carbonate radical anion reactions with molecules of environmental interest in aqueous solution: A review[J]. Science of the Total Environment, 2020, 717: 137219. |
| [24] |
GAO J, DUAN X D, O′SHEA K, et al. Degradation and transformation of bisphenol A in UV/Sodium percarbonate: Dual role of carbonate radical anion[J]. Water Research, 2020, 171: 115394. |
| [25] |
GAO Z C, LIN Y L, XU B, et al. Effect of UV wavelength on humic acid degradation and disinfection by-product formation during the UV/chlorine process[J]. Water Research, 2019, 154: 199-209. |
| [26] |
GHANBARI F, GIANNAKIS S, LIN K Y A, et al. Acetaminophen degradation by a synergistic peracetic acid/UVC-LED/Fe(Ⅱ) advanced oxidation process: Kinetic assessment, process feasibility and mechanistic considerations[J]. Chemosphere, 2021, 263: 128119. |
| [27] |
DENG J, WU G X, YUAN S J, et al. Ciprofloxacin degradation in UV/chlorine advanced oxidation process: Influencing factors, mechanisms and degradation pathways[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2018, 371: 151-158. |
| [28] |
DONG H Y, QIANG Z M, HU J, et al. Degradation of chloramphenicol by UV/chlorine treatment: Kinetics, mechanism and enhanced formation of halonitromethanes[J]. Water Research, 2017, 121: 178-185. |
| [29] |
YANG L X, ZHANG Z H. Degradation of six typical pesticides in water by VUV/UV/chlorine process: Evaluation of the synergistic effect[J]. Water Research, 2019, 161: 439-447. |
| [30] |
LIAO Q N, JI F, LI J C, et al. Decomposition and mineralization of sulfaquinoxaline sodium during UV/H2O2 oxidation processes[J]. Chemical Engineering Journal, 2016, 284: 494-502. |
| [31] |
LIU Y Q, HE X X, DUAN X D, et al. Significant role of UV and carbonate radical on the degradation of oxytetracycline in UV-AOPs: Kinetics and mechanism[J]. Water Research, 2016, 95: 195-204. |
| [32] |
LI L, GUO R N, ZHANG S, et al. Sustainable and effective degradation of aniline by sodium percarbonate activated with UV in aqueous solution: Kinetics, mechanism and identification of reactive species[J]. Environmental Research, 2021, 207: 112176. |
| [33] |
KATSOYIANNIS I A, CANONICA S, VON GUNTEN U. Efficiency and energy requirements for the transformation of organic micropollutants by ozone, O3/H2O2 and UV/H2O2[J]. Water Research, 2011, 45(13): 3811-3822. |
| [34] |
HUANG N, WANG T, WANG W L, et al. UV/chlorine as an advanced oxidation process for the degradation of benzalkonium chloride: Synergistic effect, transformation products and toxicity evaluation[J]. Water Research, 2017, 114: 246-253. |
| [35] |
MANO T, NISHIMOTO S, KAMESHIMA Y, et al. Water treatment efficacy of various metal oxide semiconductors for photocatalytic ozonation under UV and visible light irradiation[J]. Chemical Engineering Journal, 2015, 264(11): 221-229. |
| [36] |
ELHORRI A M, BELAID K D, ZOUAOUI-RABAH M, et al. Theoretical study of the azo dyes dissociation by advanced oxidation using Fukui indices. DFT calculations[J]. Computational and Theoretical Chemistry, 2018, 1130: 98-106. |
| [37] |
LI Q S, LAI C R, YU J W, et al. Degradation of diclofenac sodium by the UV/chlorine process: Reaction mechanism, influencing factors and toxicity evaluation[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2022, 425(1): 113667. |
| [38] |
WANG J B, ZHI D, ZHOU H, et al. Evaluating tetracycline degradation pathway and intermediate toxicity during the electrochemical oxidation over a Ti/Ti4O7 anode[J]. Water Research, 2018, 137: 324-334. |
| [39] |
TANG Y Q, SHI X T, LIU Y Z, et al. Degradation of clofibric acid in UV/chlorine disinfection process: Kinetics, reactive species contribution and pathways[J]. Royal Society Open Science, 2018, 5(2): 171372. |
| [40] |
HU R K, ZHANG L F, HU J Y. Study on the kinetics and transformation products of salicylic acid in water via ozonation[J]. Chemosphere, 2016, 153: 394-404. |
| [41] |
ARAÚJO A, SOARES O S G P, ORGE C A, et al. Metal-zeolite catalysts for the removal of pharmaceutical pollutants in water by catalytic ozonation[J]. Journal of Environmental Chemical Engineering, 2021, 9(6): 106458. |
| [42] |
ZUPANC M, PETKOVŠEK M, ZEVNIK J, et al. Anomalies detected during hydrodynamic cavitation when using salicylic acid dosimetry to measure radical production[J]. Chemical Engineering Journal, 2020, 396: 125389. |
| [43] |
REUSCHENBACH P, SILVANI M, DAMMANN M, et al. ECOSAR model performance with a large test set of industrial chemicals[J]. Chemosphere, 2008, 71(10): 1986-1995. |
| [44] |
MIYAGAWA M. Globally harmonized system of classification and labelling of chemicals (GHS) and its implementation in Japan[J]. Nippon Eiseigaku Zasshi (Japanese Journal of Hygiene), 2010, 65(1): 5-13. |




