免疫细胞疗法已成为治疗恶性肿瘤的新希望[1],其中NK细胞作为一种以非主要组织相容性复合体限制(major histocompatibility complex,MHC)方式发挥其杀伤肿瘤细胞的免疫细胞[2]在临床上有重要应用价值。然而,原代NK细胞难以获取和进行体外扩增限制了其临床应用。随着细胞克隆技术的发展,已建立多种NK细胞系,包括KHYG-1、NK-92、NKL、NKG和YT细胞[3-4],其中NK-92细胞是一种依赖白细胞介素-2(IL-2)扩增的细胞,抗肿瘤谱广,表达CD56,不表达CD3,具有强烈的细胞毒性作用[5-6]。NK-92细胞经过基因改造可得到CAR-NK-92细胞,在临床上具有极大的应用潜能[7-8]。为满足临床细胞输注的要求,NK-92细胞的体外高效扩增是其临床应用的重要保证。搅拌式生物反应器因可提供均匀的培养环境是进行悬浮细胞体外规模化扩增的常用装备[9]。然而搅拌式生物反应器在运行过程中会产生流体剪切力,而其剪切力大小会随搅拌桨桨型的差异而变化[10]。有研究表明常用的螺旋搅拌桨运行时产生的流体剪切力较大,会对剪切力敏感的细胞造成伤害;而球体搅拌可显著减小流体剪切力的产生[11-12],避免因剪切力损伤而导致细胞扩增能力的下降。在搅拌式生物反应器中,磁力搅拌瓶是通过磁场的变化控制搅拌装置运动实现培养体系的混合,其流体剪切力的大小同样受磁性搅拌子形状和性质的影响[13]。为此,研制磁性搅拌珠并通过其有规律的运动,达到混合培养体系的目的,是设计磁性生物反应器的一个新思路。
海藻酸钠作为一种从海藻或海带中提取的天然聚阴离子多糖化合物,具有良好的生物相容性,可以与2价金属阳离子(如钙离子)反应形成凝胶球[14]。在海藻酸钠形成凝胶球的过程中,加入Fe3O4纳米颗粒,可制备出磁性搅拌珠[15]。改变海藻酸钠浓度或2价阳离子浓度可调节磁性搅拌珠的稳定性[14, 16]。此外,壳聚糖作为天然唯一带正电荷多糖,可与海藻酸钠发生静电络合反应[17]。将壳聚糖覆裹于海藻酸钙凝胶球表面,可有效降低海藻酸钙凝胶球的孔隙率,减少内部物质的泄漏[18],进一步提高磁性搅拌珠的稳定性。
本研究采用两步法制备海藻酸钠/壳聚糖双组分磁性搅拌珠[19],第1步以海藻酸钠和Fe3O4制备磁性搅拌珠核,第2步将壳聚糖覆裹于磁性搅拌珠表面,增强其磁稳定性;应用于NK-92细胞体外扩增。根据细胞总扩增倍数,细胞表型和杀伤活性探讨磁性搅拌珠对NK-92细胞的扩增的影响,为免疫细胞体外扩增设备提供技术支持。
2 材料与方法 2.1 仪器与设备多功能酶标仪(Bio Tek,美国),磁力转瓶机(integra bioscience,瑞士),电脑控制拉力试验机(GT-TCS2000,GOTECH,中国),大口摇瓶(德国VITLAB公司,容积为100 mL,工作体积为10~50 mL)。
2.2 实验材料海藻酸钠(sodium alginate,Sigma Aldrich,美国);壳聚糖(chitosan,脱乙酰度95%,黏度100~ 200 mPa·s,上海麦克林生化科技有限公司);四氧化三铁(Fe3O4,粒径100~300 nm,阿拉丁试剂(上海)有限公司);白介素-2(IL-2)购于美国Pepro Tech公司;FITC标记的鼠抗人CD3抗体和PE标记的鼠抗人CD56抗体购于美国Becton Dickinson (BD)公司;胎牛血清购于Bio Sun公司;CCK 8试剂盒,购于东仁化学科技(上海)有限公司;IMDM培养基购于美国Thermo公司;NK-92细胞来自中科院上海细胞库;水为双蒸水。
2.3 海藻酸钠/壳聚糖双组分磁性搅拌珠制备本研究制备海藻酸钠壳/聚糖双组分磁性搅拌珠流程如下:首先向30 mg Fe3O4粉末中加入100 μL水,超声30 min;加入1 mL海藻酸钠溶液,混匀,得到黑色磁性海藻酸钠溶液,使用200 μL移液枪吸取该溶液,均匀滴入300 mmol·L-1 CaCl2溶液中,置于130 r·min-1摇床上30 min,得到海藻酸钠磁性搅拌珠核;接着取出海藻酸钠磁性搅拌珠核,转入质量浓度为5 mg·mL-1的壳聚糖溶液中,置于130 r·min-1摇床上1 h,得到海藻酸钠/壳聚糖双组分磁性搅拌珠。将磁性搅拌珠用超纯水反复清洗3遍,除去表面未反应的壳聚糖。最后浸泡于培养基中备用。
2.4 磁性搅拌珠溶胀率检测将20个制备好的磁性搅拌珠浸没于纯水中静置,分别在10,20,40,60,90和120 min从纯水中取出磁性搅拌珠,用滤纸吸干表面水分,快速称重,继续浸没于上述纯水中。计算不同时间的溶胀率Sw:
| $ {S_{\rm{w}}} = \frac{{{m_{\rm{t}}} - {m_0}}}{{{m_0}}} $ |
式中:mt为20个磁性搅拌珠溶胀后的质量,m0为20个磁性搅拌珠初始的质量。Sw为20个磁性搅拌珠平均溶胀率。
2.5 磁性搅拌珠浸出液浊度检测将14个磁性搅拌珠放入装有2 mL IMDM+10% FBS(胎牛血清)培养基的24孔培养板中,置于37 ℃、5% CO2饱和湿度的培养箱中静置20 d。分别在第1、4、7、11、14、17和20 d检测磁性搅拌珠浸出液在450 nm处的吸光度,以浸出液吸光度的变化评价磁性搅拌珠的稳定性。
2.6 磁性搅拌珠机械性能测定磁性搅拌珠机械性能通过小载荷应力应变压缩试验测定。通过装有计算机和控制测量系统的机械测试系统(GT-TCS2000,GOTECH,China)进行小载荷应力应变压缩试验。用于试验的磁性搅拌珠被制成尺寸为10 mm×5.0 mm的柱形样品(直径×厚度)。将所有样品以1 mm·min-1的速度进行压缩,压缩到样品破裂或压缩程度达到80% 立即停止。在整个过程中,数据的变化直接输送至显示器上,在显示的结果统计表中可直接读出磁性搅拌珠应力-应变及弹性模量。
2.7 NK-92细胞培养将NK-92细胞以5×104 cells·mL-1密度接种于IMDM+10% FBS培养基中,添加1 000 U·mL-1 IL-2,于37 ℃、5% CO2饱和湿度的培养箱中培养8 d。隔天吹散细胞团,采用血球计数板计数,计算细胞密度,并添加新鲜培养基和1 000 U·mL-1 IL-2,维持细胞密度在2×105 cells·mL-1。
实验组采用磁力搅拌瓶,培养体积10 mL,动态培养;对照组采用T 25培养瓶,培养体积为5 mL,静态培养。
2.8 CD3-CD56+细胞比例分析采用流式细胞术对细胞表型分析,分析培养8 d后培养物中CD3-CD56+细胞的比例。收集5×105~1×106个细胞,用10 μL FITC-CD3和10 μL PE-CD56的流式抗体标记收集的细胞,在4 ℃孵育30 min后用FASC Callibur(美国BD公司)进行细胞表型分析,结果运用FlowJo软件进行处理。
2.9 NK-92细胞杀伤活性收集培养8 d后的NK-92细胞作为效应细胞(E),K562细胞为靶细胞(T),采用CCK8检测细胞活性,以此评价NK-92细胞对K562细胞的杀伤活性。将1×105个NK-92细胞与1×104个K562细胞(效应细胞和靶细胞个数比(E/T)为10:1)同时加入0.1 mL IMDM+10% FBS培养基中作为实验组,将1×105个NK-92细胞和1×104个K562细胞分别加入上述培养基中作为对照组。在培养箱中孵育24 h后加入10 μL CCK-8,继续在培养箱中孵育4 h,检测450 nm处的吸光度(OD)值,其中1×105个NK-92细胞、1×104个K562细胞以及1×105个NK-92细胞与1×104个K562细胞共培养检测得到的OD值分别是ODE、ODT、ODE/T。根据下式计算杀伤活性。
| ${\rm{}} 杀伤活性 = 1 - \frac{{{\rm{O{D_{E/T}}}} - {\rm{O{D_E}}}}}{{{\rm{O{D_T}}}}} \times 100\% $ |
本研究用T检验(T-test)进行两组之间的统计分析,结果以平均值±标准偏差(SD)表示,p < 0.05代表有显著差异。
3 结果与讨论 3.1 海藻酸钠浓度对双组分磁性搅拌珠稳定性的影响 3.1.1 磁性搅拌珠形貌尺寸磁性搅拌珠形貌如图 1所示,所得磁性搅拌珠直径均为3 mm,整体黑亮,粒径均匀,可见制备的磁性搅拌珠中磁粉分布均匀。磁性搅拌珠表面光滑,在细胞培养中可有效降低剪切力,减少对细胞的伤害。

|
图 1 磁性搅拌珠形貌 Fig.1 Morphology of magnetic stirring beads |
溶胀率反映磁性搅拌珠的稳定性。双组分磁性搅拌珠制备过程中,海藻酸钠浓度对磁性搅拌珠溶胀率的影响如图 2所示。由图 2可见,随着海藻酸钠浓度的提高,溶胀率降低。当海藻酸钠质量浓度达到25 mg·mL-1时,磁性搅拌珠溶胀率明显降低,且继续增大海藻酸钠浓度,溶胀率变化不大,说明制备双组分磁性搅拌珠时,海藻酸钠质量浓度为25 mg·mL-1较为合适。这可能是因为高浓度的海藻酸钠与Ca2+形成的蛋壳内部结构更加紧密,减少了水分的进入,束缚磁性搅拌珠的溶胀。
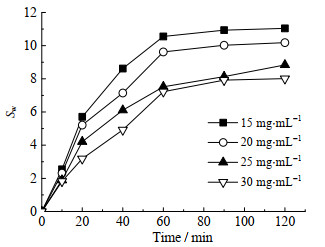
|
图 2 海藻酸钠浓度对磁性搅拌珠溶胀率的影响 Fig.2 Effects of sodium alginate concentrations on swelling rates of magnetic hydrogel beads |
将所制备的双组分磁性搅拌珠浸泡于IMDM+10% FBS培养基中,检测浸出液OD值随浸泡时间的变化,该指标同样可以反映磁性搅拌珠的稳定性。结果如图 3所示,磁性搅拌珠在培养基中浸泡前期,其浸出液OD值上升趋势明显,而至第11 d后基本稳定;且随着海藻酸钠浓度的提高,浸出液OD值变小,当海藻酸钠浓度达到25 mg·mL-1时,浸出液OD值达到稳定值,说明此浓度下,此时磁性搅拌珠稳定性最佳。
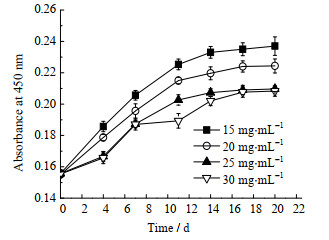
|
图 3 海藻酸钠浓度对磁性搅拌珠浸出液吸光度的影响 Fig.3 Effects of sodium alginate concentrations on absorbance values of magnetic hydrogel beads leaching solutions |
磁性搅拌珠的稳定性也反映在其力学性能上。图 4为磁性搅拌珠应力-应变曲线和弹性模量。如图 4(a)所示,当磁性搅拌珠压缩程度达到80% 时,不同海藻酸钠浓度的磁性搅拌珠的应力-应变曲线均未发生骤变现象,磁性搅拌珠均未破裂,表明其具有良好弹性。如图 4(b)所示,磁性搅拌珠的弹性模量随海藻酸钠质量浓度的增加而增大;当海藻酸钠质量浓度为25 mg·mL-1时,磁性搅拌珠的弹性模量为(17.22±1.09) kPa,与海藻酸钠质量浓度为30 mg·mL-1制备的磁性搅拌珠弹性模量(19.33±0.96) kPa相近,而分别是另外两组的2.71和3.95倍。在钙离子浓度一定的条件下,海藻酸钠浓度低时,与钙离子结合不完全,所形成磁性搅拌珠强度小;海藻酸钠质量浓度达到25 mg·mL-1时,钙离子与海藻酸钠已经充分结合形成致密的蛋壳结构,且海藻酸钠大分子之间相互作用[20],增强磁性搅拌珠力学性能;继续增大海藻酸钠浓度,并不能够继续增大磁性搅拌珠的致密的空间结构,因此对磁性搅拌珠的力学性能影响不大。
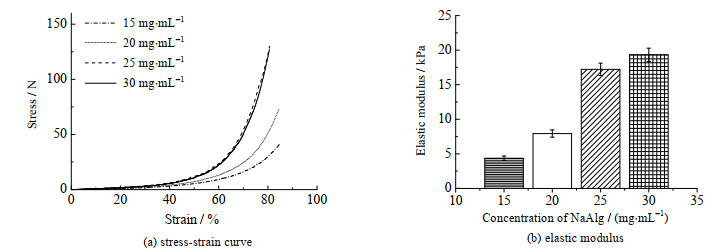
|
图 4 磁性搅拌珠机械性能 Fig.4 Mechanical properties of magnetic hydrogel beads |
可见,从溶胀率、浸泡液上清的浊度以及力学性能等指标看,当海藻酸钠质量浓度为25 mg·mL-1,所制备的双组分磁性搅拌珠具有良好的稳定性。
3.2 双组分磁性搅拌珠在NK92细胞培养中的应用利用双组分磁性搅拌珠代替传统搅拌桨放入摇瓶(容积为100 mL)中,置于转瓶机上组形成磁力搅拌瓶生物反应器,用于NK-92细胞的体外扩增。
NK-92细胞以2×105 cells·mL-1的密度接种于含有10 mL IMDM+10% FBS的磁力搅拌瓶中,进行动态培养,并以T 25培养瓶静态培养为对照,以总细胞扩增倍数,扩增至8 d后培养物中CD3-CD56+细胞的比例以及扩增后NK-92细胞的杀伤活性为指标,评估采用双组分磁性搅拌珠动态培养对NK-92细胞体外扩增的效果。
图 5为培养8 d时的细胞形态。可以发现,磁力搅拌瓶中NK-92细胞大部分透亮,聚团较大;而T 25培养由瓶中细胞小而暗淡,细胞聚团较小,说明磁力搅拌瓶中NK-92细胞状态更好。磁性搅拌珠在转动过程中将培养基中营养成分均匀分散在培养体系中,同时分散细胞在生长过程中产生的代谢废物,降低细胞周围代谢废物浓度,为细胞生长提供均一环境。此外磁性搅拌珠搅拌柔和,未打散细胞团,保障细胞间的相互作用[21]。

|
图 5 培养8 d后NK-92细胞的形态 Fig.5 Morphology of NK-92 cells after 8 days |
图 6为NK-92细胞的扩增效果。由图 6可见,无论是静态对照组还是磁力搅拌瓶中,细胞活性均能维持在90% 以上(图 6(a))。但磁力搅拌瓶中总细胞扩增倍数可达到(72.63±7.80)倍,显著高于T 25培养瓶中总细胞扩增倍数(22.4±1.46)倍(p < 0.05)(图 6(b))。此外,从图 6(c)可知,在整个扩增期间,磁力搅拌瓶中细胞的比生长速率μ均显著高于T 25方瓶(p < 0.05)。说明磁力搅拌瓶可用于NK-92细胞的高效扩增。
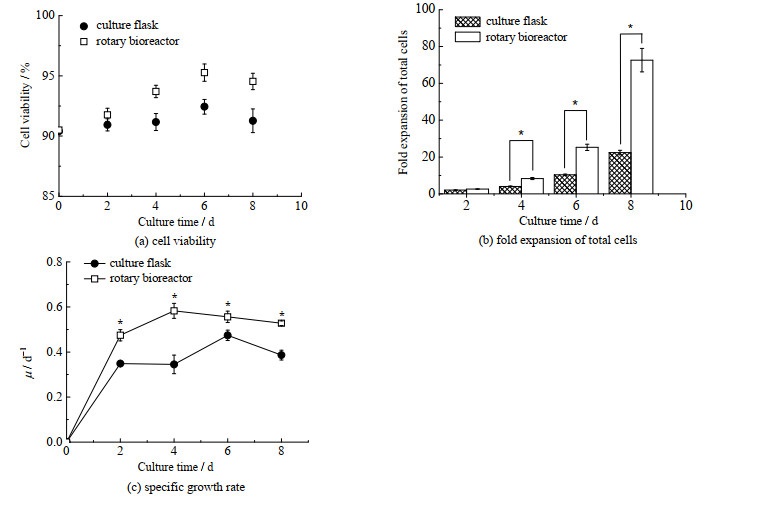
|
图 6 NK-92细胞的生长特性(n=3) Fig.6 Growth characteristics of NK-92 cells (n=3) * compare with control, p < 0.05 |
培养8 d后的培养物中CD3-CD56+细胞比例如图 7(a)所示。无论是磁力搅拌瓶还是T 25培养瓶,培养物中CD3-CD56+细胞的比例均在92%~96%,无显著差别。进一步以K562细胞作为靶细胞,评价扩增后NK-92细胞的杀伤活性,结果如图 7(b)所示。当效靶比为10:1时,磁力搅拌瓶扩增后的细胞杀伤活性为(85.57±3.69)%,显著高于T 25培养瓶扩增后的细胞杀伤活性(70.53±1.72)%(p < 0.05)。可见,利用磁力搅拌瓶扩增的NK-92细胞具有更高的对K562细胞的杀伤效应。
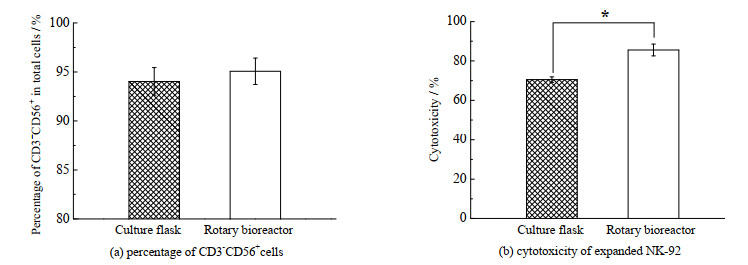
|
图 7 NK92细胞表型及功能(n=3) Fig.7 Phenotype and function of NK-92 cell (n=3) * compare with control, p < 0.05 |
本研究采用两步法制备了具有良好稳定性的海藻酸钠/壳聚糖双组分磁性搅拌珠。应用该磁性搅拌珠配合摇瓶在转瓶机上对NK-92细胞进行动态培养时,总细胞扩增倍数可达到(72.63±7.80)倍,显著高于T 25培养瓶中的(22.41±1.46)倍(p < 0.05);扩增后的细胞杀伤活性为(85.57±3.69)%,显著高于T 25培养瓶的(70.53±1.72)% (p < 0.05)。研究结果为免疫细胞体外扩增的生物反应器研制以及培养方法的开发提供了新思路。
| [1] |
DWARSHUIS N J, PARRATT K, SANTIAGO-M A, et al. Cells as advanced therapeutics: State-of-the-art, challenges, and opportunities in large scale biomanufacturing of high-quality cells for adoptive immunotherapies[J]. Advanced Drug Delivery Reviews, 2017, 114: 222-239. DOI:10.1016/j.addr.2017.06.005 |
| [2] |
WANG Z, GUO L, SONG Y, et al. Augmented anti-tumor activity of NK-92 cells expressing chimeric receptors of TGF-betar Ⅱ and Nkg2d[J]. Cancer Immunol Immunother, 2017, 66(4): 537-548. DOI:10.1007/s00262-017-1959-1 |
| [3] |
KLINGEMANN H, BOISSEL L, TONEGUZZO F. Natural killer cells for immunotherapy-advantages of the NK-92 cell line over blood NK cells[J]. Frontiers in Immunology, 2016, 7: 91. |
| [4] |
ZHANG J, ZHENG H, DIAO Y. Natural killer cells and current applications of chimeric antigen receptor-modified NK-92 cells in tumor immunotherapy[J]. International Journal of Molecular Sciences, 2019, 20(2): 317. DOI:10.3390/ijms20020317 |
| [5] |
GONG J H, MAKI G, KLINGEMANN H G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells[J]. Leukemia, 1994, 8(4): 652-658. |
| [6] |
BOUTEILLER P, BARAKONY A, GIUSTINIANI J, et al. Engagement of CD160 receptor by HLA-C is a triggering mechanism used by circulating natural killer (NK) cells to mediate cytotoxicity[J]. Proceedings of the National Academy of Sciences, 2002, 99(26): 16963-16968. DOI:10.1073/pnas.012681099 |
| [7] |
OELSNER S, FRIEDE M E, ZHANG C C, et al. Continuously expanding CAR NK-92 cells display selective cytotoxicity against B-cell leukemia and lymphoma[J]. Cytotherapy, 2017, 19(2): 235-249. DOI:10.1016/j.jcyt.2016.10.009 |
| [8] |
NOWAKOWSKA P, ROMANSKI A, MILLER N, et al. Clinical grade manufacturing of genetically modified, CAR-expressing NK-92 cells for the treatment of ErbB2-positive malignancies[J]. Cancer Immunology, Immunotherapy, 2018, 67(1): 25-38. DOI:10.1007/s00262-017-2055-2 |
| [9] |
唐江伟, 吴振强. 新型生物反应器结构研究进展[J]. 中国生物工程杂志, 2007, 27(5): 146-152. TANG J W, WU Z Q. Advances in bioreactor structure innovation and related studies[J]. China Biotechnology, 2007, 27(5): 146-152. |
| [10] |
GHOTLI R A, ABDUL A A R, IBRAHIM S, et al. Study of various curved-blade impeller geometries on power consumption in stirred vessel using response surface methodology[J]. Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(2): 192-201. DOI:10.1016/j.jtice.2012.10.010 |
| [11] |
HOSSEINIZAND H, EBRAHIMI M, ABDEKHODAIE M J. Agitation increases expansion of cord blood hematopoietic cells and promotes their differentiation into myeloid lineage[J]. Cytotechnology, 2016, 68(4): 969-978. DOI:10.1007/s10616-015-9851-3 |
| [12] |
MCKEE C, CHAUDHRY G R. Advances and challenges in stem cell culture[J]. Colloids Surf B Biointerfaces, 2017, 159: 62-77. |
| [13] |
ISMADI M-Z, GUPTA P, FOURAS A, et al. Flow characterization of a spinner flask for induced pluripotent stem cell culture application[J]. Plos One, 2014, 9(10): e106493. DOI:10.1371/journal.pone.0106493 |
| [14] |
PLACE E S, ROJO L, GENTLEMAN E, et al. Strontium- and zinc-alginate hydrogels for bone tissue engineering[J]. Tissue Engineering Part A, 2011, 17(21/22): 2713-2722. |
| [15] |
陶虎春, 李硕, 张丽娟, 等. 一种新型磁性壳聚糖/海藻酸钠复合凝胶球的制备与性能研究[J]. 北京大学学报(自然科学版), 2018, 54(4): 899-906. TAO H C, LI S, ZHANG L J, et al. Preparation and optimization of a novel magnetic chitosan/sodium alginate composite gel bead[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2018, 54(4): 899-906. |
| [16] |
BRANCO D C C, KLUMPERS D D, LI W A, et al. Influence of the stiffness of three-dimensional alginate/collagen-Ⅰ interpenetrating networks on fibroblast biology[J]. Biomaterials, 2014, 35(32): 8927-8936. DOI:10.1016/j.biomaterials.2014.06.047 |
| [17] |
KHONG T T, AARSTAD O A, BRAK G S, et al. Gelling concept combining chitosan and alginate-proof of principle[J]. Biomacromolecules, 2013, 14(8): 2765-2771. DOI:10.1021/bm400610b |
| [18] |
XU Y M, ZHAN C Y, FAN L H, et al. Preparation of dual crosslinked alginate-chitosan blend gel beads and in vitro controlled release in oral site-specific drug delivery system[J]. International Journal of Pharmaceutics, 2007, 336(2): 329-337. DOI:10.1016/j.ijpharm.2006.12.019 |
| [19] |
李莎, 高杨, 李研, 等. 壳聚糖-海藻酸钠复凝聚法制备微胶囊技术及其应用研究[J]. 化工新型材料, 2016(5): 28-30. LI S, GAO Y, LI Y, et al. Preparation technology and application of chitosan-sodium alginate microencapsule using complex coacervation[J]. New Chemical Materials, 2016(5): 28-30. |
| [20] |
HECHT H, SREBNIK S. Structural characterization of sodium alginate and calcium alginate[J]. Biomacromolecules, 2016, 17(6): 2160-2167. DOI:10.1021/acs.biomac.6b00378 |
| [21] |
LOPEZ-VERGES S, MILUSH J M, PANDEY S, et al. CD57 defines a functionally distinct population of mature NK cells in the human CD56dimCD16+ NK-cell subset[J]. Blood, 2010, 116(19): 3865-3874. DOI:10.1182/blood-2010-04-282301 |




