生物质广泛存在于自然界,具有资源丰富、来源广泛、可再生以及可生物降解等特点,使其得到了广泛的应用。5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)是由生物质碳水化合物如葡萄糖、果糖和纤维素等直接转化合成,是实现生物质资源综合利用的一种重要平台化合物,也被认为是最具潜力的化学品。HMF的化学结构中含有醛基、羟基和呋喃环,这些都是化学性质非常活泼的官能团,正因为如此,由HMF可以衍生出多种精细化学品。HMF氧化可以生产多种重要的平台化合物,如2, 5 -二甲酰基呋喃(2, 5-diformylfuran,DFF)、2, 5-呋喃二甲酸(2, 5-furandicarboxylic acid,FDCA)、5-醛基-2-呋喃甲酸(5-formyl-2-furancaboxylic acid,FFCA)和5-羟甲基糠酸(5-hydroxymethyl-2-furancarboxylic acid,HMFCA),其中DFF和FDCA是选择氧化HMF所得的重要下游产品[1]。
DFF商业价格昂贵,在许多领域有广泛的应用[2-5]:作为一种有机物单体,可作为高端药物中间体、杀菌剂和杀线虫剂的原料;作为杂环配体;在电池分离器中作为聚乙烯醇的交联剂;是铸造用砂黏结剂的成分之-;由于其分子具有对称性与不饱和性的结构,它可以作为单体用于各种聚合材料,如DFF与非线性二胺缩合产生的树脂具有高热稳定性,可作为吸附材料应用在储能或天然气中;在电渡金属、分析化学、有机金属的前驱体、电子光学器械、有机荧光粉和发光体、合成多功能材料的单体等方面都有广泛的应用。作为平台化合物可转化为高附加值化学品如2, 5-二(氨基甲基)呋喃[6-8],2, 5-二氰呋喃[9]等。DFF通常使用金属催化剂催化氧化纯HMF制备得到[10-13]。
FDCA是DFF进一步氧化的产物,其分子结构中含有与石油基单体对苯二甲酸(p-phthalic acid,PTA)相似的芳环体系,被认为是石油基单体对苯二甲酸(PTA)的理想替代品,用于生产与聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)和聚对苯二甲酸丁二醇酯(polybutylene terephthalate,PBT)等结构相似的生物基塑料[14]。据报道FDCA为原料得到的生物基聚酯(polyethylene 2, 5-furandicarboxylate,PEF)的性能优于PTA为原料得到的石油基聚酯(PET),具有更好的热稳定性、低温成型性及更优异的气体阻隔性能[15],具有巨大的市场潜力。因此,它被美国能源部评为12种最具潜力的生物基平台化合物之一,被杜邦和DSM公司誉为“沉睡的巨人”[16]。近年来催化氧化HMF制备FDCA所开发的催化剂主要包括贵金属Au、Pt、Pd和非贵金属Mn、Co、Cu等[17-20]。
尽管从HMF生产DFF或FDCA可以得到几乎定量的产率,但是HMF的成本很高,不稳定(性质活泼、易液化且见光易分解),在制备过程中,其自身的分离和纯化是尚未解决的技术难题,导致其价格昂贵,且货源紧张,供不应求。由于其性质活泼,保存也比较困难(需低温避光)[21]。因此,由HMF生产DFF或FDCA是一个不经济且耗能的过程。而果糖、葡萄糖和纤维素之类的碳水化合物比HMF便宜很多且来源更丰富。因而,直接以碳水化合物为原料通过一锅法反应制备DFF或FDCA更具吸引力。但是这个过程需要考虑杂质的影响,例如在制备HMF过程中产生的胡敏素,这些不溶性胡敏素会抑制HMF到DFF或FDCA的氧化,胡敏素会使催化剂失活,因此影响多相催化剂的使用[22]。
本综述结合作者前期在碳水化合物制备HMF及HMF的氧化领域的研究工作,介绍了近年来国内外研究主要以绿色的分子氧为氧化剂,一锅法由碳水化合物(果糖、葡萄糖)直接制备DFF和FDCA的进展,按照所使用的催化剂进行分类,并针对研究中存在的问题对其前景进行了展望。
2 果糖一锅法制备DFF由碳水化合物一锅法直接合成DFF,近年来大多以果糖为原料,果糖到DFF的转化是一个串联反应,涉及在酸性位点上催化果糖得到HMF的脱水反应,以及在氧化还原位点上催化HMF到DFF的转化。然而,在前述脱水步骤中形成的水会使随后的氧化步骤减缓。此外,催化体系中,氧化还原位点和水的共存会导致果糖的氧化降解/聚合和HMF的再水化/聚合而产生大量副产物,如甲酸(formic acid,FA)、乙酰丙酸(levulinic acid,LA)和腐殖质(见图 1)[1, 23]。研究表明二甲基亚砜(dimethyl sulfoxide,DMSO)在抑制副反应、稳定生成的HMF具有明显的作用[24-25],因此,研究大多采用DMSO为溶剂。而DMSO为高沸点溶剂,大多为非分离的高效液相色谱(high performance liquid chromatography,HPLC)测定收率,仅少数采用升华法[26-27]、萃取法[28]或吸附-解析法[29]得到分离收率。另外,在高温下DMSO原位热解能产生强酸(如硫酸和甲磺酸),强酸可有效促进果糖的脱水[25, 30]。在DMSO中150~160 ℃,无额外催化剂添加下,果糖脱水可得到85%~92% 收率的HMF[31-32]。一锅法由果糖制备DFF有一锅两步法和一步法。
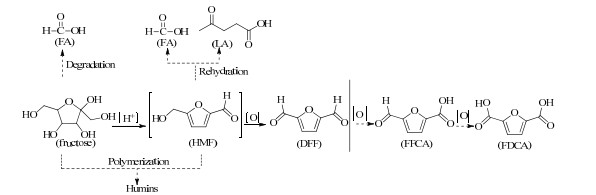
|
图 1 果糖一锅法制备DFF Fig.1 Preparation of DFF from fructose in one-pot process |
基于以果糖为原料制备DFF的反应机理,相关研究者将有脱水性能和催化氧化作用的催化剂联合形成组合催化剂。为获得高于50% 收率的DFF,该反应一般需分步添加催化剂。在果糖脱水步骤中,只有酸催化剂存在,避免氧化还原催化剂的并存而导致果糖氧化反应生成副产物。在氧化步骤中酸催化剂的存在也不利于HMF的氧化,降低DFF的收率[1]。
由于钒具有多种氧化态,钒基催化剂常被用于HMF的氧化反应中。2003年,Grushin等[32]、Halliday等[33]采用一锅两步法由果糖制备DFF,以DMSO为溶剂,先以H-型阳离子交换树脂BioRad AG 50W-X8为催化剂,在110 ℃下反应5 h,气相色谱(gas chromatography,GC)测定,HMF收率为85%,过滤除去催化剂,再加入钒催化剂VOHPO4·0.5H2O或V2O5,通入空气,在150 ℃下分别反应13.5和17 h,DFF的收率分别为52% 和67% (见图 2)。然而,由于该催化体系反应温度高,DMSO是一种偶极非质子溶剂[34],易分解为Me2S和Me2SO2,并伴随有难闻的气味,污染产物DFF,这些杂质使得最终产物难以纯化[1]。需要通过真空升华和索氏提取获得纯净的DFF晶体[33]。2015年,Xu等[35]采用Amberlyst-15和聚苯胺-双(乙酰丙酮)氧钒(VO(acac)2)组合催化剂,在DMSO-对氯甲苯组成的混合溶剂中,一锅两步法:首先以Amberlyst-15为催化剂在110 ℃下反应1.5 h,HMF的收率为91.8%,除去脱水催化剂,加入催化剂聚苯胺-VO(acac)2,在相同的反应温度下氧气流中反应12 h, DFF的收率为71.1%(见图 3)。若采用一步法110 ℃下氧气流中反应12 h,由果糖转化为DFF的收率仅为42.1%。可见,DFF一锅两步法的收率远远高于一步法,主要原因可能是果糖的氧化导致副产物的产生。2017年,Cui等[36]以DMSO为溶剂,140 ℃下以浓硫酸为脱水催化剂,果糖反应20 min后,加入五氧化二钒(V2O5)/陶瓷粉并通入氧气,继续反应200 min,DFF的收率为68.4%。使用组合催化剂需要过滤除去第1步脱水反应的固体酸催化剂,或者采用具有强腐蚀性的均相酸催化剂。

|
图 2 果糖经脱水、氧化制备DFF Fig.2 Preparation of DFF from fructose by dehydration and air-oxidation |

|
图 3 两步法由果糖制备DFF Fig.3 Preparation of DFF from fructose in two-step conversion |
最近,A1 Ghatta等[37]以离子液体为溶剂,在常压下将果糖直接转化为DFF,并采用升华法对DFF进行分离。第1步以水质量分数为3.5% 的离子液体[bmim][OTf]为溶剂,离子液体中果糖的质量分数为14%,HCl为催化剂,100 ℃反应10 min,HMF的收率为83%。第2步加入固载有吡啶配体和2, 2, 6, 6-四甲基哌啶氧化物(2, 2, 6, 6-tetramethyl-1-piperidinyloxy,TEMPO)的离子液体([bbpy][NTf2]、[TEMPO-bmim][NTf2]),同时添加催化剂CuCl,80 ℃常压下反应10 h后,采样升华法得到分离收率为52%的DFF。该报道提供了一种从反应体系中分离DFF的方法,然而未对催化剂进行以果糖为底物的循环使用。
为了方便回收催化剂,研究者们设计了磁性组合催化剂用于催化果糖直接制备DFF。2012年,Yang等[38]以磁性固体酸Fe3O4-SBA-SO3H和含有KMnO16·nH2O的多孔氧化锰K-OMS-2为组合催化剂催化果糖一锅两步法制备DFF。首先以固体酸Fe3O4-SBA-SO3H为催化剂,DMSO为溶剂,110 ℃空气中反应2 h,果糖几乎完全转化,不分离催化剂,继续加入催化剂K-OMS-2,通入氧气,反应6 h,DFF的收率为80%。而以葡萄糖为原料,几乎没有DFF生成,DFF的收率 < 5%,表明葡萄糖不能在该催化剂作用下有效异构化为果糖。若一步添加酸催化剂和氧化催化剂,果糖在脱水反应中二者共存,只能得到少量的HMF(收率 < 5%)和DFF(收率 < 5%)。2014年,Zhang等[23]以羟基磷灰石(HAP)包裹γ-Fe2O3,然后将HAP中的Ca2+与Ru3+进行离子交换生成催化剂γ-Fe2O3@HAP-Ru。首先在DMSO-对氯甲苯混合溶剂中,以Fe3O4@SiO2-SO3H为催化剂,果糖在110 ℃下反应2.5 h后,HMF的收率为90.1%,利用磁铁除去催化剂Fe3O4@SiO2-SO3H,加入催化剂γ-Fe2O3@ HAP-Ru,在110 ℃,0.1 MPa O2压力下反应24 h,DFF的总收率为79%。2017年,Yang等[39]首先以磁性固体酸Fe3O4−RGO−SO3H为催化剂,DMSO为溶剂,果糖在110 ℃空气中反应2 h后,除去催化剂,再加入通过碱共沉淀法制得的Ru基混合金属氧化物ZnFe1.65Ru0.35O4,同时添加DMSO,在氧气流中反应6 h,DFF的收率为73.3%。若第2步添加DMSO和水的混合溶剂,130 ℃氧气流中反应16 h,可得到FDCA,其收率为70.5%。
从以上研究可以看出,为了避免不同性质催化剂对脱水反应和氧化反应的相互干扰,组合催化剂一般需要分步添加,完成脱水反应后除去酸性催化剂再添加氧化催化剂进行氧化反应。
光催化反应可以利用太阳光来加速化学反应,被认为是一种经济和环境友好的技术,近年来对有机物选择性转化引起了人们浓厚的兴趣。研究者也研究了光催化果糖合成DFF。2018年,Ma等[40]以还原型的氧化石墨烯负载Au-Ru双金属纳米粒子Au0.5Ru2.5/rGO为催化剂,以DMSO为溶剂,110 ℃光照条件下,果糖首先在Ar气氛围中反应2 h,接着在0.5 MPa的氧气压力下反应6 h,DFF的收率最高可达到86%,且催化剂Au0.5Ru2.5/rGO表现出了优异的重复使用性,重复使用5次后,催化剂的光催化活性变化不大。第1步的脱水反应可以解释为由DMSO的原位热解生成的强酸催化反应。第2步氧化反应的机理是:通过导电石墨烯载体将光激发电子从Ru转移到Au纳米颗粒,使得Au纳米粒子表面带负电,而Ru纳米粒子表面缺电子。电荷分布的不均匀性可增强反应物分子与催化剂之间的相互作用,降低反应的活化能以增强催化活性。催化剂吸附反应物分子,光诱导的电子可能会从双金属纳米颗粒转移到O2形成超氧自由基,然后超氧自由基氧化HMF形成DFF和水。
2.1.2 双功能催化剂从综合角度看,使用含有酸性和氧化-还原性的双功能催化剂进行脱水和氧化反应,免去了第1步反应后催化剂的分离,因而更可取。但为了克服O2存在下,氧化-还原位点催化果糖的氧化并形成副产物,脱水反应常常需要在氮气氛围中进行。Lv等[30]用硫酸制备的氧化石墨烯(GO)具有来自磺酸基团的酸位和来自羧酸基团和边缘缺陷处未配对电子的氧化-还原催化活性。以这种双功能材料为催化剂,果糖为原料,DMSO为溶剂,140 ℃下果糖先在N2气流中反应2 h,再在氧气流中反应22 h,DFF的收率为72.5%。若采用一锅一步法,果糖在氧气流中反应24 h,DFF的收率仅为53%。2014年,Chen等[41]以质子化的氮化碳[g-C3N4(H+)]和钒掺杂的氮化碳(V-g-C3N4)为组合催化剂,DMSO为溶剂,果糖经一锅两步法,先在氮气保护下,加入g-C3N4(H+)在120 ℃下反应2 h,再加入V-g-C3N4在常压氧气下130 ℃反应6 h,DFF的收率为63%。若采用双功能催化剂V-g-C3N4(H+),130 ℃先在N2保护下反应2 h,再在1 MPa氧气压力下反应6 h,DFF的收率仅为45%。且催化剂V-g-C3N4 (H+)不稳定,尽管每次使用后用0.1 mol·L−1的HCl进行再生,重复使用3次后,DFF的收率仍然从45% 降到20%。可见,相同性质的双功能催化剂效果要比组合催化剂差。
杂多酸是由金属原子和氧原子桥接而成的金属-氧簇化合物,其结构决定了杂多酸具有质子酸性和氧化-还原性,被广泛应用于化工、医药、环境等各个领域[42-43]。然而,杂多酸易溶于水和含氧有机溶剂中而作为均相催化剂致使反应后分离困难。因此,研究者将杂多酸进行固载化作为果糖制备DFF的双功能催化剂。2014年,Liu等[44]将Cs与钼钒磷系列杂多酸进行离子交换制得酸性铯盐杂多酸Cs3HPMo11VO40非均相催化剂,并通过调整催化剂的酸密度和V含量一锅两步法催化果糖制备DFF。以DMSO为溶剂,先在N2保护下110 ℃反应2 h,再在常压O2下120 ℃反应6 h,DFF的收率为60%。
金属氧化物也常常被作为固体酸或者氧化-还原催化剂。2017年,Yang等[45]制备了三维花状的Ce-Mo微米/纳米复合氧化物(f-Ce10−xMoxOδ)双功能催化剂,当Ce与Mo的物质的量比约为9:1时,以DMSO为溶剂,120 ℃下,先在氮气流中反应2 h,再在氧气流中反应10 h,果糖可以接近全部转化,DFF的收率为74%。催化剂在600 ℃下煅烧2 h可以重复利用,循环使用5次后催化活性变化不大,DFF的收率仍保持在70%左右。2019年,Srivastava等[28]以FeVO4修饰-SO3H功能化的聚苯胺得到催化剂S-PANI-FeVO4(X)(X代表PANI与FeVO4的质量比),以S-PANI-FeVO4(11)为催化剂,DMSO为溶剂,120 ℃下,蔗糖先在N2气流中反应6 h,然后升温至140 ℃,通入氧气,继续反应24 h,以MIBK为萃取剂,DFF的分离收率可达到80%。若以果糖为原料,DFF的分离收率可高达91%。
为了方便催化剂的分离,研究者也设计了磁性双功能催化剂。2016年,Mittal等[46]以二氧化硅包覆的磁性纳米粒子SiO2@Fe3O4进行氯硅烷化得到Cl-SiO2@Fe3O4,通过亲核取代Cl来负载salten配体和钨酸,salten配体与氧钒化合物配位,最终得到磁性双功能化催化剂WO3HO-VO(salten)-SiO2@Fe3O4。以异丙醇为溶剂,果糖首先在80 ℃反应1 h,HMF的收率为82.2%,果糖的转化率为94.2%,然后以H2O2为氧化剂,60 ℃下反应15 h,DFF的收率为71%。该磁性催化剂也显示了高的稳定性,循环使用5次后,DFF的收率仅下降了5%。2017年,Fang等[47]以硫粉为掺杂的铁基金属-有机框架材料(MIL-88B),通过热解的方法得到催化剂Fe/C-S,该催化剂Fe3O4的(111)晶面高度分散在S掺杂的碳上,催化果糖直接合成DFF的效果非常好。以乙醇为溶剂,100 ℃下,果糖首先在常压氮气中反应2 h,然后在常压氧气中反应3 h,果糖转化率为99%,DFF的收率为99%,是目前报道的最高收率。该催化剂具有显著催化活性的原因是被氧化的硫官能团提供了果糖脱水的酸性,Fe3O4纳米粒子的(111)晶面催化HMF氧化为DFF。另外DFF在催化剂上的吸附能要比HMF低,有利于HMF在催化剂上的吸附和DFF的脱附,从而抑制DFF的继续氧化,同时,DFF的高选择性还在于催化剂上有大量未被氧化的S。
2.2 一步法制备DFF两步法需要将脱水和氧化反应分步进行,若采用组合或者多功能催化剂将两步反应合并一步完成,不仅方便操作、加速了果糖转化反应的进行,还可以节省设备的投入,降低成本。一步法面临的主要瓶颈是当催化剂的酸性与氧化-还原位点共存时, 导致碳水化合物的氧化产生胡敏素等副产物[48]。因此,在相同催化剂作用下,通常一步法得到DFF的收率低于两步法。目前也有针对这一瓶颈问题的研究。Chen等[48]研究显示双功能催化剂的两个催化活性位点间的纳米距离和溶剂的组成对DFF的选择性至关重要。还原型的氧化石墨烯双功能化磺酸官能团和Ru得到催化剂Ru/S-rGO,酸性位点和金属位点之间的距离若太近如~3 nm,果糖在酸性位点上产生的糖中间体在未形成HMF之前,被邻近的金属位点氧化,使得HMF和DFF的选择性降低。溶剂方面,与水溶液相比,水-甲苯组成的双相体系有利于减少乙酰丙酸(LA)和甲酸(FA)的形成,且有利于提高HMF氧化为DFF的选择性。
2.2.1 无金属催化剂金属催化剂的使用增加了生产成本且会污染最终产品,特别是在药物合成方面,反应混合物中痕量金属的存在可能造成巨大影响[49],因此发展了无金属催化葡萄糖、果糖等制备DFF。2014年,Laugel等[50]在均相NaBr/DMSO体系中,果糖在150 ℃反应23 h,DFF的收率为67%。该催化体系的缺陷是催化剂的用量大,NaBr的摩尔分数达到30 %,且DMSO的分解造成产物的分离纯化困难。Peng等[51]开发了一种磺化的二维共价有机框架材料(TFP-DABA)作为固体酸催化果糖脱水和HMF的氧化。以DMSO为溶剂,100 ℃反应1 h,最高可得到97% 收率的HMF。以KBr(摩尔分数20%)为助催化剂,100 ℃反应12 h,一步法可得到65% 收率的DFF。该方法与均相NaBr为单一催化剂相比,反应条件更温和,反应时间更短。最近,Zhao等[52]以葡萄糖为碳源,采用熔盐法制备碳纳米片,再用浓硝酸和硫酸处理得到具有丰富含氧官能团(羧基、磺酸基和硝基)的碳纳米片催化剂(GN-NS)。以DMSO为溶剂,150 ℃氧气流中,果糖一步法制备DFF,反应2 h后,HMF的收率为87%,反应25 h后,DFF的收率为70%。催化剂经循环使用5次,催化活性变化不大。Hu等[53]以可见光催化一步法制备DFF。果糖在乙腈中,以HBr(HBr与果糖的物质的量比为25:1)为催化剂,常压氧气下,50 ℃光照12 h,DFF的收率为42.1%。如采用两步法,以DMSO为溶剂,果糖先在120 ℃ N2气氛中反应2 h,用活性炭吸附胡敏素后分离,再添加DMSO,80 ℃ O2气氛中光照8 h,DFF的收率可提高到80.2%。该方法的优势是反应条件温和,但HBr的用量大、腐蚀性强,污染环境。
2.2.2 Ru基催化剂Raut等[54]以蒙脱土负载Ru(Ru-MMT)为催化剂,DMSO为溶剂,120 ℃下由果糖制备DFF。一步法在0.3 MPa氧气压力下反应1.5 h后,HMF的收率为87%,反应6 h后,DFF的收率为81%。分别以葡萄糖、菊粉、蔗糖、淀粉、核糖和麦芽糖为原料,一步法得到21%~55%收率的DFF。一锅两步法,果糖先在常压N2中反应2 h后,果糖完全转化,HMF的收率为98%,继续在0.3 MPa氧气压力下反应6 h,DFF的收率为89%。采用一锅两步法重复使用催化剂,经5次循环使用后,催化剂催化活性变化不大。一步法中在反应的初始阶段由于氧气的存在导致胡敏素等副产物的产生,降低了催化剂的反应活性。
2.2.3 V基催化剂Zhang等[21]采用α-CuV2O6和固体酸聚离子液体P(EVPI-Br)的二元组合催化剂,以DMSO为溶剂,果糖在常压氧气下,135 ℃反应3.5 h,一步法得到DFF的收率为63.1%。该催化体系利用二元组合催化剂对反应底物和中间体的良好吸附行为有效地减弱了一锅法中脱水和氧化反应的相互干扰,从而获得了高的DFF收率。固体酸P(EVPI-Br)的亲水性表面使得其优先吸附果糖,有利于果糖接近酸位点进一步转化为HMF。而α-CuV2O6表现出对果糖低的吸附性能对HMF显示出强的吸附性,使得果糖不易被氧化,HMF在氧化位点转化成DFF。
2017年,Zhang等[55]采用无模板法制备了高硅沸石负载氧化钒得到催化剂V2O5@MOR。以HCl为添加剂,DMSO为溶剂,在常压氧气下,果糖先在130 ℃反应4 h,再在120 ℃反应12 h,DFF的收率为96% 仅次于目前报道的最高收率99%,催化剂重复使用5次后DFF的收率仍为91.8%。该催化剂的活性氧化位点是V高度分散形成独立的四面体[V2O8]6−,催化剂的高硅沸石骨架(SiO2、Al2O3物质的量比为60)为形成中间体HMF提供了很好的酸度,且在酸性环境下耐腐蚀性,因而具有良好的稳定性。
2014年,Tao等[56]将掺有钯和钒的铬基MOF材料用于果糖直接转化制备DFF。以5% Pd-V(3:2)-MIL-101(5% 为Pd-V的质量分数,3:2为Pd和V物质的量比)和磺酸树脂为催化剂,DMSO为溶剂,在140 ℃,0.1 MPa O2的条件下,可获得34% 收率的DFF和约40% 收率的HMF中间体。收率不高的原因是反应过程中形成的腐殖质使催化剂活性位点失活,从而使反应中产生的HMF无法有效转化为DFF。
2.2.4 Mo基催化剂近年来,具有布朗斯酸性和氧化还原性的含钼Keggin杂多酸常作为双功能催化剂,催化果糖一步法生产DFF。2015年,Ghezali等[57]以Mo-V Keggin杂多酸HPMoV为催化剂,氯化胆碱(ChCl)/DMSO为溶剂,由于果糖与ChCl可以形成深度共溶剂,ChCl的加入一方面可以提高果糖到HMF的选择性,另一方面可以提高O2在溶剂中的溶解度,加快氧化反应的速率。在氧气流中120 ℃、8 h的反应条件下,果糖的转化率为95%,DFF的收率为84%。2017年,Zhao等[58]将磷钼酸引入对苯二甲酸铬金属-有机框架材料(MIL-10)的孔中制得催化剂PMA-MIL-10。以DMSO为溶剂,果糖在110 ℃下氧气流中反应7 h,得到DFF的收率为75.1%。但催化剂不稳定,Mo会从催化剂中流失(重复使用5次后,流失9%)。这一现象在Zhao等[59]报道的以MoO3掺杂的质子化氮化碳(Mo-HNC)双功能催化剂中也有报道。以Mo-HNC为催化剂,DMSO为溶剂,氧气流中,170 ℃反应9 h,一步法得到DFF的收率为77%。质子化位点和Mo均有助于果糖脱水生成HMF。但由于Mo的流失,催化剂在循环使用中DFF的收率不断下降。
避免杂多酸浸出的一种方法是用Cs+部分取代H+。Liu等[29]以Cs+部分取代Keggin杂多酸H3PMo12O40中的质子形成非均相催化剂钼钒磷酸铯盐Cs0.5H2.5PMo12,以DMSO为溶剂,160 ℃下,空气中反应4 h,果糖一步法转化为DFF的收率为69.3%。催化剂在循环使用的前2次DFF的收率略有下降,循环使用2次后,催化活性保持稳定,5次使用后催化剂的XRD谱图与新鲜催化剂相比几乎没有变化。整个反应在空气条件下进行,简化了操作过程。此外,通过吸附-解析法从反应混合物中分离出产生的DFF,其中活性炭和糠醛分别作为吸附剂和解析剂,实现了58.2% 的分离收率。
另一种杂多酸非均相化的方法是将杂多酸进行固载。2019年,Liu等[60]以甲酰化的聚苯胺负载磷钼杂多酸40-PMo12/F3-PAN(40代表杂多酸质量占杂多酸与聚苯胺总质量的40%)为催化剂,DMSO为溶剂,果糖在160 ℃常压空气中反应7 h后,DFF的收率为76.7%。同年,Li等[61]通过纺丝的方法合成了多金属氧酸盐修饰的壳聚糖纳米纤维HPMoV/CS-f,该催化剂具有Brønsted性、碱性和氧化还原催化活性位,以HPMoV/CS-f(25)(25代表多金属氧酸盐POM的量)为催化剂,DMSO为溶剂,140 ℃、0.8 MPa氧气压下,反应6 h,一步法催化葡萄糖、果糖直接合成DFF,反应的转化率分别为82.3%和83.1%,DFF的收率分别为31.4% 和61.9%。壳聚糖的─NH2与HMF的─OH基通过氢键相互作用,使得─OH被活化,有利于DFF的生成。
经过高温煅烧制得的氧化物也常用于一步法催化果糖制备DFF。2018年,Zhao等[62]以磺化的MoO3-ZrO2二元氧化物为催化剂,DMSO为溶剂,150 ℃氧气流中反应10 h,一步法由果糖得到DFF的收率为74%,果糖的转化率为100%。但催化剂氧化位上产生的碳质沉积物导致循环使用过程中DFF的收率不断下降。类似的,2019年,Zhou等[63]先将葡萄糖水热碳化再在空气中275 ℃退火得到具有丰富介孔的碳球负载钼氧化合物的催化剂MoOx/CS-air,在160 ℃ DMSO溶剂中氧气流下,催化果糖反应2 h后,果糖100% 转化,并得到78% 收率的DFF。然而,催化剂循环使用5次后,DFF的收率下降了近20%。2020年,Lei等[64]制备了一系列金属复合氧化物MxMoOδ (M=Ca、Mn、Fe、Co、Ni、Cu、Zn、Y、Bi、Zr、La或Ce),其中ZrMoOδ对一步法催化果糖制备DFF具有较好的催化活性,DMSO为溶剂,160 ℃下空气中反应4 h,DFF的收率为61%。氧化反应的活性位点来源于氧化锆与氧化钼在600 ℃煅烧的情况下产生强相互作用形成的Zr(MoO4)2,可以产生表面化学吸附的氧物种。2017年,Lu等[65]将铜离子掺入氧化锰八面体分子筛中得到Cu-K-OMS-2,协同Amberlyst-15催化果糖一步法制备DFF。以DMSO为溶剂,160 ℃常压氧气下反应12 h,DFF的收率可达到80% 以上,且该混合催化剂表现出了良好的循环使用性,重复使用6次后,DFF的收率仍保持在80% 以上。
2.2.5 Co-Al基催化剂2018年,Raut等[66]以Co-Al(Co与Al物质的量比为2:1)水滑石煅烧所得的复合金属氧化物为催化剂,DMSO为溶剂,一步法果糖在120 ℃ 0.3 MPa氧气压下反应8 h后,DFF的收率为77%。采用一锅两步法,果糖首先在常压N2气中反应2 h,再在0.3 MPa氧气压下反应6 h,DFF的收率可以提高到87%。
未来制备DFF催化剂的开发应建立催化剂结构与催化活性之间的关联,并能够设计合理的催化果糖直接转化为DFF的双功能催化剂,且这些催化剂具有高的催化活性和产物选择性。
3 葡萄糖一锅法制备DFF葡萄糖是比果糖更丰富的六碳糖,价格低廉,在单糖中占据重要的地位。但由于葡萄糖自身稳定的吡喃型结构加大了酸催化下葡萄糖转化为HMF的难度。通过葡萄糖脱水制备HMF的过程分2步进行,首先葡萄糖异构化为果糖,然后果糖再进一步脱水得到HMF。反应过程中的决定性步骤是葡萄糖异构化过程,决定了反应的选择性和产物收率的高低。迄今为止报道的由葡萄糖直接转化为DFF的收率非常低,目前最好的结果为55%[1]。
3.1 均相催化体系2011年,Xiang等[67]通过CrCl3·6H2O/NaBr//NaVO3·2H2O催化体系一锅两步法催化葡萄糖制备DFF。以N, N-二甲基乙酰胺(DMA)为溶剂,首先加入催化剂CrCl3·6H2O和NaBr,葡萄糖在N2气保护下100 ℃反应6 h,过滤除去NaBr和CrCl3·6H2O,再加入催化剂NaVO3·2H2O,通入空气,110 ℃反应10 h后,DFF的收率为55%。该催化体系虽然获得了中等收率的DFF,但采用均相复杂的混合催化剂,且催化剂NaVO3·2H2O的摩尔分数高达21%。类似的,Zhang等[68]以DMF为溶剂,AlCl3·6H2O/NaBr/钒催化剂,DFF的收率为33%~44%。
2016年,Girka等[22]采用均相体系H3BO3/NaBr/HCOOH/DMSO催化葡萄糖一步法制备DFF,150 ℃下反应17 h后,DFF的收率可达到28%。H3BO3有利于解聚、异构化和脱水反应,而大量的H3BO3导致HMF的分解,NaBr和水有利于选择性氧化HMF,甲酸则有助于脱水反应和加速HMF的氧化。但该均相催化体系催化剂用量较大,H3BO3的摩尔分数为50%,NaBr和HCOOH的摩尔分数均达到30%。
这类均相混合催化剂腐蚀设备、产物分离困难、废液难处理会形成污染,催化剂不能回收,因而,均相催化剂不符合环境友好的化学过程。
3.2 非均相组合催化剂基于均相催化剂的弊端,将具有不同功能的非均相催化剂进行组合,催化葡萄糖制备DFF。
2011年,Takagaki等[69]将水滑石、Amberlyst-15和Ru/HT催化剂组合使用,将葡萄糖直接转化为DFF。其中,碱性水滑石催化葡萄糖异构化为果糖,酸性Amberlyst-15催化果糖脱水,贵金属催化HMF选择性氧化。采用两步法,先加入催化剂水滑石、Amberlyst-15在N2流中373 K下反应3 h,再加入催化剂Ru/HT在O2流中反应6 h,葡萄糖的转化率为98%,DFF的收率为25%。天然不可消化的三糖棉子糖(葡萄糖、果糖和半乳糖单元构成)通过同样的两步法得到DFF的收率为27%。在组合催化剂Amberlyst-15和Ru/HT的作用下,110 ℃以DMF为溶剂,O2气流中反应9 h,果糖一步法转化为DFF的收率为13%。若采用两步法,果糖先在氮气流中Amberlyst-15催化剂的作用下反应3 h,不分离催化剂随后加入催化剂Ru/HT继续在氧气流中反应6 h,DFF的收率提高到49%。
2017年,Zhang等[70]采用干凝胶法酸催化硅前体和偏钒酸铵共水解制备了含钒的全硅β-沸石(VSi-Beta),独立的四面体V5+、[V2O7]4−和(VO3)nn−均匀分散在VSi-Beta沸石骨架中。这些种类的V可以阻止HMF的过度氧化而选择性得到DFF,一步法催化碳水化合物制备DFF。以VSi-Beta(50) (50代表凝胶中Si、V的物质的量比)和H2SO4为催化剂,DMSO为溶剂,130 ℃常压氧气下,以葡萄糖为原料,一步法制得DFF的收率为38.2%。以果糖为原料反应4 h,DFF的收率为86.3%。
3.3 非均相多功能催化剂组合催化剂分离较困难,近年来,开发了越来越多的非均相多功能催化剂用于葡萄糖的转化研究中。
2017年,Rathod等[71]合成了葡萄糖衍生的含有─SO3H,─COOH酸性官能团和硅丙基氨碱性官能团的酸碱双官能团碳基催化剂(CC-SO3H-NH2),碱基位点催化葡萄糖异构化为果糖。以CC-SO3H-NH2(质量分数为30%)为催化剂,DMSO为溶剂,140 ℃下,葡萄糖先在氮气流中反应15 h,再在氧气流中反应22 h,DFF的收率为51%。催化剂重复使用5次,DFF的收率变化不大。该催化体系避免了有腐蚀性或有毒过渡金属的使用,且生物质碳可再生,资源丰富,价格低廉。
2019年,Wang等[72]采用无自由基聚合羧基功能化的离子液体和二乙烯基苯,得到P(DVPI-Br),再与杂多酸H5PMoV2进行离子交换引入杂多酸阴离子,最后部分碳化得到催化剂PMoV2@CP-x-y (x代表P(DVPI-Br)/PMoV2的质量比,y代表碳化温度)。以PMoV2@CP-5.5-400为催化剂,DMSO为溶剂,120 ℃常压氧气下,以葡萄糖为原料,135 ℃反应5 h后,DFF的收率为51.2%。以果糖为原料,反应4 h后,DFF的收率为87.3%。
4 果糖一锅法制备FDCA由碳水化合物直接制备FDCA的报道较少。多采用催化脱水和氧化反应的组合催化剂,由于HMF的选择性氧化制备FDCA通常需要添加碱而脱水反应在酸性催化剂的作用下,因此反应需要通过两步法由果糖制备FDCA。一般在有机溶剂如DMSO、γ-戊内酯(GVL)中,果糖脱水能得到高收率的HMF(> 70%)[73],而通常需要在碱性水溶液中将HMF氧化为FDCA[74],因为水被证明是氧化中的氧源[75],化学计量碱的加入使得FDCA溶解在溶液中,避免沉积在固体催化剂的表面[76-77]。
2000年,Kröger等[78]使用膜的两步法由果糖制备FDCA,为了防止果糖的氧化,反应在用聚四氟乙烯膜分隔的反应器内进行。首先以Lewatit SPC 108(微孔H+型阳离子交换剂)作为固体酸催化剂,水为溶剂,在80 ℃将果糖脱水得到HMF。由于HMF在甲基异丁基酮(MIBK)中具有更高的溶解度,因此可以提取HMF进入MIBK中,HMF分子透过膜转移到MIBK相,然后以PtBi/C为催化剂在80 ℃下将HMF氧化为FDCA,反应速率受HMF透过扁平膜的扩散的限制,果糖不溶于MIBK,避免了果糖被氧化。反应7 d后,FDCA的收率为25%,选择性为50%,同时产生25% 收率的副产物乙酰丙酸。该方法设备比较复杂,反应时间长,产生的FDCA收率低,并且很难从副产物中纯化。
2003年,Ribeiro等[79]将乙酰丙酮钴(Co(acac)3)包封在溶胶-凝胶二氧化硅中,制备了双功能催化剂Co(acac)3-gel,结合催化剂的酸性和氧化还原能力,研究了果糖一锅法转化为FDCA,以水为溶剂,果糖的转化率为72%,FDCA的选择性为99%。与前面Kröger报道[65]的方法相比,FDCA的收率和选择性均改善了几倍。但反应需要在高温(165 ℃)、高压(2 MPa)下进行。
2014年,Yi等[80]发现在果糖脱水生产HMF的反应中产生的杂质显著影响催化氧化反应,杂质沉积在金属催化剂的表面,导致催化剂失活。因此他们在由果糖制备FDCA的过程中增加了HMF的纯化步骤。其过程为果糖在异丙醇-水的体积比为32:1的溶剂中,在HCl存在下,120 ℃反应3 h,减压蒸馏收集异丙醇用于下一轮反应中,用水萃取剩余物,得到HMF水溶液,以Au/HT为催化剂,添加Na2CO3,氧气流中先在50 ℃反应2 h,再在95 ℃反应7 h,FDCA的收率为83%。整个过程中水萃取的步骤非常重要。在相同条件下,氧化HMF而不经过萃取,即使反应20 h,仍只能得到51% 收率的FDCA,而通过水萃取的反应7 h后就可达到98% 的收率。作者认为杂质如胡敏素使Au/HT催化剂失活。此方法用于以菊芋块茎(主要成分为果糖)作为原料,FDCA收率为52%。此后,同一小组报道了类似的工作[81],以聚苄基氯化铵树脂作为固体催化剂在第1步中催化果糖脱水,得到72% 收率的FDCA。该类方法需要将第1步脱水反应的溶剂蒸发干净,耗时耗能,且第2步氧化反应加入Na2CO3物质的量与果糖物质的量相同,造成大量的碱废水。为了简化纯化操作步骤,2015年,Yi等[82]设计了一个三相反应器一锅法由果糖或葡萄糖直接制备FDCA。该三相体系由四乙基溴化铵(TEAB)或水(相Ⅰ)-甲基异丁基酮(MIBK)(相Ⅱ)-水(相Ⅲ)组成。在设计的三相装置中,首先碳水化合物(果糖或葡萄糖)在相Ⅰ中脱水得到HMF,果糖以Amberlyst-15为催化剂,葡萄糖以Amberlyst-15和CrCl3为组合催化剂。然后通过连接相Ⅰ和相Ⅲ的桥梁(相Ⅱ)萃取,纯化HMF并转移到相Ⅲ中。最后,在Au-Pd/HT催化剂的作用下,HMF被氧化为FDCA。整个过程,使用果糖和葡萄糖为原料,FDCA的收率分别为78% 和50%。相Ⅱ具有多重作用:作为HMF提取、运输和纯化的桥梁。将HMF从相Ⅰ转移到相Ⅲ的传质过程较慢,导致反应时间较长。脱水和氧化反应在同一反应器的不同相中进行,反应温度需要一致。
随后Yi等[83]以商业化的Ru/C和FDCA为催化剂将果糖分2步制备FDCA。在异丙醇/H2O的体积比为32:1的溶剂体系中以FDCA为酸催化剂催化果糖脱水转化为HMF,在170 ℃反应30 min后HMF的产率为64%,用水进行萃取,所得的HMF水溶液进行第2步反应,以Ru/C为催化剂,120 ℃,0.2 MPa氧气压力下反应15 h后,FDCA的整体收率为53%。Ru/C催化HMF无碱氧化为FDCA的收率为88%(在293 K和0.2 MPa O2压力下反应10 h)。从糖中合成的HMF的氧化速率(15 h)比商业纯的HMF氧化速率(10 h)慢,可能是由于从糖合成的HMF水溶液中含有少量水溶性杂质引起的。该反应体系不需要额外添加酸催化剂,形成一个封闭的自催化体系,但反应的温度较高,溶剂产生的压力较大,对设备的要求较高。
2017年,Wrigstedt等[84]以菊粉(果糖聚合物)为原料,先以KBr(摩尔分数为30%)-H2SO4为催化剂,乙腈为溶剂,150 ℃微波反应4 min后,再以Pt/C为催化剂,在NaHCO3碱性介质中,70 ℃反应10 h,FDCA的收率为52%。
2018年,Yan等[85]以离子液体[Bmin]Cl为溶剂,Amberlyst-15和Fe0.6Zr0.4O2为催化剂,果糖在160 ℃ 2 MPa O2压力下反应24 h,FDCA的收率为46.4%。这是目前查阅到的较少的以非贵金属为催化剂一步法由果糖制备FDCA的文献。同年,Chen等[86]以果糖为原料,第1步在N2保护下,以DMSO为溶剂,Amberlyst-15为催化剂,120 ℃反应1 h,过滤除去催化剂,第2步加入K2CO3水溶液(K2CO3水溶液与DMSO的体积比为3:1),以Pt/C为催化剂,通入氧气,100 ℃反应10 h后,FDCA的收率为91%。
2018年,Motagamwala等[73]以果糖为原料,GVL/H2O(质量比50:50)为溶剂,FDCA为催化剂,180 ℃下反应70 min可得到70% 收率的HMF,由于胡敏素会导致催化剂失活,用活性炭脱除产生的胡敏素,以Pt/C为催化剂,110 ℃、4 MPa O2压力下,反应16 h,可得到63% 收率的FDCA,通过冷却结晶可提取94%的FDCA。该方法通过调整GVL与H2O的比例,提高FDCA的溶解度,免除了均相碱的加入,是目前唯一一个报道了反应后FDCA分离的实例,催化剂和溶剂均可回收利用,但反应操作较繁琐,反应压力大。
2019年,Chen等[87]向既有Brønsted酸性和氧化还原性的杂多酸H3PMo12O4(HPM)中添加V制得催化剂HPMV6,利用HMF和FDCA等呋喃化合物在咪唑基离子液体中有较好的溶解性,以[Bmim]Cl为溶剂,在无碱的条件下,分别以果糖和葡萄糖为原料,140 ℃,1 MPa O2压力下反应9 h,FDCA的收率分别为30.7% 和48.6%。该方法一步由单糖制备FDCA,缺陷是催化剂不能回收。
2019年,Liu等[74]发现溶剂显著影响生物质衍生物分子的催化转化[88],采用较佳质量比的DMSO/H2O的混合溶剂体系可在碱性环境中稳定HMF,抑制其缩合生成胡敏素。以果糖为原料,首先以Amberlyst-15为催化剂,DMSO为溶剂,N2保护下,120 ℃反应2 h后,得到80% 收率的HMF,过滤除去催化剂,再加入水,使得DMSO的质量分数为66%,加入催化剂Ru/C和2倍于果糖物质的量的NaHCO3,在130 ℃、4 MPa O2压力下反应12 h,FDCA的收率为65%。该方法的优势在于反应底物果糖的质量分数较高,达到了19%,使得大规模生产FDCA更经济。随后该研究组[89]制备了氧化催化剂NiOx,果糖首先在深度共溶剂ChCl/MeCN的两相体系中,以HCl为催化剂,100 ℃ N2气氛下反应4 h,冷却过滤除去ChCl,旋蒸除去MeCN后,添加NiOx和氧化剂NaClO水溶液,在室温下反应30 min,FDCA的收率为86%。
为了方便回收催化剂并降低催化剂成本,磁性组合催化剂用于一锅法由果糖制备FDCA。2015年,Wang等[90]采用2种磁性组合催化剂通过一锅两步法将果糖转化为FDCA。在DMSO中,首先以磁性Fe3O4 @SiO2-SO3为酸催化剂,果糖在DMSO中100 ℃下反应2 h后得到93.1% 收率的HMF。用磁铁将催化剂分离,以t-BuOOH为氧化剂,磁性纳米Fe3O4-CoOx为催化剂,80 ℃下反应15 h后,FDCA的收率为59.8%。该催化体系采用廉价的钴取代贵金属催化剂。2017年,Yang等[39]采用碱共沉淀的方法制备了磁性金属氧化物ZnFe1.65Ru0.35O4,结合磁性固体酸催化剂Fe3O4-RGO-SO3H一锅两步法分别制备了DFF和FDCA。以DMSO为溶剂,首先加入Fe3O4-RGO-SO3H,110 ℃下空气氛围中,果糖反应2 h,通过磁性除去催化剂,再加入催化剂ZnFe1.65Ru0.35O4和DMSO,并通入O2,110 ℃继续反应6 h,得到DFF收率为73.3%。若除去磁性固体酸催化剂后,再加入催化剂ZnFe1.65Ru0.35O4,添加水和DMSO,通入O2,在130 ℃继续反应16 h,得到FDCA的收率为70.5%。
同时具有酸性和氧化催化活性的多功能催化剂应用于一锅法制备FDCA也有报道。2018年,Rathod等[91]将葡萄糖碳化和磺化生成嵌有磺酸、羧酸和羟基的多环芳族结构的碳基载体,再引入碱性─OSi─CH2CH2CH2NH2基团,最后通过N的配位作用掺入钯得到催化剂Pd/CC。以水为溶剂,140 ℃氮气氛围中果糖反应9 h后,再加入K2CO3,通入氧气继续反应30 h,FDCA的收率为64%。该催化体系以绿色溶剂水为溶剂,且只需加一种催化剂催化2个不同的反应,免除了组合催化剂的分离。
5 结语与展望综述了近年来采用不同的催化剂将碳水化合物(葡萄糖、果糖)一锅两步法或一步法经过异构化/脱水/氧化反应,直接制备呋喃衍生物(DFF和FDCA)的研究进展,一锅法避免了中间产物的分离和纯化,大大简化了操作步骤和减少了能耗。碳水化合物中广泛采用果糖为原料制备DFF和FDCA。为了避免碳水化合物的氧化,大多用两步法,即先在空气或N2中脱水,除去脱水催化剂,再添加氧化催化剂。一锅法直接转化碳水化合物制备FDCA通常需要添加碱,且其报道要明显少于一锅法制备DFF。
尽管在该领域的研究取得了很多成果,但仍存在着一些亟待解决的问题。全面的文献调研表明,对于底物葡萄糖、果糖或其他糖,主要使用的有机溶剂为DMSO,从而获得高选择性、高收率的DFF和FDCA。然而,没有文献讨论如何循环使用高沸点的DMSO以及很少分离目标产物DFF和FDCA,因此,有待进一步探索新的溶剂体系。葡萄糖是一种比果糖更丰富、更便宜的六碳糖。而将葡萄糖直接转化为DFF,迄今为止报道的DFF收率非常低,且极少以葡萄糖为原料制备FDCA。另外,目前的许多方法在技术上是可行的,但并不经济,还需要进一步开发具有高选择性、高活性和高稳定性的环境友好催化体系。对这一生物质转化过程的全面研究有利于开发新的,甚至更有效的方法提供帮助。
为了适应商业化应用,需要进一步探索以葡萄糖甚至是纤维素为原料的新型的催化剂:(1)发展催化纤维素等复杂碳水化合物一步法合成DFF或FDCA的多功能催化剂;(2)开发具有低成本高性能的催化剂,在温和条件下高效催化碳水化合物制备目标产物;(3)为降低生产成本,应重视开发活性高、稳定性好、催化剂易于回收利用的非贵金属多功能催化剂催化转化碳水化合物;(4)深入研究转化反应的机理,以及催化剂结构-性能的“构效关系”。
| [1] |
ARIAS P L, CECILIA J A, GANDARIAS I, et al. Oxidation of lignocellulosic platform molecules to value-added chemicals using heterogeneous catalytic technologies[J]. Catalysis Science & Technology, 2020, 10(9): 2721-2757. |
| [2] |
AMARASEKARA A S, GREEN D, WILLIAMS L D. Renewable resources based polymers: Synthesis and characterization of 2, 5-diformylfuran-urea resin[J]. European Polymer Journal, 2009, 45(2): 595-598. DOI:10.1016/j.eurpolymj.2008.11.012 |
| [3] |
HOPKINS K T, WILSON W D, BENDER B C, et al. Extended aromatic furan amidino derivatives as anti-Pneumocystis carinii agents[J]. Journal of Medicinal Chemistry, 1998, 41(20): 3872-3878. DOI:10.1021/jm980230c |
| [4] |
ADAMS H, BASTIDA R, DEBLAS A, et al. Complexes of lead(Ⅱ) and lanthanide(Ⅲ) ions with a macrocyclic ligand containing a furan head unit. Crystal structure of a methanol inclusion compound of a novel macrocycle[J]. Polyhedron, 1997, 16(4): 567-572. DOI:10.1016/0277-5387(96)00333-6 |
| [5] |
MA J, WANG M, DU Z, et al. Synthesis and properties of furan-based imine-linked porous organic frameworks[J]. Polymer Chemistry, 2012, 3(9): 2346-2349. DOI:10.1039/c2py20367g |
| [6] |
DUNBABIN A, SUBRIZI F, WARD J M, et al. Furfurylamines from biomass: Transaminase catalysed upgrading of furfurals[J]. Green Chemistry, 2017, 19(2): 397-404. DOI:10.1039/C6GC02241C |
| [7] |
XU Y M, JIA X Q, MA J Q, et al. Selective synthesis of 2, 5-bis(aminomethyl) furan via enhancing the catalytic dehydrationhydrogenation of 2, 5-diformylfuran dioxime[J]. Green Chemistry, 2018, 20(12): 2697-2701. DOI:10.1039/C8GC00947C |
| [8] |
YUAN H K, KUSEMA B T, YAN Z, et al. Highly selective synthesis of 2, 5-bis(aminomethyl) furan via catalytic amination of 5-(hydroxymethyl) furfural with NH3 over a bifunctional catalyst[J]. RSC Advances, 2019, 9(66): 38877-38881. DOI:10.1039/C9RA08560B |
| [9] |
LI Z, WANG T, QI X, et al. Green synthesis of benzonitrile using ionic liquid with multiple roles as the recycling agent[J]. RSC Advances, 2019, 9(31): 17631-17638. DOI:10.1039/C9RA02296A |
| [10] |
PAL P, SARAVANAMURUGAN S. Recent advances in the development of 5-hydroxymethylfurfural oxidation with base (nonprecious)-metal-containing catalysts[J]. ChemSusChem, 2019, 12(1): 145-163. DOI:10.1002/cssc.201801744 |
| [11] |
LIN K-Y A, OH W-D, ZHENG M-W, et al. Aerobic oxidation of 5-hydroxymethylfurfural into 2, 5-diformylfuran using manganese dioxide with different crystal structures: A comparative study[J]. Journal of Colloid and Interface Science, 2021, 592: 416-429. DOI:10.1016/j.jcis.2021.02.030 |
| [12] |
WANG Q, LI Y, GUAN H, et al. Hydroxyapatite-supported polyoxometalates for the highly selective aerobic oxidation of 5-hydroxymethylfurfural or glucose to 2, 5-diformylfuran under atmospheric pressure[J]. Chempluschem, 2021, 86(7): 997-1005. DOI:10.1002/cplu.202100199 |
| [13] |
WU J, YAN S, WANG C, et al. Fabrication of ordered mesoporous POMs/SiO2-NH2 nanofibers for production of DFF from 5-HMF for cellulose wastewater resource recovery[J]. Chemosphere, 2021, 277: 130316. DOI:10.1016/j.chemosphere.2021.130316 |
| [14] |
GUPTA K, RAI R K, SINGH S K. Metal catalysts for the efficient transformation of biomass-derived HMF and furfural to value added chemicals[J]. ChemCatChem, 2018, 10(11): 2326-2349. DOI:10.1002/cctc.201701754 |
| [15] |
TIRSOAGA A, EL FERGANI M, NUNS N, et al. Multifunctional nanocomposites with non-precious metals and magnetic core for 5-HMF oxidation to FDCA[J]. Applied Catalysis B-Environmental, 2020, 278: 119309. DOI:10.1016/j.apcatb.2020.119309 |
| [16] |
王静刚, 刘小青, 朱锦. 生物基芳香平台化合物2, 5-呋喃二甲酸的合成研究进展[J]. 化工进展, 2017, 36(2): 672-682. WANG J G, LIU X Q, ZHU J. Research progress on the synthesis of bio-based aromatic platform chemical 2, 5-furandicarboxylic acid[J]. Chemical Industry and Engineering Progress, 2017, 36(2): 672-682. |
| [17] |
GUAN W, ZHANG Y, WEI Y, et al. Pickering HIPEs derived hierarchical porous nitrogen-doped carbon supported bimetallic AuPd catalyst for base-free aerobic oxidation of HMF to FDCA in water[J]. Fuel, 2020, 278: 118362. DOI:10.1016/j.fuel.2020.118362 |
| [18] |
LIGUORI F, BARBARO P, CALISI N. Continuous-flow oxidation of HMF to FDCA by resin-supported platinum catalysts in neat water[J]. ChemSusChem, 2019, 12(12): 2558-2563. DOI:10.1002/cssc.201900833 |
| [19] |
LIU X, ZHANG M, LI Z. CoOx-MC (MC=Mesoporous Carbon) for highly efficient oxidation of 5-hydroxymethylfurfural (5-HMF) to 2, 5-furandicarboxylic acid (FDCA)[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(12): 4801-4808. |
| [20] |
MISHRA D K, LEE H J, KIM J S, et al. MnCo2O4 spinel supported ruthenium catalyst for air-oxidation of HMF to FDCA under aqueous phase and base-free conditions[J]. Green Chemistry, 2017, 19(7): 1619-1623. DOI:10.1039/C7GC00027H |
| [21] |
ZHANG Z, DENG K. Recent advances in the catalytic synthesis of 2, 5-furandicarboxylic acid and its derivatives[J]. ACS Catalysis, 2015, 5(11): 6529-6544. DOI:10.1021/acscatal.5b01491 |
| [22] |
GIRKA Q, ESTRINE B, HOFFMANN N, et al. Simple efficient one-pot synthesis of 5-hydroxymethylfurfural and 2, 5-diformylfuran from carbohydrates[J]. Reaction Chemistry & Engineering, 2016, 1(2): 176-182. |
| [23] |
ZHANG Z H, YUAN Z L, TANG D G, et al. Iron oxide encapsulated by ruthenium hydroxyapatite as heterogeneous catalyst for the synthesis of 2, 5-diformylfuran[J]. ChemSusChem, 2014, 7(12): 3496-3504. DOI:10.1002/cssc.201402402 |
| [24] |
HOU W, WANG Q, GUO Z J, et al. Nanobelt alpha-CuV2O6 with hydrophilic mesoporous poly(ionic liquid): A binary catalyst for synthesis of 2, 5-diformylfuran from fructose[J]. Catalysis Science & Technology, 2017, 7(4): 1006-1016. |
| [25] |
AMARASEKARA A S, WILLIAMS L D, EBEDE C C. Mechanism of the dehydration of D-fructose to 5-hydroxymethylfurfural in dimethyl sulfoxide at 150 degrees C: An NMR study[J]. Carbohydrate Research, 2008, 343(18): 3021-3024. DOI:10.1016/j.carres.2008.09.008 |
| [26] |
AL GHATTA A, WILTON-ELY J D E T, HALLETT J P. Strategies for the separation of the furanic compounds HMF, DFF, FFCA, and FDCA from ionic liquids[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(19): 16483-16492. |
| [27] |
AL GHATTA A, WILTON-ELY J D E T, HALLETT J P. Efficient formation of 2, 5-diformylfuran in ionic liquids at high substrate loadings and low oxygen pressure with separation through sublimation[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(6): 2462-2471. |
| [28] |
KUMAR A, SRIVASTAVA R. FeVO4 decorated -SO3H functionalized polyaniline for direct conversion of sucrose to 2, 5-diformylfuran & 5-ethoxymethylfurfural and selective oxidation reaction[J]. Molecular Catalysis, 2019, 465: 68-79. DOI:10.1016/j.mcat.2018.12.017 |
| [29] |
LIU Y, ZHU L F, TANG J Q, et al. One-pot, one-step synthesis of 2, 5-diformylfuran from carbohydrates over Mo-containing Keggin heteropolyacids[J]. ChemSusChem, 2014, 7(12): 3541-3547. DOI:10.1002/cssc.201402468 |
| [30] |
LV G Q, WANG H L, YANG Y X, et al. Direct synthesis of 2, 5-diformylfuran from fructose with graphene oxide as a bifunctional and metal-free catalyst[J]. Green Chemistry, 2016, 18(8): 2302-2307. DOI:10.1039/C5GC02794B |
| [31] |
RICHARD M, MUSAU R M M. The preparation of 5-hydroxymethyi-2-furaldehyde (HMF) from D-fructose in the presence of DMSO[J]. Biomass, 1987, 13(1): 67-74. DOI:10.1016/0144-4565(87)90072-2 |
| [32] |
GRUSHIN V, HERRON N, HALLIDAY G A. Process for preparing 2, 5-diformylfuran from carbohydrates: WO, 2003024947[P]. 2003-03-27.
|
| [33] |
HALLIDAY G A, YOUNG R J, GRUSHIN V V. One-pot, two-step, practical catalytic synthesis of 2, 5-diformylfuran from fructose[J]. Organic Letters, 2003, 5(11): 2003-2005. DOI:10.1021/ol034572a |
| [34] |
HU Z, LIU B, ZHANG Z H, et al. Conversion of carbohydrates into 5-hydroxymethylfurfural catalyzed by acidic ionic liquids in dimethyl sulfoxide[J]. Industrial Crops and Products, 2013, 50: 264-269. DOI:10.1016/j.indcrop.2013.07.014 |
| [35] |
XU F, ZHANG Z. Polyaniline-grafted VO(acac)2: An effective catalyst for the synthesis of 2, 5-diformylfuran from 5-hydroxymethylfurfural and fructose[J]. ChemCatChem, 2015, 7(9): 1470-1477. DOI:10.1002/cctc.201500119 |
| [36] |
CUI M, HUANG R L, QI W, et al. Cascade catalysis via dehydration and oxidation: one-pot synthesis of 2, 5-diformylfuran from fructose using acid and V2O5/ceramic catalysts[J]. RSC Advances, 2017, 7(13): 7560-7566. DOI:10.1039/C6RA27678D |
| [37] |
AL GHATTA A, WILTON-ELY J D E T, HALLETT J P. Efficient formation of 2, 5-diformylfuran in ionic liquids at high substrate loadings and low oxygen pressure with separation through sublimation[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(6): 2462-2471. |
| [38] |
YANG Z Z, DENG J, PAN T, et al. A one-pot approach for conversion of fructose to 2, 5-diformylfuran by combination of Fe3O4-SBA-SO3H and K-OMS-2[J]. Green Chemistry, 2012, 14(11): 2986-2989. DOI:10.1039/c2gc35947b |
| [39] |
YANG Z, QI W, SU R, et al. Selective synthesis of 2, 5-diformylfuran and 2, 5-furandicarboxylic acid from 5-hydroxymethylfurfural and fructose catalyzed by magnetically separable catalysts[J]. Energy & Fuels, 2017, 31(1): 533-541. |
| [40] |
MA B, WANG Y, GUO X, et al. Photocatalytic synthesis of 2, 5-diformylfuran from 5-hydroxymethyfurfural or fructose over bimetallic Au-Ru nanoparticles supported on reduced graphene oxides[J]. Applied Catalysis a-General, 2018, 552: 70-76. DOI:10.1016/j.apcata.2018.01.002 |
| [41] |
CHEN J, GUO Y, CHEN J, et al. One-step approach to 2, 5-diformylfuran from fructose by proton-and vanadium-containing graphitic carbon nitride[J]. ChemCatChem, 2014, 6(11): 3174-3181. DOI:10.1002/cctc.201402323 |
| [42] |
SHI N, LIU D, DANG F L, et al. Bifunctional and recyclable Dawson-type polyoxometalates catalyze oxidative degradation of lignocellulose to selectively produce phthalates[J]. Bioresource Technology, 2019, 273: 677-681. DOI:10.1016/j.biortech.2018.11.047 |
| [43] |
LIU K, XU Y, YAO Z, et al. Polyoxometalate-intercalated layered double hydroxides as efficient and recyclable bifunctional catalysts for cascade reactions[J]. ChemCatChem, 2016, 8(5): 929-937. DOI:10.1002/cctc.201501365 |
| [44] |
LIU R, CHEN J, CHEN L, et al. One-step approach to 2, 5-diformylfuran from fructose by using a bifunctional and recyclable acidic polyoxometalate catalyst[J]. ChemPlusChem, 2014, 79(10): 1448-1454. DOI:10.1002/cplu.201402147 |
| [45] |
YANG Z, QI W, SU R, et al. 3D Flower-like micro/nano Ce-Mo composite oxides as effective bifunctional catalysts for one-pot conversion of fructose to 2, 5-diformylfuran[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(5): 4179-4187. |
| [46] |
MITTAL N, NISOLA G M, MALIHAN L B, et al. One-pot synthesis of 2, 5-diformylfuran from fructose using a magnetic bi-functional catalyst[J]. RSC Advances, 2016, 6(31): 25678-25688. DOI:10.1039/C6RA01549B |
| [47] |
FANG R Q, LUQUE R, LI Y W. Efficient one-pot fructose to DFF conversion using sulfonated magnetically separable MOF-derived Fe3O4 (111) catalysts[J]. Green Chemistry, 2017, 19(3): 647-655. DOI:10.1039/C6GC02018F |
| [48] |
CHEN Z, LIAO S, GE L, et al. Reduced graphene oxide with controllably intimate bifunctionality for the catalytic transformation of fructose into 2, 5-diformylfuran in biphasic solvent systems[J]. Chemical Engineering Journal, 2020, 379: 122284. DOI:10.1016/j.cej.2019.122284 |
| [49] |
REN Y, YUAN Z, LV K, et al. Selective and metal-free oxidation of biomass-derived 5-hydroxymethylfurfural to 2, 5-diformylfuran over nitrogen-doped carbon materials[J]. Green Chemistry, 2018, 20(21): 4946-4956. DOI:10.1039/C8GC02286K |
| [50] |
LAUGEL C, ESTRINE B, LE BRAS J, et al. NaBr/DMSO-induced synthesis of 2, 5-diformylfuran from fructose or 5-(hydroxymethyl) furfural[J]. ChemCatChem, 2014, 6(5): 1195-1198. |
| [51] |
PENG Y W, HU Z G, GAO Y J, et al. Synthesis of a sulfonated two-dimensional covalent organic framework as an efficient solid acid catalyst for biobased chemical conversion[J]. Chemsuschem, 2015, 8(19): 3208-3212. DOI:10.1002/cssc.201500755 |
| [52] |
ZHAO J, YAN Y, HU Z T, et al. Bifunctional carbon nanoplatelets as metal-free catalysts for direct conversion of fructose to 2, 5-diformylfuran[J]. Catalysis Science & Technology, 2020, 10(13): 4179-4183. |
| [53] |
HU W, SHE J, FU Z, et al. Highly efficient and tunable visible-light-catalytic synthesis of 2, 5-diformylfuran using HBr and molecular oxygen[J]. RSC Advances, 2021, 11(38): 23365-23373. DOI:10.1039/D1RA00865J |
| [54] |
RAUT A B, SHENDE V S, BHANAGE B M. The one-step transformation of fructose to 2, 5-diformylfuran over Ru metal supported on montmorillonite[J]. New Journal of Chemistry, 2020, 44(32): 13659-13668. DOI:10.1039/C9NJ06275K |
| [55] |
ZHANG W, MENG T, TANG J, et al. Direct synthesis of 2, 5-diformylfuran from carbohydrates using high-silica MOR zeolite-supported isolated vanadium species[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(11): 10029-10037. |
| [56] |
TAO F, CUI Y, YANG P, et al. One-pot, one-step, catalytic synthesis of 2, 5-diformylfuran from fructose[J]. Russian Journal of Physical Chemistry A, 2014, 88(7): 1091-1096. DOI:10.1134/S0036024414070152 |
| [57] |
GHEZALI W, VIGIER K D O, KESSAS R, et al. A choline chloride/DMSO solvent for the direct synthesis of diformylfuran from carbohydrates in the presence of heteropolyacids[J]. Green Chemistry, 2015, 17(8): 4459-4464. DOI:10.1039/C5GC01336D |
| [58] |
ZHAO J, ANJALI J, YAN Y, et al. Cr-MIL-101-encapsulated Keggin phosphomolybdic acid as a catalyst for the one-pot synthesis of 2, 5-diformylfuran from fructose[J]. ChemCatChem, 2017, 9(7): 1187-1191. DOI:10.1002/cctc.201601546 |
| [59] |
ZHAO J, JAYAKUMAR A, HU Z T, et al. MoO3-containing protonated nitrogen doped carbon as a bifunctional catalyst for one-step synthesis of 2, 5-diformylfuran from fructose[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(1): 284-291. |
| [60] |
LIU S Q, FU X, DAI J H, et al. One-pot synthesis of 2, 5-diformylfuran from fructose by bifunctional polyaniline-supported heteropolyacid hybrid catalysts[J]. Catalysts, 2019, 9(5): 445. DOI:10.3390/catal9050445 |
| [61] |
LI Y M, LI P L, CAO P, et al. Fabrication of trifunctional polyoxometalate-decorated chitosan nanofibers for selective production of 2, 5-diformylfuran[J]. ChemSusChem, 2019, 12(15): 3515-3523. DOI:10.1002/cssc.201901384 |
| [62] |
ZHAO J, JAYAKUMAR A, LEE J M. Bifunctional sulfonated MoO3-ZrO2 binary oxide catalysts for the one-step synthesis of 2, 5-diformylfuran from fructose[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(3): 2976-2982. |
| [63] |
ZHOU C, ZHAO J, SUN H, et al. One-Step approach to 2, 5-diformylfuran from fructose over molybdenum oxides supported on carbon spheres[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(1): 315-323. |
| [64] |
LEI Q F, LI J F, CAO N N, et al. Direct production of 2, 5-diformylfuran from fructose catalysed by Mo-based composite oxides in static air[J]. Molecular Catalysis, 2020, 487: 110892. DOI:10.1016/j.mcat.2020.110892 |
| [65] |
LU X Y, ZHAO H J, FENG W, et al. A non-precious metal promoting the synthesis of 5-hydroxymethylfurfural[J]. Catalysts, 2017, 7(11): 330. DOI:10.3390/catal7110330 |
| [66] |
RAUT A B, BHANAGE B M. Co-Al hydrotalcites: highly active catalysts for the one-pot conversion of fructose to 2, 5-diformylfuran[J]. Chemistryselect, 2018, 3(41): 11388-11397. DOI:10.1002/slct.201802771 |
| [67] |
XIANG X, HE L, YANG Y, et al. A one-pot two-step approach for the catalytic conversion of glucose into 2, 5-diformylfuran[J]. Catalysis Letters, 2011, 141(5): 735-741. DOI:10.1007/s10562-011-0555-9 |
| [68] |
ZHANG S Q, LI W F, ZENG X H, et al. Production of 2, 5-diformylfuran from biomass-derived glucose via one-pot two-step process[J]. Bioresources, 2014, 9(3): 4568-4580. DOI:10.15376/biores.9.3.4568-4580 |
| [69] |
TAKAGAKI A, TAKAHASHI M, NISHIMURA S, et al. One-pot synthesis of 2, 5-diformylfuran from carbohydrate derivatives by sulfonated resin and hydrotalcite-supported ruthenium catalysts[J]. ACS Catalysis, 2011, 1(11): 1562-1565. DOI:10.1021/cs200456t |
| [70] |
ZHANG W, HOU W, MENG T, et al. Direct synthesis of V-containing all-silica beta-zeolite for efficient one-pot, one-step conversion of carbohydrates into 2, 5-diformylfuran[J]. Catalysis Science & Technology, 2017, 7(4): 6050-6058. |
| [71] |
RATHOD P V, NALE S D, JADHAV V H. Metal free acid base catalyst in the selective synthesis of 2, 5-diformylfuran from hydroxynnethylfurfural, fructose, and glucose[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(1): 701-707. |
| [72] |
WANG Q, HOU W, MENG T S, et al. Direct synthesis of 2, 5-diformylfuran from carbohydrates via carbonizing polyoxometalate based mesoporous poly(ionic liquid)[J]. Catalysis Today, 2019, 319: 57-65. DOI:10.1016/j.cattod.2018.07.042 |
| [73] |
MOTAGAMWALA A H, WON W, SENER C, et al. Toward biomass-derived renewable plastics: Production of 2, 5-furandicarboxylic acid from fructose[J]. Science Advances, 2018, 4(1): eaap9722. DOI:10.1126/sciadv.aap9722 |
| [74] |
LIU H, CAO X, WANG T, et al. Efficient synthesis of bio-monomer 2, 5-furandicarboxylic acid from concentrated 5-hydroxymethylfurfural or fructose in DMSO/H2O mixed solvent[J]. Journal of Industrial and Engineering Chemistry, 2019, 77: 209-214. DOI:10.1016/j.jiec.2019.04.038 |
| [75] |
DAVIS S E, ZOPE B N, DAVIS R J. On the mechanism of selective oxidation of 5-hydroxymethylfurfural to 2, 5-furandicarboxylic acid over supported Pt and Au catalysts[J]. Green Chemistry, 2012, 14(1): 143-147. DOI:10.1039/C1GC16074E |
| [76] |
ARTZ J, PALKOVITS R. Base-free aqueous-phase oxidation of 5-hydroxymethylfurfural over ruthenium catalysts supported on covalent triazine frameworks[J]. ChemSusChem, 2015, 8(22): 3832-3838. DOI:10.1002/cssc.201501106 |
| [77] |
RASS H A, ESSAYEM N, BESSON M. Selective aerobic oxidation of 5-HMF into 2, 5-furandicarboxylic acid with Pt catalysts supported on TiO2- and ZrO2-based supports[J]. ChemSusChem, 2015, 8(7): 1206-1217. DOI:10.1002/cssc.201403390 |
| [78] |
KRÖGER M, PRÜßE U, VORLOP K-D. A new approach for the production of 2, 5-furandicarboxylic acid by in situ oxidation of 5-hydroxymethylfurfural starting from fructose[J]. Topics in Catalysis, 2000, 13(3): 237-242. DOI:10.1023/A:1009017929727 |
| [79] |
RIBEIRO M L, SCHUCHARDT U. Cooperative effect of cobalt acetylacetonate and silica in the catalytic cyclization and oxidation of fructose to 2, 5-furandicarboxylic acid[J]. Catalysis Communications, 2003, 4(2): 83-86. DOI:10.1016/S1566-7367(02)00261-3 |
| [80] |
YI G S, TEONG S P, LI X K, et al. Purification of biomass-derived 5-hydroxymethylfurfural and its catalytic conversion to 2, 5-furandicarboxylic acid[J]. ChemSusChem, 2014, 7(8): 2131-2135. DOI:10.1002/cssc.201402105 |
| [81] |
TEONG S P, YI G S, CAO X Q, et al. Poly-benzylic ammonium chloride resins as solid catalysts for fructose dehydration[J]. ChemSusChem, 2014, 7(8): 2120-2124. DOI:10.1002/cssc.201402131 |
| [82] |
YI G S, TEONG S P, ZHANG Y. The direct conversion of sugars into 2, 5-furandicarboxylic acid in a triphasic system[J]. ChemSusChem, 2015, 8(7): 1151-1155. DOI:10.1002/cssc.201500118 |
| [83] |
YI G, TEONG S P, ZHANG Y. Base-free conversion of 5-hydroxymethylfurfural to 2, 5-furandicarboxylic acid over a Ru/C catalyst[J]. Green Chemistry, 2016, 18(4): 979-983. DOI:10.1039/C5GC01584G |
| [84] |
WRIGSTEDT P, KESKIVALI J, PEREA-BUCETA J E, et al. One-pot transformation of carbohydrates into valuable furan derivatives via 5-hydroxymethylfurfural[J]. ChemCatChem, 2017, 9(22): 4244-4255. DOI:10.1002/cctc.201701106 |
| [85] |
YAN D, WANG G, GAO K, et al. One-pot synthesis of 2, 5-furandicarboxylic acid from fructose in ionic liquids[J]. Industrial & Engineering Chemistry Research, 2018, 57(6): 1851-1858. |
| [86] |
CHEN G Y, WU L B, FAN H, et al. Highly efficient two-step synthesis of 2, 5-furandicarboxylic acid from fructose without 5-hydroxymethylfurfural (HMF) separation: In situ oxidation of HMF in alkaline aqueous H2O/DMSO mixed solvent under mild conditions[J]. Industrial & Engineering Chemistry Research, 2018, 57(48): 16172-16181. |
| [87] |
CHEN R, XIN J, YAN D, et al. Highly efficient oxidation of 5-hydroxymethylfurfural to 2, 5-furandicarboxylic acid with heteropoly acids and ionic liquids[J]. ChemSusChem, 2019, 12(12): 2715-2724. DOI:10.1002/cssc.201900651 |
| [88] |
SHUAI L, LUTERBACHER J. Organic solvent effects in biomass conversion reactions[J]. ChemSusChem, 2016, 9(2): 133-155. DOI:10.1002/cssc.201501148 |
| [89] |
LIU H, LI W L, ZUO M, et al. Facile and efficient two-step formation of a renewable monomer 2, 5-furandicarboxylic acid from carbohydrates over the NiOx catalyst[J]. Industrial & Engineering Chemistry Research, 2020, 59(11): 4895-4904. |
| [90] |
WANG S G, ZHANG Z, LIU B H. Catalytic conversion of fructose and 5-hydroxymethylfurfural into 2, 5-furandicarboxylic acid over a recyclable Fe3O4-CoOx magnetite nanocatalyst[J]. ACS Sustainable Chemistry & Engineering, 2015, 3(3): 406-412. |
| [91] |
RATHOD P V, JADHAV V H. Efficient method for synthesis of 2, 5-furandicarboxylic acid from 5-hydroxymethylfurfural and fructose using Pd/CC catalyst under aqueous conditions[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(5): 5766-5771. |




