2. 工业发酵微生物教育部重点实验室,天津 300457
2. Key Laboratory of Industrial Fermentation Microbiology Ministry of Education, Tianjin 300457, China
木质纤维素是地球上含量最丰富的生物质资源,是生物质研究的热点[1]。木质纤维素的利用首先需要采用纤维素酶等对其进行降解[2],但是木质纤维素复杂且顽固的结构限制了纤维素酶对其的降解效率[3]。虽然可通过物理、化学、生物等预处理技术在一定程度上降低纤维素的聚合度和结晶度,脱去部分木质素,但木质素的无效吸附和纤维素的晶体结构使得其经预处理后仍然难以被高效水解[4-7]。近年来,向纤维素酶中添加少量的辅助蛋白,被证明是提高纤维素酶活性和木质纤维素降解率的有效途径[8-9]。其中,裂解性多糖单加氧酶(LPMO)辅助活性家族9(AA9)是近几年发现的目前最具应用前景的木质纤维素降解辅助蛋白。AA9是一类作用于结晶纤维素的铜依赖型氧化酶,在外部电子供体的作用下,通过氧化葡萄糖单元的C1或C4位,氧化断裂纤维素的糖苷键,生成氧化的糖链末端和新的非还原糖链端,使得结晶底物的结构趋于松散,在纤维素水解体系中,可以提高纤维素酶对纤维素的可亲和性,进而提高纤维素酶等糖苷水解酶的水解活性,最终提高纤维素的水解还原糖的得率[10-11]。目前,针对AA9的研究主要集中于基因的克隆表达、结构及特性研究[12]。但是,相对其发挥的作用,对AA9的研究仍然非常有限。黑曲霉是一种应用广泛的糖苷水解酶分泌真菌,通过CAZy数据库检索比对,发现其中含有7个编码AA9家族多糖单加氧酶的基因,对它们的研究将可丰富AA9资源信息库,对木质纤维素的有效利用意义重大。
毕赤酵母是目前应用最广泛的外源蛋白真核表达系统之一[13],其细胞内存在着蛋白质的糖基化修饰,主要由糖基转移酶催化在内质网中进行。其中,糖链通过与新生肽链中特定天冬酰胺的自由─NH2基连接,进而对新生肽链进行的翻译后修饰方式称为N-糖基化修饰[14]。氨基酸序列Asn-Xaa-Ser/Thr被认为是N-糖基化的特征序列。N-糖基化修饰对不同蛋白的影响不同。研究表明,去除N-糖基化会导致酶的活性发生变化。例如,Muller-Steffner等研究发现去除Asn-201位点的N-糖基化作用会使酶的活性下降3%[15];WEI等研究发现N-糖基化是Ag-EGase具有活性的关键[16];Albers等的研究也表明在6个糖基化位点的任何一处去除N-糖基化都导致血浆磷脂转运蛋白(PLTP)活性显著下降35%~78%[17];而TIAN等的研究则发现虽然N-链糖基化在AXE1分泌中起着至关重要的作用,但对重组酶的催化活性影响甚微[18]。此外,同一个蛋白上,不同位点的N-糖基化也可能对这个酶产生不同影响。研究表明,在蛋白N-乙酰葡糖胺转移酶Ⅲ上,Asn-243或者Asn-261位点去除N-糖基化的突变酶比Asn-399位点去除糖基化的突变酶更具有活性[19];YANG等研究发现N-60位点上的聚糖在重组脂肪酶的表达和分泌中起关键作用,N-14位点上的N-聚糖对重组脂肪酶的分泌没有影响,但对脂肪酶催化活性是有利的,同时具有更多N-聚糖的脂肪酶热稳定性更高[20];本课题组在研究β-甘露聚糖酶时也发现其中3个N-糖基化修饰位点N-131、N-158和N-329发生突变后甘露聚糖酶活力分别降低了85.43%、79.48%和16.3%,而热稳定性分别提高了7.87%、13.5%和15.37%[21]。由此可见,N-糖基化修饰对蛋白的活性、分泌、稳定性等性质均具有不同程度的影响。研究来源于黑曲霉的AnLPMO15g在毕赤酵母中表达时N-糖基化对其活性及其与纤维素酶协同作用的影响,对进一步优化重组该蛋白与纤维素酶的协同作用,扩大AA9家族辅助蛋白的应用范围,提升木质纤维素水解效率有着非常重要的意义。
本文通过NetNGlyc 1.0 Server软件在线分析来源于黑曲霉的纤维素酶辅助蛋白AnLPMO15g中易发生N-糖基化修饰的位点,利用定点突变技术将AnLPMO15g蛋白中N-糖基化修饰位点上的天冬酰胺(Asn)替换为中性谷氨酰胺(Gln)。比较突变前后该蛋白与纤维素酶协同作用产生的还原糖的产量,进而揭示N-糖基化对AnLPMO15g与纤维素酶协同性的影响,为AnLPMO15g的定向改造提供理论基础。
2 材料与方法 2.1 菌株和质粒菌株:黑曲霉(Aspergillus niger CBS513.88)、大肠杆菌(Escherichia coli DH5α)、毕赤酵母(Pichia pastoris GS115),由天津科技大学生物工程学院保藏。
质粒:pPIC9k,由天津科技大学生物工程学院保藏。
2.2 试剂和仪器3, 5-二硝基水杨酸(3, 5-dinitrosalicylic acid, DNS)购自国药集团化学试剂有限公司;甲醇、甘油购自天津市化学试剂一厂;微晶纤维素购自天津光复精细化工研究所;无水葡萄糖、磷酸氢二钾、磷酸二氢钾购自天津市化学试剂厂;考马斯亮蓝R-250、山梨醇购自北京索莱宝公司;咪唑购自天津市化学试剂三厂;酵母提取物、蛋白胨购自英国OXOID公司。
LRh-250A型生化培养箱、BSD250恒温振荡器、GZY-9246MBE型电热恒温鼓风干燥箱、立式高压蒸汽灭菌锅购自上海博讯实业有限公司;BG-subMINI迷你水平电泳仪购自北京百晶生物技术有限公司;HE-180微型垂直电泳槽购自上海天能科技公司;ZHJH-C1115B型超净台购自上海智诚分析仪器制造有限公司;MASTERCYCLER NEXUS梯度PCR仪、5430R型4 ℃离心机购自德国eppendorf公司;凝胶成像仪购自上海勤翔科学仪器有限公司;紫外分光光度计购自上海美谱达仪器有限公司;DK-8D型电热恒温水槽购自上海一恒科技有限公司;分析天平购自METTLER TOLEDO国际贸易有限公司。
2.3 实验方法 2.3.1 N-糖基化位点的预测NetNGlyc 1.0 Server在线分析软件预测黑曲霉AnLPMO15g蛋白中易发生N-糖基化修饰的位点,选择电势超过阈值的位点进行下一步研究。
2.3.2 去N-糖基化分析利用去N-糖基化酶PNGase酶(NEB)对纯化后的AnLPMO15g蛋白进行去N-糖基化处理。首先对蛋白进行变性处理,然后按照说明书配制反应体系,将反应体系置于37 ℃恒温培养箱中过夜反应,最后通过SDS-PAGE检测AnLPMO15g蛋白的去N-糖基化效果。
2.3.3 突变重组质粒的构建利用定点突变试剂盒将N-糖基化对应位点上的天冬酰胺Asn(AAT或AAC)突变为中性的谷氨酰胺Gln(CAA),在相应位点设计引入突变碱基CAA的上下游引物。所用引物如表 1所示。用An15g-F分别和N151-R,N334-R,N385-R扩增出3个包含突变位点基因的上部分,再用An15g-R分别和N151-F,N334-F, N385-F扩增出3个包含突变位点基因的下部分。PCR体系组成为:cDNA 1 μL、上游引物An15g-F 0.5 μL、下游引物An15g-R 0.5 μL、2×Pyrobest Mix 10 μL,去离子水加至总量为20 μL。PCR扩增程序为:94 ℃,10 min;94 ℃,5 min,55 ℃,30 s,72 ℃,70 s,共30个循环;72 ℃,7 min;扩增完毕后4 ℃保存。琼脂糖凝胶电泳来验证扩增结果,将正确的条带用胶回收试剂盒进行回收。用融合PCR的方法先按表 2配制一轮PCR的无引物体系,按上述PCR程序扩增10个循环初步形成全长片段,然后取扩增产物为模板,按表 2配制二轮PCR的体系,按上述PCR程序扩增30个循环,从而获得分别包含3个突变位点的目的基因,琼脂糖凝胶电泳验证扩增结果。将正确的条带用胶回收试剂盒进行回收并保存于-20 ℃冰箱用于下一步利用。
|
|
表 1 引物列表 Table 1 Primers used in this study |
|
|
表 2 N-糖基化位点突变目的基因的PCR体系 Table 2 Reaction mixtures for PCR |
将回收的目的基因和pPIC9k质粒分别配制双酶切体系:基因/质粒20 μL、EcoRⅠ 2.5 μL、NotⅠ 2.5 μL、Buffer H 5 μL,去离子水加至总体积为50 μL,分别在37 ℃反应2.5和3 h,用纯化回收试剂盒对酶切产物进行纯化回收。然后按:基因5.5 μL、载体2.5 μL、T4 DNA连接酶1 μL、Buffer 1 μL配制连接体系,在4 ℃冰箱中连接过夜后,分别转化大肠杆菌感受态,用含有氨苄的LB培养基筛选阳性克隆,挑取阳性单克隆到含氨苄液体LB培养基中,37 ℃、200 r·min-1摇床培养过夜后提取质粒并进行测序,比对测序结果确定质粒是否突变成功。
2.3.4 毕赤酵母重组菌株的构建与筛选参照马清等的方法[21],将验证正确的突变载体经限制性内切酶BglⅡ线性化后,取10 μL加入80 μL毕赤酵母GS115感受态,混匀后转入提前预冷的0.2 cm的电转杯中,冰上静置5 min后电击(1 500 V,200 Ω,20 μF,4.8~5.5 ms)转化。然后立即向杯中加入1 mL预冷的1 mol·L-1的山梨醇,混匀后将菌液转移至灭菌的1.5 mL离心管中,30 ℃静置培养1~2 h,取200 μL涂布于MD平板上,30 ℃培养2~3 d至克隆产生。挑取阳性克隆至不同浓度G418的YPD平板上,培养2~3 d,挑取生长较大的菌落进行菌落PCR验证。
2.3.5 蛋白的诱导表达挑取菌落验证正确的阳性克隆接种至5 mL的BMGY液体培养基中,30 ℃,200 r·min-1,震荡培养过夜。取过夜培养物以1%的接种量接种至25 mLBMGY培养基中,30 ℃,200 r·min-1震荡培养至OD600为2~6 (对数期,大约12~16 h)。将培养物转移至50 mL离心管中,5 000 r·min-1离心5 min,弃上清,用50 mL BMMY液体培养基重悬细胞至OD600为1.0,加入甲醇至浓度为0.5%。将菌液转移到250 mL摇瓶中,30 ℃,250 r·min-1震荡培养。每24 h取样,测OD600,12 000 r·min-1离心1 min收集上清。每24 h补加甲醇至终浓度为0.5%,达到最佳诱导时间后,将培养物7 500 r·min-1离心10 min,收集上清。
2.3.6 AnLPMO15g及其突变体蛋白的纯化将上清液通过0.22 μm滤膜过滤,取10 mL加载到经10 mmol·L-1咪唑平衡过的Ni-Agarose柱上,用10倍体积的10 mmol·L-1的咪唑去除杂蛋白,然后用含有20 mmol·L-1 Tris-HCl (pH=7.9)和0.5 mmol·L-1 NaCl的80 mmol·L-1咪唑洗脱加载的样品。将洗脱液置于8~14 kDa透析膜上用50 mmol·L-1醋酸钠缓冲溶液(pH=5.0)在低温下进行透析,以除去咪唑和盐离子。最后使用12%(w/v)聚丙烯酰胺凝胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。
2.3.7 N-糖基化位点突变对AnLPMO15g蛋白与纤维素酶协同性的影响将纯化后的AnLPMO15g及N-151,N-334和N-385 3个突变体用于协同水解研究。取1.5 mL离心管若干,加入微晶纤维素或稻草粉0.01 g,加入纯化后蛋白使其浓度为0.9 mg·g-1底物,加入抗坏血酸使其终浓度达到10 mmol·L-1,用50 mmol·L-1,pH 5.0的醋酸钠缓冲溶液将体积补加到1 mL,纤维素酶(Cellic®CTec2)加入量为0.9 FPU·g-1底物,分别配制纤维素酶体系,各种AA9酶体系及各种AA9与纤维素酶协同反应体系。用封口膜封口,50 ℃,200 r·min-1反应48 h后,沸水浴加热5 min终止反应,12 000 r·min-1离心1 min收集上清液,测定还原糖的产量。此过程中,不加酶的反应体系作为对照,每个样品3个平行。设定纤维素酶单独作用时产生的还原糖量为100%,计算AnLPMO15g,N-151,N-334和N-385 4种蛋白单独作用和与纤维素酶共同作用的相对还原糖产量。
2.3.8 协同度分析在分析AnLPMO15g与纤维素酶的协同活性时,除了还原糖产量的提高,本研究还用到了协同度来评价协同两种酶的协同能力。协同度的计算式如下:
| $ 协同度 =\left(C_{\mathrm{A}+\mathrm{C}}\right) /\left(C_{\mathrm{C}}+C_{\mathrm{A}}\right) $ |
其中,CA+C代表AnLPMO15g和纤维素酶共同作用的还原糖产量,CC代表纤维素酶单独作用的还原糖产量,CA代表AnLPMO15g单独作用的还原糖产量,如果协同度大于1,说明两种酶不只是简单的叠加作用,一种酶的存在还能促进另一种酶的作用,如果在1左右,则说明两者可能只是简单的叠加作用,如果明显小于1,则说明两者可能因为竞争底物而存在相互抑制作用。
2.4 还原糖的测定采用DNS法[22]测定各水解体系中的还原糖浓度。
3 结果与讨论 3.1 糖基化位点的预测通过NetNGlyc 1.0 Server在线分析软件分析黑曲霉AnLPMO15g蛋白中易发生N-糖基化修饰的位点,预测结果如表 3所示。由表可见,AnLPMO15g中存在的N-糖基化特征序列共有3个,并且它们的电势均超过了阈值0.5,由表中可见这3个位点分别为151,334和385,对这3个位点进行进一步研究。
|
|
表 3 N-糖基化位点预测结果 Table 3 Prediction results of N-glycosylation sites |
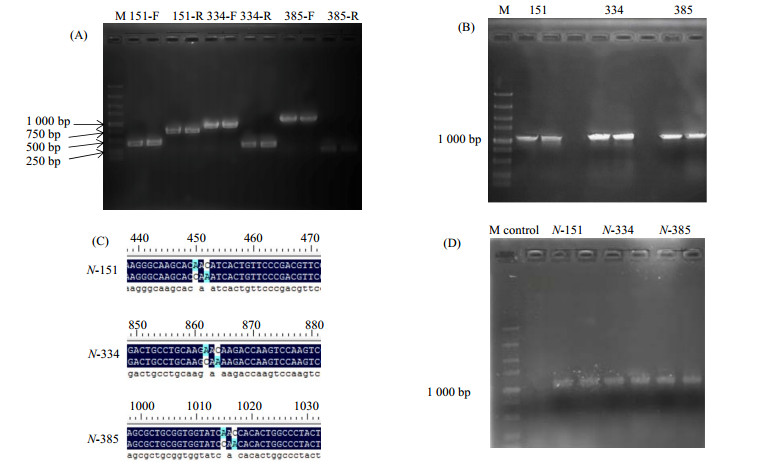
An15g04900基因各短片段及全长的琼脂糖凝胶电泳验证结果分别如图 1(A),2(B)所示。根据NCBI数据库中的基因数据,将突变位点与目的基因长度对应,再考虑到引物长度,最终得到各短片段的理论长度,图 1(A)中的各个条带的大小与理论长度相符,因此初步判断获得正确的产物,将正确的短片段用胶回收试剂盒进行回收,通过融合PCR的方法将对应的短片段进行连接,得到的全长通过琼脂糖凝胶电泳的验证结果如图 1(B)所示,各个条带的大小均与An15g04900基因的全长1 098 bp相符,由此判断获得了正确的片段。
|
图 1 AnLPMO15g突变载体的构建及验证 Fig.1 Construction and verification of AnLPMO15g mutant vector (A) obtain of short fragment (B) certification of full length genes (C) sequence alignment between mutant strains and recombinant plasmid (D) colony PCR verification of Recombinant P. Pastoris containing mutant gene |
重组质粒转化大肠杆菌感受态,将筛选的阳性克隆提取质粒后进行测序,将测序结果与未突变的目的基因序列进行比对,结果如图 1(C)所示。N-糖基化修饰的特征氨基酸序列Asn-Xaa-Ser/Thr中编码Asn的位点(AAT或AAC)均已突变为编码中性的谷氨酰胺的位点(CAA)说明3个糖基化位点均已成功突变。
3.2.3 毕赤酵母的转化与验证筛选阳性克隆进行菌落PCR,扩增产物的琼脂糖凝胶电泳验证结果如图 1(D)所示。由图可见,只转入空质粒的毕赤酵母菌株的菌落PCR的电泳没有明显条带产生,而含有突变基因的毕赤酵母阳性克隆菌落PCR产物的验证中均有与理论长度大小相符的条带产生,说明筛选出的这几个菌落是阳性菌落,对阳性菌株进行保藏。
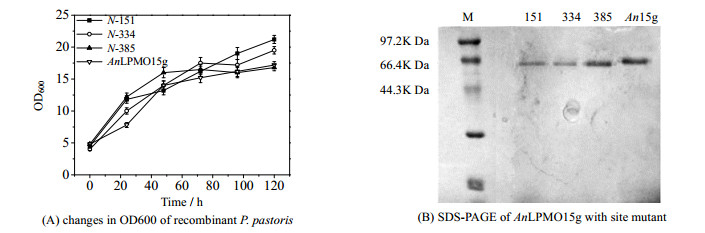
3.2.4 重组毕赤酵母的诱导表达将正确的菌株接种到诱导培养基中,用甲醇诱导目的基因表达,诱导期间的OD600的变化如图 2(A)所示,由图可见,3种突变重组菌株N-151、N-334和N-385的菌株生长趋势与原基因AnLPMO15g的突变菌株生长趋势大体相同,但是最后的菌液浓度均要稍高于原菌,说明3个位点的突变对重组菌株的生长无明显影响。
|
图 2 重组毕赤酵母的诱导表达和蛋白表达结果验证 Fig.2 Verification of induced expression and protein expression of recombinant E. coli |
将培养过后的培养上清液用镍琼脂糖凝胶进行纯化,将纯化后的蛋白进行SDS-PAGE,其结果如图 2(B)所示,由图可见,3种N-糖基化位点突变的基因表达的蛋白其表观分子量稍低于原基因表达的蛋白,其原因是糖基化的产生影响蛋白的结构,增加表观分子量,N-糖基化位点的突变,使得相应位点不再发生糖基化,蛋白整体的糖基化程度降低,从而能稍微减低表观分子量。这也验证了N-糖基化的产生会增加蛋白的表观分子量。
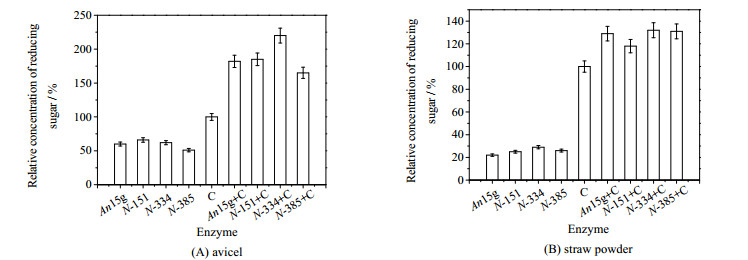
3.3 N-糖基化位点对AnLPMO15g蛋白与纤维素酶协同性的影响当作用底物为微晶纤维素时,结果如图 3(A)所示。单独作用时,151和334位点突变的AnLPMO15g蛋白产生的还原糖量较未突变的AnLPMO15g提高了10.34%和2.92%,而突变体N-385产生的还原糖量比AnLPMO15g明显降低了12.73%。与纤维素酶共同作用时,突变体N-334产生的还原糖较AnLPMO15g明显提高38.89%,而N-385产生的还原糖产量较AnLPMO15g降低了20.64%,N-151没有明显变化。由此可见,334位点发生N-糖基化后不利于AnLPMO15g与纤维素酶的协同作用,而385位点发生N-糖基化后则有利于其与纤维素酶的协同作用。不同位点的N-糖基化对AnLPMO15g的作用会产生不同的影响,原因可能是不同位点的糖基化影响了酶的局部结构的改变,例如改变了蛋白质的折叠方式,从而影响了由结构决定的酶的相应功能[23]。这种现象在其他研究中也有报道,例如HAN等在对重组弹性蛋白酶的研究中,有3个糖基化位点,其中212和280位点的突变使弹性蛋白酶的酶活提高,而36位点的突变使弹性蛋白酶的酶活性降低[24]。
|
图 3 N-糖基化位点突变的AnLPMO15g与纤维素酶的协同作用 Fig.3 Synergetic activity of AnLPMO15g with mutant on N-glycosylation and cellulase |
当以木质纤维素稻草粉为作用底物时,结果如图 3(B)所示。由图可见,当AnLPMO15g及其突变体蛋白分别单独作用于稻草粉时,3个突变体产生的还原糖均高于AnLPMO15g产生的还原糖,分别提高了6.64%、18.72%和7.77%。与纤维素酶共同作用时,突变体N-334和N-385产生的还原糖较AnLPMO15g没有明显的变化,而N-151产生的还原糖比AnLPMO15g降低了8.04%。经计算可知,AnLPMO15g和3种突变蛋白与纤维素酶协同作用于稻草粉时产生的还原糖分别比纤维素酶单独作用时提高了31.55%、12.94%、36.48%和35.16%。由此可见,151位点的突变降低了AnLPMO15g与纤维素酶的协同活性,而334和385位点的突变对协同活性的影响不明显。所以,当作用于稻草粉底物时,151位点发生N-糖基化后有利于协同作用。
协同度计算结果如表 4所示,分别作用于微晶纤维素和稻草粉时,只有突变体N-385及N-151与纤维素酶的协同度是低于1的,也印证了385和151两个位点的突变会在分别作用于微晶纤维素及稻草粉时会降低其与纤维素酶的协同性,即两个位点发生的N-糖基化是对协同作用有利的。此外,作用于微晶纤维素时,N-334与纤维素酶的协同性明显大于1,说明该位点发生的糖基化不利于协同作用。
|
|
表 4 作用于不同底物时AnLPMO15g与纤维素酶的协同度 Table 4 Synergetic degrees of AnLPMO15g and cellulase when acting on microcrystalline cellulose and straw powder |
本研究通过对AnLPMO15g蛋白上糖基化位点的预测,发现AnLPMO15g含有3个N-糖基化位点(151,334和385),通过定点突变的方法得到了3个AnLPMO15g的突变体,比较了突变酶与未突变酶单独作用于底物和与纤维素酶共同作用于底物时产生的还原糖。结果发现当作用于微晶纤维素时,385位点发生N-糖基化后有利于AnLPMO15g与纤维素酶的协同作用,334位点发生N-糖基化后不利于AnLPMO15g与纤维素酶的协同活性;而当作用于木质纤维素底物时,151位点发生N-糖基化后有利于协同作用,而334和385位点发生N-糖基化后对协同作用影响不明显。由此可见,当作用于不同底物时,AnLPMO15g的N-糖基化的位点不同,对其与纤维素酶的协同性影响也不同。
| [1] |
ENGEL D, WEGENER G. Wood: Chemistry, ultrastructure, reactions[M]. Berlin: Springer Verlag, 1984.
|
| [2] |
KARIMI K, KHERADMANDINIA S, TAHERZADEH M J. Conversion of rice straw to sugars by dilute-acid hydrolysis[J]. Biomass & Bioenergy, 2006, 30(3): 247-253. |
| [3] |
LYND L R, LASER M S, BRANSBY D, et al. How biotech can transform biofuels[J]. Nature Biotechnology, 2008, 26(2): 169-172. DOI:10.1038/nbt0208-169 |
| [4] |
祝其丽, 何明雄, 谭芙蓉, 等. 木质纤维素生物质预处理研究现状[J]. 生物技术进展, 2015, 5(6): 414-419. ZHU Q L, HE M X, TAN F R, et al. Progress on pretreatment technologies of lignocellulosic biomass[J]. Current Biotechnology, 2015, 5(6): 414-419. DOI:10.3969/j.issn.2095-2341.2015.06.02 |
| [5] |
HUMPULA J F, UPPUGUNDLA N, VISMEH R, et al. Probing the nature of AFEX-pretreated corn stover derived decomposition products that inhibit cellulase activity[J]. Bioresource Technology, 2014, 152(1): 38-45. |
| [6] |
TADESSE H, LUQUE R. Advances on biomass pretreatment using ionic liquids: An overview[J]. Energy & Environmental Science, 2011, 4(10): 3913-3929. |
| [7] |
SINGH J, SUHAG M, DHAKA A. Augmented digestion of lignocellulose by steam explosion, acid and alkaline pretreatment methods: A review[J]. Carbohydrate Polymers, 2015, 117: 624-631. DOI:10.1016/j.carbpol.2014.10.012 |
| [8] |
HORN S J, VAAJEKOLSTAD G, BJØRGE WESTERENG, et al. Novel enzymes for the degradation of cellulose[J]. Biotechnology for Biofuels, 2012, 5(1): 45-45. DOI:10.1186/1754-6834-5-45 |
| [9] |
HU J, CHANDRA R, ARANTES V, et al. The addition of accessory enzymes enhances the hydrolytic performance of cellulase enzymes at high solid loadings[J]. Bioresource Technology, 2015, 186: 149-153. DOI:10.1016/j.biortech.2015.03.055 |
| [10] |
李欣, 张丽丽, 田莉, 等. 裂解多糖单加氧酶高效催化的研究进展[J]. 生物化学与生物物理进展, 2016, 43(10): 970-979. LI X, ZHANG L L, TIAN L, et al. The advance of efficient catalysis of lytic polysaccharide monooxygenases[J]. Progress in Biochemistry and Biophysics, 2016, 43(10): 970-979. |
| [11] |
JOHANSEN K S. Lytic polysaccharide monooxygenases: The microbial power tool for lignocellulose degradation[J]. Trends in Plant Science, 2016, 21(11): 926-936. DOI:10.1016/j.tplants.2016.07.012 |
| [12] |
TANGHE M, DANNEELS B, CAMATTARI A, et al. Recombinant expression of Trichoderma reesei Cel61A in Pichia pastoris: optimizing yield and N-terminal processing[J]. Molecular Biotechnology, 2015, 57(11/12): 1010-1017. |
| [13] |
武婕, 张晓雪, 余河水, 等. 毕赤酵母工程菌高密度发酵研究与进展[J]. 中国生物工程杂志, 2016, 36(1): 108-114. WU J, ZHANG X X, YU H S, et al. Research progress of high density fermentation process of Pichia pastoris[J]. China Biotechnology, 2016, 36(1): 108-114. |
| [14] |
詹洁, 吴军. 酵母N-糖基化工程研究进展[J]. 生物技术通讯, 2004, 15(3): 272-274. ZHAN J, WU J. Advanced studies on the engineering of yeast asparagines-linked glycosylation[J]. Letters in Biotechnology, 2004, 15(3): 272-274. DOI:10.3969/j.issn.1009-0002.2004.03.020 |
| [15] |
MULLERSTEFFNER H, KUHN I, ARGENTINI M, et al. Identification of the N-glycosylation sites on recombinant bovine CD38 expressed in Pichia pastoris: Their impact on enzyme stability and catalytic activity[J]. Protein Expression & Purification, 2010, 70(2): 151-157. |
| [16] |
WEI Y D, LEE S J, LEE K S, et al. N-glycosylation is necessary for enzymatic activity of a beetle (Apriona germari) cellulase[J]. Biochemical & Biophysical Research Communications, 2005, 329(1): 331-336. |
| [17] |
ALBERS J J, DAY J R, WOLFBAUER G, et al. Impact of site-specific N-glycosylation on cellular secretion, activity and specific activity of the plasma phospholipid transfer protein[J]. Biochimica et Biophysica Acta, 2011, 1814(7): 908-911. DOI:10.1016/j.bbapap.2011.04.004 |
| [18] |
TIAN B, CHEN Y, DING S. A combined approach for improving alkaline acetyl xylan esterase production in Pichia pastoris, and effects of glycosylation on enzyme secretion, activity and stability[J]. Protein Expression & Purification, 2012, 85(1): 44-50. |
| [19] |
NAGAI K, IHARA Y, WADA Y, et al. N-glycosylation is requisite for the enzyme activity and Golgi retention of N-acetylglucosaminyltransferase Ⅲ[J]. Glycobiology, 1997, 7(6): 769-776. DOI:10.1093/glycob/7.6.769 |
| [20] |
YANG M, YU X W, ZHENG H, et al. Role of N-linked glycosylation in the secretion and enzymatic properties of Rhizopus chinensis lipase expressed in Pichia pastoris[J]. Microbial Cell Factories, 2015, 14(1): 40. DOI:10.1186/s12934-015-0225-5 |
| [21] |
马清, 蔡瑞, 姜风超, 等. N-糖基化对β-甘露聚糖酶在毕赤酵母中异源表达的影响[J]. 食品科学, 2017, 38(16): 86-91. MA Q, CAI R, JIANG F C, et al. Effect of N-glycosylation on the heterologous expression of β-mannanase in Pichia pastoris[J]. Food Science, 2017, 38(16): 86-91. DOI:10.7506/spkx1002-6630-201716013 |
| [22] |
MILLER G. L.. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Biochemistry, 1959, 31(3): 426-428. |
| [23] |
TROMBETTA E S. The contribution of N-glycans and their processing in the endoplasmic reticulum to glycoprotein biosynthesis[J]. Glycobiology, 2003, 13(9): 77R-91R. DOI:10.1093/glycob/cwg075 |
| [24] |
HAN M, WANG W, WANG X, et al. Enhanced expression of recombinant elastase in Pichia pastoris through the substitution of Thr for Ser in Asn-Xaa-Ser sequons[J]. Applied Biochemistry & Biotechnology, 2015, 175(1): 428-435. |




