2. 上海市煤气化工程技术研究中心,上海 200237
2. Shanghai Engineering Research Center of Coal Gasification, Shanghai 200237, China
煤气化是煤炭洁净高效利用的核心技术[1],广泛应用于燃料气、合成气及碳氢化合物的生产[2]。热解气化耦合工艺作为一种重要的煤气化技术,采用二段水煤浆气化,提高了碳转化率、煤气热值以及冷煤气效率,降低了氧耗,然而由于二段气化反应温度较低,会产生焦油,成为限制合成气和能源进一步利用的关键。一般来说,气化过程产生的焦油会降低可燃气体的利用率,增加管道堵塞的风险、加大操作维修费用。此外焦油中含有的大量碳氢化合物会增加致癌的可能性,焦油在气化过程中如能转化为能量值较高的合成气,也能进一步提高能量转化率[3-4]。
热解气化耦合工艺二段出口气体温度一般为800~1 000 ℃[5],对出口合成气进一步利用之前,使其中的焦油含量达标成为一个关键问题。根据FOURCAULT等[6]提出的标准,气化过程中出口气体中焦油的浓度在标准状况下应在30~500 mg·m-3之间。目前工业生产中,主要通过在气体出口之后增加一个催化重整或者热裂解装置进行焦油脱除,通过温度控制、气化剂调整、添加催化剂等,焦油去除效率可达35%~90% [7]。然而采用催化重整技术仍存在大量问题,第一是高效催化剂多为铬镍贵金属,价格昂贵;第二是催化重整焦油产生的积炭会附着在催化剂表面,使催化剂失活。而热裂解技术无需添加催化剂,主要通过调节温度、压力等提高焦油裂解率,操作简单,且能提高煤气热值[8]。因此对于热解气化耦合工艺,采用热裂解的方式更为可行。
DOOLAN等[9]的研究表明,焦油的热裂解一般包含以下过程:焦油受热分解,产生固体碳、气体和反应自由基。在低温下,这些自由基可以聚合形成较大的分子,冷凝形成轻组分的焦油;在较高温度下,反应自由基可进一步裂解形成气体产品和积炭;在更高温度下,积炭可以和水蒸气发生气化反应,增加了气体产物产率。目前已有很多学者研究不同条件对焦油裂解过程的影响,NARAVAEZ等[10]和候斌等[11]通过研究均发现温度的升高能提高焦油的裂解率;ALDEN等[12]通过研究发现CO2和水蒸气会促进焦油裂解而H2则会抑制焦油裂解,相反,JESS [13]却报导H2对焦油热解过程没有影响。
本文以苯酚、甲苯以及萘作为焦油模型化合物,利用Aspen Plus基于芳香族化合物动力学反应及其参数构建焦油热解模型,采用热解模型研究焦油热解过程,对影响焦油热裂解率的因素进行分析,为气化系统合理高效处理焦油提供依据。
2 焦油热解模型的描述 2.1 焦油热解过程模型假设基于化工流程模拟软件Aspen Plus和焦油热解的相关化学反应及动力学方程[15, 20-24],构建了焦油热解模型,并对焦油热解过程进行模拟。模拟焦油热裂解过程时作出了以下假设:
1) 焦油成分十分复杂,目前尚不能确定焦油的所有成分,直接采用焦油进行模拟过于复杂。目前研究者主要采用单一组分作为焦油模型化合物进行实验或者计算,GREGORIO等[14]和JESS [15]选择萘作为焦油模型化合物;CHAO等[16]和GUO等[17]用苯酚作为焦油模型化合物;CHEN等[18]选择甲苯作为焦油模型化合物;DAMARTZI等[19]采用苯:甲苯:萘=3:1:1作为焦油模型化合物。因为苯酚为焦油中杂环化合物的代表组成,甲苯代表了高温形成焦油过程中的一种稳定的芳香结构,萘为焦油中多环芳烃的代表组成,而焦油本身重质成分含量相对较少。所以采用苯酚、甲苯以及萘的混合物作为焦油模型化合物,已经可以代表除了重质组分外焦油的性质。通过对实验焦油样品进行元素分析,忽略微量的N、S元素,对结果进行归一化后得到焦油元素组成为C:H:O=0.89:0.07:0.04。确定焦油组成为苯酚:甲苯:萘=1:1:3。
2) 焦油热解除了产生积炭外,还会转化生成CO、CO2、H2、CH4以及微量低碳烃类气体和含硫含氮气体,计算中仅考虑生成了CO、CO2、H2和CH4 4种主要气体成分。本文研究目的是基于气化系统中微量焦油脱除,仅对影响较大的焦油转化率和积炭产率进行讨论。
3) 焦油的热解反应基于焦油模型化合物,只涉及焦油模型化合物的热裂解反应。
4) 反应过程处于稳态。
5) 热解停留时间恒定,忽略温度和压力变化对停留时间的影响。
2.2 焦油热解反应及动力学焦油的热裂解、蒸气及干基重整反应是焦油分解中的主要反应[16],如下所示。
热裂解:
蒸气重整:
干基重整:
成碳反应:
式中:CnHx、CmHy分别为焦油和碳数更小的碳氢化合物,p, q, k, n, x均为化学计量系数。
本文以苯酚、甲苯以及萘的混合物作为焦油模型化合物,确定了焦油热解过程的化学反应并构建模型,所有反应动力学参数均来源于文献,其中只有水煤气变换反应被认为是可逆的,具体如表 1所示,表中:r为化学反应速率,T为温度,pB为气体分压,R为摩尔气体常数,cB为气体摩尔浓度。
|
|
表 1 焦油热解反应及其动力学参数 Table 1 Kinetic parameters and reactions of tar pyrolysis |
基于Aspen Plus构建的焦油热解过程主要包含HEATER、MIX和PFR反应器3个模块,如图 1所示,PFR模块代表热解反应器,焦油和气体(氮气和反应气氛)经过预热,混合后进入反应器(PFR模块)。Kinoshita等[25]通过实验发现苯、萘等物质的热解需要在气化温度850 ℃以上时才会发生,且基于热解气化耦合工艺出口合成气的温度,模拟过程中考察焦油热解温度范围为900~1 100 ℃,间隔50 ℃,同时满足文献反应动力学参数适应温度;为了便于实验验证,反应器直径设定为38 mm,反应考察压力范围为0.1~5 MPa;考察停留时间之外的影响因素时,为保证停留时间足够,反应器长度均设定为10 m。进口焦油质量流量固定为3 kg·h-1,入口2种气体总体积流量固定为4 L·min-1,通过调节气体流量控制入口气体浓度,并保证总气体流量不变。
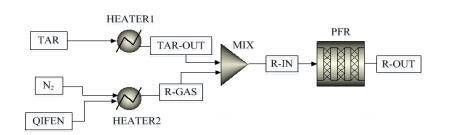
|
图 1 基于Aspen Plus的焦油热解过程模拟流程图 Fig.1 Simulation flow chart of tar pyrolysis processes using Aspen Plus |
结果与讨论中对模拟结果计算方法如下:
| ${X_{{\rm{tar}}}}{\rm{ = }}\frac{{{m_{{\rm{in, tar}}}} - {m_{{\rm{out, tar}}}}}}{{{m_{{\rm{in, tar}}}}}} \times 100\% $ | (1) |
| ${Y_{\rm{C}}}{\rm{ = }}\frac{{{m_{{\rm{out, C}}}}}}{{{m_{{\rm{in, tar}}}} - {m_{{\rm{out, tar}}}}}}$ | (2) |
式中:Xtar和YC分别为焦油转化率和积炭产率,min, tar和mout, tar分别为反应器进口和出口中焦油的总质量,mout, C为反应器出口积炭的质量。
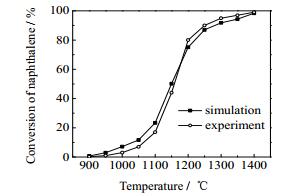
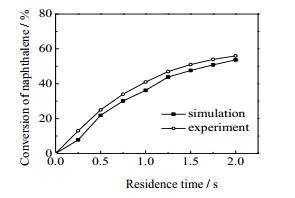
3 结果与讨论 3.1 模型的验证采用JESS[15]实验所得的萘的热解数据,对建立的焦油热解模型进行验证。该实验条件为:压力160 kPa,温度900~1 400 ℃,停留时间0~2 s,反应管直径20 mm、长度50 cm。将不同温度和停留时间下萘热解转化率的模拟值与实验值进行对比,结果如图 2和3所示,图 2中萘的停留时间为0.5 s,图 3中萘的热解温度为1 100 ℃。
|
图 2 温度对萘热解转化率的影响 Fig.2 Effects of temperature on the conversion of naphthalene pyrolysis |
如图 2所示,不同温度下萘热解转化率模拟值与实验值趋势相一致,平均偏差为3.48%,最大偏差为6.41%;如图 3所示,不同停留时间下,萘热解转化率的实验值会略高于模拟值,但两者趋势一致,平均偏差为3.22%,最大偏差为5.15%。因此,通过模拟值与文献实验值的对比,说明该模型能够较好地预测萘的热解过程,这表明通过添加苯酚及甲苯热解的动力学反应,采用该模型模拟苯酚、甲苯和萘的热解过程是可行的。
|
图 3 停留时间对萘热解转化率的影响 Fig.3 Effects of residence time on the conversion of naphthalene pyrolysis |
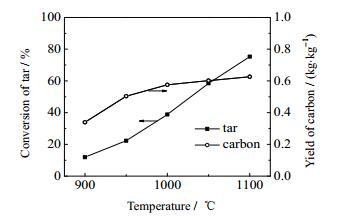
在压力为0.1 MPa、停留时间为5 s、N2气氛下,考察了温度对焦油热解结果的影响,如图 4所示为焦油转化率及积炭产率随温度变化曲线图。
|
图 4 温度对焦油转化率和积炭产率的影响 Fig.4 Effects of temperature on the conversion of tar pyrolysis and carbon yields |
从图 4中可看出,当温度从900升高到1 100 ℃,焦油的转化率从11.91%升高到75.29%,且温度越高,提高温度对促进焦油转化的效果越明显。说明在900~1 100 ℃范围内,温度升高会显著提高焦油转化率,主要是因为焦油热解是吸热反应,升高温度有利于反应的进行,同时从动力学角度来看,升高温度有利于提高反应速率,在相同停留时间内有利于焦油的热解,且在这一温度范围内提高温度对增加焦油转化率的效果不会减弱;此外,从图 4中还可以看出,焦油在热解过程中会产生大量积炭,随着温度升高,积炭产率增加,说明升高温度会促进积炭的形成,根据反应动力学参数,生成积炭的反应速率常数更大,提高温度对生成积炭反应促进效果更强,因此积炭产率随温度升高而增加;积炭产率随温度上升增加趋势逐渐变慢,主要是因为随温度升高,会促进积炭和焦油热解产物的反应,降低了积炭产率的增长速率。
3.3 停留时间对焦油热解过程的影响通过改变反应器的长度,考察0.1 MPa、900~1 100 ℃下,停留时间对焦油热解的影响。如图 5所示,焦油的转化率随停留时间的增加而增加,900 ℃下焦油的转化率随停留时间几乎呈线性增加,但是增幅较小,说明在低温下增加停留时间对提高焦油转化率作用不大;在1 000 ℃时,随着停留时间增加,焦油转化率显著提高,且增长趋势没有明显衰弱;而在温度为1 100 ℃时,停留时间由2 s增至10 s的条件下,焦油转化率的增量依次为11.1%、4.7%、2.8%和1.9%,呈递减趋势。这可能是因为,随着焦油裂解程度的加深,焦油的转化已经接近这一状态的最大值,继续提高停留时间,促进作用将变得很微弱,因此采用6 s左右的停留时间最佳,停留时间过短焦油转化率低,达不到要求,过长则会增加各种费用。在900 ℃下和1 100 ℃下,积炭产率随着停留时间增加而增加,但在1 000 ℃,积炭产率随停留时间先增加后又略微下降,且1 000 ℃和1100 ℃下积炭产率随停留时间变化很小,结合图 4,表明在1 000 ℃上,增加停留时间和温度对积炭产率影响都很小。
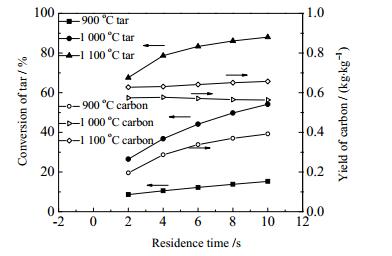
|
图 5 停留时间对焦油转化率和积炭产率的影响 Fig.5 Effect of residence time on the conversion of tar pyrolysis and carbon yields |
在停留时间为5 s、温度为1 100 ℃、压力为0.1 MPa下,考察了反应气氛及气体浓度对焦油热裂解过程的影响,得到了入口H2、CO、CO2和水蒸气体积分数为0~50%之间下的焦油热解转化率及积炭产率的结果。
如图 6所示,随着入口气体体积分数的不断增加,CO2和水蒸气反应气氛中的焦油热解转化率不断增加,说明CO2和水蒸气均会促进焦油的热解,且水蒸气气氛下的焦油转化率高于CO2气氛中的焦油转化率,随着浓度增加差距不断扩大,说明水蒸气对焦油热解的促进作用强于CO2;而CO气氛中焦油的转化率基本没有变化,和N2气氛中的焦油转化率相差甚微,说明CO气氛对焦油的热解过程影响不大;而随着H2的加入,焦油转化率明显下降,且随着H2体积分数的增加,焦油转化率仍在进一步下降。从曲线斜率可以看出,随着H2体积分数的增加,焦油转化率的下降速率越来越快,说明H2对焦油热解有着抑制作用。因为焦油热裂解过程符合自由基反应机理,在焦油热解过程中,首先是焦油脱氢产生H自由基,而H2气氛下,也会产生大量H自由基,抑制焦油的热解的脱氢阶段,因此抑制了焦油的裂解。
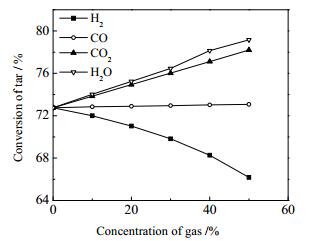
|
图 6 不同气体浓度对焦油转化率的影响 Fig.6 Effects of gas concentration on the conversion of tar pyrolysis |
如图 7所示,在水蒸气和H2气氛中,随着气体浓度的增加,积炭产率下降,且低于N2气氛中的积炭产率,说明水蒸气和H2均能降低焦油热解过程中的积炭产率,这是因为水蒸气能和积炭发生反应;H2会抑制焦油裂解产生积炭,是因为H2气氛下H自由基浓度更高,更易与碳结合,抑制了积炭的形成,且水蒸气抑制效果非常显著。WARSITA等[26]在研究中也发现通过添加水蒸气,调节水蒸气与甲苯或萘的比,可以抑制甚至消除积炭的生成。而在CO2气氛中,随气体浓度增加,积炭产率略微上升,高于N2气氛中积炭产率。积炭产率随CO浓度增加变化很小,有略微下降。
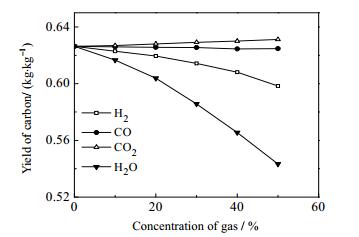
|
图 7 不同气体浓度对积炭产率的影响 Fig.7 Effects of gas concentration on carbon yields |
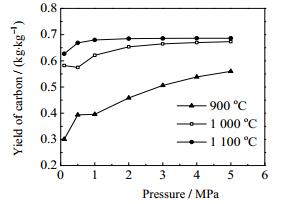
在N2气氛、停留时间为5 s、温度分别为900、1 000、1 100 ℃下,考察了0.1、0.5、1、2、3、4、5 MPa等不同压力对焦油热解结果的影响,结果如图 8、9所示。
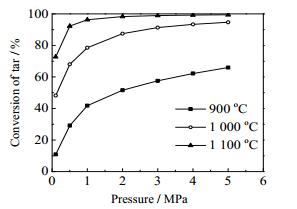
|
图 8 不同温度下压力对焦油转化率的影响 Fig.8 Effects of pressure on the conversion of tar pyrolysis at different temperatures |
|
图 9 不同温度下压力对积碳产率的影响 Fig.9 Effects of pressure on carbon yields at different temperatures |
从图 8中可以看出,随着压力的增加,焦油热解程度加深,转化率不断升高;但随着压力的升高,焦油转化率的变化程度越来越小。在1 000 ℃下,压力从0.1~1 MPa,焦油转化率从35.2%增加到78.5%;而压力从1~3 MPa以及3~5 MPa时转化率的变化分别为78.5%~91.3%和91.3%~94.5%,转化率增量越来越小。表明在压力比较低时,提高压力对促进焦油热解有显著作用。因为压力较低时,提高压力引起的压力相对变化量大,例如从0.1~0.5 MPa,压力相对变化量为400%,从2~3 MPa时仅为50%,所以低压时提高压力促进效果更佳显著;随着压力的继续升高,压力的上升对提高焦油转化率的作用越来越小,一方面是因为压力相对变化量小,另一方面是因为压力较高时,焦油转化率已经逼近这一反应条件下的平衡,继续增加压力对提高焦油转化率的促进效果微弱。
从图 9中可以看出,积炭产率随着压力增加而增加,在1 MPa以后,积炭产率的变化趋势和同一条件焦油转化率的变化趋势基本一致。但在900 ℃时,压力从0.5 MPa上升至1 MPa,积炭产率基本不变,略微上升;在1 000 ℃时,压力从0.1 MPa上升至0.5 MPa时,积炭产率呈现下降趋势,但0.5 MPa后积炭产率呈上升趋势,且随着焦油的转化率趋于稳定,积炭的产率的变化也很小。
4 结论(1) 基于Aspen Plus软件,根据芳香族化合物热解反应及其动力学参数构建焦油热解模型,模拟结果与实验结果误差在5%以内,验证了模型的可靠性。采用该模型预测了以苯酚、甲苯和萘作为焦油模型化合物的热解结果。
(2) 不同反应条件下焦油模型化合物热解结果表明,随着反应温度升高,焦油转化率持续增加。900~1 100 ℃之间转化速率增大,1 100 ℃为这一温度区间内焦油最佳热解温度;焦油转化率随停留时间增加而增加,在1 100 ℃下,停留时间4~6 s为最佳,过大会增加设备费用;随着压力的增加,焦油转化率增加明显,1 100 ℃时,压力从0.1 MPa增加到1 MPa,焦油转化率从72.76%增至96.27%,增加压力效果显著,继续提高压力焦油转化率增加很小,在满足焦油转化率前提下,焦油热解过程中操作压力选择1 MPa为优。
(3) 不同反应气氛下焦油模型化合物热解结果表明,CO2和水蒸气对焦油热解过程有着促进作用,且水蒸气的促进效果更加显著;CO对焦油热解过程影响很小;H2对焦油热解过程有着抑制作用。水蒸气和H2能降低积炭产率,且水蒸气效果更佳明显;CO对积炭产率影响很小;CO2会略微促进积炭的生成。
| [1] |
王辅臣, 于广锁, 龚欣, 等. 大型煤气化技术的研究与发展[J]. 化工进展, 2009, 28(2): 173-180. WANG F C, YU G S, GONG X, et al. Research and development of large-scale coal gasification technology[J]. Chemical Industry and Engineering Progress, 2009, 28(2): 173-180. DOI:10.3321/j.issn:1000-6613.2009.02.001 |
| [2] |
CHIANG K Y, LU C H, LIN M H, et al. Reducing tar yield in gasification of paper-reject sludge by using a hot-gas cleaning system[J]. Energy, 2013, 50: 47-53. DOI:10.1016/j.energy.2012.12.010 |
| [3] |
张书, 陈宗定, 徐敏, 等. 煤气化焦油脱除/催化重整技术研究进展[J]. 煤炭科学技术, 2014, 42(1): 106-111. ZHANG S, CHEN Z D, XU M, et al. Review on technology development for tar removol/catalytical reforming during coal gasification[J]. Coal Science and Technology, 2014, 42(1): 106-111. |
| [4] |
ZENG X, WANG F, SUN Y L, et al. Characteristics of tar abatement by thermal cracking and char catalytic reforming in a fluidized bed two-stage reactor[J]. Fuel, 2018, 231: 18-25. DOI:10.1016/j.fuel.2018.05.043 |
| [5] |
MA J, ZITNEY S E. Computational fluid dynamic modeling of entrained-flow gasifiers with improved physical and chemical submodels[J]. Energy Fuels, 2012, 26(12): 7195-7219. DOI:10.1021/ef301346z |
| [6] |
FOURCAULT A, MARIAS F, MICHON U. Modelling of thermal removal of tars in a high temperature stage fed by a plasma torch[J]. Biomass & Bioenergy, 2010, 34(9): 1363-1374. |
| [7] |
AHMED A M A, SALMIATON A, CHOONG T S Y, et al. Review of kinetic and equilibrium concepts for biomass tar modeling by using Aspen Plus[J]. Renewable and Sustainable Energy Reviews, 2015, 52: 1623-1644. DOI:10.1016/j.rser.2015.07.125 |
| [8] |
骆仲泱, 张晓东, 周劲松, 等. 生物质热解焦油的热裂解与催化裂解[J]. 高校化学工程学报, 2004, 18(2): 162-167. LUO Z Y, ZHANG X D, ZHOU J S, et al. Experimental study on catalytic and thermal cracking of tar from biomass pyrolysis[J]. Journal of Chemical Engineering of Chinese Universities, 2004, 18(2): 162-167. DOI:10.3321/j.issn:1003-9015.2004.02.006 |
| [9] |
DOOLAN K R, MACKIE J C, TYLER R J. Coal flash pyrolysis secondary cracking of tar vapours in the range 870~2000K[J]. Fuel, 1987, 66(4): 572-578. DOI:10.1016/0016-2361(87)90166-9 |
| [10] |
NARAVAEZ I, ORIOA A, AZNAR M P, et al. Biomass gasification with air in an atmospheric bubbling fluidized bed: effect of six operational variables on the quality of the produced raw gas[J]. Industrial and Engineering Chemistry Research, 1996, 35(7): 2110-2120. DOI:10.1021/ie9507540 |
| [11] |
侯斌, 吕子安, 李晓辉, 等. 生物质热解产物中焦油的催化热解[J]. 燃料化学学报, 2001, 29(1): 70-75. HOU B, LÜ Z A, LI X H, et al. Catalytic cracking of tar derived from biomass pyrolysis[J]. Journal of Fuel Chemistry and Technology, 2001, 29(1): 70-75. DOI:10.3969/j.issn.0253-2409.2001.01.014 |
| [12] |
ALDEN H, BJORKMAN E, CARLSSON M, et al. Catalytic cracking of naphthalene on dolomite[J]. Advances in Thermochemical Biomass Conversion, 1993, 216-232. |
| [13] |
JESS A. Catalytic upgrading of tarry fuel gases: A kinetic study with model components[J]. Chemical Engineering & Processing Process Intensification, 1996, 35(6): 487-494. |
| [14] |
DI GREGORIO F, PARRILLO F, SALZANO E, et al. Removal of naphthalene by activated carbons from hot gas[J]. Chemical Engineering Journal, 2016, 291: 244-253. DOI:10.1016/j.cej.2016.01.081 |
| [15] |
JESS A. Mechanisms and kinetics of thermal reactions of aromatic hydrocarbons from pyrolysis of solid fuels[J]. Fuel, 1996, 75(12): 1441-1448. DOI:10.1016/0016-2361(96)00136-6 |
| [16] |
CHAO G, YU P D, ZHAO C L, et al. Pyrolysis behavior and kinetic study of phenol as tar model compound in micro fluidized bed reactor[J]. International Journal of Hydrogen Energy, 2015, 40(25): 7956-7964. DOI:10.1016/j.ijhydene.2015.04.098 |
| [17] |
GUO F Q, DONG L, FAN P, et al. Detailed kinetic study of phenol decomposition under isothermalconditions to understand tar catalytic cracking process[J]. Journal of Analytical and Applied Pyrolysis, 2016, 118: 155-163. DOI:10.1016/j.jaap.2016.01.014 |
| [18] |
CHEN G Y, LI J, CHENG Z J, et al. Investigation on model compound of biomass gasification tar cracking inmicrowave furnace: Comparative research[J]. Applied Energy, 2018, 217: 249-257. DOI:10.1016/j.apenergy.2018.02.028 |
| [19] |
DAMARTZIS T, MICHAILOS S, ZABANIOTOU A. Energetic assessment of a combined heat and power integrated biomass gasification–internal combustion engine system by using Aspen Plus[J]. Fuel ProcessTechnology, 2012, 95: 37-44. |
| [20] |
PAULS J H, MAHINPEY N, MOSTAFAVI E. Simulation of air-steam gasification of woody biomass in a bubbling fluidized bed using Aspen Plus: A comprehensive model including pyrolysis, hydrodynamics and tar production[J]. Biomass and Bioenergy journal, 2016, 95: 157-166. DOI:10.1016/j.biombioe.2016.10.002 |
| [21] |
MAKI T, MIURA K. A simulation model for the pyrolysis of Orimulsion[J]. Energy Fuels, 1997, 11(4): 819-824. DOI:10.1021/ef9601834 |
| [22] |
CORELLA J, SANZ A. Modeling circulating fluidized bed biomass gasifiers. A pseudo-rigorous 1-dimensional model for stationary state[J]. Fuel Process Technology, 2005, 86(9): 1021-1053. DOI:10.1016/j.fuproc.2004.11.013 |
| [23] |
MORF P, HASLER P, NUSSBAUMER T. Mechanisms and kinetics of homogeneous secondary reactions of tar from continuous pyrolysis of wood chips[J]. Fuel, 2002, 81(7): 843-853. DOI:10.1016/S0016-2361(01)00216-2 |
| [24] |
UMEKI K, YAMAMOTO K, NAMIOKA T, et al. High temperature steam-only gasification of woody biomass[J]. Applied Energy, 2010, 87(3): 791-798. DOI:10.1016/j.apenergy.2009.09.035 |
| [25] |
KIONSHITA C M, WANG Y, ZHOU J. Tar formation under different biomass gasification conditions[J]. Journal of Analytical and Applied Pyrolysis, 1994, 29(2): 169-181. DOI:10.1016/0165-2370(94)00796-9 |
| [26] |
WARSITA A, Al-ATTAB K A, ZAINAL Z A. Effect of water addition in a microwave assisted thermal cracking of biomass tar models[J]. Applied Thermal Engineering, 2017, 113: 722-730. DOI:10.1016/j.applthermaleng.2016.11.076 |




